甘草不同种植模式与土壤微生态关联性的研究△
祖勒胡玛尔·乌斯满江,朱军,李晓瑾*,石书兵,张际召,贾晓光
(1.新疆农业大学 农学院,新疆 乌鲁木齐 830052;2.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002;3.新疆康隆科技股份有限公司,新疆 乌鲁木齐 830002)
·中药农业·
甘草不同种植模式与土壤微生态关联性的研究△
祖勒胡玛尔·乌斯满江1,2,朱军2,李晓瑾1,2*,石书兵1*,张际召3,贾晓光2
(1.新疆农业大学 农学院,新疆 乌鲁木齐 830052;2.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002;3.新疆康隆科技股份有限公司,新疆 乌鲁木齐 830002)
目的:了解甘草不同的种植模式对土壤微生物的影响。方法:以甘草规模化种植基地为研究对象,检测和分析轮作、连作种植模式下,其土壤中微生物类群及数量变化。结果:不同种植模式对土壤微生物的数量影响差异显著,随着种植年限增加甘草土壤微生物明显降低,甘草与棉花、小麦轮作土壤微生物数量较连作地显著提高;各土壤总微生物数量变化均为细菌>真菌>放线菌;随着土层深度增加三大微生物数量呈逐渐降低趋势。结论:轮作能够提高甘草地土壤微生物数量,对改善土壤理化性质、提高土壤肥力具有重要意义。
甘草;种植模式;土壤微生物数量
甘草为豆科甘草属多年生草本植物,以根和根茎入药,是我国大宗常用药用植物,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、缓和药性、调和诸药等功效[1-2]。是我国源于野生资源,应用极为广泛的最大宗药材。目前,逐年增长的巨大市场需求已致其资源接近枯竭,处于濒危状态,被列入《中国珍稀濒危保护植物名录》和《国家重点保护野生药材物种名录》[3-4]。因此,实现甘草的规模化、规范化人工栽培势在必行。
土壤微生物是土壤——植被系统中重要的组份,是土壤中有机质和养分转化等物质循环的主要动力,对植物生长有着至关重要的作用。土壤微生物对环境变化非常敏感,也是评价生态环境质量的重要指标[5-7],成为现代栽培学与环境生态学研究的热点。本文通过测试和分析甘草不同种植模式下,土壤中细菌、真菌、放线菌的微生物数量变化与分布,研究其与土壤微生态环境关联性,为提升和完善甘草人工种植技术、科学布局产业及实现可持续性发展提供依据。
1 材料与方法
1.1 样本采集
2014年8月,在康隆现代农业GAP甘草认证基地(新疆布克塞尔蒙古自治县)(46°47′31.92″,85°43′32.21″)选取不同种植模式的6块甘草样地,分别为3块棉花-甘草轮作地;2块连作两年甘草——甘草地(标记为G1,G2,G3,G4,G5);同时,取葵花、玉米、小麦等常规农作物种植地(标记N1,N2,N3)土样为对照。同时,取未种过甘草的常规农作物种植地(棉花-玉米)为对照。每块样地条件基本一致,按照《S》型五点取样法,在采样点挖垂直深1 m剖面,分别在距地平面0~10 cm,10~20 cm,20~30 cm,30~40 cm处取约1 kg土样。24 h内贮藏于4 ℃的冰箱。甘草不同种植模式采样点的基本情况件见表1。
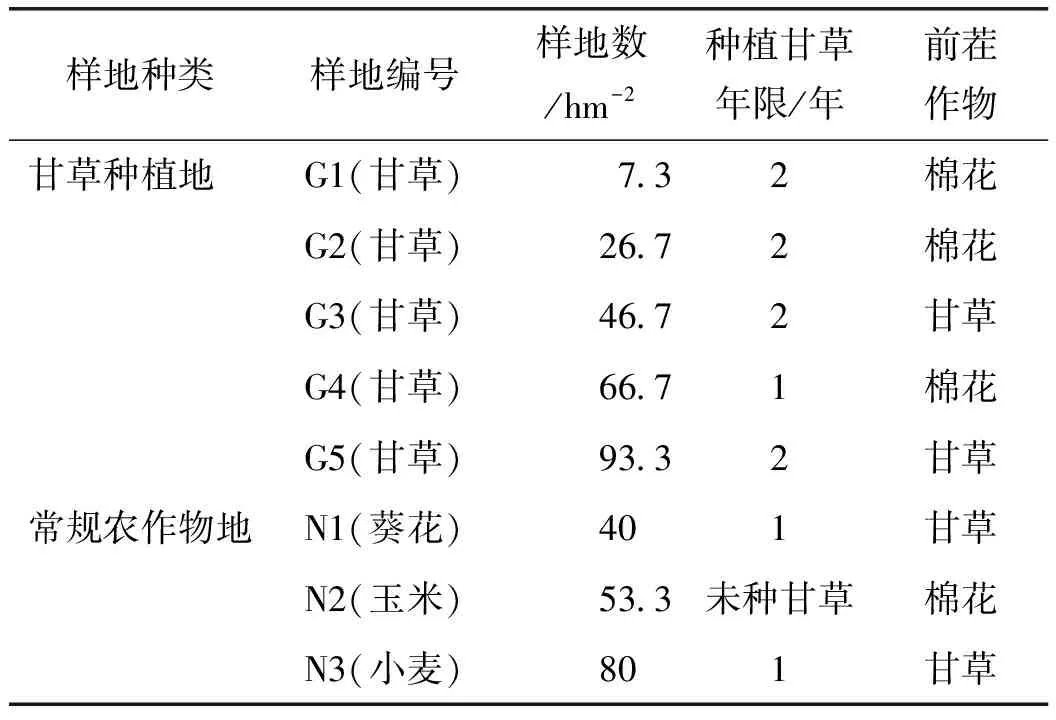
表1 研究样地信息
1.2 试验方法
1.2.1土壤菌悬液的制备 土壤微生物数量的测定采用稀释平板计数法[8]。称取10 g土样,置250 mL锥瓶中,加90mL无菌水,加玻璃珠振荡20 min,取1 mL混悬液,置已加9 mL无菌水的试管中,混匀;在净化台中,按需要,分别稀释细菌10-5、10-6、10-7;放线菌10-2、10-3、10-4;真菌10-1、10-2、10-3等不同浓度的土壤溶液。真菌选菌落数在10~100之间的培养皿进行计数[9]。土壤微生物的培养条件见表2。
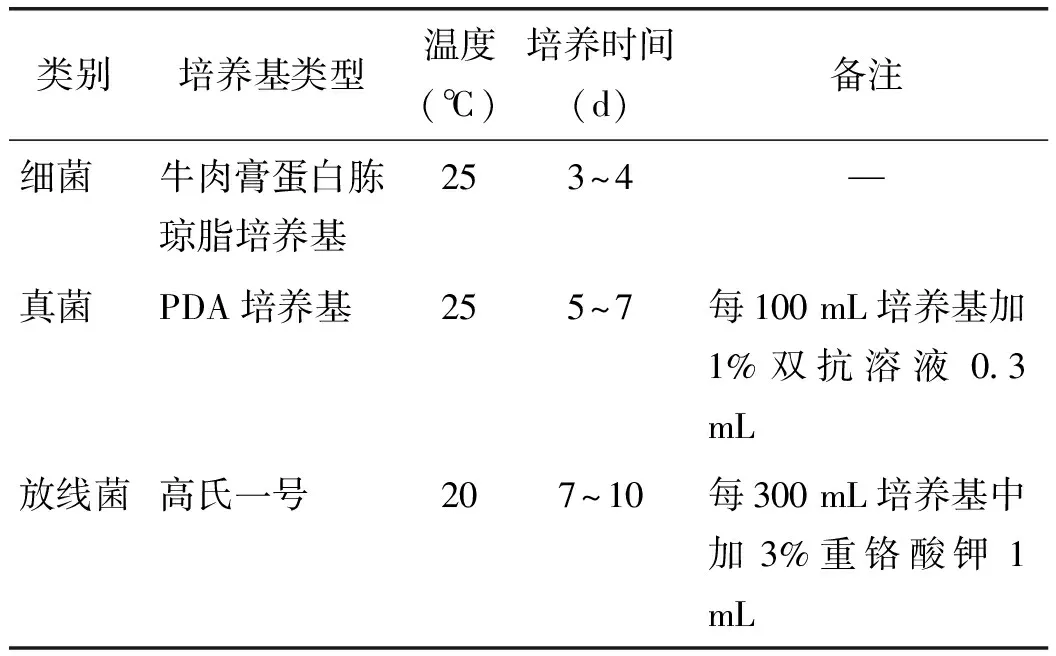
表2 土壤微生物培养条件
1.2.2 微生物数量计算 微生物数量以每克土壤样品所含的菌数表示。计算公式:每mL土壤样品所含的菌数(CFU/g土)=同一个稀释度几次重复的菌落平均数×5×稀释倍数。
2 结果
2.1 甘草与农作物地土壤三大类微生物数量特征
2.1.1 甘草连作与轮作对土壤细菌数量的影响 各样地中,甘草地块轮作处理样地的土壤细菌数量显著高于连作处理样地,其中甘草轮作地块G4的细菌总数最高,达29.8×106CFU;其次是甘草轮作地块G1和常规农作物地N2,分别为27.9×106CFU、24.9×106CFU;连作2年甘草地块G5土壤细菌数量最低,仅为6.2×106CFU。详见表3。
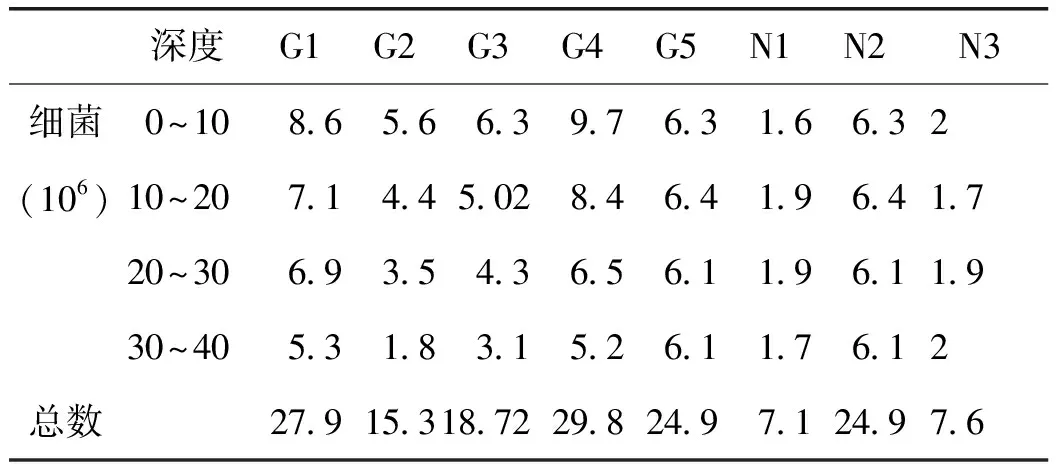
表3 甘草地不同深度土壤细菌数量特征 CFU·mL-1
注:表中数据是各样地不同土层的微生物平均值
2.1.2 甘草连作与轮作对土壤真菌数量的影响 真菌在各样地上的分布差异很大,轮作样地N3真菌总数量最高,为2.29×104CFU;连作样地G5真菌数量显著低于轮作,为0.41×104CFU。农作物地块N2(玉米地)真菌数量最少,为0.35×104CFU。详见表4。
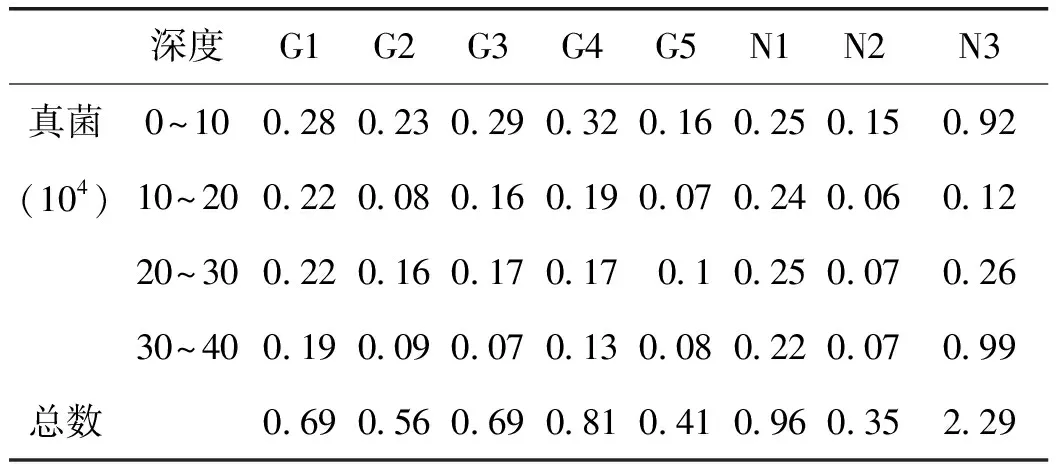
表4 甘草地不同深度土壤真菌数量特征 /CFU·mL-1
注:表中数据是各样地不同土层的微生物平均值
2.1.3 甘草连作与轮作对土壤放线菌数量的影响 各样地中放线菌在常规作物轮作地块N3最多,总数达到6.1×105,其次是轮作地G4和常规农作物地N2,分别为4.6×105CFU、4.07×105CFU,甘草连作地G5最少,为2.3×105CFU。放线菌数量在上两层土壤中最多,下两层土壤中最少。详见表5。
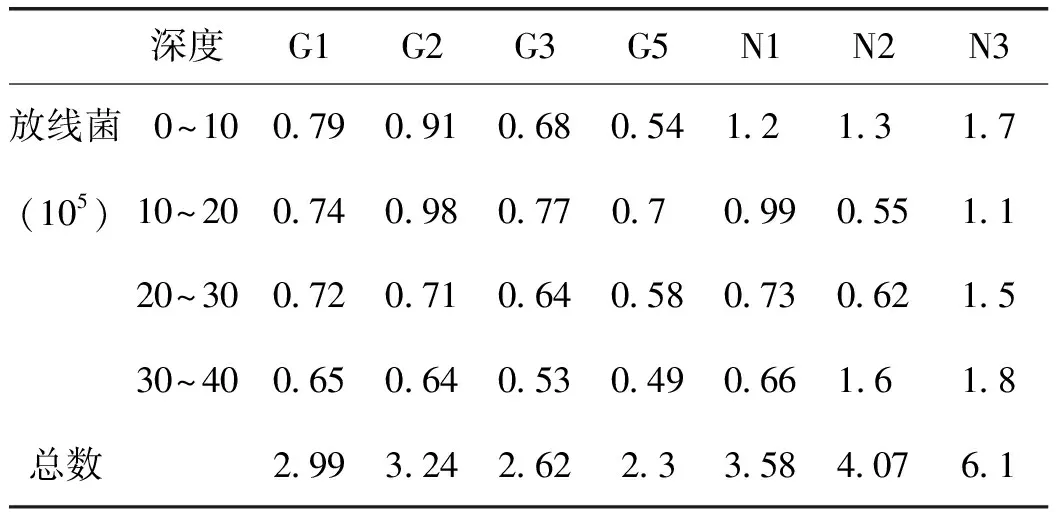
表5 甘草地不同深度土壤放线菌数量特征 /CFU·mL-1
注:表中数据是各样地不同土层的微生物平均值
2.1.4 甘草连作与轮作对土壤三大类微生物总数的影响 在0~10 cm土层的微生物数量关系占绝对优势,因此总体上决定了三大类微生物数量的大小关系,而30~40 cm上层的微生物数量较小。土壤三大类微生物数量随着土层的加深而减小,详见表6。
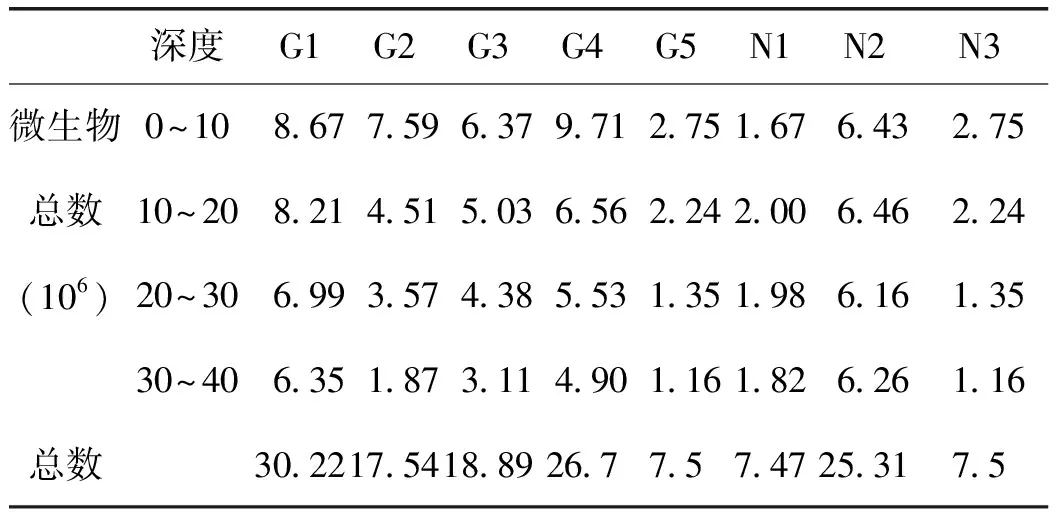
表6 土壤三大类微生物总数
注:表中数据是各样地不同土层的微生物平均值
2.2 甘草与农作物地土壤三大类微生物垂直分布
从图1、图2、图3、图4三大类土壤微生物数量及总数量的最近邻元素分析来看,甘草根系的0~40 cm区域都是土壤微生物分布较为集中的范围,但各土层的规律有所差异,常规农作物与甘草地相比,各土层土壤放线菌总数量明显高于甘草地,且常规农作物30~40 cm土层微生物数量大于比甘草地深层土壤微生物的数量。
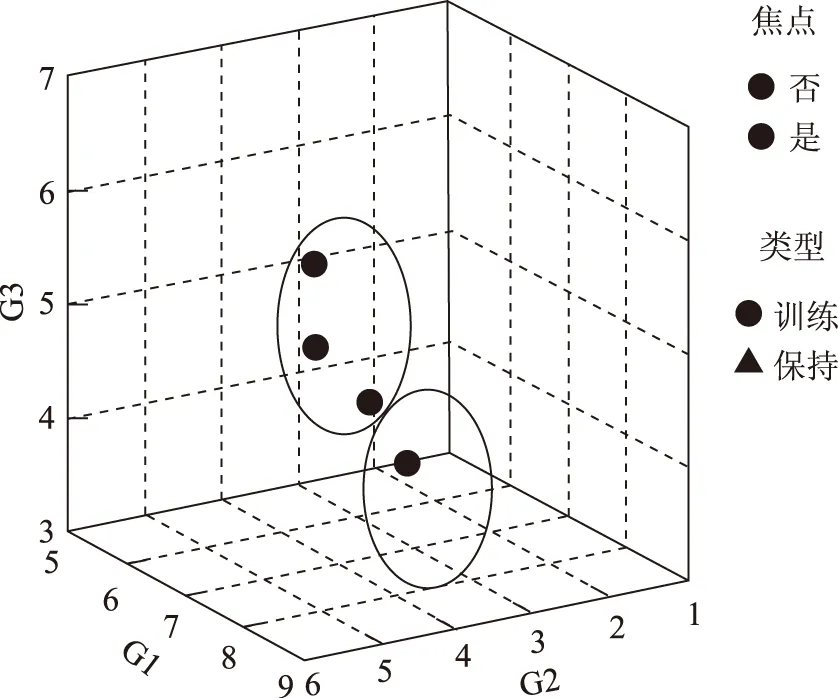
图1 土壤细菌的最近邻元素聚类分析
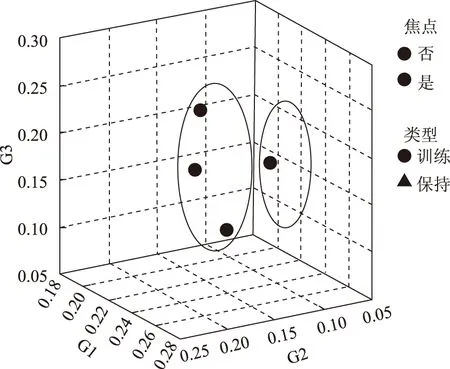
图2 土壤真菌的最近邻元素聚类分析
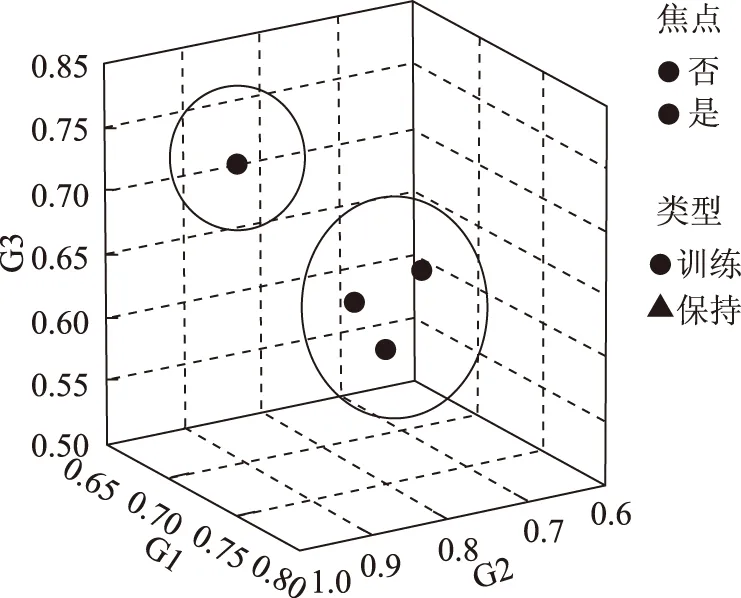
图3 土壤放线菌的最近邻元素聚类分析
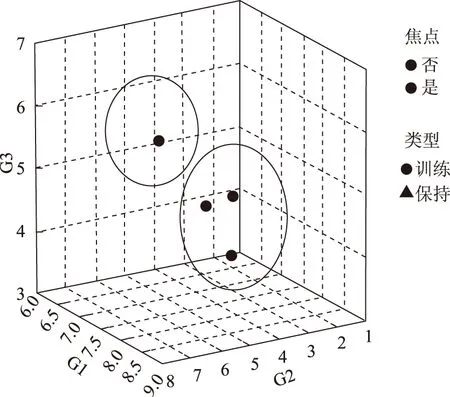
图4 土壤三大类微生物总数的最近邻元素分析
2.3 各样地土壤微生物类群数量聚类分析
2.3.1 各样地0~10 cm土层土壤微生物数量聚类分析 在0~10 cm土层中,各样地划分为两类:第1类包括甘草轮作地块G1、G2、G4、及连作地块G3,进一步划分,其中农作物轮作地块N1、N2为一组、连作样地G5自为一组;农作物轮作地块N3单独归为第2类。详见图5。
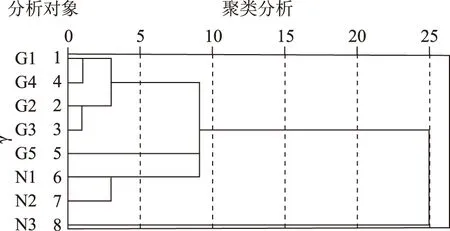
图5 各样地0~10 cm土壤微生物聚类分析
2.3.2 各样地10~20 cm土层土壤微生物数量聚类分析 10~20 cm土层处,如图2分为两类,轮作地块N1、N3、G2及连作地块G5自为一类;其余地块分为一类,其中轮作地块G4为一组。此种形式表明,各样地10~20 cm土层处的微生物数量与分布没有差异。详见图5。

图6 各样地10~0 cm土壤微生物聚类分析
2.3.3 各样地20~30 cm土层土壤微生物数量聚类分析 20~30c m土层处,如图3也是分为两类,轮作地块G4与N8自为一类;其他地块归为一类,进一步划分,轮作地G1与N2为一组。此种形式表明,各样地20~30 cm土层土壤微生物分布有差异。
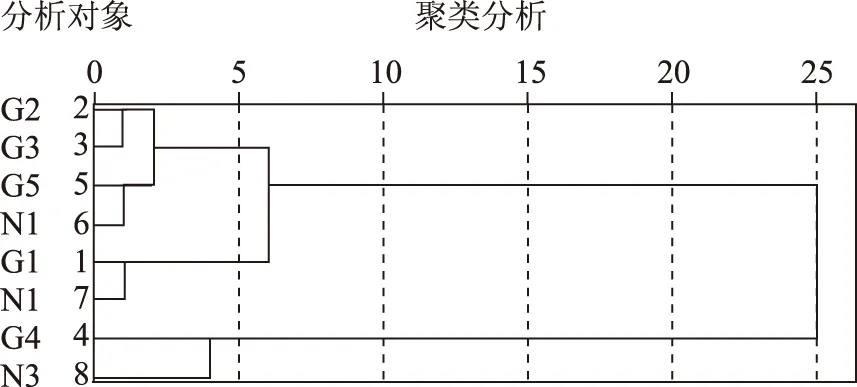
图7 各样地20~30 cm土壤微生物聚类分析
2.3.4 各样地30~40 cm土层土壤微生物数量聚类分析 30~40 cm土层中,各样地微生物划分为两类,农作物轮作地块N2、N3自为一类,其他地块归为一类,其中甘草轮作地块G1组、G4为一组,G2、G3、G5及N1为一组;表明,30~40 cm土层分为一类的样地土壤微生物分布没有差异。
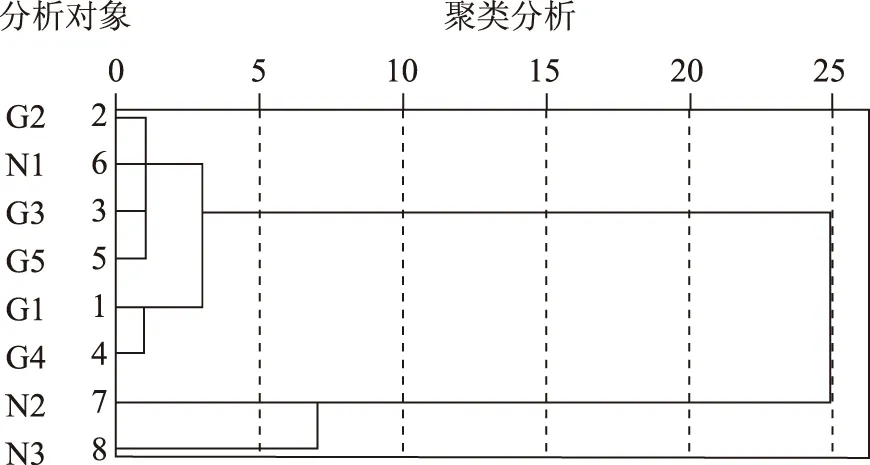
图8 各样地30~40cm土壤微生物聚类分析
研究结果表明:干旱半干旱地区的甘草种植地的土壤微生物中,细菌占绝对优势,占总微生物数量的99%,放线菌,真菌数量较小;甘草的种植模式、连作年限、前茬作物都影响土壤微生物数量与分布,甘草连作地中的土壤微生物数量低于前茬棉花轮作甘草及常规农作物地;前茬是甘草农作物种植地的土壤中细菌数量降低,真菌和放线菌数量升高。
3 讨论
甘草种植的各样地不同土层微生物数量随着土层深度增加均呈减少趋势,土壤表层的微生物数量明显多于深层的,与植物的生物量积累正相关。土壤微生物中数目最多的类群是细菌,占微生物总数的99%以上,细菌的多样性受土壤条件、季节、植物以及年龄的影响[10-12]。由于采样时间处于7月底,温度适宜细菌个体的快速繁殖,因此,并随着甘草种植年限和连作增加,土层的加深而减小,提示甘草种植能增加土壤的养分,与豆科植物能改良土壤的传统说法一致[13]。
甘草轮作样地土壤中的真菌与放线菌数量高于连作样地。真菌是土壤有机质分解与腐殖质的主要成分,其直接影响到土壤肥力[14]。真菌的数量和组成受土壤有机质多少的影响。真菌数量增加,可以增加土壤N的质量分数,从一定程度上提高土壤肥力,促进土壤N的良性循环[15]。放线菌是分解土壤中含氮和不含氮有机化合物的主要成分,放线菌的发育比大多数的真菌和细菌缓慢,其主要作用是分解植物和动物的某些难分解的组分,形成腐殖质,将植物残体和枯落物转化为土壤有机组分,与土壤肥力、植物病害防治有密切的关系[16-17]因此,虽尚无甘草连作障碍的报道,亦提倡甘草采取轮作种植模式为宜。
综上所述,甘草种植对新疆干旱半干旱地区土壤中的微生物数量及分布都会产生影响。甘草是根系发达型植物,在吸收土壤中的养分的同时,也向其释放有机物质[18-19],而致使土壤的结构、通气状况以及生物学活性发生改变,抑制或促进土壤中微生物生存,不同甘草种植模式导致土壤中的各种微生物之间、与植物产生怎样的相互作用,尚有待于进一步深入研究。
[1] 黄泰康,丁志遵,赵守训,等.现代本草纲目[M].北京:中国医药科技出版社,2001:662.
[2] 国家药典委员会.中华人民共和国药典:二部[S].北京:中国医药科技出版社,2010:235.
[3] 魏胜利,王文全,王海.我国中西部地区甘草资源及其可持续利用的研究[J].中国中药杂志,2003,28(3):202.
[4] 刘洋洋,刘春生,曾斌芳,等.甘草种质资源研究进展[J].中草药,2013,(24):3593-3598.
[5] 陈义群,董元华,王辉,等.不同农业措施对草葛连作土壤微生物群落特征的影响[J].安徽农业科学,2011,39(25):15286-15289,15294.
[6] 顾美英,徐万里,茹军,等.新疆绿洲农田不同连作年限棉花根际土壤微生物群落多样性[J].2012,32(10):3031-3040.
[7] Anderson T H.Microbial eco-physiological indicators to assess soil quality[J].Agric Ecosyst Environ,2003(98):285-293.
[8] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986:49-52,102-109,176-182,261-291.
[9] 吴金水,林启美.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[10] Liang J F,Qi Q Z,Jia X H,et a1.Efects of different tillage managements on soil properties and corn growth.Ecology and Environmental Sciences,2010,19(4):945-950.
[11] 杨海君,肖启明,刘安元.土壤微生物多样性及其作用研究进展[J].南华大学学报:自然科学版,2005,19(4):21-26.
[12] 章家恩,刘文高,王伟胜.南亚热带不同植被根际微生物数量与根际土壤养分状况[J].土壤与环境,11(3):279-282.
[13] 谢玉英.豆科植物在发展生态农业中的作用[J].安徽农学通报.2007,13(4):150-151.
[14] 张晶,张惠文,李新宇,等.土壤微生物生态过程与微生物功能基因多样性[J].应用生态学报,2006(6):1129-1132.
[15] Lou Y L,Liang W J,Xu M G,et a1.Straw coverage alleviatesseasonal variability of the topsoil microbial bio-mass and activity[J].Catena,2011(86):117-120.
[16] 刘均霞,陆引罡,远红伟,等.玉米、大豆间作对根际土壤微生物数量和酶活性的影响[J].贵州农业科学,2007,35(2):60-61.
[17] 马冬云,郭天财,宋晓,等.尿素施用量对小麦根际土壤微生物数量及土壤酶活性的影响[J].生态学报,2007,27(12):5222-5228.
[18] 刘洋洋,刘春生,曾斌芳,等.甘草种质资源研究进展[J].中草药,2013(24):3593-3598.
[19] 李明,王根轩,魏小平.不同生境甘草的生态型研究[J].西北植物学报,2006,26(2):368-376.
ResearchonRelationBetweenDifferentCroppingSystemsandSoilMicroecologyofLicorice
ZULEHUMAER·Wusimanjiang1,2,ZHUJun2,LIXiaojin1,2*,SHIShubing1*,ZHANGJizhao3,JIAXiaoguang2
(1.Collegeofagricultural,XinjiangAgriculturalUniversity,Urumqi830052,China;2.XinJiangInstituteofChineseTraditionalMedicaandEthicalMateriaMedica,Urumqi830002,China;3.XinJiangKANGLONGPolytronTechnologiesInc,Urumqi830002,China)
Objective:To realize the influences of different Licorice planting patterns on soil microorganism.Methods:To research the large-scale planting base of licorice,we detected and analysed the soil microbial groups and quantity on continuous cropping and crop rotation model.Results:Different planting patterns had significant influence on soil microbial quantity,with increase of planting years,the soil microorganism licorice decreased gradually.The microbial quantity of licorice rotation soil with cotton or wheat were significantly higher than that of continuous cropping.The total numbers of soil microbial quantity changes were as follows bacteria > fungus > actinomycetes.With the increase of soil depth,the number of three microorganisms has been gradually reduced.Conclusion:Crop rotation can improve the licorice soil microbial quantity,which have important significance on improving soil fertility and properties.
Licorice;planting patterns;soil microbial quantity
10.13313/j.issn.1673-4890.2016.11.018
2016-02-29)
新疆维吾尔自治区“十二五”重大专项(201130105-1);2015年度中医药行业科研专项(201507002-16)
*
李晓瑾,研究员,研究方向:中药资源与栽培,Tel:(0991)2665614,E-mail:xjlxj@126.com; 石书兵,教授,研究方向:作物栽培,E-mail:ssb@xjau.edu.cn

