博落回属植物内生真菌种类与分布差异△
刘金凤,黄鹏,柳亦松,刘秀斌,曾建国,3*
(1.湖南农业大学 园艺园林学院,湖南 长沙 410128;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;3.湖南农业大学 动物医学院,湖南 长沙 410128)
博落回属植物内生真菌种类与分布差异△
刘金凤1,2,黄鹏1,2,柳亦松2,3,刘秀斌1,2,曾建国1,2,3*
(1.湖南农业大学 园艺园林学院,湖南 长沙 410128;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;3.湖南农业大学 动物医学院,湖南 长沙 410128)
目的:探索博落回属植物内生真菌的种类与多样性,为发现影响博落回次生代谢产物的内生真菌提供前期研究基础。方法:采用组织培养法从博落回属植物根部组织中分离纯化内生真菌,利用分子生物学和常规的形态学方法对分离出的内生真菌进行分类鉴定。结果:共分离纯化67株内生真菌,其中博落回中分离到40株,而小果博落回中得到27株内生真菌。发现Coniothyrium为博落回根部特有的内生真菌,Botryosphaeria、Chaetomium和Phyllosticta属菌株为小果博落回特有菌株。结论:博落回属植物内生菌多样性与博落回属植物的地理分布差异、博落回属植物之间的差异有关。
博落回属;内生真菌;多样性;分子鉴定
植物内生真菌(Endophytic fungi)是指生活在植物组织内,却对其宿主没有产生明显病害症状的微生物[1]。目前,关于植物内生真菌的研究主要集中在以下几个方面:对内生真菌抑菌和抗癌次生代谢产物的筛选与发掘[2-3];内生真菌对宿主次生代谢产物的调控作用机制[4-6];内生真菌提高植物宿主的竞争性[7-8];植物宿主中不同部位的内生真菌分布规律[9-10];内生真菌对植物生长的促进作用[11]。
博落回Macleayacordata(Willd.) R.Br.与小果博落回Macleayamicrocarpa(Maxim.) Fedde.属于罂粟科博落回属植物。该种属植物主要分布于东亚、北美洲和欧洲[12]。博落回属植物作为一种传统中草药最早见于《本草拾遗》。现代药理研究表明博落回属植物中4种主要生物碱(原阿片碱、别隐品碱、白屈菜红碱、血根碱)具有显著的生物活性,其中血根碱对治疗多种炎症有效,对畜禽类有较好的肠道菌群调节作用,目前已经作为饲用抗菌药的替代品在欧洲等地区广泛销售[13]。博落回与小果博落回的形态差别主要在果荚部分,博落回果荚呈倒卵形而小果博落回果荚呈近圆形。前期研究显示博落回与小果博落回中的4种主要生物碱(原阿片碱、别隐品碱、白屈菜红碱、血根碱)具有组织特异性[12,14]。其中血根碱和白屈菜红碱主要分布在博落回的果荚和小果博落回的叶片中,而原阿片碱和别隐品碱主要分布在博落回叶片、根和小果博落回果荚中。两者在地理分布上也呈现特异性,博落回在我国主要分布在湖南、安徽、江苏、浙江、广西、海南、广东及四川等地。而小果博落回主要分布在山西东南部、江苏北部、江西西南部、河南西部和北部、湖北西部、陕西南部至东南部、甘肃东南部、四川东北部等地[15]。由于博落回和小果博落回存在地理分布与代谢产物分布的差异,这些因素也许会对其内生真菌的分布产生影响,或者这种分布差异本身就有内生菌参与到其中。因此,对于博落回属植物内生真菌分布差异的研究具有一定的价值。本研究采集了全国3个不同产地的博落回的根部与3个不同产地的小果博落回的根部进行内生菌分离,对其种类和分布进行研究,从而为博落回内生真菌资源利用提供依据。
1 材料
健康博落回植株根部材料,采集地点分别为安徽省祁门县、福建光泽县、浙江开化县。健康小果博落回植株根部材料,采集地点分别为湖北南漳县、河南洛阳、陕西户县。采集根部时连带土样一起挖出,放入无菌纸袋。
氯霉素麦芽提取物琼脂培养基(海博生物公司)。
2 方法
2.1样本与处理
流水冲刷根部表面,用软毛轻轻刷去根部泥土。再用超声波清洗仪超声10 min后取出,用超纯水冲洗,晾干备用。
2.2内生真菌的分离与纯化
取预处理后博落回的根,自来水洗净,装入无菌三角瓶中进行表面消毒,程序依次为:无菌水冲洗3次→75%乙醇浸泡1 min→无菌水冲洗3次→2%次氯酸钠浸泡10 min→无菌水冲洗3次→75%乙醇浸泡30 s→无菌水冲洗3次→用灭菌滤纸干燥表面水分。将根部样品用手术刀切割成2 cm×2 cm的小块,接种到分离培养基上,每皿接6块,重复3皿。26 ℃恒温箱培养,定时观察真菌生长情况。
每3天取出平板,及时转接生长出的真菌,持续20 d。待长出菌落后挑取菌落顶端菌丝接入斜面培养基中,并转管纯化,将纯化后不同的菌株编号,4 ℃冰箱中保存备用。同时,将消毒样品最后一步漂洗的无菌水置培养平板上同样条件进行培养作为空白对照。
2.3内生菌的鉴定
2.3.1 形态学鉴定 在载玻片上固定检测样本后,显微镜下观察孢子形态、产孢结构和菌丝形态等特征,根据形态特征鉴定内生真菌。
2.3.2 分子生物学鉴定 采用CTAB法提取所得内生真菌的DNA,并作为模板,以通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行ITS序列扩增。
PCR扩增产物送至生工生物工程(上海)股份有限公司纯化和测序。扩增产物测序结果在GenBank中进行Blast分析,选取与目标菌株相似度较高的菌株序列,使用Clustal软件进行多序列比对;运用MEGA5.0软件对计算后的序列进行系统发育树分析,构建系统发育树。(N-J法,Bootstrap重复1000次,Kimura-2-parameter)[16]。
2.4统计分析方法
采用Simpson指数D=1-∑(Ni/N)2分析内生真菌的菌群多样性。
3 结果与分析
3.1博落回属植物根部内生真菌的分离与纯化
6个不同产地的博落回属植物根部中共分离出67株内生真菌,其中博落回中分离出40株内生真菌,占全部内生真菌的59%;小果博落回中分离出27株内生真菌,占全部内生真菌的41%。空白对照组培养皿中未生长微生物,表明菌种分离过程中的消毒和培养过程是合理可靠的,分离得到的真菌均来自于博落回组织内部,而非环境中污染的真菌。由于有的培养基中生长不止一种菌株,所以对菌株进行纯化。用接种环挑取内生真菌菌丝并接种到新的PDA培养基中,至纯化出单菌落。
3.2博落回属植物根部内生真菌的分子鉴定
对不同产地的博落回与小果博落回内生真菌进行分子鉴定,安徽祁门产的博落回分离出18株内生真菌,隶属于5个属。福建光泽产的博落回分离出10株内生真菌,隶属于3个属。浙江开化产的博落回分离出12株内生真菌,隶属于2个属。见表1和表2。
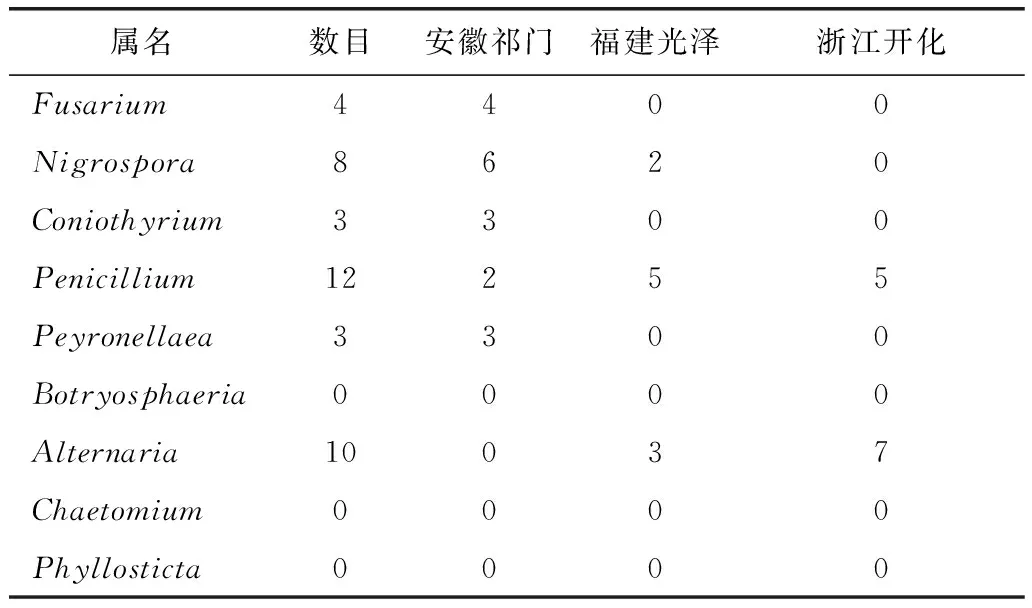
表1 不同产地博落回根部内生真菌的分类
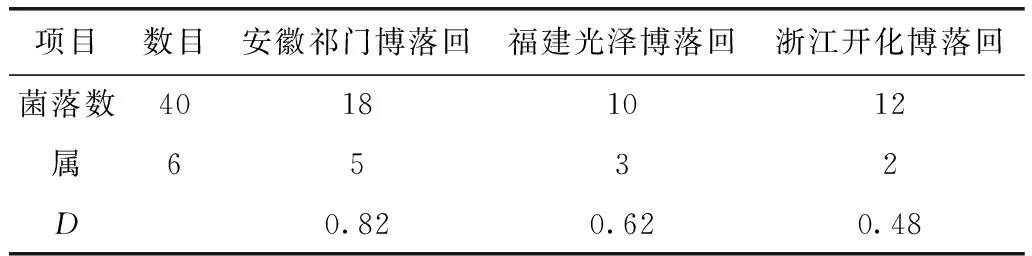
表2 不同产地博落回根部内生真菌的分布
湖北南漳产的小果博落回分离出的12株内生真菌隶属于4个属。河南洛阳产的小果博落回分离出的8株内生真菌隶属于3个属。陕西户县产的小果博落回分离出的7株内生真菌隶属于6个属。见表3和表4。
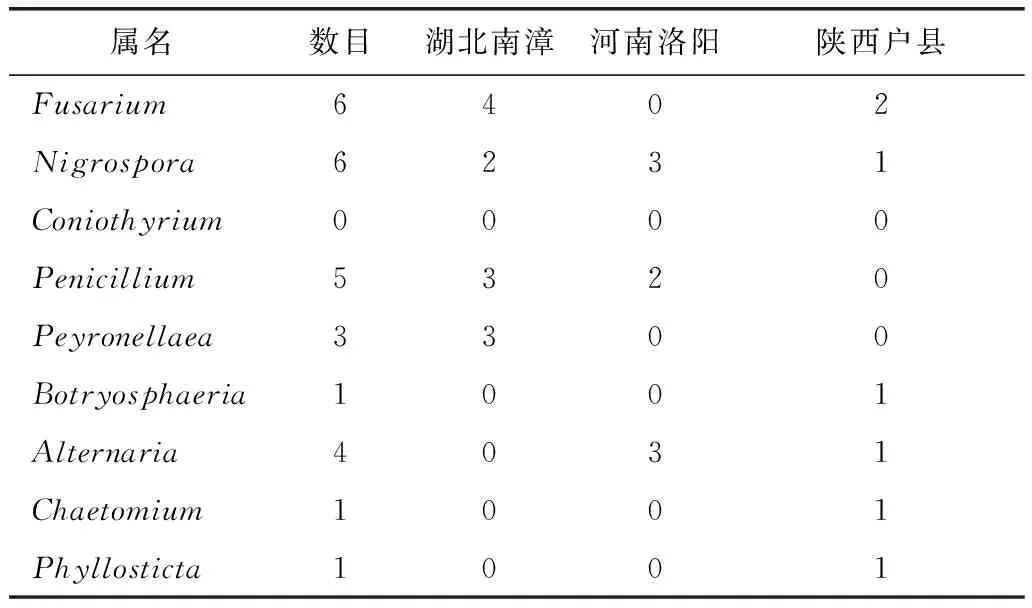
表3 不同产地小果博落回根部内生真菌的分类
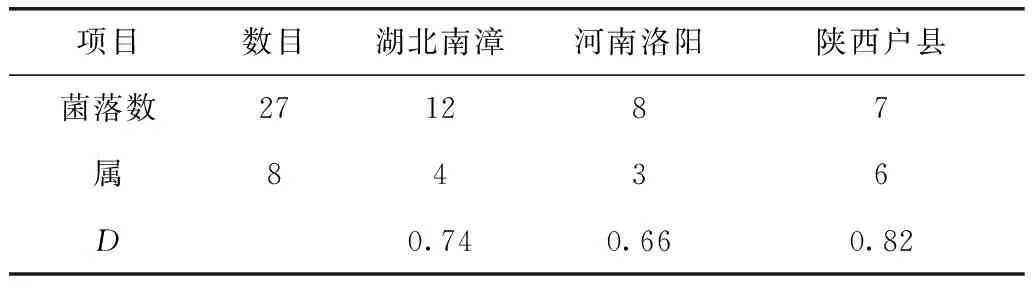
表4 不同产地小果博落回根部内生真菌的分布
3.3博落回属植物根部内生真菌的分布与多样性分析 博落回的内生真菌中,从产地分布来看,以安徽祁门产地中分离到的内生真菌最多,共18株,5个属。福建光泽产地中分离到的内生真菌最少,共10株,3个属(见表2)。其中Fusarium、Coniothyrium和Peyronellaea属菌株为安徽祁门产地特有菌株,而Penicillium属菌株为各个产地分布最广的菌株。Simpson多样性指数(D)显示,安徽祁门博落回(0.82)>福建光泽博落回(0.62)>浙江开化博落回(0.48),结果见表2。
小果博落回的内生真菌中,从产地分布来看,以湖北南漳产地中分离到的内生真菌最多,共12株,4个属;陕西户县产地中分离到的内生真菌最少,共7株,6个属;其中Botryosphaeria、Chaetomium和Phyllosticta属菌株为陕西户县产地特有菌株,而Nigrospora属菌株为各个产地分布最广的菌株。Simpson多样性指数(D)显示,陕西户县小果博落回(0.82)>湖北南漳小果博落回(0.74)>河南洛阳小果博落回(0.66),结果见表4。
3.4博落属植物根部内生真菌的多样性差异分析
对比博落回与小果博落回根部内生真菌的分类结果发现,博落回中安徽祁门产地特有的Chaetomium菌株在3个产地的小果博落回中都不存在。而在3个产地博落回中不存在的Botryosphaeria、Chaetomium和Phyllosticta属菌株在小果博落回中均存在。从种属分布的多样性上看,小果博落回比博落回要丰富。
4 讨论
由于博落回属植物目前还无法大规模人工种植,所以目前的资源主要来自野生博落回属植物。因此此次实验选择的样本均来自于野外,而且在选择采样样本时刻意选择地域差异很大的地区,这也是为了研究不同野生环境对博落回属植物内生真菌分布的影响。由于博落回属植物是多年生的大型草本植物,且每年冬季只有地上部分会枯萎,所以根部组织中内生真菌的多样性是最丰富的,也是受环境影响最大的部位。因此,我们专门针对博落回属植物的根部组织采样并进行内生真菌多样性分析,实验结果显示不同产地博落回属植物之间以及博落回与小果博落回之间根部内生真菌的分布多样性上都存在着显著差异,该结果说明环境因素和宿主因素对博落回属植物内生真菌的分布有较大的影响。
博落回中主要的生物碱有4种(血根碱、白屈菜红碱、原阿片碱、别隐品碱),前期研究结果发现博落回与小果博落回的生物碱分布呈现组织特异性[12,14]。两者的果荚和叶片中的4种生物碱含量呈现有趣的交叉现象:博落回果荚组织的血根碱和白屈菜红碱含量最高,而叶片中原阿片碱和别隐品碱含量最高。小果博落回中的情况则相反,果荚的原阿片碱和别隐品碱含量最高,而叶片中血根碱和白屈菜红碱含量最高。前期研究结果推测根部是博落回属植物中BIA类生物碱累积和合成的主要场所,叶片和果荚中的生物碱是经由茎部组织输送过来的。他们之间的差异主要是由于合成相关代谢产物的功能基因在不同部位表达差异导致的[12]。而不同产地的博落回之间4种生物碱差异也较大[17-20],因此,外部环境和宿主体内的内生真菌也造成了次生代谢产物的差异[6]。有研究表明造成这种情况可能的原因有两个,一个是内生真菌经过与宿主长期的相互作用会对其次生代谢产物合成的功能基因转录水平产生影响;另一个原因就是部分内生真菌对宿主次生代谢产物产生了耐受现象,从而在宿主体内对抗其竞争对手[4]。除了内生真菌会对宿主产生影响外,宿主本身也会对内生真菌产生重要的影响。已经有研究发现宿主会利用本身的次生代谢产物来影响其体内内生真菌的种群组成和多样性[21]。
研究显示,不同产地的博落回植株的遗传多样性较低[22]。目前博落回内生真菌的研究主要集中在次生代谢产物内生真菌的筛选和具有抗菌活性内生真菌的筛选上[23-25],而没有涉及到不同产地和博落回属植物之间内生真菌的差异研究[26]。本研究对不同产地博落回属植物根部的内生真菌进行了比较,显示博落回与小果博落回内生真菌的多样性差异与宿主和内生真菌之间的相互作用关系密不可分,这对于找寻可能存在的调控代谢产物的内生真菌具有重要意义。
[1]StrobelSA,StrobelGA.Plantendophytesasaplatformfordiscovery-basedundergraduatescienceeducation[J].NatChemBiol,2007,3(7):356-359.
[2]PuX,QuX,ChenF,etal.Camptothecin-producingendophyticfungusTrichodermaatrovirideLY357:isolation,identification,andfermentationconditionsoptimizationforcamptothecinproduction[J].ApplMicrobiolBiotechnol,2013,97(21):9365-9375.
[3]SolimanSS,RaizadaMN.InteractionsbetweenCo-HabitatingfungiElicitSynthesisofTaxolfromanEndophyticFungusinHostTaxusPlants[J].FrontMicrobiol,2013,4:3.
[4]SolimanSS,TrobacherCP,TsaoR,etal.Afungalendophyteinducestranscriptionofgenesencodingaredundantfungicidepathwayinitshostplant[J].BMCPlantBiol,2013,13:93.
[5]OlaAR,ThomyD,LaiD,etal.InducingsecondarymetaboliteproductionbytheendophyticfungusFusariumtricinctumthroughcoculturewithBacillussubtilis[J].JNatProd,2013,76(11):2094-2099.
[6]KusariS,ZuhlkeS,SpitellerM.EffectofartificialreconstitutionoftheinteractionbetweentheplantCamptothecaacuminataandthefungalendophyteFusariumsolanioncamptothecinbiosynthesis[J].JNatProd,2011,74(4):764-775.
[7]KhanAL,HamayunM,KangSM,etal.Endophyticfungalassociationviagibberellinsandindoleaceticacidcanimproveplantgrowthunderabioticstress:anexampleofPaecilomycesformosusLHL10[J].BMCMicrobiol,2012,12:3.
[8]SaariS,FaethSH.HybridizationofNeotyphodiumendophytesenhancescompetitiveabilityofthehostgrass[J].NewPhytol,2012,195(1):231-236.
[9]GlennA,BodriMS.FungalendophytediversityinSarracenia[J].PLoSOne,2012,7(3):e32980.
[10]SandbergDC,BattistaLJ,ArnoldAE.Fungalendophytesofaquaticmacrophytes:diversehost-generalistscharacterizedbytissuepreferencesandgeographicstructure[J].MicrobEcol,2014,67(4):735-747.
[11]YouYH,YoonH,KangSM,etal.FungaldiversityandplantgrowthpromotionofendophyticfungifromsixhalophytesinSuncheonBay[J].JMicrobiolBiotechnol,2012,22(11):1549-1556.
[12]ZengJ,LiuY,LiuW,etal.Integrationoftranscriptome,proteomeandmetabolismdatarevealsthealkaloidsbiosynthesisinMacleayacordataandMacleayamicrocarpa[J].PLoSOne,2013,8(1):e53409.
[13]WindischW,SchedleK,PlitznerC,etal.Useofphytogenicproductsasfeedadditivesforswineandpoultry[J].JAnimSci,2008,86(14):E140-E148.
[14] 郭宇鸽,曾建国,谈满良,等.博落回叶与小果博落回叶中4种生物碱的含量比较[J].中南药学,2011,9(11):829-832.
[15] 芦强,彭琼,李炎林,等.不同激素对博落回愈伤组织血根碱代谢累积水平的影响[J].湖南农业科学,2014(9):20-24.
[16]FelsensteinJC.limitsonphylogenies:anapproachusingthebootstrap[J].Evolution,1985,39(4):783-791.
[17] 陈应庄.博落回属植物中苄基异喹啉类生物碱代谢组学研究[D].长沙:湖南师范大学,2008.
[18] 刘秀斌.博落回属植物中生物碱代谢累积研究[D].长沙:湖南农业大学,2012.
[19] 郭宇鸽.小果博落回叶质量标准及其不同产地指纹图谱研究[D].长沙:湖南中医药大学,2012.
[20] 邹惠亮,何家希,赵晶晶,等.不同产地博落回各部位血根碱与白屈菜红碱含量分析[J].暨南大学学报(自然科学与医学版),2015,36(4):290-293.
[21]SaundersM,KohnLM.Evidenceforalterationoffungalendophytecommunityassemblybyhostdefensecompounds[J].NewPhytol,2009,182(1):229-238.
[22] 朱鹏程,柳亦松,黄鹏,等.博落回SSR引物的开发以及遗传多样性分析[J].生命科学研究,2013,17(2):120-124.
[23] 汪学军,闵长莉,殷智超,等.博落回内生放线菌的分离及活性菌株的鉴定[J].中药材,2014,37(11):1947-1950.
[24] 闵长莉,汪学军,赵梦凡,等.博落回内生真菌的分离及产血根碱菌株的筛选[J].中国中药杂志,2014,39(22):4288-4292.
[25] 闵长莉,王允,汪学军.博落回内生真菌的分离及其抗菌活性的初步研究[J].皖西学院学报,2012,28(2):4-6.
[26] 贾晓,叶佑丕,卢东升.博落回内生真菌种类与分布[J].信阳师范学院学报(自然科学版),2011,24(4):487-489.
EndophyticFungiSpeciesandDistributionDifferencesinMacleayaspp.
LIUJinfeng1,2,HUANGPeng1,2,LIUYisong2,3,LIUXiubin1,2,ZENGJianguo1,2,3*
(1.Horticulture&LandscapeCollegeofHunanAgriculturalUniversity,Changsha410128,China;2.NationalandLocalUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,HunanAgriculturalUniversity,Changsha410128,China;3.VeterinaryFacultyofHunanAgriculturalUniversity,Changsha410128,China)
Objective:The study was explored the species and diversity of fungal endophytes inMacleayaspp.to provide an initial research base for fungal endophytes which have an impact onMacleayaspp.secondary metabolites.Methods:Fungal endophytes were isolated and purified by tissue cultivation from the root ofMacleayaspp.and were classified and identified by molecular biology and morphology.Results:67 fungal endophytes ofMacleayaspp.were obtained,40 strains isolated fromMacleayacordataand 27 strains isolated fromM.microcarpa.Coniothyriumwas the specific fungi from the root ofM.cordata.Botryosphaeria、ChaetomiumandPhyllostictawere specific strains inM.microcarpa.Conclusion:The diversity and distribution differences of fungal endophytes fromMacleayaspp.associated with the geographical distribution difference and the differences between species ofMacleayaspp..
Macleayaspp.;fungal endophyte;diversity;molecularidentification
10.13313/j.issn.1673-4890.2016.7.016
2016-04-27)
国家重点实验室培育基地开放项目(15KFXM09);国家自然科学基金(31200615);湖南省研究生科研创新项目(CX2014B302)
*
曾建国,博士生导师,教授,研究方向:饲用植物与中兽药创制;Tel:(0731)84673824,E-mail:ginkgo@world-way.net

