基于CT图像的纹理分析鉴别肝脏实性局灶性病变
黄燕琪HUANG Yanqi
马泽兰1,2MA Zelan
何 兰2 HE Lan
梁翠珊1,2LIANG Cuishan
梁长虹2LIANG Changhong
刘再毅2 LIU Zaiyi
基于CT图像的纹理分析鉴别肝脏实性局灶性病变
黄燕琪1,2HUANG Yanqi
马泽兰1,2MA Zelan
何 兰2HE Lan
梁翠珊1,2LIANG Cuishan
梁长虹2LIANG Changhong
刘再毅2LIU Zaiyi
作者单位
1.南方医科大学研究生院 广东广州 510515
2.广东省人民医院 广东省医学科学院放射科 广东广州 510080
2016-01-13
中国医学影像学杂志
2016年 第24卷 第4期:289-292,297
Chinese Journal of Medical Imaging
2016 Volume 24 (4): 289-292,297
目的 CT是鉴别肝脏实性局灶性病灶的常用检查方法,但其对不典型病灶的鉴别诊断仍有较大的经验依赖性,而纹理分析可以提供客观、定量的图像描述特征。本研究旨在探讨基于CT图像的纹理分析在肝脏实性局灶性病变鉴别诊断中的价值。资料与方法 回顾性分析258例经病理证实或临床确诊的肝脏局灶性病变患者的CT图像,其中肝脏局灶性结节增生(FNH)34例,血管瘤(HEM)60例,肝细胞肝癌(HCC)60例,肝内胆管细胞癌(ICC)44例,转移瘤(MET)60例。所有患者均行腹部CT平扫与三期增强扫描。以MaZda软件生成CT图像的纹理特征并进行特征筛选,进行各组病灶的判别。结果 258例患者中,基于增强CT图像的纹理分析对于肝脏实性局灶性病变的鉴别诊断错判率(4.26%~37.80%)低于基于平扫图像的纹理分析(9.57%~39.02%)。对于良恶性病变的鉴别,门静脉期图像纹理分析错判率最低(13.57%);对于FNH与HEM的鉴别,动脉期及门静脉期图像纹理分析效果相当(错判率为4.26%);对于恶性肿瘤间的鉴别纹理分析错判率相对较高,若于恶性肿瘤间两两鉴别则错判率可降低(错判率最低为HCC 与MET,约11.67%)。结论
肝疾病;结节病;肝肿瘤;血管瘤;癌,肝细胞;胆管肿瘤;肿瘤转移;体层摄影术,螺旋计算机;图像增强;诊断,鉴别
肝脏实性局灶性病灶的鉴别诊断对于后续治疗方案的制订至关重要[1]。CT是较常用于鉴别肝脏实性局灶性病灶的手段[2-3],然而其对于不典型病灶的鉴别诊断仍有较大的经验依赖性[4]。通过量化分析图像像素灰度值局部特征、像素灰度值变化规律及其分布模式,纹理分析可反映感兴趣区(ROI)内的生理不均质性,近年被应用于多种医学成像图像中以辅助疾病诊疗[5-10]。以往有关纹理分析在肝脏辅助诊断中的研究多采用平扫图像[11]。然而近年来CT增强扫描在肝脏病变诊断中的应用逐渐广泛,它可以提供病变血供的信息、提高病灶的检出[4,12]。目前关于应用基于三期增强图像纹理分析鉴别肝脏实性局灶性病变的研究鲜有报道,本研究应用基于三期增强扫描图像纹理分析判别肝脏实性局灶性病变,以期对其鉴别诊断提供辅助手段。
1 资料与方法
1.1 研究对象 回顾性纳入2010年12月—2013年12月广东省人民医院(广东省医学科学院)经手术病理确诊为肝脏局灶性结节增生(focal nodular hyperplasia,FNH)的258例患者,其中女97例,男161例;年龄28~68岁,平均(46.50±13.19)岁;FNH 34例,肝细胞癌(hepatocellular carcinoma,HCC)60例,肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)44例,肝转移瘤(metastasis,MET)60例,血管瘤(hemangioma,HEM)60例。纳入标准:①病理证实为FNH、HCC、
ICC、MET者;CT影像典型的HEM,并经随访证实者;②同时行常规平扫及三期CT增强扫描者。排除标准:图像存在伪影,影响病灶观察者。
1.2 仪器与方法 采用GE 64排螺旋CT扫描仪(64-slice LightSpeed VCT,GE Medical systems,Milwaukee,Wis)。扫描参数:准直器0.625 mm,视野350 mm,管电压120 kV,管电流160 mAs,层厚5.0 mm。注射对比剂前先行平扫。增强扫描采用双筒高压注射器于肘静脉注射90~100 ml对比剂(Ultravist 370,Bayer Schering Pharma AG,Berlin,Germany),注射速度3 ml/s。注射对比剂后25~30 s、60~70 s、128~180 s分别行动脉期、门静脉期及延迟期扫描。CT扫描图像以DICOM格式导出。
1.3 纹理分析 采用MaZda软件(Version 4.6,下载页面:http://www.eletel.p.lodz.pl/mazda/)进行纹理分析[13]。选取病灶最大层面沿病灶轮廓放置ROI,然后生成ROI内的各个纹理参数值。为了减小不同时相间ROI的放置误差,先于病灶边界最清晰的时相中勾画ROI,随后将ROI复制粘贴于其他时相,错位较大时根据邻近解剖结构进行适当的位置调整。所有ROI由1名有20年腹部CT诊断经验的主治医师放置。在纹理特征生成之前先进行图像灰阶的标准化。生成的基于灰度共生矩阵、灰度直方图、游程矩阵、基于傅里叶变换的纹理特征、自回归模型的各纹理特征见表1[13]。

表1 生成的纹理特征
1.4 研究方法
1.4.1 判别分组 ①良性病变间的鉴别(HEM与FNH);②良性病变与恶性病变间的鉴别(HEM+FNH 与HCC+MET+ICC);③恶性病变间的鉴别(HCC与MET与ICC);④恶性病变间的两两比较(HCC与ICC;HCC与MET;ICC与MET)。
1.4.2 判别分析 根据MaZda软件自带的程序进行判别分析。其中,以互信息系数为标准对特征进行筛选排序。对于每一判别分组,选择排序前10位的纹理特征组成特征子集进行后续判别。基于之前提取的特征子集,以线性判别分析筛选出最优判别特征,使不同类别间差距最大化,同一类别间差距最小化。利用k-邻域(k-NN)分类器计算基于这些最优鉴别特征的错判率(MCR)。根据公式(1)计算MCR。

根据MCR将鉴别能力分为5个等级:MCR≤10%为优秀,10%<MCR≤20%为良好,20%<MCR≤30%为中等,30%<MCR≤40%为一般,MCR>40%为差。
2 结果
2.1 各期CT图像用于纹理分析的MCR 基于CT增强扫描图像的纹理分析得到的MCR较基于CT平扫图像的MCR低,见表2、3。
2.2 各鉴别分组的MCR 无论是基于平扫还是各期CT增强图像,纹理分析用于良性肿瘤间的鉴别及良恶性肿瘤的鉴别较恶性肿瘤间的鉴别MCR低,见表2、3。2.2.1 良性病变间的鉴别 良性病变间(FNH与HEM)基于平扫及CT增强扫描图像的纹理分析鉴别能力均为优秀;动脉期及门静脉期CT图像的纹理分析MCR均为4.26%(4/94),见图1。
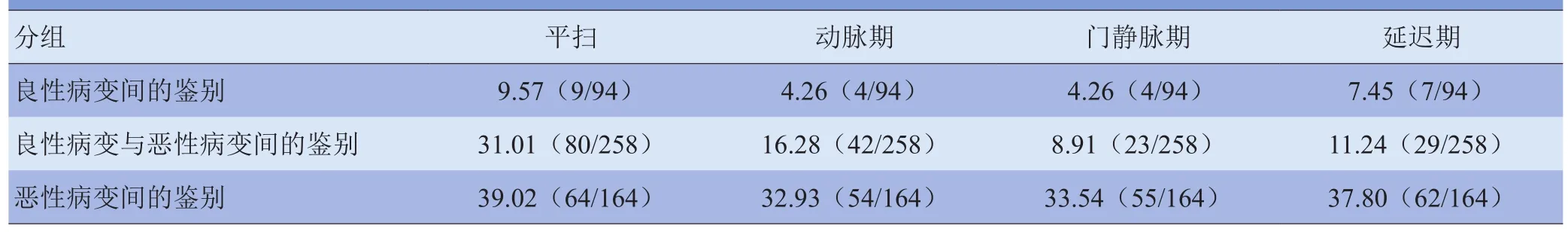
表2 各病变鉴别组MCR[%(n1/n2)]
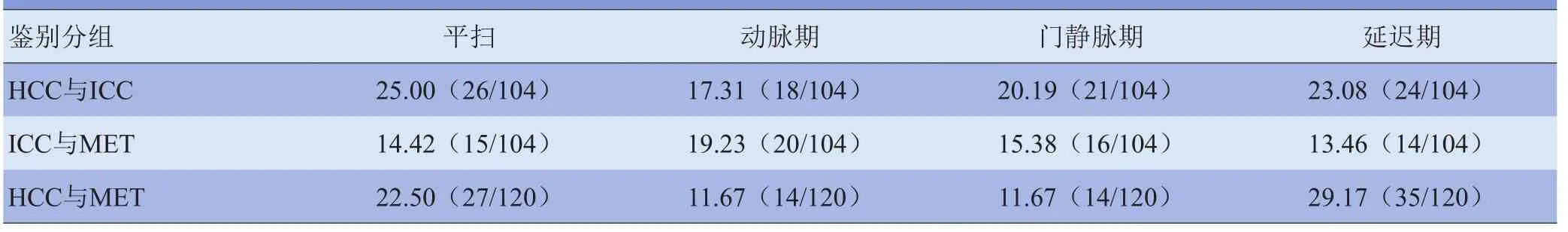
表3 恶性病变两两鉴别MCR[%(n1/n2)]
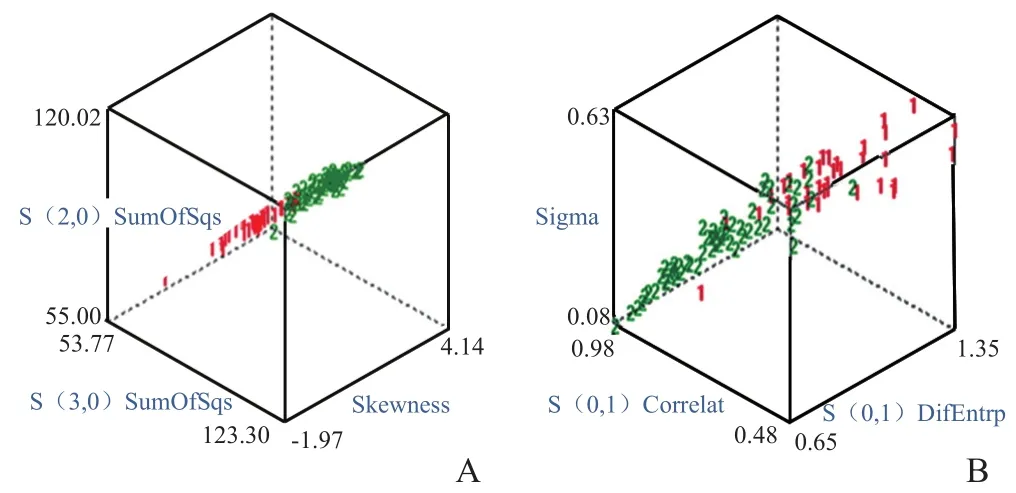
图1 A、B分别为基于增强扫描动脉期、门静脉期CT图像的纹理分析鉴别肝脏良性实性局灶性病变。1表示FNH,2表示HEM。3种特征为区分2种病变的最优纹理特征。“1”与“2”区分较明显,表明纹理分析鉴别能力均较好
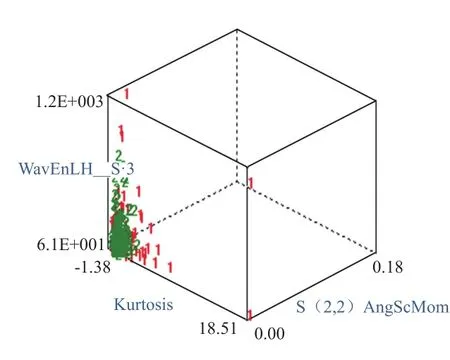
图2 基于增强扫描门静脉期CT图像的纹理分析鉴别肝脏良性与恶性实性局灶性病变。1表示良性病变,2表示恶性病变。3种特征为区分2种病变的最优纹理特征。“1”与“2”区分较明显,表明纹理分析鉴别能力较好
2.2.2 良性与恶性病变的鉴别 对于良性病变与恶性病变间的鉴别(FNH+HEM 与ICC+HCC+MET),基于增强扫描图像的纹理分析鉴别能力(MCR为8.91%~12.68%,优秀或良好)亦优于基于平扫图像的鉴别能力(MCR 为31.01%,一般)。其中,基于门静脉期图像的纹理分析鉴别能力优秀,MCR为8.91%(图2);而增强扫描动脉期与延迟期鉴别能力良好。
2.2.3 恶性病变间的鉴别 对于恶性病变间基于平扫及增强扫描图像纹理分析的鉴别能力均为一般(MCR 为32.93%~39.02%),其中基于动脉期图像的MCR最低。当两两鉴别恶性病变时,图像纹理分析的鉴别能力为良好与中等(MCR为11.67%~29.17%)。基于动脉期图像的纹理分析对于恶性病变间两两鉴别的能力均为良好,其中对于鉴别HCC与MET的MCR最低,为11.67%(图3)。
3 讨论
3.1 基于CT增强扫描图像的纹理分析 本研究显示,对于肝脏实性局灶性病变的鉴别,基于增强扫描CT图像的纹理分析较基于平扫图像能提供更大的价值。增强扫描可以提供病灶血供的信息,目前肝脏实性局灶性病变的术前评估多普及多期CT增强扫描[12];类似于传统的主观影像判断,对于肝脏实性局灶性病变的鉴别诊断,纹理分析亦应基于CT增强扫描图像[14-15]。Gletsos等[16]的研究显示,基于平扫CT图像纹理分析建立的计算机辅助诊断系统用于鉴别正常肝脏组织、肝囊肿、HEM、HCC的最低MCR为15.79%;而本研究基于CT增强扫描图像的纹理分析对于良恶性病变及良性病变的鉴别准确度更高(MCR为4.26%、8.91%)。3.2 肝脏良性病变的鉴别及良恶性病变的鉴别 对于良性病变的鉴别,由于FNH和HEM均为相对富血供病变,对于影像学表现不典型者仍存在错判的可能[17-18]。本研究应用基于动脉期或门静脉期CT图像的纹理分析鉴别两者MCR较低(4.26%),提示对于鉴别FNH 与HEM,基于CT图像的纹理分析推荐使用动脉期或门静脉期采集的图像。目前,基于CT图像的纹理分析鉴别FNH与HEM的相关研究鲜有报道,而纹理分析鉴别良恶性实性局灶性病变可减免不必要的有创治疗手段[3,17]。本研究鉴别良恶性病变的MCR较低,其中基于门静脉期的纹理分析MCR低至8.91%。因此,对于良恶性实性局灶性肝脏病变的鉴别,纹理分析推荐使用门静脉期的图像。
3.3 肝脏恶性病变的鉴别 由于不同肝脏恶性占位病变的治疗方式不同,因此术前正确鉴别恶性肿瘤的具体类型尤为重要[19]。本研究鉴别恶性肿瘤间的MCR较高,纹理分析鉴别能力为中等。本文使用线性判别分析进行判别,而目前医学图像纹理分析应用于病灶的分类、鉴别手段较多,使用其他判别手段能否提高恶性肿瘤内鉴别的准确度亦是亟待解决的问题[14,20]。若用于恶性病灶间的两两鉴别,本研究发现纹理分析鉴别能力提高,如HCC与MET的鉴别MCR为11.67%。目前鲜见关于纹理分析鉴别HCC与MET的文献,但文献[14]中纹理分析鉴别HCC与ICC的准确度为51.42%~91.02%,而本研究关于HCC与ICC的鉴别在动脉期亦有较高的准确度(82.96%)。
3.4 本研究的局限性 本研究中特征提取是基于单张CT图像进行,理想的情况应该是对CT图像序列进行三维建模,从三维空间分析病灶的纹理特征[21]。因此,未来需进一步应用CT图像序列的三维建模,提取可更全面描述病灶的纹理特征。此外,本研究仅比较基于平扫及三期增强扫描CT图像的纹理分析鉴别能力的差异;而医师识别诊断过程常通过综合考量平扫及增强扫描各期病灶的特点才能得到较完备的诊断结论[4,12,21]。虽然目前鲜见结合平扫及CT增强扫描图像的纹理分析对肝脏实性局灶性病变鉴别能力的研究,但这可能是提高鉴别准确度的途径。
总之,对于肝脏实性局灶性病变的鉴别诊断,基于CT图像的纹理分析可以作为辅助手段,尤其是用于FNH与HEM、良性病灶与恶性病灶、恶性病灶间的两两鉴别。基于三期增强扫描的纹理分析较基于平扫图像者效果更优。对于其中不同病变的鉴别,基于增强扫描各期图像的纹理分析鉴别能力亦有不同。

图3 基于增强扫描动脉期CT图像的纹理分析鉴别肝脏恶性实性局灶性病变。1表示ICC,2表示HCC,3表示MET。3个纹理特征为区分2种病变的最优纹理特征。“1”、“2”、“3”区分部分区域尚可,部分区域存在重叠现象,表明纹理分析鉴别能力一般
[1]Bottcher J,Hansch A,Pfeil A,et al. Detection and classification of different liver lesions: comparison of Gd-EOB-DTPA-enhanced MRI versus multiphasic spiral CT in a clinical single centre investigation. Eur J Radiol,2013,82(11): 1860-1869.
[2]Halavaara J,Breuer J,Ayuso C,et al. Liver tumor characterization: comparison between liver-specific gadoxetic acid disodium-enhanced MRI and biphasic CT--a multicenter trial. J Comput Assist Tomogr,2006,30(3): 345-354.
[3]Ros PR,Mortele KJ. Hepatic imaging. An overview. Clin Liver Dis,2002,6(1): 1-16.
[4]Van Leeuwen MS,Noordzij J,Feldberg MA,et al. Focal liver lesions: characterization with triphasic spiral CT. Radiology,1996,201(2): 327-336.
[5]刘卫芳,夏翃,周震,等. 多发性硬化患者脑磁共振图像的纹理分析. 中国医学影像学杂志,2013,21(4): 297-300.
[6]Castellano G,Bonilha L,Li LM,et al. Texture analysis of medical images. Clin Radiol,2004,59(12): 1061-1069.
[7]Hahn S,Heusner T,Zhou X,et al. Computer-aided detection (CAD) and assessment of malignant lesions in the liver and lung using a novel PET/CT software tool: initial results. Rofo,2010,182(3): 243-247.
[8]House MJ,Bangma SJ,Thomas M,et al. Texture-based classification of liver fibrosis using MRI. J Magn Reson Imaging,2015,41(2): 322-328.
[9]Virmani J,Kumar V,Kalra N,et al. Neural network ensemble based CAD system for focal liver lesions from b-mode ultrasound. J Digit Imaging,2014,27(4): 520-537.
[10]于鹏,田嘉禾.18F-FDG PET图像纹理分析的研究进展. 中国医学影像学杂志,2014,22(9): 711-713.
[11]Mougiakakou SG,Valavanis IK,Nikita A,et al. Differential diagnosis of CT focal liver lesions using texture features,feature selection and ensemble driven classifiers. Artif Intell Med,2007,41(1): 25-37.
[12]Hafeez S,Alam MS,Sajjad Z,et al. Triphasic computed tomography (CT) scan in focal tumoral liver lesions. J Pak Med Assoc,2011,61(6): 571-575.
[13]Szczypinski PM,Strzelecki M,Materka A,et al. MaZda--a software package for image texture analysis. Comput Methods Programs Biomed,2009,94(1): 66-76.
[14]Duda D,Kretowski M,Bezy-Wendling J. Texture characterization for hepatic tumor recognition in multiphase CT. Biocybern Biomed Eng,2006,26(4): 15-24.
[15]Ganeshan B,Miles KA,Young RC,et al. Hepatic entropy and uniformity: additional parameters that can potentially increase the effectiveness of contrast enhancement during abdominal CT. Clin Radiol,2007,62(8): 761-768.
[16]Gletsos M,Mougiakakou SG,Matsopoulos GK,et al. A computer-aided diagnostic system to characterize CT focal liver lesions: design and optimization of a neural network classifier. IEEE Trans Inf Technol Biomed,2003,7(3): 153-162.
[17]Cherqui D. Benign liver tumors. J Chir (Paris),2001,138(1):19-26.
[18]Hussain SM,Terkivatan T,Zondervan PE,et al. Focal nodular hyperplasia:findings at state-of-the-art MR imaging,US,CT,and pathologic analysis. Radiographics,2004,24(1): 3-17.
[19]Powerski MJ,Scheurig-Muenkler C,Banzer J,et al. Clinical practice in radioembolization of hepatic malignancies: a survey among interventional centers in Europe. Eur J Radiol,2012,81(7): e804-811.
[20]朱碧云,陈卉. 医学图像纹理分析的方法及应用. 中国医学装备,2013,10(8): 77-81.
[21]Tesar L,Shimizu A,Smutek D,et al. Medical image analysis of 3D CT images based on extension of Haralick texture features. Comput Med Imaging Graph,2008,32(6): 513-520.
(本文编辑 冯 婕)
Differentiation of Solid Focal Liver Lesions: A CT-based Texture Analysis
Liver diseases; Sarcoidosis; Liver neoplasms; Hemangioma; Carcinoma,hepatocellular; Bile duct neoplasms; Neoplasm metastasis; Tomography,spiral computed;Image enhancement; Diagnosis,differential
刘再毅
国家自然科学基金资助项目(81271569)。
2015-12-15
10.3969/j.issn.1005-5185.2016.04.013
Department of Radiology,Guangdong General Hospital (Guangdong Academy of Medical Sciences),Guangzhou 510080,China
Address Correspondence to: LIU Zaiyi E-mail: zyliu@163.com
R445.3;R735.7
基于CT图像的纹理分析可以作为肝脏实性局灶性病灶鉴别诊断的辅助手段,尤其是FNH与HEM、良性病灶与恶性病灶、恶性病灶间的两两鉴别;其中基于三期增强扫描的纹理分析较基于平扫图像者效果更优。
【Abstract】Purpose CT is a common tool for the differentiation of solid focal liver lesions. However,the traditional CT assessment relies heavily on radiologists’ experience,which leaves the differential diagnosis unfaithful. Conversely,texture analysis (TA) provides an objective and quantitative description of images. Under such circumstances,this study aims to discuss the value of TA based on both non-enhanced and triphasic contrast-enhanced CT in the differentiation of solid focal liver lesions.Materials and Methods The CT images of 258 patients with pathologically proven focal nodular hyperplasia (FNH,n=34),hemangioma (HEM,n=60),hepatocellular carcinoma (HCC,n=60),intrahepatic cholangiocarcinoma (ICC,n=44),metastasis (MET,n=60) were retrospectively analyzed. All the patients underwent non-enhanced CT and triphasic contrast-enhanced CT (CECT) scan with a standard protocol. A list of texture features was generated with free software MaZda for lesions' classification.Results The TA based on CECT had lower misclassification rate (MCR) of differentiation (4.26%-37.80%) compared with that on NECT (9.57%-39.02%)in general. In the differentiation between benign and malignant lesions,the lowest MCR was obtained on portal venous phase (13.57%); in the differentiation between FNH and HEM,similar MCR was observed on both arterial and portal venous phases (4.26%); in the differentiation of malignant lesions,although TA yielded a comparably higher MCR,better results were observed in the differentiation of malignant masses in pairs (the lowest MCR was 11.67% for HCC versus MET).Conclusion The CT-based TA could serve as a supplementary tool in the differentiation of solid focal liver lesions,and it has better performance in the differential analysis of FNH and HEM,benign and malignant lesions,and malignant lesions in pairs. The triphasic CECT contains more relevant discriminatory textural information in compared with the non-enhanced CT.

