高强度多孔聚乙烯醇水凝胶的制备*
周学华,刘克硕,叶海木,周 琼
(中国石油大学,北京 102249)
高强度多孔聚乙烯醇水凝胶的制备*
周学华,刘克硕,叶海木,周琼
(中国石油大学,北京 102249)
为制备兼顾多孔性和高强度的水凝胶,本研究利用循环冷冻和冷冻干燥联用设计和制备了一系列聚乙烯醇水凝胶。从聚乙烯醇溶液的浓度、循环冷冻次数、单次冷冻时长三个方面对水凝胶的力学性能、内部微观形貌、含水量进行了研究。结果表明:以质量分数14%浓度的聚乙烯醇水溶液经过3次循环冷冻过程(16h冷冻,8h解冻)和液氮冷冻冰干后的支架,再经溶胀平衡后得到的PVA水凝胶具有最佳的力学性能,此时PVA水凝胶的拉伸强度为5.74MPa,断裂伸长率为347%;改变循环冷冻次数可有效地调节PVA水凝胶的含水量;水凝胶力学性能提高来源于体系结晶度的增大。
PVA水凝胶,微孔结构,循环冷冻法,力学性能
具有生物相容性和生物活性的聚乙烯醇(PVA)水凝胶因其优异的机械性能和超强的吸水能力被广泛地应用于生物组织工程领域。例如药物控制释放、仿生软骨和人工皮肤、伤口敷料以及组织细胞的培养等[1-4]。然而,一般的方法制备的PVA水凝胶不能兼有高强度和多孔结构,从而在一定程度上限制了其应用。因此,制备一种兼具有多孔结构和高强度的PVA水凝胶是目前研究的一个重要方向。
循环冷冻法是一种制备高强度PVA水凝胶的常用方法[5]。PVA溶液在低温发生相分离,富集的PVA相中构筑了水凝胶中的物理交联点。Wan等人利用循环冷冻法对浓度为15%的PVA水体系进行了研究,实验表明PVA水凝胶的力学性能随着冷冻循环次数的增加而增大,当循环次数为6时,拉伸强度达到最大值,0.5MPa[6]。然而,循环冷冻法制备的PVA水凝胶并不适于制备多孔结构。Gutiérrez等人实验表明液氮冷冻干燥法是一种制备多孔材料的有效方法,并且水凝胶的微观形貌参数(孔的形貌、尺寸、孔壁厚度等)可以通过PVA的分子量、PVA溶液的浓度以及冷冻速率来调节[7]。因此,本文通过循环冷冻法和液氮冷冻干燥法联用制备了多孔高强度的PVA水凝胶。这一方法不仅能够同时保证水凝胶的高孔隙率和高强度,而且制备过程中没有引入外来杂质,保持了水凝胶的生物相容性。
1 实验
1.1实验材料
聚乙烯醇(PVA),上海阿拉丁试剂有限公司,牌号为PVA1799。
1.2PVA水凝胶的制备
分别将不同质量(6g~18g)的PVA加入100mL去离子水中,将其置于95℃的水浴锅中加热溶解8h。待PVA完全溶解后将溶液置于超声波仪中除气泡30min,获得均一透明溶液。然后将PVA溶液倒入方形培养皿中,将体系进行循环冷冻操作。在-18℃冷冻4h~16h,37℃解冻8h。达到所需循环次数后,将样品移入液氮中冷冻8h,接着将冷冻样品置于冷冻干燥机中(FD-1A-50,北京博医康实验仪器有限公司)干燥4天。将冰干的PVA支架重新浸泡于37℃去离子水中24h达溶胀平衡状态得到PVA水凝胶。
1.3形貌观察
将样品置于液氮中淬断,断裂面经高真空镀膜仪中喷金后在场发射扫描电镜(SEM,FEI Quanta 200F)中观察其形貌。利用NanoMeasurer 1.2.5 软件来统计SEM图中孔的尺寸。随机选取100个孔并测量其直径,然后计算100个孔直径的平均值。
1.4水凝胶的含水率
初始PVA的质量为W1,冰干后再溶胀平衡的凝胶质量为W2,则最终水凝胶的含水率可由以下公式计算:
1.5力学性能
在25℃室温下,采用WDL-5000N电子万能拉伸机分别对不同的PVA水凝胶样品进行拉伸力学性能测试,拉伸速率为10mm/min。样品的尺寸为36mm×4mm×2.2mm,每种样品测试5个,实验结果取平均值。
1.6热力学性质表征
示差扫描量热仪(DSC)为NETZSCH204F1型,氩气氛围。称取5mg的干态样品密封于铝坩埚中,以10℃/min的升温速率从20℃升温至240℃。材料的相对结晶度Xc计算如下:
其中,ΔHm是PVA样品的测试熔融焓值,ΔHm0是100%结晶PVA的理论熔融焓值,为138.6J/g。
广角X射线衍射测试在Burker D8 FOCUS衍射仪上进行。测试电压为40kV,电流为40mA,扫描速率为2°/min,扫描温度为25℃。
2 结果与讨论
2.1不同浓度PVA水凝胶
经过三次循环冷冻和液氮冷冻步骤后,再经冰干后所得PVA支架内部结构形貌如图1所示。除初始浓度为18%(质量分数,后同)的样品外,PVA支架均呈现出类似的蜂窝状有序多孔通道结构。6%、10%和14%初始浓度所制备PVA支架内孔结构的平均尺寸分别为2.1μm、1.1μm和0.7μm。随着浓度的增加,孔径逐渐减小,这是由于溶液中PVA分子对冰晶的生长抑制作用随浓度增加而增大[8]。当浓度为18%时,高浓度的PVA溶液中的水在冷冻过程中更倾向于形成无定型的超冷水(而不是冰晶)的缘故,使得体系不出现孔结构[7]。对于某一特定浓度的PVA溶液,冷冻温度越高,冰晶的晶核形成越困难[9]。-18℃循环冷冻制备的PVA凝胶中的水分子并没有形成冰晶,所以利用循环冷冻法制备的PVA支架一般不具备多孔结构。而将循环冷冻后的PVA凝胶进一步用液氮冷冻,体系中的水在形成冰晶,去除冰晶提供了多孔结构。

图1 由不同初始浓度PVA溶液所制备冰干支架内部结构的SEM形貌图:(a)6%、(b)10%、(c)14%、(d)18%
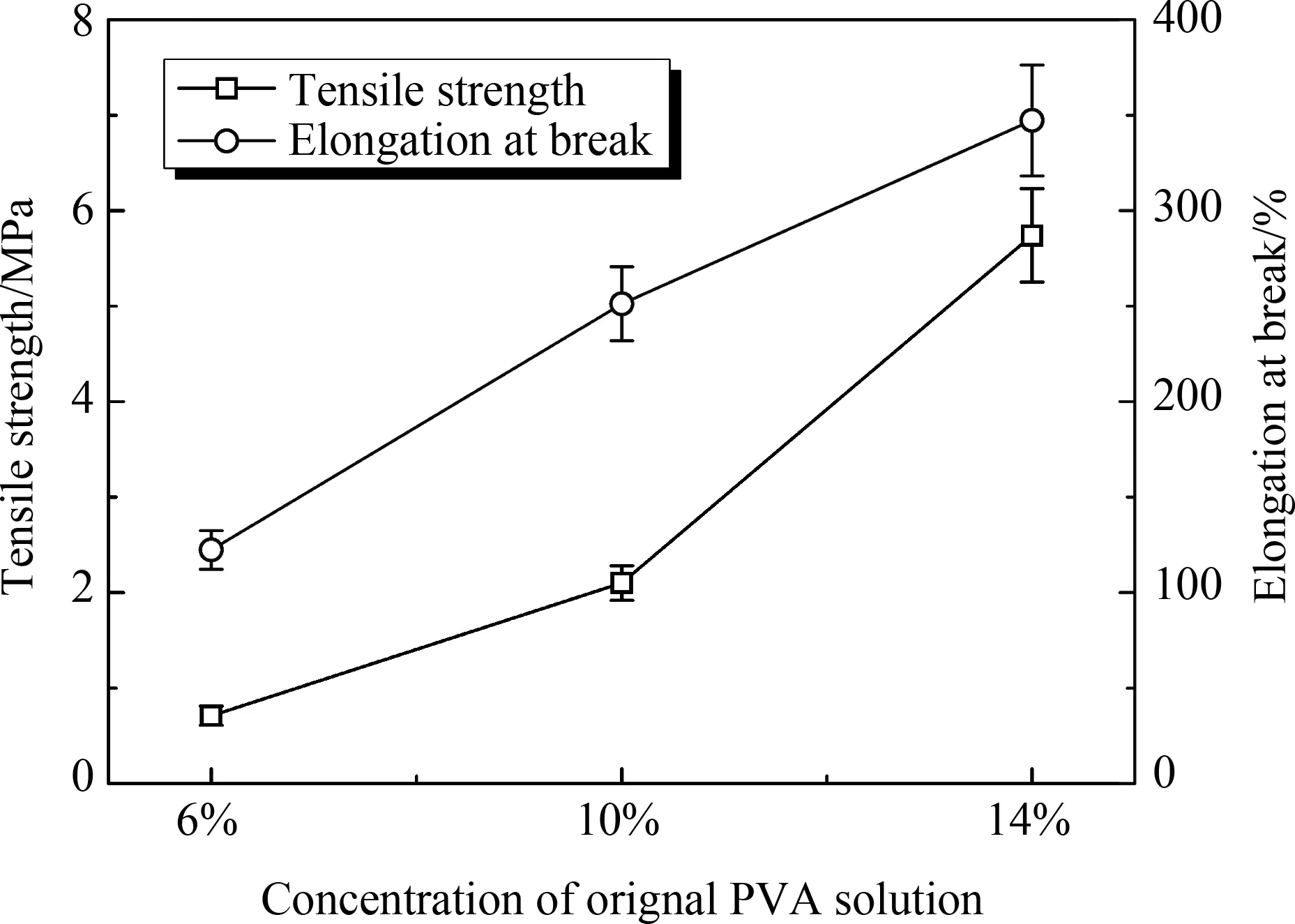
图2 图1中多孔样品溶胀平衡后所得PVA水凝胶的力学性能
将冰干的PVA支架进行溶胀平衡获得凝胶,再进行力学性能测试。如图2所示,PVA水凝胶的拉伸强度和断裂伸长率随着初始溶液浓度的增加而增大,6%、10%和14%初始浓度的PVA水凝胶的拉伸强度分别为0.71MPa、2.10MPa和5.74MPa,断裂伸长率分别为122%、251%和347%。拉伸强度远大于利用循环冷冻法直接制备的PVA水凝胶[6]。
2.2不同冷冻时间PVA水凝胶
影响循环冷冻法的因素包括冷冻时长和循环次数等。本部分选取初始溶液浓度为14%的PVA溶液经过3次冷冻循环和液氮冷冻过程,研究单次循环的冷冻时长对PVA水凝胶的力学性能的影响。如图3所示,PVA水凝胶的拉伸强度和断裂伸长率随单次冷冻时长的增加而增大。4h、8h和16h冷冻时长所制备的PVA水凝胶的拉伸强度分别为1.77MPa、3.47MPa和5.74MPa。相对于4h单次冷冻时长制得的PVA水凝胶,8h和16h单次冷冻时长制得的PVA水凝胶的拉伸强度提升分别达96%和224%。综合图4和图1(c)中PVA支架内部微观形貌可知PVA水凝胶拉伸力学性能的变化与其孔结构密切相关。4h、8h和16h冷冻时长得到的PVA冰干支架内孔通道的平均直径分别为0.95μm、0.77μm和0.7μm。更致密的孔结构使得PVA水凝胶力学性能的提高。同时,测量了平衡溶胀状态的PVA水凝胶的含水率,发现单次冷冻时长的改变不改变溶胀平衡PVA水凝胶的含水量,均维持在约75%,较初始溶液的含水率(86%)下降了9%。为探究PVA水凝胶含水率的变化是否引起了力学性能的变化,利用循环冷冻法(16h冷冻,8h解冻,3次循环)制备了初始浓度为25%的PVA水凝胶。测试结果显示,该PVA水凝胶的拉伸强度和断裂伸长率分别为0.86MPa、201%,远低于液氮冷冻干燥处理的初始溶液浓度为14%的PVA水凝胶,这表明含水率的变化不是引起PVA水凝胶力学性能显著提升的主要原因。

图3 冷冻时长对PVA水凝胶的力学性能的影响

图4 单次冷冻时长为(a)4h和(b)8h时所制备的PVA支架的内部形貌(样品初始溶液浓度选为14%,循环冷冻次数为3)
2.3冷冻循环次数PVA水凝胶
如图5所示,PVA水凝胶的力学性能随着冷冻次数的增加呈现先增大后减小的趋势。经过3次冷冻循环得到的PVA水凝胶的力学性能最优,此时凝胶的拉伸强度为5.74MPa、断裂伸长率为347%,满足部分软骨力学性能的使用要求[10]。此外,实验结果表明冷冻循环次数对最终所制备PVA水凝胶的含水率影响很大。循环冷冻次数为1、3和5所对应得到的PVA凝胶含水率分别为80%、75%和67%。随循环冷冻次数的增加,PVA凝胶含水率下降。这可能是由于循环冷冻次数的增加,使得更多的羟基参加到结晶过程中,自由羟基数减少,最终导致PVA水凝胶的亲水能力下降,含水率下降。因此,通过改变循环冷冻的次数可以有效调节PVA水凝胶的力学性能和含水量,从而满足不同领域的使用要求。
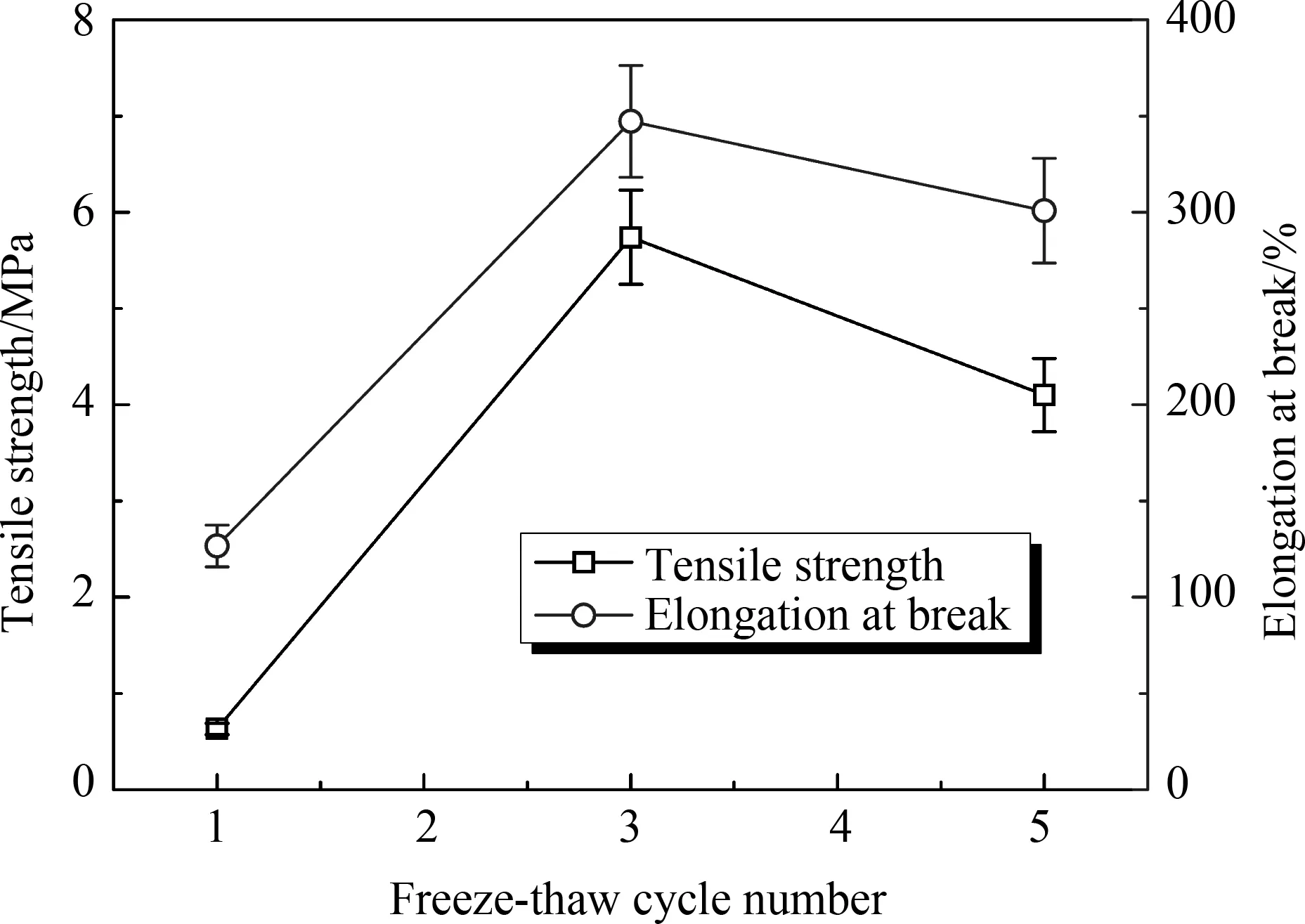
图5 冷冻循环次数对最终PVA水凝胶力学性能的影响(样品初始溶液浓度选为14%)
2.4分析讨论
Holloway等在研究循环冷冻法制备PVA水凝胶的实验中指出,体系中PVA分子的结晶行为影响了PVA水凝胶的力学性能,聚合物的力学性能与其结晶能力成正相关性[11]。结晶度的增大使得聚合物体系力学性能提高。从图6中可以看出,经历过1、3和5次冷冻循环的PVA冰干支架的相对结晶度分别为37.6%、44.9%和43.5%,呈现出先增加后减小的趋势,与图5中的对应水凝胶的力学性能的变化规律相符。Hong等指出3次冷冻循环前,PVA分子的结晶逐步完善,3次循环后凝胶的结晶程度不再改变[5]。因此,本研究认为相对结晶度的变化是PVA水凝胶力学性能改变的一个重要原因。
为了进一步证实PVA水凝胶力学性能的提高与其结晶结构密切相关,实验测量的PVA水凝胶的衍射谱图,如图7所示:25% PVA溶液直接循环冷冻3次得到的水凝胶没有出现PVA晶体相关的衍射峰,而利用循环冷冻与液氮冷冻后冰干再溶胀获得的PVA水凝胶显示出PVA的晶体衍射峰(20.7°、28.2°、31.6°),且衍射峰的强度随循环冷冻次数的增加而增强。因此本研究中所制备的高强度水凝胶的力学性能主要来源于其高的结晶度。
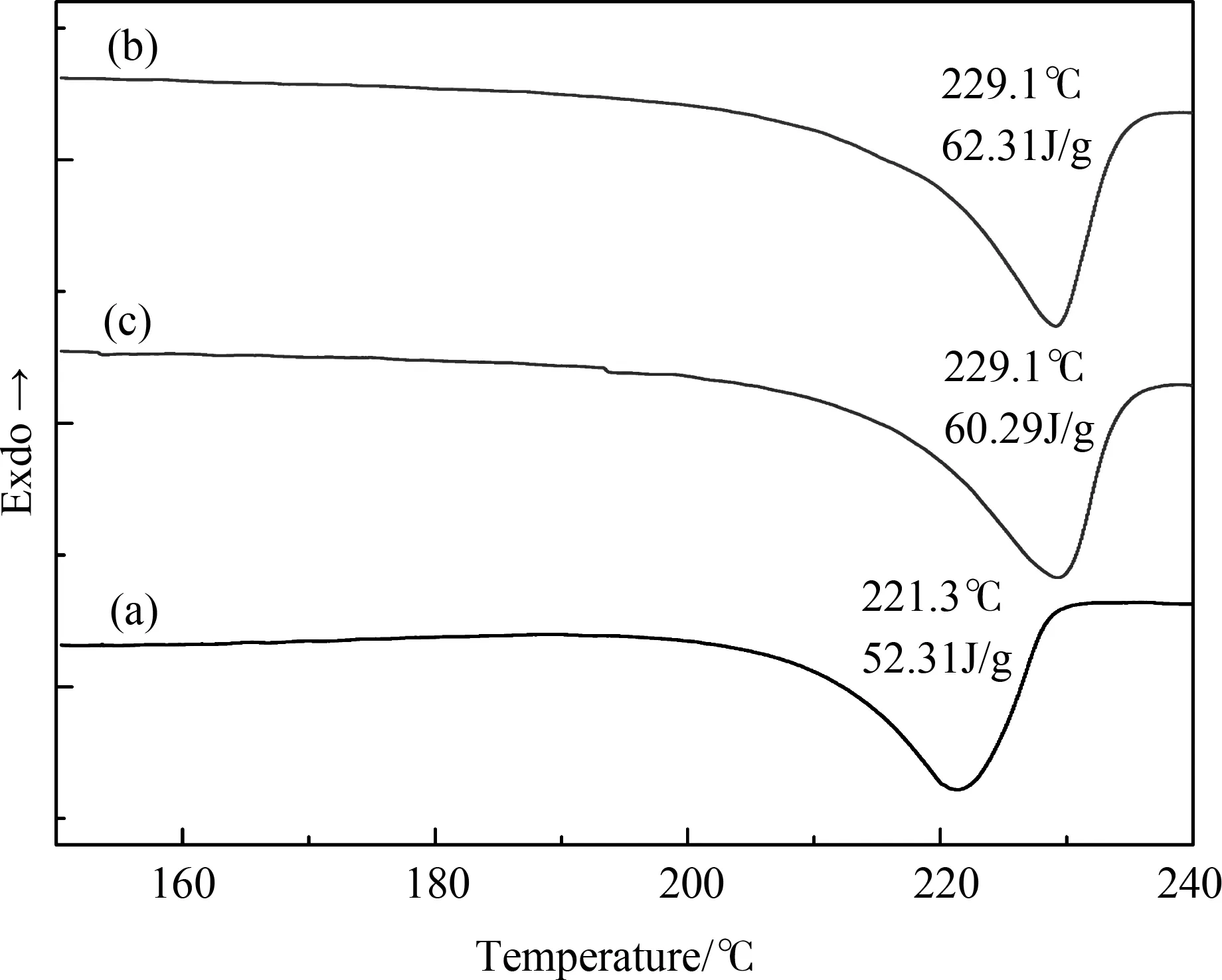
图6 经历不同冷冻循环次数所制备的冰干PVA支架的DSC熔化曲线:(a)1次,(b)3次,(c)5次
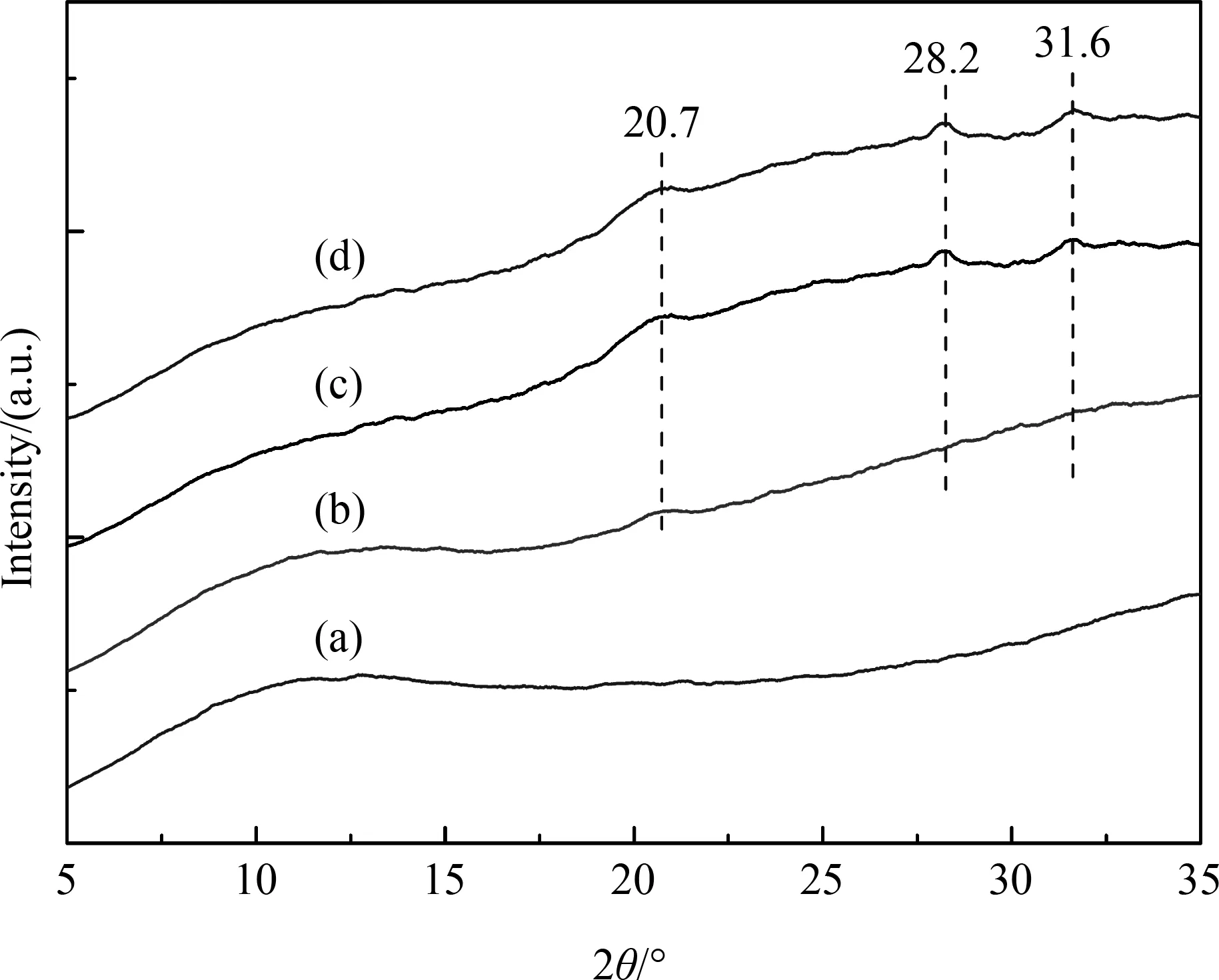
图7不同水凝胶的X射线衍射谱图:(a)25% PVA溶液直接循环冷冻3次得到的水凝胶;(b)、(c)、(d)则分别为循环冷冻1、3和5次与液氮冷冻后冰干再溶胀获得的PVA水凝胶(初始PVA浓度为14%)
Fig.7X-ray diffractograms of PVA hydrogels:(a) Hydrogel prepared from 25% PVA solution by directly freezing-thaw method.(b),(c) and(c) belong to hydorgels prepared by the combined method using in this study with 1,3 and 5 freezing-thaw cycles respectively from 14% original PVA solution
3 结论
(1)综合利用循环冷冻法和液氮冷冻干燥法可以制备高强度多孔PVA水凝胶。
(2)以质量分数14%浓度的PVA水溶液经过3次循环冷冻(16h冷冻,8h解冻)过程和液氮冷冻冰干后的支架,再经溶胀平衡后得到的PVA水凝胶具有最佳的力学性能,此时的PVA水凝胶的拉伸强度可达5.74MPa。
(3)改变循环冷冻次数可以有效地调节PVA水凝胶的含水量。
(4)PVA水凝胶的力学性能提高主要由于其结晶度的提高。
[1] Cavalieri F,Chiessi E,Villa R,etc. Novel PVA-Based Hydrogel Microparticles for Doxorubicin Delivery[J]. Biomacromolecules,2008,9:1967-1973.
[2] Li J K,Wang N,Wu X S. Poly(vinyl alcohol) nanoparticles prepared by freezing-thawing process for protein/peptide drug delivery[J]. Journal of Controlled Release,1998,56:117-126.
[3] Vrana N E,O’Grady A,Kay E,etc. Cell encapsulation within PVA-based hydrogels via freeze-thawing:a one-step scaffold formation and cell storage technique[J]. Journal of Tissue Enginnering and Regenerative Medicine,2009,3:567-572.
[4] Kobayashi M,Chang Y S,Oka M. A two year in vivo study of polyvinyl alcohol-hydrogel(PVA-H) artificial meniscus[J]. Biomaterials,2005,26:3243-3248.
[5] Hong H,Liao H,Chen S,etc. Facile method to prepare self-healable PVA hydrogels with high water stability[J]. Materials Letters,2014,122:227-229.
[6] Wan W K,Campbell G,Zhang Z F,etc. Optimizing the Tensile Properties of Polyvinyl Alcohol Hydrogel for the Construction of a Bioprosthetic Heart Valve Stent[J]. Journal of Biomedical Materials Research,2002,63:854-861.
[7] Gutiérrez M C,del Monte F,Rubio F,etc. Poly(vinyl alcohol) Scaffolds with Tailored Morphologies for Drug Delivery and Controlled Release[J]. Advanced Function Materials,2007,17:3505-3513.
[8] Inada T,Lu S. Inhibition of Recrystallization of Ice Grains by Adsorption of Poly(Vinyl Alcohol) onto Ice Surfaces[J]. Crystal Growth & Design,2003,3:747-752.
[9] Wang H,Inada T,Funakoshi K,etc. Inhibition of nucleation and growth of ice by poly(vinyl alcohol) in vitrification solution[J]. Cryobiology,2009,59:83-89.
[10] Fu Q,Saiz E,Rahaman M N,etc. Bioactive glass scaffolds for bone tissue engineering:state of the art and future perspectives[J]. Materials Science and Engineering C,2011,31:1245-1256.
[11] Holloway J L,Lowmanb A M,Palmese G R. The role of crystallization and phase separation in the formation of physically cross-linked PVA hydrogels[J]. Soft Matter,2013,9:826-833.
Preparation of High Strength Porous Poly(vinyl alcohol) Hydrogels
ZHOU Xue-hua,LIU Ke-shuo,YE Hai-mu,ZHOU Qiong
(China University of Petroleum,Beijing 102249,China)
In order to obtain hydrogel with porous structure and excellent mechanical properties,the combination of freeze-thaw method and liquid nitrogen freezing method was utilized to design and prepare a series of PVA hydrogels. The mechanical properties,inner microstructure and water uptake content were regulated through three aspects,including original concentration of PVA,freeze-thaw cycle number and freezing time length. The results revealed that PVA hydrogel prepared form solution with 14 wt% original concentration after freeze-thaw(freeze for 16h and thaw for 8h) for 3 cycles and liquid nitrogen freezing possesses the optimal mechanical properties,while the scaffold can also has good porous structure. The tensile strength and elongation at break of optimized porous hydrogel can reach 5.74MPa and 347%,respectively. The water uptake content of PVA hydrogel can be modulated by changing freeze-thaw cycle. And the improvement of hydrogel mechanical properties is due to the increase of PVA crystallinity.
PVA hydrogel,micropore structure,freeze-thaw method,mechanical property
中国石油大学(北京)科研基金资助(2462013BJRC001)
O 631.2

