中美两国抗菌药物产品目录比较
刘正跃,王 辉,陈忠社,杨樟卫
(第二军医大学第一附属医院药学部,上海 200433)
中美两国抗菌药物产品目录比较
刘正跃*,王辉,陈忠社,杨樟卫#
(第二军医大学第一附属医院药学部,上海200433)
目的:了解中美两国抗菌药物产品目录的差异,为相关部门提供参考。方法:结合国家食品药品监督管理总局网站公布的国产与进口药品数据和美国FDA网站中的美国国家药品代码目录(NDC),对比分析两国抗菌药物品种数、品规数、产品数、儿童剂型以及生产企业集中度的差异。结果与结论:中美两国抗菌药物产品目录中,抗菌药物品种数分别为191、84个,品规数分别为460、1 392个,产品数分别为23 824、3 139个;儿童剂型分别为51、26个;产品数列前10位的抗菌药物生产企业的产品数分别占各自总产品数的6.29%和33.67%,表明我国抗菌药物品种数、品规数虽然较丰富,但集中度较低。建议我国相关部门对抗菌药物的批准和生产实施严格审批和监管,同时对已上市产品进行重新遴选和评价,采用价格或市场机制,优胜劣汰。
抗菌药物;产品目录;品规;国家药品代码目录;美国
抗菌药物作为治疗细菌感染性疾病的主要药物,占世界卫生组织(WHO)药品目录的27.3%[1],是临床应用最为广泛的药物之一。据估计,我国医药市场到2020年将成为仅次于美国的第二大医药市场[2]。然而,随着市场供应药品种类的增多、人们对于疾病治愈期望的增强,很多医师与患者过度依赖抗菌药物,导致抗菌药物滥用现象越来越严重、细菌耐药问题突出,同时还出现了严重药品不良反应和不同程度的过敏反应[3]。2011年,WHO将世界卫生日的主题确定为“控制细菌耐药,今天不采取行动,明天将无药可用”,促使全球范围内对抗菌药物滥用和耐药问题再次引发关注。从经济学角度看,产品服务于市场需求,同时影响用户的实际使用,其质量优劣、价格高低往往决定了市场供给。抗菌药物品种同样会对临床的实际选择和应用产生影响,研究抗菌药物产品供应目录可从侧面反映临床应用中发生的问题。为此,笔者拟通过比较中美两国抗菌药物产品目录,分析两国的抗菌药物品种数、品规数、产品数、儿童剂型及生产企业集中度的差异,为相关部门提供参考。
1 资料与方法
1.1资料来源
我国的抗菌药物产品目录来源于国家食品药品监督管理总局(CFDA),通过公开的数据查询入口,选取截至2014年2月收录的全部药品数据,统计所有全身用抗菌药物品种(简称“我国目录”)[4];美国的抗菌药物产品目录来源于美国FDA于2015年2月发布的国家药品代码(NDC)目录(简称“NDC目录”)[5]。排除标准包括:(1)各种含抗菌药物的原料药、外用制剂;(2)植物成分的抗感染药及其制剂;(3)抗结核药;(4)抗寄生虫药;(5)抗病毒药;(6)抗麻风病药。
1.2方法
将抗菌药物所含的起主要治疗作用的成分(不包含其盐基及酸根)及其复方成分定义为主成分,相同主成分名称的药物定义为一个品种;同一品种下相同规格和剂型定义为一个品规;药品生产企业所生产的一个品规即为一个抗菌药物产品。应用Excel表,分别对我国目录和NDC目录中的抗菌药物名称、规格、厂家等相关属性信息进行标准化处理,并对所有抗菌药物的主成分以WHO解剖治疗化学结构分类(ATC)代码进行标记分类。按ATC分类比较我国目录和NDC目录中的抗菌药物品种数、品规数、产品数、儿童剂型,以及抗菌药物产品数列前10位的生产企业的相关情况。
2 结果
2.1中美两国目录中抗菌药物品种数、品规数和产品数比较
参照WHO的ATC分类法,可将抗菌药物分为四环素类、大环内酯类、β-内酰胺类与青霉素类等11大类。中美两国目录中抗菌药物品种数、品规数和产品数比较见表1。
由表1可见,我国目录和NDC目录中的抗菌药物产品数分别有23 824、3 139个,品种数分别有191、84个,品规数分别有1 392、460个。我国目录中每个抗菌药物品种对应的产品数平均产品为124.73个(23 824/191),品规数平均为7.23个(1 392/191);NDC目录中每个抗菌药物品种对应的产品数平均产品为37.37个(3 139/84),品规数平均为5.47个(460/84)。
2.2中美两国目录中抗菌药物的品种数比较
经笔者比较,NDC目录中有16种抗菌药物未在我国目录内。其中,头孢洛林、非达霉素、奥利万星、达巴万星、泰地唑胺等5种是由美国FDA于2010-2014年陆续批准上市的新型抗菌药物[6-7];头孢替坦、多尼培南、泰利霉素、泰拉万星等4种是由美国FDA于2004-2009年陆续批准上市的抗菌药物。另外,去甲金霉素因不良反应较多,临床应用受限,并未在我国申请上市;头孢布烯虽在美国上市多年,国内也有众多生产企业申请仿制,但均未获CFDA批准。NDC目录中的抗菌药物品种数统计见图1(注:图中“*”表示未列入我国目录中的品种)。
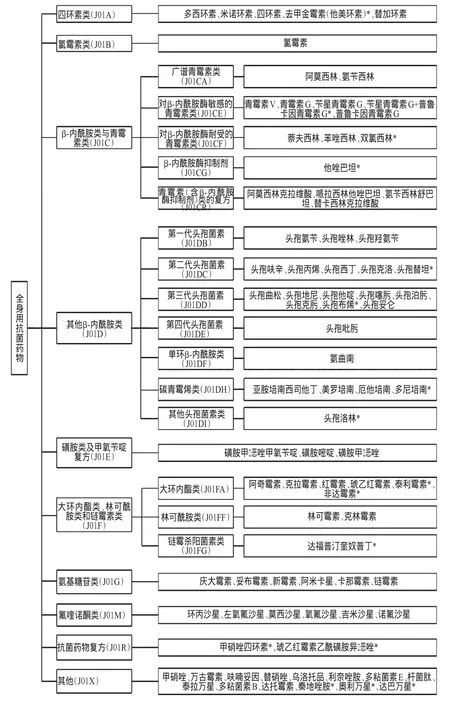
图1 NDC目录中的抗菌药物品种数统计Fig 1 Types of antibacterial agent in NDC directory
2.3中美两国目录中抗菌药物产品数列前10位生产企业的产品数比较
我国目录中有2 243家抗菌药物生产企业,其中产品数列前10位的企业共生产了1 499个产品,占总产品数的6.29%;NDC目录中有231家抗菌药物生产企业,其中产品数列前10位的企业共生产了1 057个产品,占总产品数的33.67%。由此表明,我国目录中抗菌药物生产企业的集中度较NDC目录更低。中美两国目录中抗菌药物产品数列前10位生产企业的产品数比较见表2。
2.4中美两国目录中抗菌药物儿童剂型比较
儿童作为一个特殊的群体,其身体正处于发育阶段,药物在体内的吸收、代谢、排泄过程与成人有所不同,因此某些药品需要儿童专用剂型;并且,儿童的给药途径和使用方法也与成人不同,采用适宜的给药方式和方法可提高其用药依从性。Strickley RG等[8]对美国市场的儿童口服制剂进行分析,发现共有17个剂型,其中一类为随时可用剂型,包括溶液剂、混悬剂、糖浆剂等;另一类为经处理后可用剂型,即必须经过一定的方法处理(如颗粒剂必须冲泡)后才能服用。经统计表明,我国目录中的191个抗菌药物,共有51个拥有溶液剂、混悬剂、糖浆剂、颗粒剂等儿童口服剂型;NDC目录中的84个抗菌药物,共有26个含有溶液剂、混悬剂、糖浆剂、颗粒剂等儿童口服剂型。

表2 中美两国目录中抗菌药物产品数列前10位生产企业的产品数比较Tab 2 Comparison of the number of products in enterprises with the top 10 product number in antibacterial agents directory between China andAmerica
3 讨论
3.1中美两国抗菌药物目录的结构比较
与NDC目录相比,我国目录中抗菌药物呈现出品种多、品规多、产品多(简称“三多”)的特点。尽管中美两国抗菌药物目录中品种数和品规数的差距较小,但是产品数差距较大,我国目录中抗菌药物产品数是NDC目录中抗菌药物的7.54倍(23 824/3 139)。“三多”现象反映出我国抗菌药物市场供应充足,临床上抗菌药物品种的选择空间较大。根据《药品注册管理办法》规定,新药是指未在我国境内上市销售的药品;对于已上市销售的、通过改变剂型、改变给药途径、增加新适应证的药品,其注册需要按照新药的申请程序重新进行申报[9]。这使得我国同一种药品下可有不同剂型或不同规格的仿制药,而且同一品规下又有不同企业在同时生产。举例来说,阿奇霉素在CFDA网站中可检索到各个剂型和规格共630个批准文号。目前,基于我国的新药研发基础和实力、制药行业发展与市场需求、经济发展状况,预计在相当长的时期内仿制药仍将成为我国医药卫生体系的支撑和基本保障[10]。据近年来的调查显示,某些国产抗菌药物的抗菌效果与进口抗菌药物相比仍存在一定差距[11-13],因此需要进一步加强对抗菌药物的质量控制。
3.2中美两国目录中抗菌药物品种数差异比较
NDC目录中有16种抗菌药物尚未在我国上市,其中10种是2004-2014年被美国FDA陆续批准上市的新品种。我国目录中的抗菌药物品种虽然较NDC目录更为丰富,给临床提供了较大的选择空间,但是也存在一些无突出优势、价格较高的品种,如同为第一代头孢菌素的头孢西酮、头孢硫脒,与头孢唑林等相比在抗菌谱上并无明显优势,价格却高出许多。
3.3中美两国目录中抗菌药物生产企业的产品数比较
经统计表明,我国目录中有2 243家抗菌药物生产企业,是NDC目录中的9.71倍(2 243/231)。我国目录中抗菌药物产品数列前10位的企业共生产了1 499个产品,仅占抗菌药物总产品数的6.29%;NDC目录中抗菌药物产品数列前10位的企业共生产了1 057个产品,占抗菌药物总产品数的33.67%。由此可见,我国制药企业虽然数量较多,但较为分散,美国抗菌药物生产企业的集中度要远远高于我国,这与国内其他调查结果一致[14]。另有资料显示,我国市场上进口抗菌药物的销售金额要大于国产抗菌药物的销售金额[15],也表明我国制药企业的数量虽然较多,但市场竞争力还不强。
4 结语
通过以上分析表明,我国的抗菌药物品种数、品规数虽然较为丰富,甚至超过了美国,为临床的药品选择提供了较大空间,但是品种的结构和产品的内在质量未必达到了满足临床需求的程度,相反却可能导致临床选用面临良莠难辨的问题,应引起相关部门重视。为此,笔者建议,一方面要对抗菌药物的批准和生产实施严格审批,同时也应对已上市品种进行重新遴选和评价,采用价格或市场机制,优胜劣汰。
[1]马培奇.抗生素市场现状及研发进展[J].中国制药信息,2012,28(5):34.
[2]干荣富.我国抗感染药物市场现状与发展趋势简析[J].上海医药,2010,31(9):398.
[3]陈世才,赵志刚,王莉文.北京地区社区医疗机构抗感染药物利用分析[J].药品评价,2010,7(4):32.
[4]国家食品药品监督管理总局.数据查询[EB/OL].(2014-09-02)[2015-04-01].http://www.sfda.gov.cn/WS01/CL 0001.html
[5]Drug Approvals and Databases.National drug code directory[EB/OL].(2015-02-22)[2015-04-01].http://www. fda.gov/drugs/informationondrugs/ucm142438.html.
[6]Drug Innovation.New molecular entity and new therapeutic biological product approvals for 2014[EB/OL].(2015-05-27)[2015-07-01].http://www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugInnovation/ucm429247.html.
[7]李轩,都晓春,张蕾.2014年美国FDA批准的新药分析[J].中国药事,2015,29(6):618.
[8]Strickley RG,Lwata Q,Wu S,et al.Pediatric drugs:a review of commercially available oral formulations[J].J Pharm Sci,2008,97(5):1 731.
[9]周迪,张方.我国化学药品注册管理体系的发展过程及现状[J].中国药业,2015,24(2):11.
[10]倪凯.跨国医药企业专利药到期对我国仿制药企业的影响[J].亚太传统医药,2012,8(7):1.
[11]静艳,邱萍,王桂良,等.国产头孢哌酮舒巴坦钠与进口头孢哌酮舒巴坦钠治疗胆道感染的成本效果分析[J].海峡药学,2015,27(4):254.
[12]王燕萍,李德榜,董春禄.国产美罗培南与进口亚胺培南西司他丁预防重症急性胰腺炎腹腔感染的随机对照研究[J].中国药房,2012,23(18):1 682.
[13]李松,吴育罗,梁春杰,等.国产与进口头孢他啶治疗新生儿呼吸窘迫综合征合并肺炎临床随机对照研究[J].儿科药学杂志,2015,21(7):27.
[14] Thach SV.High regulation and low certainty:marketing strategy challenges for the pharmaceutical industry in China[J].J Inter Bus E,2015,16(1):1.
[15]张顺国,陈敏玲.上海地区81家医院2006-2009年抗感染药利用分析[J].中国药房,2010,11(46):4 323.
(编辑:杨小军)
Comparison of Antibacterial Agent Products Directory between China and America
LIU Zhengyue,WANG Hui,CHEN Zhongshe,YANG Zhangwei
(Dept.of Pharmacy,the First Affiliated Hospital of Second Military Medical University,Shanghai 200433,China)
OBJECTIVE:To investigate the differences of antibacterial agent products directory between China and America,and to provide reference for the relevant departments.METHODS:Using domestic and imported drug data released by China Food and Drug Administration(CFDA)and national drug code(NDC)issued by America Food and Drug Administration(FDA),antibacterial drugs of China and America were analyzed comparatively in respects of types,specification,the number of products,child-size dosage form,concentration ratio of manufacturers.RESULTS&CONCLUSIONS:In CFDA's and FDA's directory of antibacterial drugs,the number of type,specification and product were 191 and 84,460 and 1 392,23 824 and 3 139,respectively.The number of child-size dosage form were 51 and 26.The number of products in enterprises with the top 10 product number accounted for 6.29%and 33.67%.In China,the type and specification of antibacterial drugs are abundant but low.It is recommend that antibacterial drugs'approval should be examined and supervised strictly.At the same time,products already marketed should be reselected and revaluated,and price or market mechanism should be adopted to promote the survival of the fittest of antibacterial drugs.
Antibacterial agents;Product directory;Specification;National drug list;America
R95
A
1001-0408(2016)22-3031-03
10.6039/j.issn.1001-0408.2016.22.03
*药师。研究方向:药学信息化。电话:021-31162307。E-mail:zhengyue_liu@163.com
副主任药师。研究方向:药事管理、临床药学。电话:021-31162298。E-mail:15021062866@139.com
2015-08-21
2015-10-28)

