茶树丙氨酸氨基转移酶基因的克隆与表达分析
白培贤,王丽鸳,韦康,阮丽,成浩,张芬,张成才
1.中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081
茶树丙氨酸氨基转移酶基因的克隆与表达分析
白培贤1,2,王丽鸳1*,韦康1,阮丽1,成浩1,张芬1,2,张成才1,2
1.中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081
丙氨酸氨基转移酶(Alanine Aminotransferase,AlaAT)是与碳氮代谢相关的一种重要酶类。采用反转录PCR的方法克隆了茶树CsAlaAT1的cDNA序列,该序列全长1 747 bp,包含一个完整的ORF(1 626 bp),编码 541个氨基酸,推导的蛋白质分子量为 59.4 kD,理论等电点(pI)为 5.82。同源比对结果表明,CsAlaAT1含有丙氨酸氨基转移酶亚家族保守的辅酶磷酸吡哆醛结合位点,其氨基酸序列与拟南芥 AtAlaAT1蛋白的相似性为84%。二级结构预测显示该蛋白由α-螺旋(40.67%)、无规则卷曲(29.57%)、β-折叠(13.68%)和延伸链(16.08%)组成,定位于线粒体,不含信号肽与跨膜结构。实时荧光定量PCR(RT-PCR)检测发现CsAlaAT1在茶树各组织中均有表达,在根中的表达量最高;CsAlaAT1基因表达对氮素的响应研究表明,成熟叶中CsAlaAT1受氮素诱导上调表达,高浓度(1 mmol·L-1NH4NO3)氮素的诱导效应比低浓度(0.1 mmol·L-1NH4NO3)氮素诱导效应更强烈;在根中,处理24 h后,高氮诱导CsAlaAT1上调表达,低氮诱导CsAlaAT1下调表达。
茶树;丙氨酸氨基转移酶;克隆;表达;氮素诱导
氮素是植物生长发育过程中需求量最大的矿质元素,氮素供应不足会严重影响农作物的产量。为了保证产量,在现代农业生产过程中往往施用大量氮肥。但是大多数农作物对氮肥的利用率只有三分之一,其余因流失而造成环境污染[1]。因此借助基因工程手段培育氮高效利用品种,成为降低氮肥施用量、减少环境污染的有效途径之一[2]。
茶树作为叶用作物,其氮素利用率只有18.4%~44.7%[3],选育氮素利用效率高的品种一直是茶树育种工作者的目标之一。茶树的氮素吸收利用率主要取决于其吸收、同化以及运输分配到收获器官中的能力。目前茶树中氮素吸收同化相关基因NR[4](Nitrate reductase)、NRT[5-6](Nitrate transporters)、GS[7](Glutamine synthetase)、GOGAT(Glutamine-α-oxoglutarate aminotransferase )、GDH[8](Glutamate dehydrogenase)以及相关的 DOF转录因子[9]已经被克隆。近来研究发现,氮素同化的下游途径基因也可以调控植物对氮素的吸收利用[10]。
丙氨酸氨基转移酶(Alanine aminotransferase,AlaAT)催化丙氨酸和α-酮戊二酸形成丙酮酸和谷氨酸[11],是植物体内与碳氮代谢相关的一种重要酶类[12]。丙氨酸氨基转移酶家族包含 4个成员,其中AlaAT1 和AlaAT2编码AlaAT蛋白;GGAT1和GGAT2具有谷氨酸-乙醛酸氨基转移酶(Glutamateglyoxylate aminotransferase,GGAT)活性[13-14]。在拟南芥的叶、根和花器官[13],水稻的果实[15]、内胚乳[16]中,均可检测到AlaAT酶的活性。有研究显示,AlaAT参与了光合作用的C4途径[17-18]和 L-丙氨酸的转氨降解途径。植物AlaAT酶活性受到光照刺激的调控。例如,黄化的黍稷幼苗受到光刺激后,叶片中的AlaAT-2基因上调表达[18]。AlaAT酶活性还受到低氧胁迫的调控,参与解除低氧胁迫后丙氨酸的降解过程[2]。有研究将大麦[10-19]的HvAlaAT基因转入水稻和欧洲油菜中,转基因植株不仅产量得到显著提高,其生物量也显著增加,这暗示着AlaAT基因在以采叶为主的茶树中,可能具有同样的增产和改善氮素利用效率的作用,而茶树上尚无关于AlaAT基因的报道。本研究根据茶树根转录组测序获得的AlaAT的 cDNA 全长序列,克隆了茶树CsAlaAT1基因,并分析该基因的组织表达特性及氮素对该基因表达的影响,为进一步研究该基因在氮素吸收利用及低氧胁迫中的作用提供研究基础。
1 材料与方法
1.1茶树CsAlaAT1基因的克隆
1.1.1总RNA提取和第一链cDNA的合成
采用天根多糖多酚植物总RNA提取试剂盒(离心柱型),提取龙井43叶片中的总RNA,并用 1%的琼脂糖凝胶检测完整性,采用Takara PrimeScriptTM 1st Strand cDNA Synthesis Kit将RNA反转录为cDNA。
1.1.2目的基因的全长验证
根据转录组中获得的CsAlaAT1的核酸序列,用DNAStar软件包中的EditSeq软件查找该基因的开放阅读框(ORF),并根据ORF两侧的序列设计引物,正向引物:GTGCAAAATGTGGAAATTCGTAGC;反向引物:CAAGGGGCAAGGTTGGATTTG。用该引物做PCR对CsAlaAT1基因的ORF进行扩增,以 0.5 μL第一链 cDNA为模板,加入10×LA Taq bufferⅡ(Mg2+,plus)5 μL,dNTPMix(2.5 mmol·L-1each)8 μL,正反向引物各 1.5 μL,LA Taq(50 U·μL-1)0.5 μL,加灭菌的ddH2O至20 μL。反应程序为:94℃预变性,94℃变性30 s,60℃退火30 s,72℃延伸2 min,30个循环,72℃延伸10 min。PCR产物经琼脂糖凝胶电泳验证目标条带,用AxyPrep DNA Gel Extraction Kit进行回收,回收产物链接pMD18-T载体后,转化至大肠杆菌DH5α感受态细胞,菌落PCR挑选阳性克隆送往上海华津生物科技有限公司测序。测序结果用 MEGA 6.0软件比对后发现克隆的cDNA序列具有CsAlaAT1基因完整的ORF。
1.2生物信息学分析
采用BioEdit软件对本研究获得的CsAlaAT1基因的cDNA序列进行ORF查询后输出氨基酸序列。在ExPASy网站(http://www.expasy.org/resources)用ProtParam软件推导蛋白质的分子量和理论等电点,SignalP预测信号肽,TMHMM预测跨膜螺旋,PredictProtein进行蛋白质的二级结构预测和亚细胞定位。在NCBI网站上swiss-prot数据库中搜索CsAlaAT1的同源蛋白,用MEGA 6.0邻接法构建系统发生树,并在ClustalW软件上进行多序列比对,在 GeneDoc中编辑输出。SWISS-MODEL模拟 CsAlaAT1蛋白质三维结构,并用Swiss-PdbViewer编辑输出。
1.3氮素响应试验
参试材料为龙井43、中茶108和中茶302 等3个品种的2年生扦插苗,水培于温室中。水培溶液的配方参照Ruan等[20]稍作调整,包括大量元素N(0.2 mmol·L-1或2 mmol·L-1),P(0.07 mmol·L-1),K(0.67 mmol·L-1),Ca(0.53 mmol·L-1),Mg(0.67 mmol·L-1)和微量元素Zn(0.67 µmol·L-1),Cu(0.13 µmol·L-1),Mn(1.0 µmol·L-1),B(7.0 µmol·L-1),Mo(0.33 µmol·L-1),Fe(4.2 µmol·L-1),Al(70 µmol·L-1)及EDTA盐(4.2 µmol·L-1)。
长势良好的茶苗氮饥饿预培养两周后,分别在低氮(0.1 mmol·L-1NH4NO3)和高氮(1 mmol·L-1NH4NO3)浓度的营养液中进行处理,每隔2 d换一次营养液。于氮素处理后0、24、72、120、168 h时取样,第一次取样时间为上午10:00,每次取3株茶苗的一芽二叶,成熟叶和嫩根组织,用蒸馏水清洗后转入液氮,-80℃保存备用。
1.4茶树CsAlaAT1基因的表达分析
利用在线软件Primer-blast设计荧光定量PCR引物,正向引物:TCCCGGTCTATG GGGTATGG,反向引物:CTCCAACCTT GGGAGGGTTC,反应体系参照胡娟等[9]。反应程序:95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。反应在 ABI 7500实时荧光定量PCR仪上进行,4次技术性重复,以GAPDH为内参基因,用法计算结果。
2 结果与分析
2.1CsAlaAT1基因的克隆与序列分析
反转录PCR扩增得到CsAlaAT1的cDNA(图1)。经测序,获得的cDNA全长1 747 bp,编码序列区长度为1 626 bp,编码541个氨基酸残基。预测的蛋白质相对分子质量为 59.4 kD,理论等电点(pI)为5.82,总平均亲水性:-0.174,为亲水性蛋白,不稳定指数:47.40,表示该蛋白在植物体内可能不稳定。
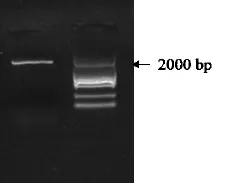
图1 CsAlaAT1基因RT-PCR电泳结果Fig.1 Electrophoresis results of CsAlaAT1 cloning by RT-PCR

注:a:磷酸吡哆醛结合位点;b:同源二聚体接触面;c:催化位点。AtAlaAT2:拟南芥AlaAT2(sp_Q9LDV4.1);AtAlaAT1:拟南芥AlaAT1(sp_F4I7I0.1);CsAlaAT1:茶树AlaAT1;HvAlaAT2:大麦AlaAT2(sp_P52894.1);PmAlaAT2:黍稷AlaAT2(sp_P34106.1)。Note:a:pyridoxal 5′-phosphate binding site.b:homodimer interface.c:catalytic residue.AtAlaAT2:Arabidopsis thaliana AlaAT2(sp_Q9LDV4.1).AtAlaAT1:Arabidopsis thaliana AlaAT1(sp_F4I7I0.1).CsAlaAT1:Camellia sinensis AlaAT1.HvAlaAT2:Hordeum vulgare AlaAT2(sp_P52894.1).PmAlaAT2:Panicum miliaceum AlaAT2(sp_P34106.1).图2 CsAlaAT1与其他植物AlaAT蛋白序列同源比对Fig.2 Alignment of the protein sequences of CsAlaAT1 and AlaATs from other species
2.2同源比对和系统发生树的构建
在NCBI网站上,将推测的CsAlaAT1氨基酸序列于swiss-prot数据库中进行BLASTP同源序列搜索并进行多序列比对(图 2),结果显示,CsAlaAT1与拟南芥(Arabidopsis thaliana)AlaAT1、AlaAT2,大麦(Hordeum vulgare)和黍稷(Panicum miliaceum)AlaAT2的相似性分别为 78%,84%,72%,79%,CsAlaAT1具有丙氨酸氨基转移酶亚家族保守的辅酶磷酸吡哆醛结合位点,属于丙氨酸氨基转移酶亚家族。将茶树CsAlaAT1的氨基酸序列与拟南芥、水稻(Oryza sativa)、亚麻荠(Camelina sativa)、大豆(Glycine max)、黄瓜(Cucumis sativus)、玉米(Zea mays)、大麦7个物种的14条AlaAT蛋白序列在MEGA 6.0中进行比对分析,并用邻接法构建系统发生树(图3)。结果表明,不同物种的AlaAT1 与AlaAT2蛋白并没有聚在一起,表明AlaAT基因的演化情况比较复杂;茶树AlaAT1与黄瓜 AlaAT2、大豆 AlaAT1聚在一起,推测CsAlaAT1与之具有相似的生物学功能。
2.3CsAlaAT1的结构预测
二级结构预测显示CsAlaAT1蛋白主要由α-螺旋(40.67%)和无规则卷曲(29.57%)组成,β折叠(13.68%)和延伸链(16.08%)仅占一小部分,不含信号肽(图4左),无跨膜结构(图 4右),定位于线粒体(图 5)。在SWISS-MODEL中进行三维结构预测(图6),结果表明,CsAlaAT1蛋白为同源二聚体,其推测的催化位点为第358位的赖氨酸残基。
2.4CsAlaAT1基因的表达分析
2.4.1组织表达特性
将龙井43、中茶108和中茶302 3个品种的 2年生无性系茶苗在正常氮素浓度的营养液中培养7天后,对其一芽二叶、成熟叶和嫩根中CsAlaAT1基因的表达量进行检测,结果(图7)显示,CsAlaAT1基因在3个组织中均有表达,且在根中的表达量高于一芽二叶和成熟叶。CsAlaAT1基因表达的组织特异性在品种间存在差异。龙井 43和中茶 108的CsAlaAT1基因在一芽二叶、成熟叶和嫩根中的表达量依次递增,中茶302的CsAlaAT1基因表达量在嫩根、一芽二叶和成熟叶中依次递减。
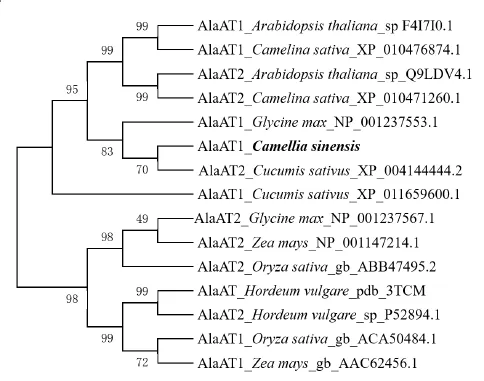
图3 不同物种AlaAT蛋白的系统发生树Fig.3 Phylogenetic tree of AlaAT proteins from various species
2.4.2CsAlaAT1基因时空表达对不同氮素水平的响应
氮饥饿2周后,高氮处理后茶苗的一芽二叶、成熟叶和根中CsAlaAT1基因的表达量均高于低氮处理(图8)。表明CsAlaAT1基因表达对高氮素水平的响应更强烈。
高氮培养24 h内,CsAlaAT1基因在各组织的表达量均上调,一芽二叶、成熟叶中的表达量分别增加到原始表达量的1.7和2.2倍,24 h后呈下降趋势;一芽二叶中的表达量在120 h降至最低,之后又迅速增加;根中的表达量在 72 h达到最大,之后缓慢下降。在低氮水平下,一芽二叶中CsAlaAT1基因的表达量呈现略微上调趋势;成熟叶中的表达量在72 h内上调,120 h之后逐渐下降;根中的表达量在24 h内增长,之后呈下降趋势,120 h达到最低,随后又呈增加趋势。总体而言,高氮条件下,CsAlaAT1基因上调表达;在低氮处理24 h之后,CsAlaAT1基因在一芽二叶和成熟叶中上调表达,在根系中下调表达。
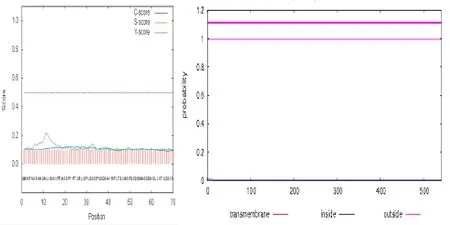
图4 SignalP和TMHMM软件预测CsAlaAT1蛋白信号肽和跨膜螺旋Fig.4 Prediction of signal peptide and transmembrane helix in CsAlaAT1 by SignalP and TMHMM respectively
图5 PredictProtein预测CsAlaAT1的亚细胞位置Fig.5 Subcellular location prediction of CsAlaAT1 by PredictProtein
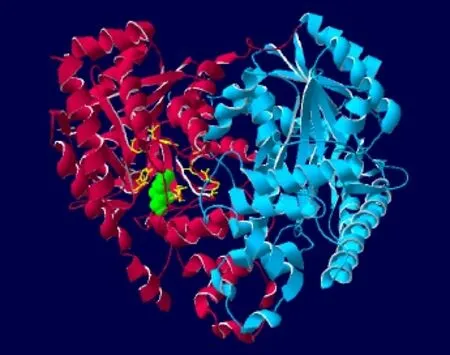
图6 通过在线软件SWISS-MODEL预测的CsAlaAT1蛋白三维结构Fig.6 Three-dimensional structure prediction of protein CsAlaAT1 by online software SWISS-MODEL

图7 CsAlaAT1基因在不同组织的表达水平Fig.7 Relative expression levels of CsAlaAT1 in different tissues of tea plants
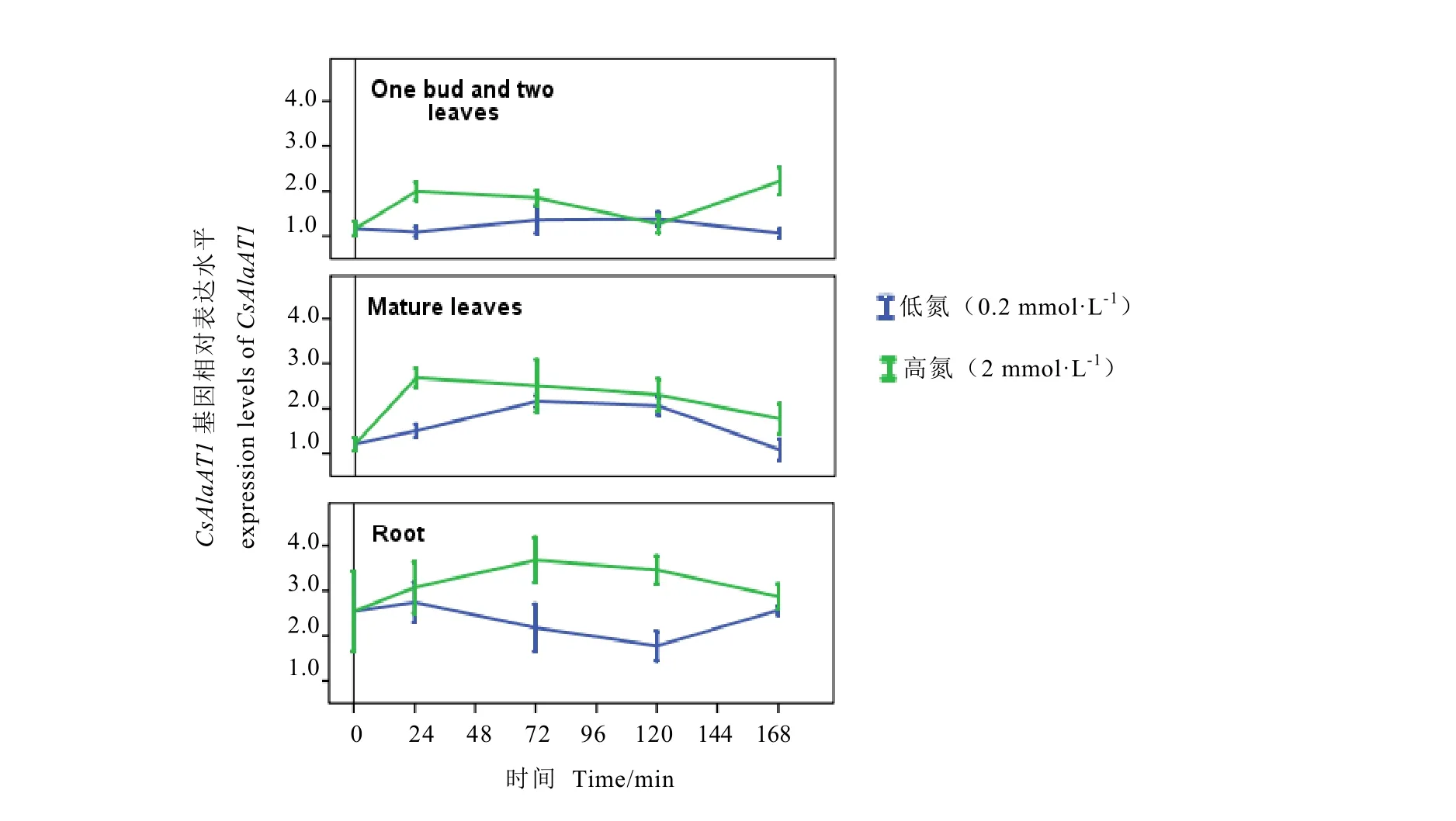
图8 在低氮和高氮处理下茶树CsAlaAT1基因不同时间的表达水平Fig.8 Time course of relative expression levels of CsAlaAT1 under low and high nitrogen levels
3 讨论
3.1茶树CsAlaAT1基因的克隆及其序列分析
茶树叶片中克隆出的CsAlaAT1基因编码541个氨基酸,与拟南芥、大麦和黍稷的AlaAT相似性达70%以上,属于丙氨酸氨基转移酶亚家族。预测CsAlaAT1不含信号肽,无跨膜结构,定位于线粒体。这与拟南芥AtAlaAT2同样位于线粒体的预测结果相一致[14,21]。AtAlaAT位于线粒体可能与其代谢功能直接相关[22],线粒体 AlaAT似乎可以通过增加丙酮酸含量而激活线粒体中的交替氧化酶,从而调节植物的呼吸氧耗[23]。
3.2CsAlaAT1组织表达特性及其对氮素响应的时空表达差异
Rocha等[12]研究表明 AlaAT-A类基因在根系和结节中表达量最高,因此推测,AlaAT基因功能的发挥可能更多地依赖于根系。Miyashita等[11]发现拟南芥 AlaAT基因主要在叶片和根系的维管组织中表达,推测 AlaAT酶可能在丙酮酸或者丙氨酸的转运过程中发挥重要作用,有利于维持整株植物的碳氮平衡[23]。本研究组织表达特性检测表明,CsAlaAT1基因在各组织中均有表达,在根中表达量最高,这与其他植物中的研究结果一致。
CsAlaAT1在不同品种间的表达特性也存在差异。中茶302的一芽二叶中,该基因的表达量高于成熟叶,为其他两个品种一芽二叶中的2倍以上。有研究显示,在相同栽培条件下,中茶 302茶苗的生长势以及鲜叶产量均高于中茶108和龙井43[24],因此推测该基因表达量的品种间差异与生长势差异相关。AlaAT是与氮代谢相关的一种酶,中茶302一芽二叶中CsAlaAT1的高表达,可能有利于茶苗对氮素的利用,进而促进其生物量的增加。
AlaAT基因的表达受氮素调控。Kendziorek等[22]研究表明,小麦在缺氮培养基上培养5 d后,芽和根中的AlaAT酶活性降低了一半以上,而在正常培养基上培养的小麦中,AlaAT酶活性保持不变。氮素胁迫解除后恢复供氮短期内,黍稷[17]叶片中AlaAT2基因的表达量增加了3倍,玉米[25]根系中的AlaAT基因的表达量增加了14倍。本研究对茶苗在氮饥饿2周后,分别用低氮和高氮进行处理,恢复供氮24 h内,CsAlaAT1基因均上调表达,表明茶树CsAlaAT1基因对氮素诱导有响应。高氮处理下,CsAlaAT1基因的表达量更高,表明CsAlaAT1基因的时空表达对高氮水平的响应更强烈;其一芽二叶和成熟叶中表达量均增加了2倍左右,根系中增加了约1.2倍,较之黍稷叶片(3倍)和玉米根系(14倍),CsAlaAT1基因的表达增量较低。本研究推测茶树作为木本植物,调控机制较为复杂,多途径参与对氮素的响应是造成该差异的原因。在根中,高氮处理24 h后,CsAlaAT1上调表达,而低氮处理24 h后,CsAlaAT1表达出现下调,其他作物中并没有关于不同浓度氮素对CsAlaAT1基因表达调控的报道。本研究发现,CsAlaAT1在不同氮素浓度下表达模式不同,推测CsAlaAT1基因受氮素有效性的调节,但是该基因与茶树氮素吸收和同化的关系有待进一步研究。
[1]Raun WR,Solie JB,Johnson GV,et al.Improving nitrogen use efficiency in cereal grain production with optical sensing and variable rate application [J].Agron J,2002,94(4):815-820.
[2]de Sousa CAF,Sodek L.Alanine metabolism and alanine aminotransferase activity in soybean(Glycine max)during hypoxia of the root system and subsequent return to normoxia [J].Environ Exp Bot,2003,50(1):1-8.
[3]吴洵,茹国敏.茶树对氮肥的吸收和利用[J].茶叶科学,1986,6(2):15-24.
[4]周月琴,庞磊,李叶云,等.茶树硝酸还原酶基因克隆及表达分析[J].西北植物学报,2013,33(7):1292-1297.
[5]冯素花.茶树硝酸根转运蛋白 NRT1.2、NRT1.5、NRT2.5基因的克隆与表达[D].杭州:中国农业科学院茶叶研究所,2014.
[6]汪进,添先凤,江昌俊.茶树硝酸盐转运蛋白基因的克隆与表达分析[J].植物生理学报,2014,50(7):983-988.
[7]徐乾.茶树中与氨基酸合成相关的三个基因的克隆与分析[D].合肥:安徽农业大学,2012.
[8]林郑和,钟秋生,陈常颂.茶树叶片 GDH、GS、GOGAT基因的克隆及荧光定量 PCR分析[J].茶叶科学,2012,32(6):523-529.
[9]胡娟,王丽鸳,韦康.茶树 CsCDF1基因克隆及表达分析[J].茶叶科学,2015,35(5):501-511.
[10]Good AG,Johnson SJ,De Pauw M.Engineering nitrogen use efficiency with alanine aminotransferase [J].Can J Bot,2007,85(3):252-262.
[11]Miyashita Y,Dolferus R,Ismond KP,et al.Alanine aminotransferase catalyses the breakdown of alanine after hypoxia in Arabidopsis thaliana [J].Plant J,2007,49(6):1108-1121.
[12]Rocha M,Sodek L,Licausi F.Alalysis of alanine aminotransferase in various organs of soybean(Glycine max)and in dependence of different nitrogen fertilisers during hypoxic stress [J].Amino Acids,2010,39(4):1043-1053.
[13]Igarashi D,Miwa T,Seki M,et al.Identification of photorespiratory glutamate:glyoxylate aminotransferase(GGAT)gene in Arabidopsis [J].Plant J,2003,33(6):975-987.
[14]Liepman AH,Olsen LJ.Alanine aminotransferase homologs catalyze the glutamate:glyoxylate aminotransferase reaction in peroxisomes of Arabidopsis [J].Plant Physiol,2003,131(1):215-227.
[15]Rech J,Crouzet J.Partial purification and initial studies of the tomato L-alanine:2-oxoglutarate aminotransferase [J].Biochim Biophys Acta,1974,350(2):392-399.
[16]Kikuchi H,Hirose S,Toki S,et al.Molecular characterization of a gene for alanine aminotransferase from rice(Oryza sativa)[J].Plant Mol Biol,1999,39(1):149-159.
[17]Son D,Kobe A,Sugiyama T.Nitrogen-dependent regulation of the gene for alanine aminotransferase which is involved in the C4 pathway of panicum miliaceum [J].Plant Cell Physiol,1992,33(8):507-509.
[18]Son D,Sugiyama T.Molecular cloning of an alanine aminotransferase from NAD-malic enzyme type C4plant Panicum miliaceum [J].Plant Mol Biol,1992,20(4):705-713.
[19]Shrawat AK,Carroll RT,DePauw M.Genetic engineering of improved nitroge use efficiency in rice by the tissue-specific expression of alanine aminotransferase [J].Plant Biotechnology Jorunal,2008,6(7):722-732.
[20]Ruan J,Gerendas J,Hardter R,et al.Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea(Camellia sinensis)plants [J].Ann Bot,2007,99(2):301-310.
[21]Ricoult C,Echeverria LO,Cliquet JB,et al.Characterization of alanine aminotransferase(AlaAT)multigene family and hypoxic response in young seedlings of the model legume Medicago truncatula [J].J Exp Bot,2006,57(2):3079-3089.
[22]Kendziorek M,Paszkowski A,Zagdanska B.Differential regulation of alanine aminotransferase homologues by abiotic stresses in wheat(Triticum aestivum L.)seedlings [J].Plant Cell Rep,2012,31(6):1105-1117.
[23]Gupta KJ,Zabalza A,van Dongen JT.Regulation of respiration when the oxygen availability changes [J].Physiol Plant,2009,137(4):383-391.
[24]阚君杰,丁仕波.山东日照市茶树无性系良种引种试验初报[J].茶业通报,2015,37(2):66-70.
[25]Muench DG,Good AG.Hypoxically inducible barley alanine aminotransferase:cDNA cloning and expression analysis [J].Plant Mol Biol,1994,24(3):417-427.
Cloning and Expression Analysis of Alanine Aminotransferase Gene in Camellia sinensis
BAI Peixian1,2,WANG Liyuan1*,WEI Kang1,RUAN Li1,CHENG Hao1,ZHANG Fen1,2,ZHANG Chengcai1,2
1.Tea Research Institute,Chinese Academy of Agricultural Sciences,National Center for Tea Improvement,Key Laboratory of Tea Biology and Resource Utilization,Ministry of Agriculture,Hangzhou 310008,China;
2.Graduate School of Chinese Academy of Agricultural Sciences,Beijing 100081,China
Alanine Aminotransferase(AlaAT)is a critical enzyme involved in carbohydrate and nitrogen metabolisms.In this study,a cDNA(1 747 bp)with a complete ORF(1 626 bp)of AlaAT1 was isolated from tea plant(Camellia sinensis).The cDNA encodes a protein with 541 amino acids,which has a molecular mass of 59.4 kD and a theoretical isoelectric point(pI)of 5.82.The deduced sequence of protein CsAlaAT1 shared 84% similarity with AlaAT1 in Arabidopsis thaliana,which contains a highly-conserved pyridoxal 5′-phosphate binding site.Secondary structure prediction showed that the CsAlaAT1 was comprised of alpha helix(40.67%),random coil(29.57%),beta turn(13.68%)and extended strand(16.08%),localized in mitochondrion and had no signal peptide or transmembrane structure.The expression levels of CsAlaAT1 in various tissues and its responses to different N concentration were investigated by real-time fluorescent quantitative RT-PCR.The results of RT-PCR showed that CsAlaAT1 expressed in all tissues of tea plant and the highest transcript level was observed in roots.The transcript abundanceof CsAlaAT1 was up-regulated by N in both shoots and mature leaves,especially under high N condition.Interestingly,the expression of CsAlaAT1 in roots was highly induced high N condition,but showed an opposite trend under low N treatment for 24 h.
tea plant(Camellia sinensis),Alanine aminotransferase,cloning,expression,nitrogen induction
S571.1;Q52
A
1000-369X(2016)04-405-09
2016-03-24
2016-04-21
国家自然科学基金(31570695)、国家现代农业产业技术体系(nycytx-23)、浙江省农业新品种选育重点专项(2012C2905-4)。
白培贤,女,硕士研究生,主要从事茶树种质资源与育种研究。*通讯作者:wangly@tricaas.com

