慢病毒介导PPAR-γ基因对瘢痕疙瘩成纤维细胞增殖、迁移和侵袭性的影响
李晋福,弓军胜,梁 钢,王 鹏,钱会利,陈志婕,张宝林
(1.山西医科大学第一医院整形外科 山西 太原 030001;2.山西医科大学第一医院病理科 山西 太原 030001)
·基础研究·
慢病毒介导PPAR-γ基因对瘢痕疙瘩成纤维细胞增殖、迁移和侵袭性的影响
李晋福1,弓军胜1,梁钢2,王鹏1,钱会利1,陈志婕1,张宝林1
(1.山西医科大学第一医院整形外科山西 太原030001;2.山西医科大学第一医院病理科山西 太原030001)
目的:研究过氧化物酶体增殖物激活受体-γ(PPAR-γ)基因对体外培养的人瘢痕疙瘩成纤维细胞(keloid fibroblasts,KF)增殖、迁移、侵袭性的影响。方法:将携带PPAR-γ及绿色荧光蛋白的慢病毒载体(LV-PPAR-γ-GFP,KF-PPAR-γ组)及空载体(LV-GFP,KF-NC组)感染KF细胞,并设空白对照组(KF组),应用实时定量PCR和Western blot分别检测PPAR-γmRNA及蛋白的表达;MTT法检测KF细胞增殖情况;划痕实验和Trans-well小室实验检测KF细胞的体外迁移和侵袭能力。结果:PPAR-γ慢病毒载体感染KF细胞96 h后,KF-PPAR-γ组PPAR-γmRNA和蛋白的表达量明显高于KF-NC组和KF组,差异有统计学意义(P<0.05);MTT结果显示,KF-PPAR-γ组吸光度A值明显降低,与KF-NC组和KF组比较,差异有统计学意义(P<0.05);划痕实验结果显示划痕后24 h和48 h,KF-PPAR-γ组划痕愈合速度明显慢于KF-NC组(P<0.05);Trans-well侵袭结果显示KF-PPAR-γ组侵袭到下室的细胞数目较KF-NC组明显减少(P<0.05)。结论:慢病毒介导PPAR-γ基因能够抑制KF细胞的增殖、迁移及侵袭能力,提示靶向提高瘢痕疙瘩中PPAR-γ的含量与活性,可能为瘢痕疙瘩的防治提供有效途径。
过氧化物酶体增殖物激活受体-γ;瘢痕疙瘩;成纤维细胞;增殖;迁移;侵袭
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor, PPAR)是一类由配体激活的核转录因子, 属于核内受体超家族成员。1990年Issemann等[1]首先发现了这种能被一类脂肪酸样化合物过氧化物酶体增殖剂(peroxisome proliferators,PP) 激活, 而被命名为PP 激活受体(PPAR)。根据结构的不同,PPAR 可分为α、β(或δ)和γ 3种类型,其中PPAR-γ 基因与脂肪细胞分化、肥胖、胰岛素抵抗、糖尿病及肿瘤等多种疾病密切相关[2],为肿瘤研究提供了新的靶点。瘢痕疙瘩本质为结缔组织肿瘤,向周围正常组织浸润,具有类肿瘤特性[3]。前期研究表明瘢痕疙瘩的形成可能与PPAR-γ 在组织中的低表达有关。提示采用基因疗法提高瘢痕疙瘩中PPAR-γ的含量与活性,可能为瘢痕疙瘩的防治提供有效途径。因此我们构建了过表达PPAR-γ的慢病毒载体,感染瘢痕疙瘩成纤维细胞,探讨过表达PPAR-γ基因对瘢痕疙瘩肿瘤样生物学特性的影响。
1 材料和方法
1.1材料:重组慢病毒LV-PPAR-γ-GFP和LV-GFP由上海吉凯基因生物技术有限公司合成并鉴定,在293T细胞中进行扩增及滴度测定。DMEM培养基、牛血清白蛋白BSA(10g/L,Gibco公司,美国);Trans-well小室(聚碳酸酯膜8.0μm,Chemicon公司,美国)、MTT试剂盒。瘢痕疙瘩标本取自山西医科大学附属第一医院整形科门诊及住院手术患者(标本术后经病理诊断为瘢痕疙瘩),所有患者均排除了其他器质性疾病,在手术切除前未接受其他任何治疗。在征得患者知情同意并签订知情同意书后,切除瘢痕组织进行实验。
1.2方法
1.2.1细胞培养:将切取的瘢痕疙瘩标本剪去表皮和皮下组织,切成1.0~2.0mm3的组织块,采用组织块贴壁法进行瘢痕疙瘩成纤维细胞的原代培养,以含20%胎牛血清、青霉素100U/ml、链霉素100U/ml的DMEM培养液,于37℃,5% CO2、饱和湿度下培养。
1.2.2慢病毒感染KF细胞:感染复数(multiplicity of infection,MOI)为20感染KF细胞,加入Polybrene至终浓度为5mg/L;96h后,荧光显微镜下观察感染效率,继续培养。
1.2.3实时荧光定量PCR检测PPAR-γ基因表达:利用Trizol抽提KF细胞的总RNA,M-MLV反转录酶逆转录成cDNA,实时定量PCR(Real-time PCR)检测PPAR-γ mRNA的表达水平。
PPAR-γ基因的上、下游引物为:
5'-ATTCCATTCACAAGAACAGATCCAG-3'
5'-TTTATCTCCACAGACACGACATTCA-3'
管家基因GAPDH为内参,上、下游引物为:
5'-AGAAGGCTGGGGCTCATTTG-3'
5'-AGGGGCCATCCACAGTCTTC-3'
1.2.4Western印迹检测PPAR-γ蛋白表达:抽提KF细胞总蛋白,BCA蛋白测定试剂盒测定蛋白浓度。SDS-PAGE分离蛋白后电转移至PVDF膜上,5%脱脂牛奶TBST溶液封闭过夜后洗膜,分别加入相应的一抗Mouse anti-PPAR-γ(1∶500稀释)及Mouse anti-GAPDH(1∶5 000稀释),再分别加入二抗Rabbit anti-mouse IgG-HRP(1∶5 000稀释),ECL法显色后化学发光成像仪上显影,并保存图像。
1.2.5MTT测定细胞增殖:取对数生长期的KF细胞,将其分为感染LV-PPAR-γ-GFP慢病毒细胞组(KF-PPAR-γ组),阴性对照组即感染LV-GFP慢病毒细胞组(KF-NC组)和空白对照组即未感染慢病毒细胞组(KF组)。以1×104个/孔接种于96孔板培养,每组3个复孔,实验重复3次,每孔100μl。按MOI为20感染细胞,于不同时间点每孔加入MTT溶液,孵育4 h后离心弃上清,另加入二甲基亚砜(DMSO)振荡数分钟,选择吸光度490 nm波长,在酶标仪上测定各孔的吸光度A值,并记录结果。
1.2.6划痕实验:细胞以5×105个/孔密度接种于6孔板中,待形成细胞单层时,用200μl的枪头在6孔板内均匀划直线,更换含1%PBS的培养基继续培养24h和48h后,在光学显微镜下随机选择5个视野(×40),测量划痕宽度,比较各组划痕愈合的情况。
1.2.7Trans-well侵袭实验:采用24孔Trans-well(8.0μm滤膜微孔)系统。小室内加入40μl基质胶(Matrigel),1∶3稀释,用含0.5%BSA的培养基调整细胞密度为5×105个/L,取200μl细胞悬液加入小室内,下室加入1 000μl含10%FBS的培养基,常规培养24h。用棉签擦去小室上面细胞,固定,HE染色。
1.2.8统计学方法:本实验结果均经SPSS 15.0统计软件分析,计量资料用均数±标准差表示,采用t检验和方差分析比组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1重组慢病毒的感染效率:慢病毒以MOI为20感染KF细胞96 h后,荧光倒置显微镜下观察绿色荧光,结果显示:PPAR-γ慢病毒感染KF细胞达到90%以上感染效率,符合基因治疗对载体的要求(图1)。
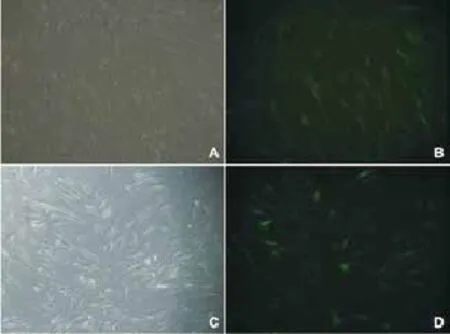
图1 慢病毒介导PPAR-γ基因感染KF细胞:A、B-阳性转染组200倍(KF-PPAR-γ组);C、D-阴性转染组200倍(KF-NC组)
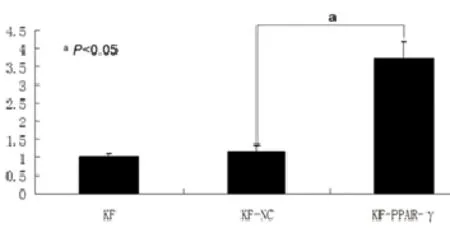
图2 慢病毒介导PPAR-γ基因感染KF细胞PPAR-γ mRNA相对表达量
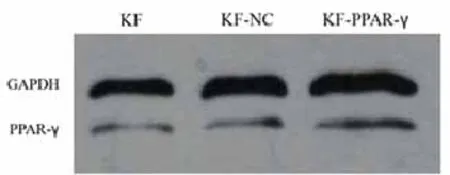
图3 慢病毒介导PPAR-γ基因感染KF细胞后PPAR-γ 蛋白的表达
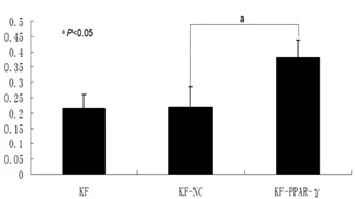
图4 慢病毒介导PPAR-γ基因感染KF细胞后各组PPAR-γ蛋白的表达比较
2.2重组慢病毒感染KF细胞后PPAR-γ mRNA和蛋白表达:慢病毒以MOI为20感染KF细胞96 h后,实时荧光定量PCR结果显示:KF-PPAR-γ组PPAR-γ mRNA表达量明显高于KF-NC组和KF组,差异有统计学意(P<0.05,图2)。Western blot结果表明:KF-PPAR-γ组PPAR-γ蛋白的水平显著高于KF-NC组和KF组(P<0.05,图3、4)。PPAR-γ mRNA和蛋白的表达量,KF-NC组与KF组相比,差异无统计学意义(P>0.05)。
2.3MTT实验检测细胞增殖:在MOI为20时,瘢痕疙瘩成纤维细胞感染LV-PPAR-γ-GFP后48h出现差异,KF组与KF-NC组比较,吸光度A值差异无统计学意义(P>0.05);KFPPAR-γ组吸光度A值明显降低,与KF-NC组比较,差异有统计学意义(P<0.05),提示PPAR-γ可抑制KF细胞增殖(表1、图5)。
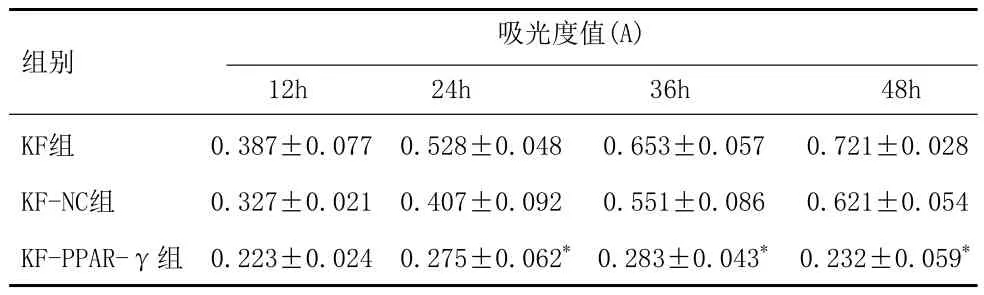
表1 慢病毒介导PPAR-γ基因感染KF细胞后各组的增殖情况
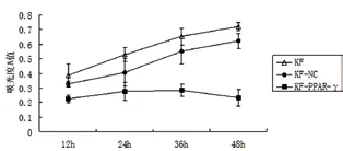
图5 慢病毒介导PPAR-γ基因感染KF细胞后各组的增殖情况比较

图6 慢病毒介导PPAR-γ基因感染KF细胞48h后各组的迁移情况
2.4重组慢病毒感染瘢痕疙瘩成纤维细胞后细胞迁移和侵袭能力的改变:划痕实验(图6、7)结果显示划痕后24h和48h,KF-PPAR-γ组划痕愈合速度明显慢于KF-NC组(P<0.05)。Trans-well侵袭(图8、9)结果显示KF-PPAR-γ组侵袭到下室的细胞数目较KF-NC组明显减少(P<0.05)。上述两组实验KF-NC组与KF组相比较,差异均无统计学意义(P>0.05)。
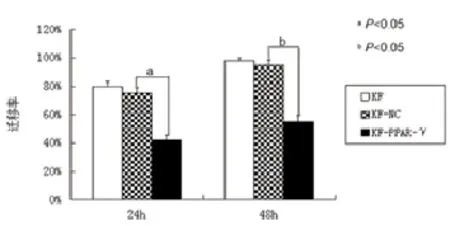
图7 慢病毒介导PPAR-γ基因感染KF细胞48h后各组的迁移率比较
图8 慢病毒介导PPAR-γ基因感染KF细胞24h后各组的侵袭情况
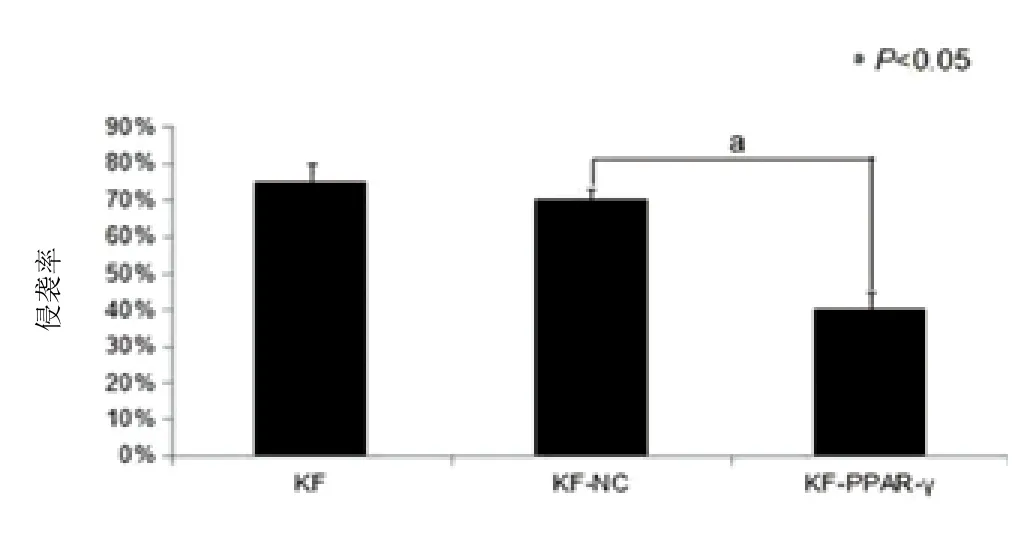
图9 慢病毒介导PPAR-γ基因感染KF细胞48h后各组的侵袭率比较
3 讨论
人类的PPAR-γ基因位于染色体3p25,全长大于105kb,含有9个外显子。由于启动子和拼接方式不同PPAR-γ mRNA存在1、2、3、4四种异构体。这4种异构体的基因基本相同,均包括外显子1-6。PPAR-γ1、PPAR-γ3、PPAR-γ4 mRNA生成相同的基因产物PPAR-γ。PPAR-γ2 mRNA生成一个在NH2端有28个氨基酸的蛋白质。4种异构体在不同组织中表达不完全相同。PPAR-γ1在所有组织中均有不同程度表达[4],PPAR-γ2主要在脂肪组织表达[5]。PPAR-γ3在脂肪组织、巨噬细胞和结肠卜皮细胞以及T淋巴细胞中表达[6-7]。PPAR-γ4的表达尚不清楚[4]。
研究表明,PPAR-γ基因与多种肿瘤的发生、发展密切相关,在抑制肿瘤增殖、侵袭转移方面具有重要作用[8]。然而,关于PPAR-γ基因与肿瘤关系的研究主要集中在消化系统肿瘤(胃癌、结直肠癌等)、前列腺癌、乳腺癌、肺癌及子宫内膜癌等[9-12],在瘢痕疙瘩中的研究较少。陕光等[13]采用免疫组织化学SP法检测50例膀胱尿路上皮癌和50例癌旁组织中PPAR-γ的表达,结果提示:①PPAR-γ在膀胱尿路上皮癌的发病和进展中起着重要的调节作用;②PPAR-γ蛋白表达水平与膀胱尿路上皮癌肿瘤分化程度及病理类型、原发肿瘤直径、淋巴结转移、临床分期均相关,提示PPAR-γ在膀胱尿路上皮癌的增殖、转移中发挥重要作用。李强等[14]采用免疫组化技术检测113例胃癌组织中PPAR-γ表达,提示癌组织中PPAR-γ表达与肿瘤的组织学类型、TNM分期密切相关,PPAR-γ可作为胃癌预后的判断指标。刘江惠等[15]研究发现,在食管癌中PPAR-γ表达与细胞分化程度、淋巴结转移相关(P均<0.05)。马元华等[16]对大肠癌的研究中同样发现,PPAR-γ表达与肿瘤分化程度、Dukes分期密切相关(P均<0.05)。杨靖宇[17]通过构建siRNA沉默PPAR-γ的A549细胞系,探讨PPAR-γ表达下调对人肺癌A549顺铂耐受性和细胞凋亡的影响,结果提示抑制A549中PPAR-γ的表达后,肿瘤细胞获得对顺铂药物更高的耐受性,其机制与升高Akt磷酸化水平和bcl-2表达水平,抑制细胞凋亡有关,PPAR-γ下调是临床肿瘤产生耐药性的可能机制之一。PPAR-γ活化后通过上调某些基因促使肝细胞癌(HCC)细胞周期停滞。Okumura[18]认为噻唑烷二酮类可通过激活PPAR-γ,上调基因p27进而促使HCC细胞周期停滞。Koga等[19]的研究表明曲格列酮可使HCC细胞停滞于G0-G1期,且与p21、p27和p18基因的上调密切相关。曲格列酮诱导的p27上调与skp2下调相关,当skp2过表达时,曲格列酮几乎不能使HCC细胞周期停滞。Cheung等[20]在分子水平发现PPAR-γ攻击的羧基末端结构-2与p21、p27上调有关。上述结果[18-20]提示,激活的PPAR-γ作用于羧基末端结构-2后,再通过p27或p21/skp2途径使HCC细胞周期停滞于G0-G1期,为HCC的基因治疗提供作用靶点。侯新新等[21]通过调控PPAR-γ基因在子宫内膜癌细胞中的表达,证实上调PPAR-γ基因的表达可抑制子宫内膜癌细胞的迁移、侵袭及增殖,而下调PPAR-γ基因的表达可促进子宫内膜癌细胞的迁移、侵袭及增殖。说明PPAR-γ基因在子宫内膜癌中可能发挥抑癌作用,而PPAR-γ基因的表达缺失可能促进子宫内膜癌的发生、发展。
瘢痕疙瘩为皮肤软组织损伤后非正常愈合过程中形成的真皮纤维组织肿瘤,呈持续性、渐进性向周边正常皮肤侵袭性生长,破坏周围正常皮肤附属器,无自限倾向,具有类肿瘤特性[3]。我们前期通过实验发现与正常皮肤成纤维细胞相比,PPAR-γ在瘢痕疙瘩成纤维细胞中呈低表达,提示激活或者过表达PPAR-γ基因可能是抑制瘢痕疙瘩的潜在靶点。为了进一步验证PPAR-γ对瘢痕疙瘩增殖的作用,以及对瘢痕疙瘩成纤维细胞类肿瘤样生物学作用的影响,构建了针对PPAR-γ基因的慢病毒表达载体,以探讨慢病毒介导的PPAR-γ对瘢痕疙瘩成纤维细胞增殖、迁移及侵袭能力的影响,结果表明LV-PPAR-γ-GFP感染KF细胞后,PPAR-γ mRNA和蛋白的表达增高,继而有效地抑制KF细胞的增殖。LV-PPAR-γ-GFP感染KF细胞后通过划痕实验和Trans-well实验发现,过表达PPAR-γ基因能够抑制KF细胞的迁移和侵袭能力,提示PPAR-γ参与了KF细胞的迁移和侵袭生长过程。Mansure等[22]和Jiang等[23]研究显示,PPAR-γ基因被激活后,对肿瘤细胞起到抑制增殖、诱导凋亡和抑制侵袭转移的作用,与本研究结果一致。
综上所述,PPAR-γ基因可以抑制KF细胞增殖、迁移和侵袭性生长,为进一步靶向治疗瘢痕疙瘩提供了新的理论基础。然而,PPAR-γ在瘢痕疙瘩形成中的机制仍有待进一步研究。
[1]Issemann I,Green S. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,18,347(6294):645-650.
[2]Jay MA,Ren J. Peroxisome proliferator-activated receptor (PPAR) in metabolic syndrome and type 2 diabetes mellitus[J].Curr Diabetes Rev,2007,3(1):33-39.
[3]蔡景龙.瘢痕疙瘩发生的肿瘤源性学说[J].中华医学杂志,2009,89(16):1084-1087.
[4]Rocchi S,Auwerx J.Peroxisome proliferator-activated receptorgamma: a versatile metabolic regulator [J]. Ann Med,1999,31(5):342-351.
[5]Rosen ED,Hsu CH.C/EBPalpha induces adipogenesis through PPARgamma:a unifed pathway [J]. Genes Dev,2002,16(1):22-26.
[6]Fajas L,Fruchart JC.PPARgamma3 mRNA:a distinct PPARgamma mRNA subtype transcribed from an independent promoter [J].FEBS Lett,1998,30,438(1-2):55-60.
[7]Tautenhahn A.Activation-induced PPARgamma expression sensitizes primary human T cells toward apoptosis[J].J Leukoc Biol,2003,73(5):665-672.
[8]Reka AK,Kurapati H,Narala VR.Peroxisome proliferatoractivated receptor-gamma activation inhibits tumor metastasis by antagonizing Smad3-mediated epithelial-mesenchymal transition[J].Mol Cancer Ther,2010,9(12):3221-3232.
[9]Robbins GT,Nie D.PPAR gamma,bioactive lipids,and cancer progression [J].Front Biosci (Landmark Ed),2012,1(17):1816-1834.
[10]Tsukahara T,Haniu H. Peroxisome proliferator-activated receptor gamma overexpression suppresses proliferation of human colon cancer cells[J].Biochem Biophys Res Commun, 2012, 424(3):5 24-529.
[11]江颖,邹琳,张春晖,等.乳腺癌中过氧化物酶体增殖激活受体γ和β-连环蛋白表达及临床意义[J].中华实验外科杂志,2010,27(6):699-701.
[12]Reka AK,Goswami MT,Krishnapuram R. Molecular crossregulation between PPAR-γ and other signaling pathways:implications for lung cancer therapy[J]. Lung Cancer. 2011 May,72(2):154-159.
[13]陕光.钱辉军.夏樾.核转录因子PPARγ在膀胱尿路上皮癌中的表达及临床意义[J].华中科技大学学报(医学版),2015,44(4):468-471.
[14]李强,党诚学.胃癌组织中PPARγ的表达[J].山东医药,2011,51(34):40-41.
[15]刘江惠,李金梅,左连富,等.食管鳞癌组织PPARγ和MMP7蛋白表达临床意义的探讨[J].河北医科大学学报,2009,16(1):40-43.
[16]马元华,郑发寿,樊晓明,等.过氧化物酶体增殖因子活化受体γ在大肠癌中的表达及意义[J].中国临床医学,2010,17(2):211-213.
[17]杨靖宇.沉默PPAR-γ通过上调bcl-2表达抑制A549细胞凋亡[J].中国肺癌杂志,2013,16(3):125-130.
[18]Okumura T.Mechanisms by which thiazolidinediones induce anticancer effects in cancers in digestive organs [J]. J Gastroenterol,2010,45(11):1097-102.
[19]KogaH,Harada M,Ohtsubo M .Troglitazone induces p27Kip1-associated cell-cycle arrest through down-regulating Skp2 in human hepatoma cells [J].Hepatology,2003,37(5):1086-1096.
[20]Cheung KF,Zhao J,Hao Y. CITED2 is a novel direct effector of peroxisome proliferator-activated receptor γ in suppressing hepatocellular carcinoma cell growth[J]. Cancer, 2013,15,119(6):1217-1226.
[21]侯新新,赵萌,张贵宇,等.PPARγ基因表达对子宫内膜癌细胞迁移、侵袭及增殖能力的影响[J].中华妇产科杂志,2014,49(5):360-365.
[22]Mansure JJ,Nassim R,Kassouf W.Peroxisome proliferatoractivated receptor gamma in bladder cancer:a promising therapeutic target [J]. Cancer Biol Ther,2009,8(7):6-15.
[23]Jiang Y,Huang Y,Cheng C.Combination of thiazolidinedione and hydralazine suppresses proliferation andinduces apoptosis by PPARγ up-expression in MDA-MB-231 cells [J]. Exp Mol Pathol,2011,91(3):768-774.
编辑/张惠娟
Effect of lentivirus-mediated PPAR-γ gene on proliferation,migration and invasion of keloid fbroblasts
LI Jin-fu1,GONG Jun-sheng1,LIANG Gang2,WANG Peng1,QIAN Hui-li1,
CHEN Zhi-jie1, ZHANG Bao-lin1
(1.Department of Plastic Surgery,The First Hospital of Shanxi Medical University,Taiyuan 030001, Shanxi,China; 2.Department of Pathology, The First Hospital of Shanxi Medical University,Taiyuan 030001, Shanxi,China)
ObjectiveTo investigate the effect of PPAR-γ gene on proliferation,migration and invasion activity of human keloid fibroblasts(KFs).MethodsPPAR-γ gene was cloned into lentivirus vector,then the lentivirus particles expressing PPAR-γ were infected into KF cells. Real-time PCR and Western blot were performed to examine the expression of PPAR-γ in lentivirus infected cells. The growth ability was detected by MTT assay.The invasion and migration were detected by matrigel invasion assay and wound healing assay.ResultsComparing to controls group and KF-NC group, the expression levels of PPAR-γ mRNA and protein were both signifcantly up-regulated after 96 hours of PPAR-γ lentivims infection. Comparing with the KF-NC group and KF group,MTT assay showed that the A490 of KF-PPAR-γ group was down-regulated after lentivims infection(P<0.05). Transfection of PPAR-γ lentivirus inhibited the migration and invasion activity of KF cells(P<0.05). ConclusionLentivirus-mediated PPAR-γ gene effciently inhibits proliferation,migration and invasion activity of KF cells. It suggests that improve the content and activity of PPAR-γ in keloid, which may provide an effective way for the prevention and treatment of the keloid.
peroxisome proliferator activated receptor-γ; keloid; fbroblasts;proliferation; migration;invasion
R619+.6
A
1008-6455(2016)07-0042-05
山西省科技发展计划<社会发展>基金(20110313011-7);山西省卫生与计划生育委员会基金,2014032;山西医科大学第一医院院基金(YC1415)
张宝林,男,科主任、教授、主任医师;中华医学会整形分会全国委员、山西省医师协会整形美容协会主委;通联:山西省太原市解放南路85号,邮编:030001
2016-03-23
2016-05-30

