AZIN1慢病毒的制备及EC109稳定感染细胞株的建立*
陈竞红,常志伟,贾永旭,秦艳茹
郑州大学第一附属医院肿瘤科 郑州 450052
AZIN1慢病毒的制备及EC109稳定感染细胞株的建立*
陈竞红,常志伟,贾永旭,秦艳茹#
郑州大学第一附属医院肿瘤科 郑州 450052
AZIN1基因;RNA编辑;慢病毒;EC109细胞
目的:制备野生型和编辑型AZIN1的慢病毒并建立稳定感染的食管癌EC109细胞株。方法:用RT-PCR法从人食管鳞状细胞癌组织中扩增出AZIN1基因的cDNA序列,选取测序结果中目标位点的A峰与G峰均高且与NCBI公布的基因编码序列一致的PCR产物,克隆至慢病毒表达载体pLenti6/V5-D-TOPO,构建野生型和编辑型AZIN1的重组慢病毒表达载体,经酶切和测序鉴定后,经293FT细胞包装,制备相应的慢病毒,然后感染EC109细胞株,行RT-PCR、测序和Western blot鉴定稳定感染的EC109细胞株。结果:双酶切重组慢病毒表达载体后产生了1 347 bp和6 915 bp的片段,经测序证实1 347 bp片段为正确的AZIN1基因编码序列;RT-PCR、测序和Western blot结果证实成功建立了稳定感染的EC109细胞株。结论:成功制备了野生型和编辑型AZIN1的慢病毒并建立了稳定感染的EC109细胞株。
RNA编辑泛指对RNA分子在转录后进行再加工和修饰的过程,能使基因编码的遗传信息在RNA水平上进一步产生多样性与可塑性,可能导致肿瘤特异性的“编辑/表观遗传突变”。研究[1]发现食管鳞状细胞癌(简称食管鳞癌)中存在RNA腺苷脱氨酶(adenosine deaminase acting on RNA, ADAR)过表达并介导编码抗酶抑制剂1(antizyme inhibitor 1, AZIN1)RNA(A→I)过度编辑,这种编辑型AZIN1作为一种获得性功能表型有可能与食管鳞癌的发生发展有关。作者制备了重组野生型和编辑型AZIN1慢病毒,并建立了稳定感染野生型AZIN1和编辑型AZIN1的EC109细胞株,为进一步研究编辑型AZIN1在食管鳞癌中的作用机制和生物学功能奠定了基础。
1 材料与方法
1.1材料食管鳞癌组织来自河南省林州市人民医院手术切除的组织,患者在手术前均未接受放化疗,液氮保存。pLenti6/V5-D-TOPO、Lipofectamine2000转染试剂、Trizol试剂购自Invitrogen公司;stbl3感受态细胞,慢病毒包装载体系统(由pLP1、pLP2、pLP VSV-G三种质粒组成),293FT细胞株及EC109细胞株由中山大学肿瘤防治中心实验研究部保存;限制性内切酶BamH Ⅰ、XhoⅠ、T4 DNA连接酶购自Thermo Scientific公司;逆转录试剂盒、普通琼脂糖凝胶DNA回收试剂盒、无内毒素质粒大提试剂盒(离心柱型)购自Tiangen公司;DMEM培养基、Trypsin-EDTA细胞消化液、胎牛血清购自Gibco公司;KAPA2G Fast HotStart ReadyMix(2×)购自KAPA Biosystems公司,DNA Marker购自TaKaRa公司;BCA蛋白含量检测试剂盒购自凯基生物公司;AZIN1抗体、β-tubulin抗体购自Abcam公司。
1.2目的基因的扩增根据NCBI检索,确定AZIN1的编码区序列,设计引物如下。扩增AZIN1编码序列全长的引物F1:5’-CGCGGATCCGCCAC CATGAAAGGATTTATTGATGAT-3’(含BamH Ⅰ酶切位点),R1:5’-CCGCTCGAGTTAAGCTTCAGCG GAAAAGCT-3’(含XhoⅠ酶切位点)。提取20例食管鳞癌患者癌组织的总RNA,逆转录获得cDNA,以cDNA为模板用引物F1、R1进行PCR反应。反应体系为KAPA2G Fast HotStart ReadyMix(2×)25 μL,引物F1、R1各2.5 μL,cDNA 2 μL,灭菌蒸馏水18 μL。反应条件:95 ℃变性2 min;然后95 ℃ 15 s,55 ℃ 10 s,72 ℃ 30 s,36个循环;最后72 ℃延伸7 min,4 ℃保存。将PCR产物送至睿博兴科生物技术有限公司测序,选取测序结果中目标位点的A峰与G峰(序列色谱图中I读为G)均高且与NCBI公布的基因编码序列一致的PCR产物行琼脂糖凝胶电泳,回收目的片段,紫外分光光度计法测定其浓度和纯度。
1.3重组慢病毒表达载体的构建PCR产物回收后与pLenti6/V5-D-TOPO同时进行BamH Ⅰ和XhoⅠ双酶切,37 ℃ 30 min,琼脂糖凝胶电泳后回收,16 ℃连接过夜。连接产物转化stbl3感受态细胞,将已转化的感受态细胞加到含氨苄青霉素的LB固体琼脂糖培养基上,将细胞均匀涂开,将平板置于37 ℃至液体被吸收,倒置平板,37 ℃培养过夜。随机挑选10个菌落,分别摇菌扩增后用无内毒素质粒大提试剂盒提取质粒,BamH Ⅰ、XhoⅠ双酶切鉴定后送测序,挑选出1个插入片段与NCBI公布的基因编码序列一致的重组野生型AZIN1慢病毒表达载体和1个除编辑位点为I外,插入片段其余序列与NCBI公布的基因编码序列一致的重组编辑型AZIN1慢病毒表达载体行下一步实验。
1.4慢病毒的包装制备293FT细胞在293FT专用培养基中培养。A液:取空载体和慢病毒包装载体质粒pLP1、pLP2、pLP VSV-G各5 μg加入1.5 mL Opti-MEM培养基;B液:取30 μL Lipofectamine2000加入1.5 mL Opti-MEM培养基,轻柔混合,室温静置5 min;将A液与B液混匀,室温静置20 min后加入细胞密度达80%~90%的293FT细胞培养基中,37 ℃孵育过夜后换液,转染后48~72 h收集上清,即病毒液。野生型和编辑型AZIN1慢病毒的制备同上。
1.5稳定感染的EC109细胞株的建立EC109细胞株在含体积分数10%胎牛血清的DMEM培养基中培养,细胞密度达30%~40%时吸去培养基,换为病毒液培养,加入polybrene(10 mg/L)促进感染,4~8 h后更换为新鲜培养基,48 h后加入blasticidin(3 mg/L)筛选培养1周。

2 结果
2.1目的基因的扩增将PCR产物送测序,选取测序结果中目标位点的A峰与G峰均高且与NCBI公布的基因编码序列一致的PCR产物(图1),行琼脂糖凝胶电泳后得到目的片段大小约为1 347 bp(图2)。

图1 PCR扩增产物的序列色谱图
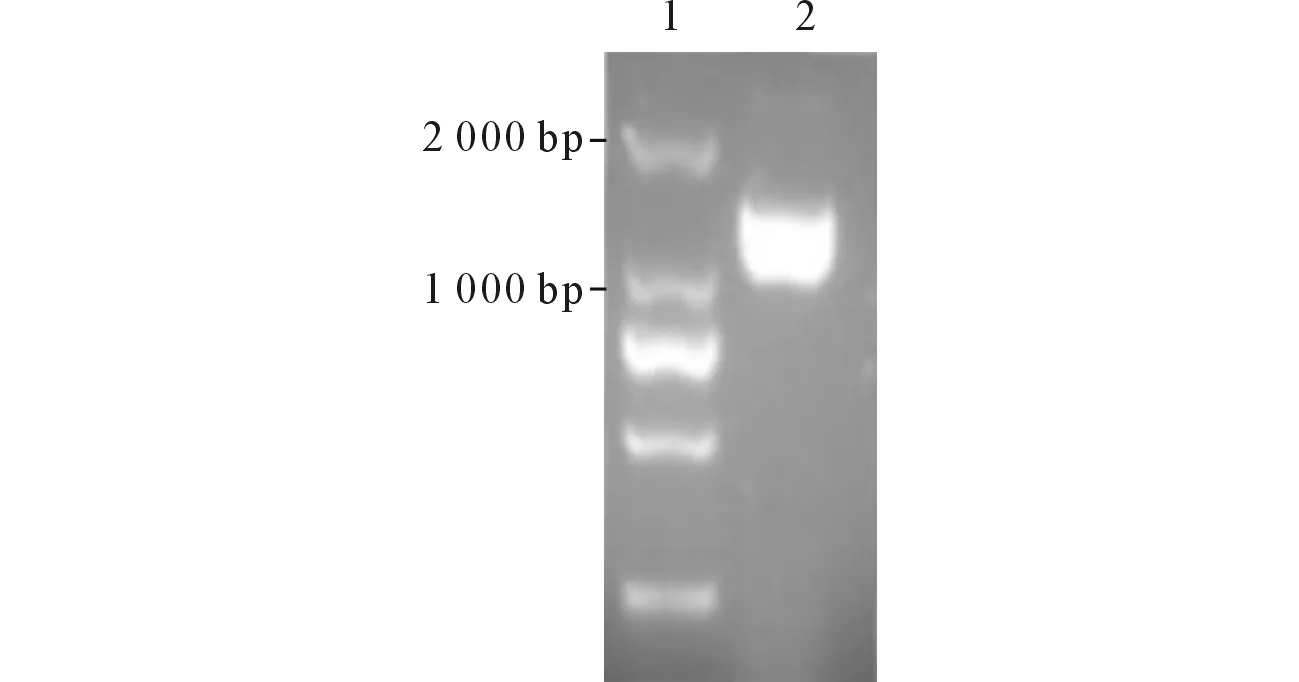
1:DNA Marker;2:扩增产物。图2 AZIN1编码序列RT-PCR扩增产物
2.2重组慢病毒表达载体的鉴定重组慢病毒表达载体用BamH Ⅰ和XhoⅠ双酶切获得1 347 bp大小的AZIN1基因片段和6 915 bp大小的pLenti6/V5-D-TOPO开环慢病毒表达载体,与预期相符,见图3。测序结果显示,重组野生型AZIN1慢病毒表达载体插入片段与NCBI公布的基因编码序列一致;重组编辑型AZIN1慢病毒表达载体插入片段除编辑位点为I外,其余序列与NCBI公布的基因编码序列一致,见图4。

1:DNA Marker;2~11:重组AZIN1慢病毒表达载体经BamH Ⅰ和Xho Ⅰ双酶切。图3 重组AZIN1慢病毒表达载体的双酶切鉴定

上:重组野生型AZIN1慢病毒表达载体;下:重组编辑型AZIN1慢病毒表达载体。图4 重组AZIN1慢病毒表达载体的序列色谱图
2.3稳定感染的EC109细胞株的鉴定EC109细胞本身只表达野生型AZIN1。RT-PCR结果示稳定感染野生型AZIN1和编辑型AZIN1慢病毒组在436 bp处的目的条带均较深,而慢病毒对照组较浅,见图5;测序结果见图6;Western blot结果示稳定感染野生型AZIN1和编辑型AZIN1慢病毒组AZIN1蛋白表达水平均高于慢病毒对照组,见图7。

1、5:DNA Marker;2、6:慢病毒对照组;3、7:稳定感染野生型AZIN1慢病毒组;4、8:稳定感染编辑型AZIN1慢病毒组。图5 稳定感染的EC109细胞株的RT-PCR鉴定

上:慢病毒对照组;中:稳定感染野生型AZIN1慢病毒组;下:稳定感染编辑型AZIN1慢病毒组。图6 稳定感染的EC109细胞株的测序结果

1、4:慢病毒对照组;2、5:稳定感染野生型AZIN1慢病毒组;3、6:稳定感染编辑型AZIN1慢病毒组。图7 稳定感染的EC109细胞株的Western blot鉴定
3 讨论
哺乳动物中最常见的RNA编辑类型A至I编辑是由具有双链特异性的RNA腺苷脱氨酶家族的RNA编辑酶ADAR1和ADAR2催化[2]。敲除小鼠的ADAR1或者ADAR2基因可导致小鼠死亡,说明这些酶和正常的生理功能密切相关,为哺乳动物正常生长所必需[3-4]。ADARs能识别特定双链RNA底物分子中的A并催化其水解脱氨成为I,从而产生新的遗传密码,是蛋白质分子多样性发生的重要机制[5-8]。AZIN1转录物的A→I编辑受到ADAR1的特异调控,导致位于β链15的AZIN1 第367位残基发生丝氨酸-甘氨酸置换,引起构象改变。在原发性肝癌中,编辑型AZIN1较野生型AZIN1具有更强的抗酶蛋白亲和力,通过中和抗酶蛋白介导的鸟氨酸脱羧酶和细胞周期蛋白D1降解,促进了细胞增殖[9]。既往研究[1]对69例食管鳞癌组织及其对应的癌旁正常食管组织样本进行RNA编辑水平检测,发现食管鳞癌组织中AZIN1的RNA编辑水平比对应的癌旁正常食管组织升高,提示编辑型AZIN1可能在食管鳞癌的发生发展中起重要作用,编辑型AZIN1有可能是食管鳞癌诊治的一个有潜力的新靶点。该实验成功制备了野生型和编辑型AZIN1的慢病毒并建立了稳定感染的EC109细胞株,为进一步的研究奠定了基础。
[1]QIN YR,QIAO JJ,CHAN TH,et al.Adenosine-to-inosine RNA editing mediated by ADARs in esophageal squamous cell carcinoma[J].Cancer Res,2014,74(3):840
[2]VALENTE L,NISHIKURA K.ADAR gene family and A-to-I RNA editing: diverse roles in posttranscriptional gene regulation[J].Prog Nucleic Acid Res Mol Biol,2005,79:299
[3]HIGUCHI M,MAAS S,SINGLE FN,et al.Point mutation in an AMPA receptor gene rescues lethality in mice deficient in the RNA-editing enzyme ADAR2[J].Nature,2000,406(6791):78
[4]WANG Q,KHILLAN J,GADUE P,et al.Requirement of the RNA editing deaminase ADAR1 gene for embryonic erythropoiesis[J].Science,2000,290(5497):1765
[5]ATHANASIADIS A,RICH A,MAAS S.Widespread A-to-I RNA editing of Alu-containing mRNAs in the human transcriptome[J].PLoS Biol,2004,2(12):e391
[6]LI JB,LEVANON EY,YOON JK,et al.Genome-wide identification of human RNA editing sites by parallel DNA capturing and sequencing[J].Science,2009,324(5931):1210
[7]CHAN TH,LIN CH,QI L,et al.A disrupted RNA editing balance mediated by ADARs (Adenosine DeAminases that act on RNA) in human hepatocellular carcinoma[J].Gut,2014,63(5):832
[8]GALLO A,LOCATELLI F.ADARs: Allies or enemies? The importance of A-to-I RNA editing in human disease: from cancer to HIV-1[J].Biol Rev Camb Philos Soc,2012,87(1):95
[9]CHEN L,LI Y,LIN CH,et al.Recoding RNA editing of AZIN1 predisposes to hepatocellular carcinoma[J].Nat Med,2013,19(2):209
(2015-10-26收稿责任编辑徐春燕)
Preparation of AZIN1 lentivirus and establishment of stable infected EC109 cell strain
CHENJinghong,CHANGZhiwei,JIAYongxu,QINYanru
DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
AZIN1;RNA editing;lentivirus;EC109 cell
Aim: To prepare the lentivirus of the wild type and the edited type of AZIN1, and then establish stable infected EC109 cell strain. Methods: The cDNA came from human esophageal squamous cell carcinoma tissue was amplified by RT-PCR. The PCR products with high peak A and peak G in the target site and the gene coding sequence matching the NCBI published were chosen and inserted into lentiviral vector pLenti6/V5-D-TOPO to construct the recombinant lentiviral vectors of the wild type and the edited type of AZIN1.The recombinant lentiviral vectors were verified with restriction enzyme digestion and DNA sequencing. Then the lentivirus were packed in 293FT cells and collected to infect EC109 cells. The stable infected EC109 cell strain was identified by RT-PCR,sequencing and Western blot. Results: By restriction enzyme digestion, the recombinant lentiviral vectors were digested into fragments of 1 347 bp and 6 915 bp. DNA sequencing results showed that the 1 347 fragments were the right gene coding sequence of AZIN1.The results of RT-PCR,sequencing and Western blot showed that the stable infected EC109 cell strain was established successfully. Conclusion: The lentivirus of the wild type and the edited type of AZIN1 and the stable infected EC109 cell strain have been constructed successfully.
10.13705/j.issn.1671-6825.2016.05.001
,女,1964年1月生,博士,主任医师,教授,研究方向:消化道肿瘤基础与临床,E-mail:yanruqin@163.com
*国家自然科学基金资助项目81472605
R735.1

