四物汤配方颗粒的质量标准研究
官永河 杜兰哲 霍文杰 钟华林 赵径华 陈向东(广东一方制药有限公司 佛山 528244)
·药品质量及检验·
四物汤配方颗粒的质量标准研究
官永河杜兰哲霍文杰钟华林赵径华陈向东(广东一方制药有限公司佛山528244)
目的:建立四物汤配方颗粒的质量控制方法。方法:采用薄层色谱(TLC)法鉴别四物汤配方颗粒中的熟地黄、当归、川芎、白芍,采用高效液相色谱(HPLC)法测定四物汤配方颗粒中的芍药苷、阿魏酸的含量。结果:TLC法分离较好,阴性无干扰;HPLC法芍药苷线性范围为0.1031~1.6496μg,r=1.000;阿魏酸线性范围为0.0209~0.3344μg,r=0.9997。平均回收率分别为100.46%、101.55%,RSD均小于2.0%。结论:该方法专属性强,重复性好,可用于控制四物汤配方颗粒的质量。
四物汤配方颗粒 芍药苷 阿魏酸 薄层色谱 高效液相色谱
四物汤由白芍、当归、熟地黄、川芎四味药组成。该方最早见于唐代蔺道人的《仙授理伤续断秘方》,为治疗营血虚滞的著名方剂,具有补血和血功效。四物汤临床上用于血虚所致的面色萎黄、头晕眼花、心悸气短及月经不调的治疗,效果显著。药效学研究和临床研究显示,该方具有抗缺氧、免疫调节、抗自由基损伤、血液系统作用及双向调节子宫平滑肌的作用,原方或其加减方现代临床常用于治疗胎位不正、月经失调、功能性子宫出血、子宫肌瘤等妇科疾病,还可用于内科、皮肤科疾病的治疗,取得了较好的治疗效果。2015年版《中国药典》一部[1]收载了四物合剂的制剂标准,其中阿魏酸是川芎和当归共同含有的活性成分,具有抗血小板凝集和血栓的作用[2],芍药苷为白芍主要活性成分,用于对抗急性心肌缺血,降低血压,扩张冠状动脉,增加冠脉流量[3]。
四物汤配方颗粒是由白芍、当归、熟地黄、川芎四味药按古方比例用水煎煮后制粒而成,在传承中药配方颗粒的优点的情况下,按照中医药整体观念,将其制成复方颗粒剂,充分发挥群药共煎及配伍的优势,同时克服汤剂临时煎煮不便、服用量大、易霉败变质等缺点。本研究在参考文献[4]的基础上,对四物汤配方颗粒中的熟地黄、白芍、当归和川芎进行定性鉴别,采用高效液相色谱法测定芍药苷、阿魏酸的含量。
1 仪器与试药
1.1仪器:Waters 2695高效液相色谱仪、Waters 2489紫外检测器、Empower 2 Personal Single System SW化学工作站;Kromasil 100-5 C18柱(4.6mm×150mm,5μm);薄层色谱自动点样仪(CAMAG AUTOMATIC TLC SAMPLER4)、薄层自动成像仪(CAMAG REPROSTAR 3);BS110S万分之一天平(赛多利斯)、xP26百万分之一天平(METTLER TOLEDO);CQ-25-6超声波清洗器(上海音波声电科技公司)。
1.2试药:芍药苷(供含量测定用,批号:110736-201035);阿魏酸(供含量测定用,批号:110773-201012);白芍对照药材(供薄层鉴别用,批号:905-9204),均购自中国药品生物制品检定所;5-羟甲基糠醛(西格玛奥德里奇(上海)贸易有限公司提供,供含量测定用,批号:1001200655);四物汤配方颗粒(自制,批号:20141101、20141102、20141103);阴性对照样品按处方药味除去被测药材,其余药味,按四物汤配方颗粒的生产工艺及供试品溶液的制备方法制备,即得。实验用四批药材均购自安徽省本草国药饮片有限公司,经魏梅副主任中药师鉴定均为正品。
2 方法与结果
2.1薄层鉴别
2.1.1当归、川芎的薄层鉴别:取本品0.8g,研细,加水40mL使溶解,用乙醚萃取2次,每次30mL,合并乙醚,挥干,残渣加甲醇1mL使溶解,作为供试品溶液。另取阿魏酸对照品,加甲醇制成每1mL含0.1mg的溶液,作为对照品溶液。按处方比例及制法,制成缺当归、川芎的阴性对照样品,取相当于供试品的量,按照供试品溶液的制备方法,制成缺当归、川芎的阴性样品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取上述三种溶液各5μL,分别点于同一硅胶G薄层板上,以环己烷-二氯甲烷-乙酸乙酯-甲酸(4∶1∶1∶0.3)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性对照样品无干扰,结果见图1。
2.1.2白芍的薄层鉴别:取本品1g,研细,加水30mL使溶解,用水饱和正丁醇溶液萃取2次,每次25mL,合并正丁醇液,蒸干,残渣加甲醇1mL使溶解,作为供试品溶液。另取白芍对照药材1g,加水60mL,煎煮30min,滤过,滤液用水饱和正丁醇溶液萃取2次,同法制成对照药材溶液。按处方比例及制法,制成缺白芍的阴性对照样品,取相当于供试品的量,按照供试品溶液的制备方法,制成缺白芍的阴性样品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取上述供试品溶液5μL,对照药材溶液2μL分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,展开,取出,晾干,喷以5%香草醛浓硫酸溶液,在105℃加热至斑点显色清晰,置日光下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照样品无干扰,结果见图2。
2.1.3熟地黄的薄层鉴别:取本品2g,研细,加水50mL使溶解,用乙酸乙酯萃取2次,每次50mL,合并乙酸乙酯,蒸干,残渣加甲醇1mL使溶解,作为供试品溶液。另取5-羟甲基糠醛对照品,加甲醇制成每1mL含1mg的溶液,作为对照品溶液。按处方比例及制法,制成缺熟地黄的阴性对照样品,取相当于供试品的量,按照供试品溶液的制备方法,制成缺熟地黄的阴性样品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取上述供试品10μL,对照品1μL,分别点于同一硅胶GF254薄层板上,以甲苯-乙酸乙酯(2∶3)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。阴性对照样品无干扰,结果见图3。
2.2含量测定
2.2.1色谱条件:色谱柱:KromasiL 100-5 C18柱(4.6mm×150mm,5μm);流动相:乙腈-0.1%醋酸(10∶90);流速:1mL·min-1;检测波长:240nm;柱温30℃。进样量:10μL;塔板数按芍药苷峰计算应不低于4000。
2.2.2溶液的制备
2.2.2.1对照品溶液的制备:精密称取芍药苷对照品2.58mg,置25mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得(每1mL含芍药苷0.1032mg);精密称取阿魏酸对照品1.048mg(99.6%),置50mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得(每1mL含阿魏酸0.0209mg)。
2.2.2.2供试品溶液的制备:取本品,研细,取约0.4g,精密称定,置具塞锥形瓶中,精密加入甲醇25mL,密塞,称定重量,超声处理(功率250W,频率33kHz)30min,放冷,称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2.2.3阴性样品溶液的制备:采用上述四物汤配方颗粒的制备方法分别制备缺白芍阴性样品、缺熟地黄阴性样品和缺当归、川芎阴性样品,按供试品溶液的制备方法,分别制备阴性样品溶液。2.2.3专属性考察:分别吸取芍药苷对照品溶液、阿魏酸对照品溶液、四物汤配方颗粒供试品溶液、阴性样品溶液,按上述四物汤配方颗粒的含量测定方法,四物汤配方颗粒中芍药苷、阿魏酸峰应与相邻的峰分离度大于1.5,阴性样品色谱在芍药苷、阿魏酸峰相应位置上无干扰。结果见图4。 2.2.4线性关系考察:分别精密吸取芍药苷、阿魏酸对照品溶液0.5、1、2、4、8、12、16μL,按上述色谱条件测定峰面积,以峰面积为纵坐标,进样量为横坐标,绘制标准曲线。结果表明,芍药苷进样量在0.1031~1.6496μg时与峰面积呈良好的线性关系。回归方程为Y=1052006x-4783,r=1.000。阿魏酸进样量在0.0209~0.3344μg时与峰面积呈良好的线性关系。回归方程为Y= 3337200x+1928,r=0.9997。
2.2.5精密度考察:取一份四物汤配方颗粒供试品溶液,按上述色谱条件,重复进样6次,测定芍药苷、阿魏酸峰面积。结果,芍药苷峰面积的RSD为1.76%,阿魏酸峰面积的RSD为1.11%,表明仪器的精密度良好。
2.2.6稳定性考察:取同一四物汤配方颗粒供试品溶液,按上述色谱条件分别于0、2、4、6、8、12h进样,测定芍药苷、阿魏酸峰面积。结果,在12h内测得四物汤配方颗粒中芍药苷的峰面积RSD为1.10%、阿魏酸的峰面积RSD为1.36%。实验结果表明,供试品溶液在12h内稳定。
2.2.7重复性考察:取同一四物汤配方颗粒,按上述方法平行制备供试品溶液六份,分别测定芍药苷、阿魏酸含量。结果,芍药苷平均含量为6.198mg·g-1,RSD为0.37%;阿魏酸平均含量为0.606mg·g-1,RSD为1.29%,此样品中含量测定方法重复性较好。
2.2.8回收率考察:取已知含量的四物汤配方颗粒粉末约0.2mg(芍药苷含量:6.198mg·g-1、阿魏酸含量:0.606mg·g-1),精密称定,共六份,置具塞锥形瓶中,精密加入含芍药苷、阿魏酸混合对照品(甲醇溶解,芍药苷浓度为0.05352g·L-1,阿魏酸浓度为0.005724g·L-1)25mL,按“2.3.2.2”项下方法制备供试品溶液,按上述色谱条件进行测定,计算回收率。结果见表1、表2。
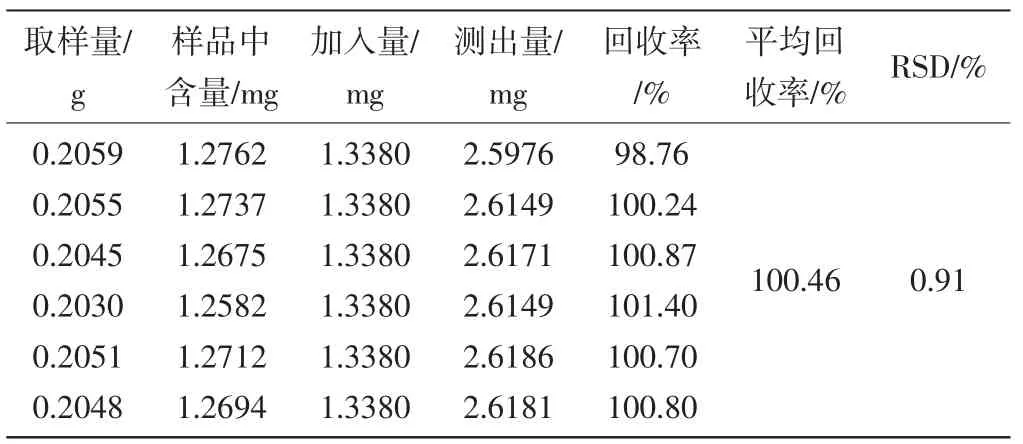
表1 四物汤配方颗粒芍药苷含量测定回收率试验结果
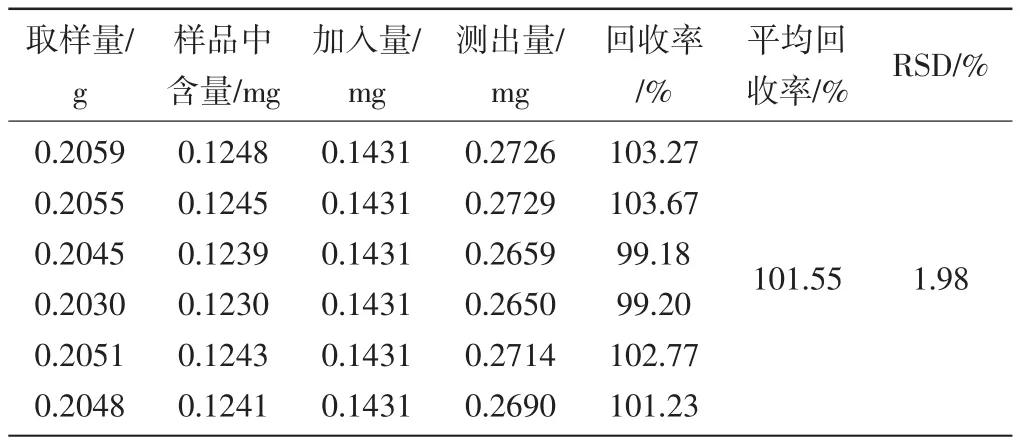
表2 四物汤配方颗粒阿魏酸含量测定回收率试验结果
2.2.9样品含量测定:分别制备3批四物汤颗粒剂供试品溶液,按“2.3”项下色谱条件进行测定,采用外标法计算四物汤配方颗粒中2种成分含量,实验结果见表3。
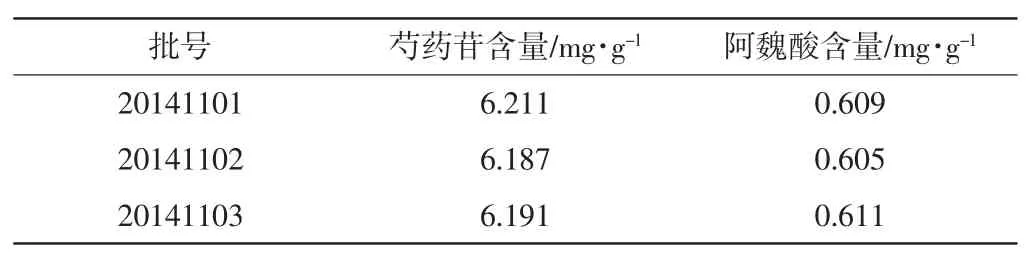
表3 3批四物汤配方颗粒含量测定结果
3 讨论
本次熟地黄的薄层鉴别实验过程中,曾经尝试使用熟地黄对照药材,但发现对照药材色谱与供试品色谱斑点有差异,故只采用5-羟甲基糠醛对照品作对照。曾经尝试采用石油醚(60-90)-乙酸乙酯(1∶1)的方法展开,但展开效果不理想,最后选择甲苯-乙酸乙酯(1∶1)的方法,经过试验调整比例为甲苯-乙酸乙酯(2∶3),效果较好。
当归、川芎的薄层鉴别实验过程中,曾经尝试使用当归、川芎对照药材,但发现对照药材色谱比四物汤供试品色谱多了挥发油的斑点,故只采用阿魏酸对照品对照。曾经尝试采用正己烷-乙酸乙酯(9∶1)、甲苯-乙酸乙酯-甲酸(4∶1∶0.1)的方法展开,但展开效果不理想,最后选择环己烷-二氯甲烷-乙酸乙酯-甲酸(4∶1∶1∶0.1)的方法,经过试验调整比例为环己烷-二氯甲烷-乙酸乙酯-甲酸(4∶1∶1∶0.3),效果较好。
白芍的薄层鉴别实验过程中,参考药典方法,曾采用乙醇提取,但斑点很多分不开,效果不好。使用正丁醇提取,并采用三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,效果较好。
本次含量测定方法的建立,在流动相的选择上,文献中已有多种报道,曾经尝试以甲醇-0.1%醋酸(14∶86)、甲醇-0.1%磷酸(14∶86)、乙腈-0.1%磷酸(20∶80)等方法用于本样品分离,但效果均不够理想,本试验采用流动相乙腈-0.1%醋酸(10∶90)的比例,能使芍药苷、阿魏酸的色谱峰形对称、结果保留时间适中、分离效果较好,可以满足含量测定的基本要求。
本次研究曾经对四物汤配方颗粒供试品制备的提取方法(超声提取、加热回流提取)、提取溶剂(甲醇、75%甲醇、50%甲醇)、提取时间(20、30、40min)进行优选,实验结果表明,采用超声提取时,芍药苷、阿魏酸的含量都比加热回流提取高,故选择超声提取。采用甲醇提取时,芍药苷、阿魏酸的含量都比75%甲醇、50%甲醇高,故选择甲醇提取。提取时间为20、30、40min时,芍药苷、阿魏酸含量相差不大,考虑到节能降耗及操作方便问题,故选择超声时间30min。本次研究建立的方法简便可行、重复性好、阴性无干扰,为四物汤配方颗粒的质量控制提供了依据。
[1]国家药典委员会.中华人民共和国药典:2015年版一部[M].北京:中国医药科技出版社,2015:786-787.
[2]夏醒醒,张蓓蕾,陈勤.RP-HPLC法测定四物合剂中阿魏酸的含量[J].中国药事,2007,21(4):247-249.
[3]孟令丹,陈晓辉,姚燕,等.RP-HPLC法同时测定四物合剂中芍药苷和阿魏酸的含量[J].药物分析杂志,2006,26(10):1398-1400.
[4]周海燕.四物汤配方颗粒质量标准示范性研究[D].成都中医药大学,2006.
Objective:To establish a quality standard for Siwutang Peifangkeli.Methods:Radix Paeoniae Alba,Radix Angelicae Sinensis,Rhizoma Chuanxiong and Radix Rehmanniae were indentified by TLC.The contents of Paeoniflorin and Ferulic acid were determined by HPLC.Results:The specific spots of Radix Paeoniae Alba,Radix Angelicae Sinensis,Rhizoma Chuanxiong and Radix Rehmanniae could be detected by TLC.The linear calibration curves were established in the concentration range of 0.1031~1.6496μg(r=1.000)for Paeoniflorin and 0.0209~0.3344μg(r=0.9997)for Ferulic acid.The average recoveries of Paeoniflorin and Ferulic acid were 100.46% and 101.55%,respectively.All the relative standard deviations were Less than2.0%.Conclusion:The method is simple,feasible and reproducible.It can be used for quality control of Siwutang Peifangkeli.
Siwutang Dispensing Granule Paeoniflorin;Ferulic acidTLC HPLC
R284.1
A
1672-8351(2016)02-0001-03

