直肠癌患者腹腔镜微创治疗的效果及对肛肠动力学和肿瘤标志物含量的影响
刘绍群 曹奕鸥
·论著·
直肠癌患者腹腔镜微创治疗的效果及对肛肠动力学和肿瘤标志物含量的影响
刘绍群曹奕鸥
目的探讨直肠癌患者腹腔镜微创治疗的效果及对肛肠动力学和肿瘤标志物含量等的影响。方法随机选取2013年5月至2015年5月进行手术治疗的120例直肠癌患者作为研究对象,依据手术方式的不同将其分为2组:观察组60例为腹腔镜微创手术治疗,对照组60例为传统开腹手术治疗。比较2组患者的临床疗效、肛肠动力学指标及肿瘤标志物含量。结果观察组患者手术时间(196.7±42.4)min显著长于对照组患者手术时间(162.5±38.3)min(P<0.05),术中出血量数据、术后排气时间数据、下床活动时间数据显著低于对照组(P<0.05),术后总体并发症发生率观察组数据显著低于对照组(P<0.05)。术前2组患者肛肠动力学指标和肿瘤标志物含量差异不显著(P>0.05),术后1个月、2个月及4个月肛肠动力学指标和术后3 d、7 d及15 d肿瘤标志物含量观察组患者显著优于对照组,差异有统计学意义(P<0.05)。结论直肠癌患者采用腹腔镜微创治疗对机体创伤性小、术中出血量少、术后恢复时间早且术后并发症发生率低,对肛肠动力学的影响小,有助于改善肿瘤标志物含量,临床疗效显著,更有助于直肠癌患者康复。
直肠癌;腹腔镜微创治疗;效果;肛肠动力学;肿瘤标志物;影响
直肠癌是由直肠组织细胞基因发生改变而引起恶变的一种常见的消化道恶性肿瘤,其病因至今尚未完全弄清楚,据研究与饮食习惯、社会环境、遗传因素等关系密切[1]。近年来随着人们生活水平的提高,人们对动物脂肪和蛋白质摄入量增加,对食物纤维摄入不足,导致直肠癌发病率逐年升高,目前最有效的治疗方式即根治性手术切除。腹腔镜手术是近年来新兴的一门微创技术,随着腹腔镜技术广泛的应用和发展,大部分医院过去传统的开腹手术治疗直肠癌已经被腹腔镜微创手术治疗所取代,但由于在我国开展腹腔镜微创治疗直肠癌的时间不长,与传统开腹手术治疗直肠癌相比,其临床疗效、并发症发生率、对肛肠动力学及肿瘤标志物含量的影响尚缺乏深入分析,有待进一步研究。在本研究中,我们选取了2013年5月至2015年5月于我院进行腹腔镜微创手术治疗的60例直肠癌患者和进行传统开腹手术治疗的60例直肠癌患者作为研究对象,分别观察2组患者临床疗效、并发症发生率、肛肠动力学指标及肿瘤标志物含量的变化,并进行统计学分析,以探讨直肠癌患者腹腔镜微创治疗的临床疗效及对肛肠动力学和肿瘤标志物含量的影响,现将研究结果整理报道如下。
1 资料与方法
1.1一般资料随机选取我院2013年5月至2015年5月收治的经病理学和细胞学确诊为直肠癌的120例患者作为研究对象,均根据2003年国际抗癌联盟(UICC)的TNM标准进行临床分期[2],并都接受手术治疗,依据手术方式的不同将其分为2组,每组60例。观察组为腹腔镜微创手术治疗,对照组为传统开腹手术治疗。2组病例在性别比、年龄、病程、肿瘤分期及手术方式等基本资料比较上差异无统计学意义(P<0.05),具有可比性。见表1。

表1 2组病例基本资料的比较 n=60
1.2纳入标准(1)术前经结肠镜和病理学检查确诊为原发性直肠癌;(2)无多发癌灶或发生远处转移;(3)手术前没有进行放化疗治疗;(4)未行预防性造口。
1.3排除标准(1)既往患有其他恶性肿瘤;(2)肿瘤广泛远处转移不能行手术切除治疗;(3)发生急性肠梗阻或肿瘤穿孔需要急诊手术;(4)已发生严重的肿瘤并发症;(5)合并有严重的重要脏器疾病;(6)手术过程中因特殊情况需改变手术方式或中转开腹。
1.4治疗方法
1.4.1术前准备:2组中术前贫血患者,给予输血;低蛋白血症患者,补充白蛋白;有吸烟史的患者,戒烟2周以上。术前3 d进流质饮食,并口服链霉素1.0 g,2次/d,甲硝唑0.4 g,3次/d,术前1 d晚口服复方聚乙二醇电解质散2包加水2 000 ml,清洁灌肠[3]。
1.4.2手术操作:①对照组在气管插管全麻下行常规D3式直肠癌根治性切除手术[5]:全麻后经腹直肌切口,用腹腔自动拉钩牵开腹腔,先分离结扎血管,然后逐渐游离出直肠,在直肠肿瘤远端切断并用吻合器吻合直肠与降结肠。②观察组采用和对照组同样的麻醉方式后,按照中华医学会外科学分会腹腔镜与内镜外科学组2006年制定的操作指南施术[4]:全麻后建立气腹,将气腹压力控制在12~14 mm Hg,然后脐下作1个10 mm观察孔,根据情况再做3~4个操作孔,超声刀从右侧到左侧的顺序分离肠系膜下动脉,结扎肠系膜动脉下根部,清扫血管周围的淋巴结,遵循全直肠系膜切除(TME)原则[5],游离直肠周围间隙,在距肿瘤下缘2~5 cm处裸化肠管,用腔镜专用直线切割闭合器切断并闭合远端直肠[6],将左下腹穿刺孔扩大到5 cm 左右,从扩大的穿刺空中将标本提出腹腔外,将近端肠管切断并进行荷包缝合,置入吻合器钉座。回纳肠管入腹腔,重新建立气腹,经肛门置入管状吻合器,在腹腔镜下重建消化道,充分止血,取出吻合器,冲洗腹腔后常规关腹;Hartmann手术先闭合远端肠管,然后直接行乙状结肠造瘘;而Miles手术需要在会阴距肛门2~3 cm处,做一梭形切口与腹腔创面会合,然后于左下腹行乙状结肠造瘘。③2组患者的手术均要求同一手术医师团队完成,主刀医生具有熟练地腹腔镜操作技术和丰富的腹腔镜直肠癌手术经验。术后予以抗炎、补液、营养对症支持等处理,根据患者恢复情况及个人意愿按最新版本NCCN指南进行放化疗。
1.5观察指标
1.5.1临床疗效比较:记录2组患者手术所用时间,术中出血量,术后排气时间、术后下床活动时间及术后并发症发生率等情况。
1.5.2肛肠动力学指标:采用消化道压力监测仪,两组患者在排尽粪便、安静的状态下,取较舒适的左侧卧位体位,屈膝90°,充分暴露检查部位,将压力探头放在肛缘处,依次测定患者肛肠动力学指标:肛管高带压、肛管静息压及肛管最大收缩压[7]。
1.5.3肿瘤标志物含量的测定:2组患者均在术前及术后3 d、7 d、15 d时空腹抽取静脉血4 ml,采用ELISA法检测血清中肿瘤标志物 CEA、CA19-9和CA242的含量,所有试剂盒均在碧云天公司购买,以试剂盒的参考值为标准:CEA>8.99 ng/ml、CA19-9>37.01 U/ml和CA242>12 U/ml为阳性[8]。

2 结果
2.12组患者临床疗效比较观察组手术所用时间内(212.5±28.7)min显著长于对照组的(179.8±30.1)min;但观察组术中出血量(102.7±35.2)ml显著少于对照组(210.1±39.8)ml;术后排气时间(45.8±14.2)min及下床活动时间(42.2±15.9)h 显著早于对照组(70.3±11.4)min、(70.1±29.6)h,差异有统计学意义(P<0.05)。观察组患者术后总体并发症的发生率为6.67%显著低于对照组15.00%,差异有统计学意义(P<0.05)。见表2、3。
表22组患者临床疗效比较
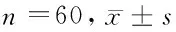

组别手术时间(min)术中出血量(ml)术后排气时间(min)术后下床活动时间(h)观察组212.5±28.7102.7±35.245.8±14.242.2±15.9对照组179.8±30.1210.1±39.870.3±11.470.1±29.6t值9.8613.124.794.95P值0.00820.0000.0410.046

表3 2组患者术后总并发症发生率 例(%)
注:与观察组比较,*P<0.05
2.22组患者术前、术后1个月、2个月及4个月肛肠动力学指标比较术前观察组肛管高压带(4.25±0.46)cm、肛管静息压(44.89±3.87)mm Hg及肛管最大收缩压值(133.98±11.87)mm Hg与对照组(3.59±0.26)cm、(36.81±2.47)mm Hg、(133.84±12.12)mm Hg比较差异无统计学意义(P>0.05)。观察组接受腹腔镜微创术后1个月、2个月、4个月时肛管高带压、肛管静息压及肛管最大收缩压值均显著高于对照组(P<0.05)。见表4。
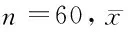
表4 2组患者手术前后肛肠动力学指标比较 ±s
注:与对照组比较,*P<0.05
2.32组患者手术前后肿瘤标志物含量比较术前观察组血清肿瘤标志物CEA(11.92±2.25)ng/ml、CA19-9(42.13±3.76)U/ml、CA242(40.71±3.94)U/ml含量与对照组(11.81±1.27)ng/ml、(41.97±5.85)U/ml、(41.09±2.35)U/ml比较差异无统计学意义(P>0.05),但2组血清肿瘤标志物含量均显著高于正常参考值(P<0.05)。术后3 d、7 d、15 d 2组患者血清肿瘤标志物含量均在逐渐下降,且各时间点观察组血清肿瘤标志物CEA、CA19-9、CA242含量(P<0.05)。见表5。
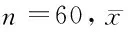
表5 2组患者手术前后肿瘤标志物含量比较 ±s
注:与对照组比较,*P<0.05
3 讨论
在我国,直肠癌是第四常见癌症,其发病率逐年增高,已经严重威胁我国居民的健康[8]。手术切除仍是治疗直肠癌的主要方法[9]。直肠癌手术治疗在一定程度上会影响直肠癌患者的肛肠动力学,这已引起了临床关注。研究发现直肠癌术后肛门功能与肛肠动力学发生显著改变,但手术4~6个月后这些指标基本恢复正常[10,11]。肛肠动力学是指用静力学和动力学的方法来研究结肠、直肠及肛管的各种运动方式,从而对排便生理、肛门自制生理及有关肛肠疾病的病理生理学进行研究。通常用肛管高带压、肛管静息压及肛管最大收缩压值来表示肛肠动力学,因此我们可以通过检测患者以上三项指标值来研究、诊断及治疗肛肠外科疾病。在本研究中,2组患者肛肠动力学指标肛管高带压、肛管静息压及肛管最大收缩压值均在术后1月、2月、4月各时间点均显著低于同组术前水平,但随着术后时间的推移,其肛肠动力学指标逐渐升高,到术后第4个月时各项指标值与术前无显著差异,表明手术会损伤直肠癌患者的肛肠运动功能,但术后会随着时间的延长而逐渐恢复。另外发现,在术后同一时间点上观察组各项肛肠动力学指标值均显著高于对照组,表明肛肠动力学指标的变化幅度受创伤程度大小的影响,进一步表明腹腔镜微创治疗对直肠癌患者肛肠运动功能的影响较传统开腹手术小,更有利于患者术后量康复。
肿瘤标志物是指在恶性肿瘤的发生和增殖过程中,由肿瘤细胞产生或分泌的具有生物学特性的生化物质[12]。监测肿瘤标志物,对于肿瘤患者的诊断、疗效及预后评估是非常重要的。特别是在直肠癌的辅助诊断及预后和疗效方面具有重要意义[13]。有研究显示,与直肠癌有关的肿瘤标志物有 CEA、CA19-9、CA242等[14]。若术前检测到患者血清中CEA和CA199单独或同时升高则预示着预后不好,术后单独或同时升高则表明术后很可能发生复发或者转移。故术前与术后检测癌症患者血清中的肿瘤标志物含量可以很好地评估治疗疗效,判断预后。有研究报道,CEA在癌症患者血清中的含量显著高于健康人,CA199是肝癌、胰腺癌、结直肠癌、胃癌等肿瘤的常用指标,但其特异性和敏感性并不显著[15],CA242是一种黏蛋白型糖抗原,是结肠癌较好的肿瘤标志物,其特异性优于CA199[16]。在本研究中,2组患者术前CEA、CA199和CA242血清含量显著高于正常参考值上限,与文献相符。但随着手术治疗和术后恢复时间的延长,三者血清含量逐渐降低,在术后第7天下降了近一半,术后半个月基本恢复到正常水平。观察组患者血清中CEA、CA199和CA242的下降幅度大于对照组,这可能与观察组微创手术对机体创伤小,术中出血少、术后恢复快,使机体可以更快速地清除肿瘤标志物有密切关系。另有文献报告,腹腔镜术可以减轻对机体免疫功能的损伤,使机体恢复较快[17]。
直肠癌传统手术治疗方式是开腹切除肿瘤肠管并进行淋巴结清扫,但为了能够减轻手术对直肠癌患者的损伤及带来的痛苦,同时加快患者术后康复,国际上的研究进展越来越多围绕在腹腔镜微创术的应用。国内、外许多研究均表明腹腔镜微创手术具有许多优点,如切口小,外观美;减少术中出血量;术后肠道功能恢复快,下床活动时间早;术后并发症少等[18-20]。在本研究中,对照组直肠癌患者采用传统开腹手术治疗, 而观察组直肠癌患者则采用腹腔镜微创手术治疗,发现观察组手术过程中的出血量显著少于对照组,术后患者排气时间及下床活动时间明显早于对照组,且观察组术后的总并发症发生率6.67%显著低于对照组15%,表明腹腔镜微创手术治疗直肠癌比传统的开腹手术治疗有明显的优势,能明显减轻手术给患者带来的痛苦和损伤,同时更有助于患者的术后康复,临床疗效明显。另外,在本研究中发现观察组腹腔镜微创治疗的手术时间长于对照组,这可能和医生操作腹腔镜手术的熟练程度有关,相信随着术者腹腔镜操作经验的积累,手术时间能够缩短。
综上所述,与传统开腹手术相比,腹腔镜微创治疗对患者肛肠动力学影响小,可以迅速降低患者血清中肿瘤标志物含量,且术中出血少,术后恢复快,并发症少,对机体创伤小,临床疗效明显,值得推广。
1曾志良.腹腔镜直肠癌手术与传统开腹直肠癌手术的临床疗效对比分析.当代医学,2013,19:25-26.
2吴亮,叶峰.腹腔镜微创术治疗结直肠癌患者的临床疗效.中国老年学杂志,2015,35:2442-2444.
3江志远,钟武,高枫,等.腹腔镜与传统开腹手术治疗老年直肠癌患者的临床疗效对比.腹腔镜外科杂志,2014,19:905-908.
4中国抗癌协会大肠癌专业委员会腹腔镜外科学组,中华医学会外科分会腹腔镜与内镜外科学组.腹腔镜结肠直肠癌根治手术操作指南(2006版).外科理论与实践,2006,11:462-464.
5Pikarsky AJ,Rosenthal R,Weiss EG,et al. Laparoscopic total mesorectal excision.Surg Endosc,2012,16:558-562.
6江志远,钟武,高枫,等.腹腔镜与传统开腹手术治疗老年直肠癌患者的临床疗效对比.腹腔镜外科杂志,2014,12:905-908.
7丁建龙,刘晓晨,豆发福,等.不同术式对直肠癌患者肛肠动力学及胃肠激素的影响比较.河北医学,2015,21:1107-1100.
8邢洁,李鹏,张澍田,等.中国结直肠癌防治现状.中华结直肠疾病电子杂志,2013,2:288-291.
9张锦辉,腹腔镜与开腹直肠癌根治术对老年患者机体炎症影响的比较.中国医药导报,2010,7:33-34,36.
10孙永红.直肠癌低位前切除术后肛门功能和肛肠动力学发生改变的相关性.山西医科大学,2012,32:1205-1207.
11孙永红,梁小波.直肠癌低位前切除术后肛门排便功能失调的肛肠动力学改变.山西医科大学学报,2007,38:184-185.
12Artiko V,Markovic AK,Sobic-Saranovic D,et al. Monoclonal immunoscintigraphy for detection of metastasis and recurrenceof colorectal cancer.World J Gastroenterol,2011,17:2424-2430.
13张海林,贾爱萍,邢丽.大肠癌患者肿瘤标志物CA19-9 CEA CA242 AFP CA125和CA153 检测结果分析.微循环学杂志,2013,23:11-12.
14潘慧娟,周胜杰.联合检测CEA.CA199.CA125对结直肠癌的诊断价值.医学信息,2011,24:3244.
15吴亮,叶峰.腹腔镜微创术治疗结直肠癌患者的临床疗效.中国老年学杂志,2015,9:2442-2444.
16Levy M,Visokai V,Lipska L,et al. Tumor markers in staging and prog-nosis of colorectal carcinoma.Neoplacma,2008,55:138.
17张锡贵,吴才,倪武,等.腹腔镜与开腹结直肠癌根治术对患者免疫功能的影响比较.微创医学,2013,8:137-140.
18江志伟,黎介寿.结直肠癌手术腹腔镜或开腹术式选择的争论.中国实用外科杂志,2013,28:453-455.
19Veldkamp R,Gholghesaei M,Bonjer HJ,et al.Laparoscopic resection of colon cancer.Surg Endosc,2014,18:1163-1185.
20The Clinical Outcomes of Surgical Therapy Study Group.A comparison of laparoscopically assisted and open colectomy for colon cancer.N Engl J Med,2012,350:2050-2059.
Therapeutic effects of laparoscopic minimally invasive treatment on rectal cancer and its effects on anorectal dynamical indexes and tumor markers levels
LIUShaoqun,CAOYi’ou.
CentralHospitalofMinhangDistric,Shanghai201199,China
ObjectiveTo observe the therapeutic effects of laparoscopic minimally invasive treatment on rectal cancer and its effects on anorectal dynamical indexes and tumor markers levels.MethodsOne hundred and twenty patients with rectal cancer who were admitted and treated in our hospital from May 2013 to May 2015 were enrolled in the study. According to different surgery modes,these patients were divided into two groups: observation group (n=60) and control group (n=60).The patients in observation group were treated by laparoscopic minimally invasive treatment,however,the patients in control group were treated by conventional laparotomy.The therapeutic effects,anorectal dynamics and tumor markers levels were detected and compared between two groups.ResultsThe operation time (196.7±42.4)min in observation group was significantly longer than that (162.5±38.3)min in control group (P<0.05).However the intraoperative hemorrhage volume, postoperative exhaust time and out-of-bed activity time in observation group were significantly lower than those in control group (P<0.05). The incidence of postoperative complications in observation group was significantly lower than that in control group (P<0.05). There were no significant differences in anorectal dynamics indexes and tumor markers levels before operation between two groups (P>0.05). The anorectal dynamical indexes on 1m,2m,4m after operation and tumor markers levels on 3d,7d,15d after operation in observation group were suprior to those in control group (P<0.05).ConclusionThe laparoscopic minimally invasive treatment has obvious therapeutic effects on rectal cancer,with less injury to organism,less intraoperative hemorrhage volume,earlier recovery after operation,fewer incidence of postoperative complications,less effects on anorectal dynamical indexes, moreover,which is helpful to improve tumor markers levels and is beneficial to rehabilitation of patients with rectal cancer.
colorectal cancer;laparoscopic minimally invasive treatment; effects;anorectal dynamics;tumor markers;influence
10.3969/j.issn.1002-7386.2016.18.005
201199上海市闵行区中心医院
曹奕鸥,201199上海市闵行区中心医院;
E-mail:wzq1915@163.com
R 735.37
A
1002-7386(2016)18-2741-04
2016-03-17)

