牛胰脂肪酶交连酶聚体的制备及性能研究
崔建东,刘容麟(河北省发酵工程技术研究中心,生物科学与工程学院,河北科技大学,河北石家庄050018)
牛胰脂肪酶交连酶聚体的制备及性能研究
崔建东,刘容麟
(河北省发酵工程技术研究中心,生物科学与工程学院,河北科技大学,河北石家庄050018)
以牛胰脂肪酶(cattle pancreatic lipase,CPL)为研究对象,采用交联酶聚体技术,研究交联酶聚体脂肪酶(CPLCLEAs)的制备条件、催化性能和酶促反应动力学参数。结果表明,交联酶聚体脂肪酶制备的最优制备条件为:硫酸铵饱和度80%,戊二醛终浓度1.5%,交联时间1 h,在此条件下,所得CPL-CLEAs最高酶活回收率为90%。CPL-CLEAs的最适催化温度是60℃,与游离脂肪酶相比,CPL-CLEAs的最适催化温度提高了10℃,且温度稳定性、储存稳定性和操作稳定性均有所提高。重复使用7次后,CPL-CLEAs仍能保持初始酶活的43%。
交联酶聚体技术,脂肪酶,固定化酶
脂肪酶作为一种天然的、绿色的生物催化剂,不仅能催化酯合成、酯交换、聚合物合成等,而且可用于催化多肽的合成以及手性化合物的拆分等反应,如可以利用某些脂肪酶的立体专一性催化某些化学方法难以完成的旋光异构体拆分和手性药物合成反应[1]。在食品领域,脂肪酶也有广泛的应用,如在食用油脂工业上,脂肪酶可以催化酯交换、酯转移、水解等反应;在乳品工业中脂肪酶可用于乳酯水解,包括奶酪和奶粉风味的增强、奶酪的熟化、代用奶制品的生产、奶油及冰淇淋的酯解改性等[2]。在食品添加剂工业中主要用于酯类添加剂的合成[2]。
但游离的脂肪酶在应用过程中,表现出不稳定、易失活以及难以回收利用的问题,限制了该酶的应用,为了提高脂肪酶的工业适用性,脂肪酶的固定化已经受到极大的关注。例如,通过将猪胰脂肪酶固定在离子液体修饰的介孔二氧化硅上,所得的固定化脂肪酶的酶活力和稳定性比游离酶均得到显著提高[3]。梁静鹃等[4]将脂肪酶固定在硅胶上,并研究了该固定化脂肪酶在离子液体中催化合成生物柴油的性能,结果表明,固定化脂肪酶的稳定性比游离酶显著提高,且离子液体的添加有效提高了生物柴油的转化率。尽管将脂肪酶固定到载体上能有效改善脂肪酶的催化稳定性。但是载体的存在不但增加了固定化的成本,而且易产生传质扩散阻碍,降低酶的催化效率[5]。近年来,无载体固定化酶技术成为研究的热点。交联酶聚体(CLEAs)是一种研究最多的无载体固定化技术,其制备过程包括沉淀和交联两步,即:将酶蛋白进行沉淀后,利用戊二醛使酶分子交联成酶聚体形式。CLEAs具有操作简便、酶回收率高、成本低廉等特点,极具开发价值[6-8]。
因此,本研究利用CLEAs技术制备稳定性好、酶活回收率高、能重复使用的牛胰脂肪酶CLEAs,优化了制备参数;并研究了脂肪酶CLEAs的催化性能。旨为脂肪酶的工业化应用提供借鉴。
1 材料与方法
1.1 材料与仪器
牛胰脂肪酶(CPL,15~25 U/mg)、对硝基苯酚、对硝基苯酚乙酸酯 阿拉丁试剂(上海)有限公司;50%戊二醛(v/v) 北京百灵威科技有限公司;聚乙二醇辛基苯基醚(Ttiton X-100) 天津博迪化工股份有限公司;其他试剂 均为分析纯。
HZX-110型电子天平 福州华志科学仪器有限公司;恒温多头磁力搅拌器 金坛市荣华仪器厂;HC-2064型高速离心机 安徽中科中佳科学仪器有限公司;742型紫外分光光度计 上海光谱仪器有限公司;DK-98-II型电热恒温水浴锅 天津市泰斯特仪器有限公司;S-4800-I型场发射扫描电子显微镜日本HITACHI。
1.2 实验方法
1.2.1 交联酶聚体脂肪酶(CPL-CLEAs)的制备 取0.561 g硫酸铵加入到含有1 mL 0.1 g/mL的牛胰脂肪酶溶液的7 mL离心管中,使硫酸铵的饱和度为80%,之后加入50%戊二醛溶液,使体系戊二醛终质量浓度为1.5%,常温下分别交联1 h,然后7000×g离心5 min,弃去上清,用50 mmol/L磷酸缓冲液(pH7.5)洗涤3次,7000×g下离心5 min,沉淀重新均匀悬浮在50 mmol/L磷酸缓冲液(pH7.5)中,4℃保存备用。
1.2.2 对硝基苯酚标准曲线的制作 分别在410 nm下测定质量浓度为1.2、2.4、3.6、4.8、6.0 mg/L的对硝基苯酚的吸光值,以吸光值为横坐标,质量浓度为纵坐标绘制标准曲线。
1.2.3 游离牛胰脂肪酶和CPL-CLEAs酶活测定 利用对硝基苯酚法(紫外分光光度法)测定游离牛胰脂肪酶酶活[9]。取4 mL 0.09 g/L的对硝基苯酚乙酸酯(含有50 mmol/L,pH7.5磷酸缓冲液,体积分数0.2% Triton X-100),加入1 mL 0.1 g/L牛胰脂肪酶酶液,37℃恒温水浴5 min,用分光光度计在410 nm测定吸光值,空白对照为含有等量灭活酶液的上述体系。根据对硝基苯酚标准曲线计算酶活。CPL-CLEAs的酶活测定条件与游离脂肪酶相似,只是把游离酶换成CPL-CLEAs。一个酶活力单位定义为每分钟催化对硝基苯酚乙酸酯生成1 μmol对硝基苯酚所用的酶量,酶活回收率及酶活残留率计算公式如下[10]:
酶活回收率(%)=交联酶聚体酶活/制备交联酶聚体所用游离酶酶活×100
酶活残留率(%)=处理后残留的酶活/处理前酶活×100
相对酶活(%)是在考察最适催化温度时,将某一温度下测定的脂肪酶酶活最高值记为100%,其他温度下测定的酶活与最高酶活的比值。
1.2.4 CPL-CLEAs的形态观察 CPL-CLEAs样品被真空冷冻干燥后,在真空条件下喷铂金后利用电子扫描显微镜检测。
1.2.5 统计分析 所有实验重复进行3次,利用SAS软件(v8.0)进行统计分析。
1.2.6 牛胰脂肪酶交联酶聚体制备条件的优化CLEAs的制备包括沉淀和交联两步,制备工艺参数的优化如下。
1.2.6.1 沉淀剂硫酸铵饱和浓度优化 分别取0.313、0.390、0.472、0.561、0.662 g硫酸铵加入到5只含有1 mL 0.1 g/mL的牛胰脂肪酶溶液(用pH7.5的50 mmol/L磷酸缓冲液配制)的7 mL离心管中,使硫酸铵的饱和浓度分别为50%、60%、70%、80%、90%,之后加入质量浓度为50%的戊二醛10 μL,常温下交联1 h,7000×g下离心5 min,弃去上清,7000×g下离心5 min,沉淀重新均匀悬浮在50 mmol/L磷酸缓冲液(pH7.5)中,用紫外分光光度法测定酶活,计算酶活回收率。
1.2.6.2 交联剂戊二醛质量浓度优化 向5只含有1 mL 0.1 g/mL牛胰脂肪酶溶液(用50 mmol/L磷酸缓冲液配制)的7 mL离心管中分别加入0.561 g硫酸铵,使硫酸铵饱和浓度为80%,然后分别加入质量浓度为50%的戊二醛10.1、20.4、30.9、41.7、52.6 μL,使得体系中戊二醛的质量浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%,常温下交联1 h,7000×g下离心5 min,弃去上清,沉淀用50 mmol/L磷酸缓冲液(pH7.5)洗涤3次,7000×g下离心5 min,沉淀重新均匀悬浮在50 mmol/L磷酸缓冲液(pH7.5)中,用紫外分光光度法测定酶活,计算酶活回收率。
1.2.6.3 交联时间的优化 将0.561 g硫酸铵分别加入到5只含有1 mL 0.1 g/mL的牛胰脂肪酶溶液(用pH7.5的50 mmol/L磷酸缓冲液配制)的7 mL离心管中,使硫酸铵的饱和浓度为80%,之后加入质量浓度为50%的戊二醛溶液,使体系戊二醛质量浓度为1.5%,常温下分别交联0.5、1、1.5、2、2.5 h,7000×g离心5 min,弃去上清,用50 mmol/L磷酸缓冲液(pH7.5)洗涤3次,7000×g下离心5 min,沉淀重新均匀悬浮在50 mmol/L磷酸缓冲液(pH7.5)中,用紫外分光光度法测定酶活,计算酶活回收率。
1.2.7 最适催化温度的测定 分别测定游离酶和CPL-CLEAs在30、40、50、60、70℃下的酶活,酶活测定方法同1.2.3。
1.2.8 动力学常数的测定 取一定量的酶样品测定不同底物浓度(120、110、100、90、80 μmol/L对硝基苯酚乙酸酯)下的酶促反应速率,利用双倒数法得到Km和Vmax。
1.2.9 CPL-CLEAs稳定性的研究 CPL-CLEAs的稳定性研究主要包括pH稳定性、温度稳定性、储藏稳定性和操作稳定性,以游离酶作为对照。
1.2.9.1 温度稳定性的测定 将游离酶和CPL-CLEAs 在60℃水浴处理,每隔1 h,分别取出1 mL游离酶和1 mL悬浮的CPL-CLEAs,游离酶直接测酶活,CPLCLEAs先在7000×g离心5 min,然后用1 mL磷酸缓冲液悬浮,测定酶活。计算不同处理时间的酶活残留率[8]。
1.2.9.2 储存稳定性测定 将游离酶,CPL-CLEAs悬浮液分别储存在25℃,每隔3 d测定一次酶活,计算酶活残留率。
1.2.9.3 操作稳定性测定 分别将游离酶、CPLCLEAs悬浮液在25℃,200 r/min振荡条件下,每隔3 d测定一次酶活,计算酶活残留率[11]。
1.2.9.4 CPL-CLEAs重复使用性的测定 取1 mL CPL-CLEAs悬浮液,在37℃条件下催化底物对硝基苯酚乙酸酯生成对硝基苯酚,反应5 min后,离心分离出固定化酶,用50 mmol/L磷酸缓冲液(pH7.5)洗涤3次后,7000×g离心5 min,在沉淀(CPL-CLEAs)中加入新的底物溶液进行第二轮反应,依此分批催化,每次催化反应后分别检测固定化酶剩余的酶活。
2 结果与分析
2.1 CPL-CLEAs制备条件的优化
2.1.1 对硝基苯酚标准曲线 所得对硝基苯酚标准曲线方程为:Y=8.7457X-0.1607,R2=0.9999。
2.1.2 硫酸铵饱和浓度对CPL-CLEAs酶活回收率的影响 从图1中可以看出,随着硫酸铵饱和浓度的增大酶活回收率逐渐增加,当饱和浓度达80%时,牛胰脂肪酶的回收率达到最高,之后小幅度降低。这可能是由于随着硫酸铵饱和浓度的增加,越来越多的盐离子与酶蛋白竞争溶液中的水分子,破坏酶蛋白表面的水化膜,降低其溶解度,使之从溶液中沉淀出来,当大部分酶蛋白析出后,再继续增加硫酸铵,析出的酶蛋白就越来越少,并且高浓度的硫酸铵使得溶液pH酸性增强,导致部分酶蛋白会变性失活,因而又开始出现下降趋势[12]。

图1 硫酸铵饱和浓度对CPL-CLEAs酶活回收率影响Fig.1 The effect of(NH4)2SO4concentration on activity recovery of CPL-CLEAs
2.1.3 戊二醛浓度(质量浓度)对CPL-CLEAs酶活回收率的影响 从图2可以看出,随着戊二醛浓度的增加,酶活回收率逐渐升高,当体系中的戊二醛浓度为1.5%时,酶活回收率达到最高,为90%。之后随着戊二醛浓度的增加,酶活回收率开始下降。戊二醛一方面是蛋白的交联剂,可以将蛋白表面的赖氨酸残基交联起来,但另一方面又是蛋白的变性剂;浓度低时,难以将大多数酶分子交联固定,导致大多数酶分子泄漏到上清中,使固定化酶的酶活回收率降低;而过量的戊二醛可以进入酶分子的活性中心,破坏酶的活性中心结构,使酶失活[13]。
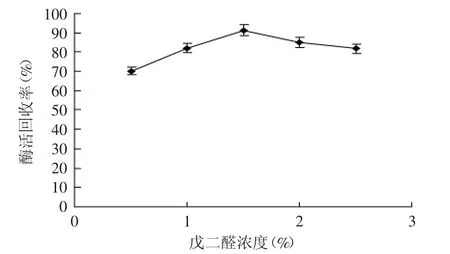
图2 戊二醛浓度对CPL-CLEAs酶活回收率影响Fig.2 The effect of glutaraldehyde concentration on enzyme recovery of CPL-CLEAs
2.1.4 交联时间对CPL-CLEAs酶活回收率的影响
从图3可知,交联时间在1 h时,酶活回收率达到最大,为90%,此时大部分酶都已经交联在一起,随着时间的增加,酶蛋白长时间的与戊二醛接触,酶活性中心更易受到戊二醛的破坏,导致酶失活,酶蛋白会受到一定破坏,时间越长,酶活损失越大[14]。
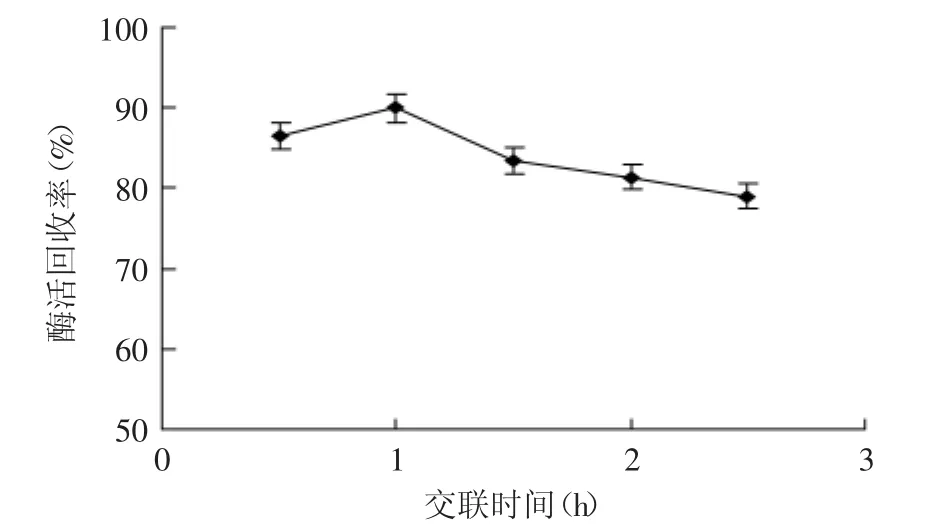
图3 交联时间对CPL-CLEAs酶活回收率的影响Fig.3 The effect of cross-linking time on activity recovery of CPL-CLEAs
2.2 交联酶聚体脂肪酶的形态观察

图4 CPL-CLEAs的形态Fig.4 Morphology of CPL-CLEAs
图4是扫描电镜观察的固定化酶的图片。从图4中可以看出,制备的CPL-CLEAs的颗粒非常小(图4a),呈现疏松多孔的网状结构(图4b)。这种疏松多孔的网状结构是由于戊二醛使酶蛋白分子以共价键结合,形成网状结构,这种结构使得制备的CPL-CLEAs具有优良的稳定性和一定的机械强度[15]。同时,网状结构还提高了固定化酶的表面积,提高了酶与底物的接触机会,使底物更容易进入酶的活性中心发生酶促反应,因而使CPL-CLEAs具有较高的催化活性。
2.3 最适催化温度和动力学参数
2.3.1 最适催化温度 由图5可知,游离脂肪酶的最适催化温度为50℃,交联酶聚体脂肪酶的最适催化温度为60℃。且交联酶聚体脂肪酶对高温的适用范围变宽;当催化温度由50℃升高至70℃时,游离酶的相对酶活下降至60%,而交联酶聚体脂肪酶的相对酶活仅下降至90%。因此,交联酶聚体脂肪酶比游离脂肪酶具有更好的温度适用性。
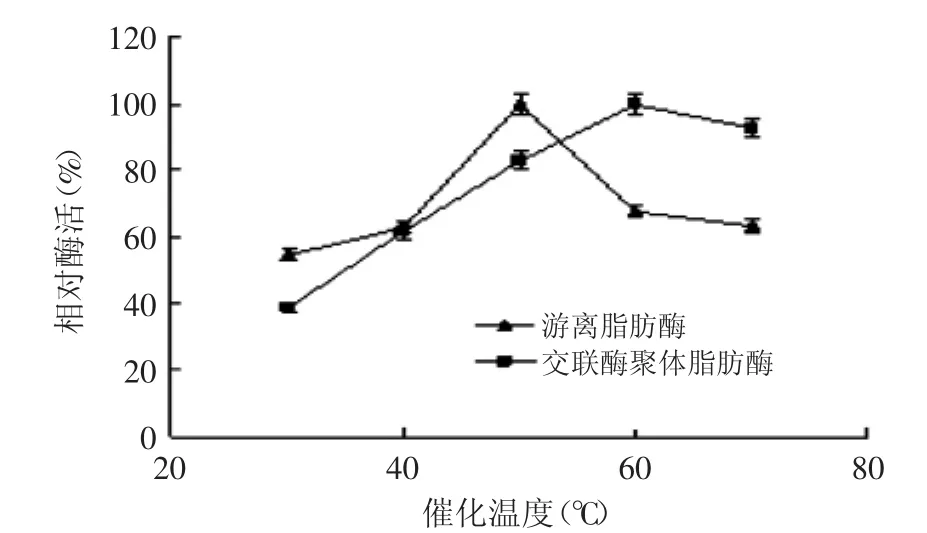
图5 游离酶和交联酶聚体脂肪酶的最适催化温度Fig.5 The optimal temperature of CPL and CPL-CLEAs
2.3.2 动力学常数 由表1可知,交联酶聚体脂肪酶的Km值比游离脂肪酶的大,表明游离脂肪酶更易与底物结合,并且与底物结合后形成的中间体结合力也相对大,不易于解离,因此游离脂肪酶的Vmax比交联酶聚体脂肪酶的大[16]。而交联酶聚体脂肪酶中由于酶分子各个亚基受共价键链接影响,其构象也发生一定变化,使活性位点的构象发生改变,导致酶活性中心与底物的亲和力有所下降;而且交联酶聚体脂肪酶中酶分子以超分子状态聚集到一起,导致底物难以进入交联酶聚体脂肪酶的活性中心,表现出Vmax降低。

表1 游离脂肪酶和交联酶交联酶聚体脂肪酶的Vmax和KmTable1 Vmaxand Kmof CPL and CPL-CLEAs
2.4 交联酶聚体脂肪酶的稳定性
2.4.1 温度稳定性 从图6可以看出,游离脂肪酶在60℃处理5 h后酶活残留率仅能保持75%,但是,交联酶聚体脂肪酶在相同条件下处理5 h后酶活几乎没有损失。这可能是由于交联酶聚体脂肪酶中由于共价键的存在阻止了酶分子的伸展变形以及分子自我变性[17],使得酶结构更加稳定。
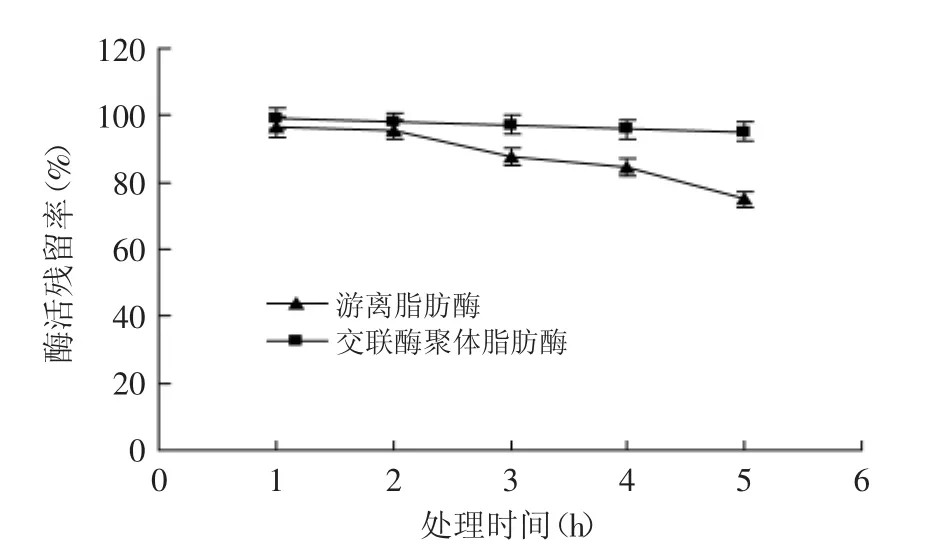
图6 游离脂肪酶和交联酶聚体脂肪酶的温度稳定性Fig.6 Thermal stability of CPL and CPL-CLEAs
2.4.2 储存稳定性 从图7可以看出,游离脂肪酶在25℃下储存到第12 d时酶活仅剩43%,但是,交联酶聚体脂肪酶仍能保留80%的酶活,显示出良好的储存稳定性。这可能由于脂肪酶在戊二醛的作用下,脂肪酶表面的活性基团互相链接后,形成了稳定结构,这种稳定的结构对酶的活性中心有一定的保护作用,使其经过长时间储存后,仍然可以保持较高酶活力[18]。

图7 游离脂肪酶和交联酶聚体脂肪酶的储存稳定性Fig.7 Storage stablility of CPL and CPL-CLEAs
2.4.3 操作稳定性 从图8中可以看出,游离脂肪酶在200 r/min振荡条件下维持12 d时,酶活残留率仅剩13%。而在同样的条件下维持12 d,交联酶聚体脂肪酶酶活残留率能保持63%。这可能是由于在高剪切力的作用下,酶分子构象更容易发生变化,使酶变性失活。但将酶分子间交联固定化后,由于固定化后的酶分子构象更趋于刚性,不易发生变化,使酶构象更稳定,从而可以保持较高酶活力[18-19]。
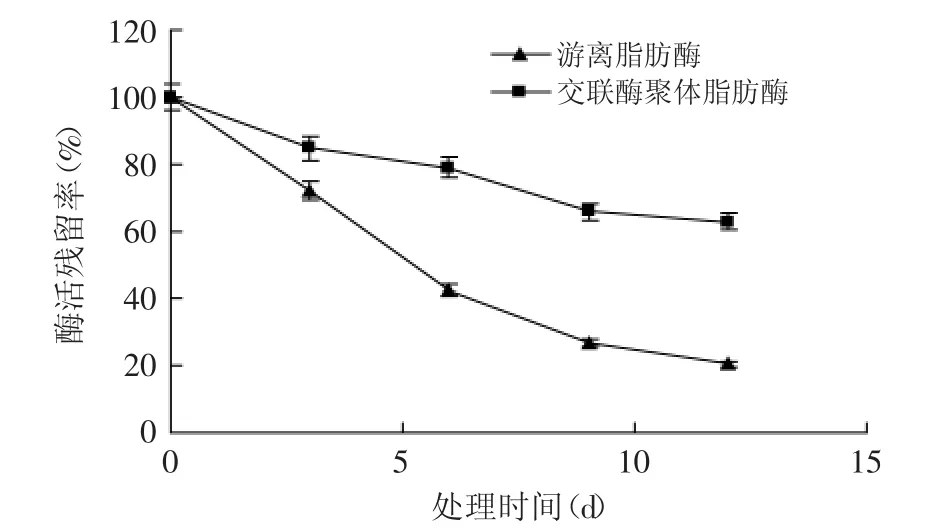
图8 游离酶和交联酶聚体脂肪酶的操作稳定性Fig.8 Operation stability of CPL and CPL-CLEAs
2.4.4 重复使用性 从图9可知,交联酶聚体脂肪酶重复使用7次,酶活残留率仍能保持43%。说明交联酶聚体脂肪酶具有较好的重复使用效果。相对于游离酶而言,交联酶聚体脂肪酶可以更容易的从反应液中分离出来用于下一循环,从而减少回收过程中酶的损失,提高工业化应用效果。

图9 交联酶聚体脂肪酶的重复使用性Fig.9 Reusability of CPL-CLEAs
3 结论
本研究制备了牛胰脂肪酶交联酶聚体,获得的最适制备条件是:硫酸铵饱和浓度80%,戊二醛质量浓度1.5%,交联时间1 h,在此条件下,获得的最大酶活回收率达到90%。与游离脂肪酶相比,交联酶聚体脂肪酶在60℃处理5 h后酶活几乎没有损失,而游离脂肪酶只能保持75%的初始酶活;交联酶聚体脂肪酶在25℃下储藏12 d后仍能保持初始酶活的80%,但游离脂肪酶只能保持43%。在持续的12 d振荡条件下,交联酶聚体脂肪酶能保持初始酶活的63%,而游离脂肪酶只有13%。在重复使用7次后,交联酶聚体脂肪酶酶活残留率仍能保持43%。上述结果表明这种固定化酶方法在工业应用中具有较好的实用前景。
[1]许建和.生物催化工程[M].上海:华东理工大学出版社,2008.
[2]刘海洲,吴小飞,牛佰慧,等.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57.
[3]邹彬,初旭明,张洋,等.离子液体修饰的SBA-16材料在猪胰脂肪酶固定化中的应用[J].生物加工过程,2014(12):6-11.
[4]梁静鹃,杨立鹏,韩钧,等.固定化脂肪酶在离子液体中催化合成生物柴油[J].可再生能源,2012,30:72-77.
[5]Zhang W W,Yang X L,Jia J Q,et al.Surfactant-activated magnetic cross-linked enzyme aggregates(magnetic CLEAs)of Thermpmyces lanuginosus lipase for biodiesel production[J].Journal of Molecular Catalysis B:Enzymatic,2015,115:3-89.
[6]Xu D Y,Yang Zh.Cross-linked tyrosinase aggregates for elimination of phenolic compounds from wastewater[J].Chemosphere,2013,92(4):391-398.
[7]Yu HW,Chen H,Wang X,et al.Cross-linked enzyme aggregates(CLEAs) with controlled particles:Application to Candida rugosa lipase[J].Molecular Catalysis,2006,43:124-127.
[8]马雷猛,贵莉莉,王飞,等.添加纳米粒子对脂肪酶交联酶聚集体活性及结构的影响[J].北京化工大学学报,2015,42 (2):83-88.
[9]Wilson L,Fern'andez-Lorente G,Fern'andez-Lafuente R.CLEAs of lipases and poly-ionic polymers:A simple way of preparing stable biocatalysts with improved properties[J].Enzyme and Microbial Technology,2006,39:750-755.
[10]孙立梅,李连连,崔建东.牛血清白蛋白辅助交联对苯丙氨酸解氨酶交联酶聚体影响的研究[J].食品工业科技,2013,13:44-47.
[11]邢肖肖,王梦凡,齐崴,等.β-半乳糖苷酶交联酶聚体的制备及酶学性质研究[J].食品工业科技,2014,35(23):158-167.
[12]李连连,崔建东.以大孔硅胶为载体的苯丙氨酸解氨酶交联酶聚体的制备及性质研究[J].食品工业科技,2014,35(11):160-165.
[13]Cui J D,Zhang S,Sun L M.Cross-linked enzyme aggregates of phenylalanine ammonia lyase:novel biocatalysts for synthesis of L-Phenylalanine[J].Applied Biochemistry and Biotechnology,2012,167(4):835-844.
[14]Moon II Kim,Jungbae Kim,Jinwoo Lee.One-dimensional crosslinked enzyme aggregates in SBA-15:Superior catalytic behavior to conventional enzyme immobilization[J].Microporous and Mesoporous Materials,2008,101:18-23.
[15]Mengfan Wang,Wei Qi,Qingxin Yu,et al.Cross-linking enzyme aggregates in the macropores of silica gel:A practical and efficient method for enzyme stabilization[J].Biochemical Engineering Journal,2010,52:168-174.
[16]刘娟,杨楠楠,姜爱莉.固定化脂肪酶的制备及其酶学性质的研究[J].油脂化学,2013,38(1):44-47.
[17]石莲莲.固载化脂肪酶交联酶聚集体的制备及应用[D].天津:河北工业大学,2013.
[18]王梦凡.新型交联酶聚体技术及其在蛋白组学与生物催化中的应用[D].天津:天津大学,2011.
[19]常凯,王红英,孙井辉.磁性壳聚糖微球固定化脂肪酶的研究[J].大连工业大学学报,2011,30(1):31-33.
Preparation and properties of cross-linked enzyme aggregates of cattle pancreatic lipase
CUI Jian-dong,LIU Rong-lin
(Research Center for Fermentation Engineering of Hebei,College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,China)
In this study,cross-linked enzyme aggregates(CLEAs)of cattle pancreatic lipase(CPL-CLEAs)was prepared by cross-linked enzyme aggregates technology,the preparation conditions,catalysis properties,and dynamics parameters of CPL-CLEAs were investigated.The results showed that the optimum conditions of the preparation of CPL-CLEAs were as followed:final saturability of the ammonium sulfate was 80%,final concentration of glutaraldehyde was 1.5%,and corss-link time was 1 h.Under this condition,the highest activity recovery reached 90%.In addition,compared to free lipase,the optimum temperature of CPL-CLEAs was 60℃,which was increased about 10℃.The thermal stability,operational stability,and storage stablility of CPL-CLEAs were significantly enhanced compared with free lipase.Furthermore,the CPL-CLEAs still retained 43%of its initial activity after consecutive 7 cycles.
CLEAs technology;lipase;immobilized enzyme
TS202.3
A
1002-0306(2016)06-0201-05
10.13386/j.issn1002-0306.2016.06.033
2015-07-06
崔建东(1974-),男,博士,教授,主要从事生物催化与微生物资源开发,E-mail:cjd007cn@163.com。
国家自然科学基金(21072041);河北省自然科学基金(B2014208054)。

