菊糖与精氨酸的美拉德反应及其产物的抗氧化性能研究
吴慧伦,张亦鸣,关 曼,江海云,谢 晶,孙 涛(上海海洋大学食品学院,上海201306)
菊糖与精氨酸的美拉德反应及其产物的抗氧化性能研究
吴慧伦,张亦鸣,关 曼,江海云,谢 晶,孙 涛*
(上海海洋大学食品学院,上海201306)
菊糖与精氨酸(菊糖与精氨酸的羰氨比为1∶5)在100℃的条件下发生美拉德反应,制备反应10、40和70 h的美拉德反应产物,分别标记为IR10、IR40以及IR70,考察其美拉德反应过程中的进程指标(pH、紫外-可见吸光光度值、荧光值)并对产物进行红外表征,然后对其抗氧化能力进行测定。结果表明:随着反应的进行,反应体系的pH呈现下降的趋势;紫外-可见光谱在296 nm处的吸收峰随着反应时间的增加而增强;在323 nm的激发波长和408 nm的发射波长下的荧光值随着反应时间的增加而增强;各衍生物均保留有菊糖本身的特征吸收峰;衍生物对DPPH、O2·-的清除能力以及还原能力均低于茶多酚对照组,但较之于菊糖(对DPPH清除能力以及还原能力几乎为0)均有提高,且抗氧化性能随着反应时间的增加而增强。
菊糖,进程指标,美拉德反应,抗氧化性能
菊糖是一种天然果聚糖,由D-呋喃果糖分子以β-(2,1)糖苷键连接生成,每个菊糖分子末尾以α-(1,2)糖苷键连接一个葡萄糖残基[1]。菊糖具有调节血糖血脂、低热量、改善肠道环境以及促进矿物质吸收等生理功能[2],因此常应用于保健食品中。我国拥有丰富的菊糖资源,但对菊糖的研究与应用基础还比较薄弱。
美拉德反应常见于食品加工、生产与储藏过程中,其产物中的类黑精、还原酮以及一些杂环化合物等具有一定的抗氧化性,且美拉德反应产物具有天然无毒的特性,因此被期望用于合成抗氧化剂[3-4]。当多糖参与美拉德反应时,很多美拉德反应产物的抗氧化性和抑菌性均优于多糖本身[5],其中的某些物质抗氧化性质可媲美于食品中的很多抗氧化剂。
菊糖在食品加工过程中能够发生美拉德反应,在加工巧克力的过程中,由于加入的菊糖参与美拉德反应,能够有效改善巧克力的风味[6]。但对于菊糖在美拉德反应过程中结构与功能变化的研究还较为罕见。精氨酸是一种较常见的氨基酸,其在很多食品中含量丰富。本文以菊糖和精氨酸进行美拉德反应,研究反应前后菊糖的结构及性质的变化,以期为多糖美拉德反应的研究提供参考。
1 材料与方法
1.1 材料与仪器
菊糖 纯度>97%,购自上海普振生物科技有限公司;鲁米诺、DPPH(1,1-二苯基-2-苦基肼) 购自Sigma公司;茶多酚 购自湖州荣凯植物提取有限公司;精氨酸、邻苯三酚、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇 均为分析纯,购自国药集团化学试剂有限公司。
TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;岛津RF-530Pc荧光分光光度计 日本岛津公司;DELTA-320型pH计 梅特勒-托利多仪器上海有限公司;FTIR-650傅里叶变换红外光谱仪 天津港东科技发展股份有限公司;IFFM-D型流动注射化学发光分析仪 西安瑞迈电子科技有限公司。
1.2 菊糖的美拉德反应
称取10.0 g菊糖和0.16 g精氨酸,使得菊糖的羰基与精氨酸的氨基的摩尔比为1∶5,将其溶解于100 mL的二次蒸馏水中,在100℃下进行回流反应。用乙醇或丙酮提取10、40、70 h的菊糖美拉德反应产物,直至用茚三酮法不能检测到产物中还有精氨酸的存在,烘干得到产物并分别标记为IR10、IR40以及IR70。
1.3 测试表征
在反应过程中,利用pH计、双光束紫外可见分光光度计和荧光分光光度计分别测美拉德反应体系的pH、紫外-可见吸光光度值以及荧光值的变化。
红外表征在傅里叶变换红外光谱仪上进行,采用KBr压片法,测定的波数范围为500~4000 cm-1,分辨率为2 cm-1。
1.4 抗氧化性能测定
1.4.1 对DPPH自由基的清除 取8只试管,分别标记为0~7。向1~7号试管中加入2 mL浓度为10-4mol/L 的DPPH乙醇溶液和不同浓度的样品溶液,混匀后于33℃条件下避光静置0.5 h,在517 nm处测得吸光度为Ai,在0号试管中加入2 mL去离子水和2 mL DPPH乙醇溶液,测吸光度为A0,阴性对照组另取7只试管加入无水乙醇、样品各2 mL,测吸光度为Aj[7]。
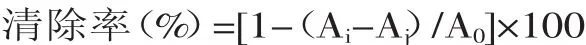
1.4.2 对超氧阴离子自由基O·2-的清除 用0.05 mol/L 的Na2CO3-NaHCO3缓冲溶液(pH=10.20)配制1.5×10-3mol/L的鲁米诺溶液以及不同浓度的样品溶液。0.1 mol/L的邻苯三酚储备液是用1×10-3mol/L的盐酸配制而成,使用前用去离子水稀释至1×10-4mol/L。在室温下,采用流动注射化学发光分析仪来测定样品溶液的峰面积Ai以及空白溶液的峰面积A0。经SOD、过氧化氢酶及甘露醇检测,该体系产生的自由基为超氧阴离子自由基(O·2-)[8]。
清除率(%)=(A0-Ai)/A0×100
1.4.3 还原能力的测定 取pH=6.60的0.2 mol/L的磷酸缓冲液、1%的铁氰化钾溶液各2.5 mL,加入到2.0 mL不同浓度的样品溶液中,于50℃条件下水浴20 min,取出后立即于冰水中冷却,加入2.5 mL 10%的三氯乙酸溶液,混匀后于3000 r/min下离心10 min,取上清液2.0 mL,加入去离子水2.5 mL和0.1%的三氯化铁溶液0.5 mL,静置10 min后,于700 nm处测定其吸光度值。其吸光度值越大,还原能力就越强[9]。1.4.1~1.4.3中均以茶多酚(TP)为对照。
1.5 数据分析
以上所有实验重复三次,最终的实验结果以三次实验数据的算术平均值确定。利用t-检验进行组间分析(p<0.05),并采用Origin软件绘图。
2 结果与讨论
2.1 结构表征
2.1.1 pH的变化 图1描述了菊糖与精氨酸美拉德反应过程中pH的变化,菊糖与精氨酸的美拉德反应体系的初始pH呈碱性,随着反应的进行,体系的pH呈现下降趋势,这是由于在美拉德反应的过程中羰基不断与碱基基团-氨基缩合,将游离的氨基封闭[10],且在反应过程中也会产生甲酸和乙酸等一些酸类物质[11],从而引起pH的下降。

图1 菊糖与精氨酸美拉德反应过程中pH的变化Fig.1 The pH change during Maillard reaction
2.1.2 紫外-可见吸光度的变化 美拉德反应的过程中糖会发生易构和脱水,产生糠醛类物质,该类物质在290 nm左右有特征吸收[12]。由图2可知,菊糖与精氨酸的美拉德反应体系在296 nm的波长处有最大吸收,随着反应的进行,反应前25 h增幅较大,其后增幅则慢慢减缓,表明反应过程中有糠醛类物质生成且不断积累,且后期糠醛类物质积累量减少。这很好地反映了美拉德反应的进程。
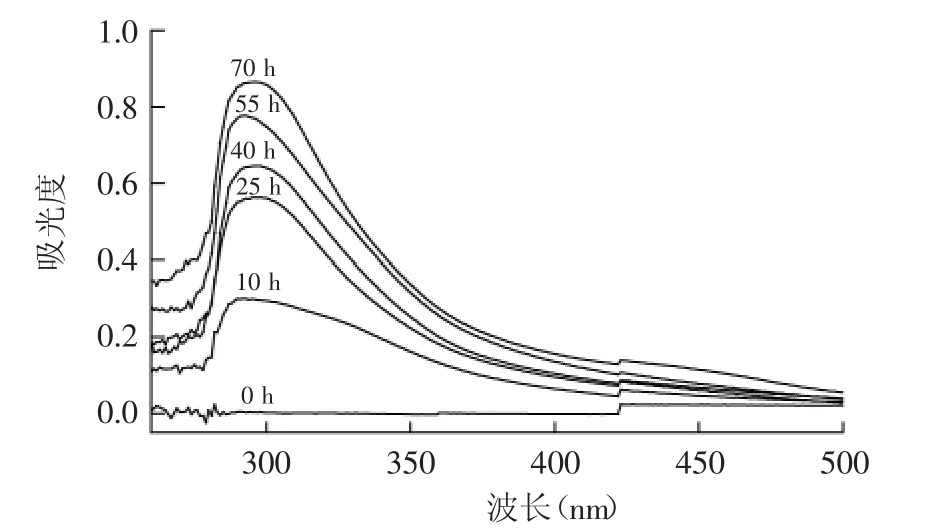
图2 菊糖与精氨酸美拉德反应过程中吸光度的变化Fig.2 The UV-vis absorbance during Maillard reaction
2.1.3 荧光值的变化 如图3所描述的是菊糖与精氨酸美拉德反应体系在323 nm激发波长,扫描发射波长为350~600 nm范围的荧光值,在408 nm发射波长下体系的荧光强度最大,且荧光强度随着反应的进行不断增加,表明了具有荧光性质的美拉德反应产物的不断增加。荧光物质是美拉德反应的一种指示剂,它能灵敏地反映出美拉德反应的过程[13]。美拉德初期产物经过脱水、重排等会产生无色的还原酮与荧光物质,而此时糠醛、脱氧邻酮醛糖等不饱和的羰基化合物增加[14]。

图3 菊糖与精氨酸美拉德反应过程中荧光值的变化Fig.3 The fluorescence absorbance during Maillard reaction
2.1.4 红外光谱表征 图4是菊糖(In)及其与精氨酸(Arg)的美拉德衍生物的红外光谱图,由图4可以看出,菊糖及其美拉德衍生物在1033 cm-1以及875 cm-1处有特征吸收峰,这些峰都是菊糖主链特征吸收峰,可作为判定菊糖及其衍生物存在的特征吸收峰[15]。菊糖及其美拉德衍生物在2933 cm-1处的吸收峰为C-H的伸缩振动引起的吸收峰,在1410 cm-1处的吸收峰为C-H的弯曲振动所引起的吸收峰。精氨酸的红外谱图显示在1684 cm-1处有吸收峰,此为C=N的特征吸收峰。三种菊糖的美拉德衍生物在1623 cm-1处都有吸收峰,此为C=O的吸收峰[16],而菊糖在此处没有吸收峰,这是因为菊糖与氨基酸在发生美拉德反应的过程中会产生还原酮等物质。
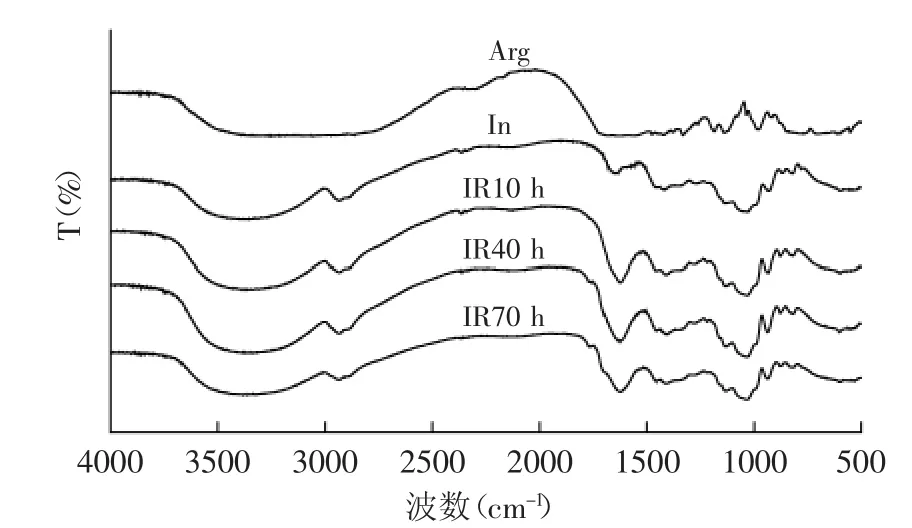
图4 菊糖与精氨酸美拉德产物的红外图谱Fig.4 FTIR spectra of Maillard reaction products
2.2 抗氧化性能分析
2.2.1 对DPPH自由基的清除 DPPH自由基较稳定,其N上有一个游离电子,它在乙醇溶液中呈深紫色,在517 nm处有特征吸收,当DPPH自由基中的孤电子被配对时,则该处的吸收会减弱。且其乙醇溶液也会褪色,其褪色程度与接受的电子数有关,故可利用分光光度法进行定量分析[17]。由图5可知,三种衍生物IR10、IR40、IR70的IC50(对自由基清除率为50%时所需的自由基清除剂的浓度)分别为1.73、0.48、0.07 mg/mL,即对DPPH自由基的清除能力IR70>IR40>IR10,对照组茶多酚TP的IC50为0.02 mg/mL,即茶多酚对DPPH清除能力优于菊糖美拉德反应产物。而菊糖本身对DPPH自由基的清除能力很低,这说明美拉德反应改性对菊糖的DPPH自由基清除能力有所提高,且随着反应的进行,对DPPH自由基的清除能力也随之增加。

图5 菊糖与精氨酸美拉德产物对DPPH自由基的清除能力Fig.5 Scavenging activity of Maillard reaction products on DPPH radical
2.2.2 对超氧阴离子自由基(O2·-)的清除 邻苯三酚在碱性条件下氧化释放出超氧阴离子自由基(O2·-),O2·-与鲁米诺可发生化学发光,发出的光可由发光计检测,自由基清除剂可降低邻苯三酚自氧化速率,清除产生的O2·-,抑制化学发光,从而可定量检测出其自由基清除能力[17-18]。由图6可知,IR70的清除效果最好,其IC50为2.65 mg/mL,IR40次之,IR10的清除效果最差,这三种衍生物对O2·-的清除效果均低于茶多酚TP对照组(IC50为0.26),但都优于菊糖本身,这说明美拉德反改善了菊糖对O2·-的清除能力,且随着反应

图6 菊糖与精氨酸美拉德产物对超氧阴离子自由基(O·)的清除能力Fig.6 Scavenging activity of Maillard reaction products on superoxide anion
时间的增加,清除能力增强。这与DPPH自由基清除能力的结果一致。
2.2.3 还原能力的测定 还原力的测定,实质是检验物质是否是良好的电子供应者。还原力强的物质可与自由基反应,使自由基成为较稳定的物质[17]。研究表明,抗氧化活性和还原力间存在密切的关系[19]。由图7可知,在浓度为2.5 mg/mL时,IR10、IR40、IR70的吸光度分别为0.49、0.71、0.87,对照组茶多酚TP的吸光度为1.72,菊糖本身的还原能力几乎为零,即它们还原能力大小顺序为TP>IR70>IR40>IR10>In,这与前面的实验结果一致。
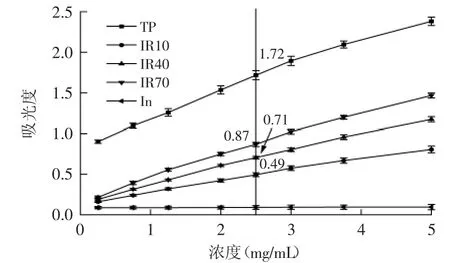
图7 菊糖与精氨酸美拉德产物的还原能力Fig.7 Reducing capacity of Maillard reaction products
3 结论
本实验以美拉德反应为改性手段,对菊糖美拉德反应进程及其抗氧化性能进行了研究。结果表明,菊糖美拉德反应体系的pH皆随着反应时间的增加而下降,紫外吸光度及荧光值均随时间的增加而增强;菊糖与精氨酸的美拉德衍生物的抗氧化性能均优于菊糖,并随着美拉德反应时间的增加,抗氧化性能越来越好。菊糖本身的抗氧化性能较弱,但其美拉德反应过程中会生成一些酸类物质、糠醛类物质以及荧光类物质,且随着反应的进行这些物质不断积累,故而菊糖衍生物的抗氧化性也在不断增强,具体机理有待进一步的研究。这为以后菊糖的美拉德反应的研究提供了理论依据和新的思路。
[1]饶志娟,郑建仙,贾呈祥.功能性食品基料-菊粉的研究进展[J].中国甜菜糖业,2002(4):26-30.
[2]曾小宇,罗登林,刘胜男,等.菊糖的研究现状与开发前景[J].中国食品添加剂,2010(4):222-227.
[3]Wagner K H,Derkits S,Herr M,et al.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chemistry,2002,78(3):375-382.
[4]Osada Y,Shibamoto T.Antioxidative activity of volatile extracts from Maillard model systems[J].Food Chemistry,2006,98(3):855-863.
[5]孙涛,刘华巍,陈春红,等.低聚壳聚糖与葡萄糖的美拉德反应及其衍生物活性研究[J].海洋科学,2012,36(8):79-85.
[6]萧忠友.菊糖低聚果糖与功能性糖果[J].食品工业,2003 (6):12-13.
[7]许钢.红薯中黄酮提取及抗氧化研究[J].食品与生物技术学报,2007,26(4):22-27.
[8]姚倩,孙涛,徐轶霞.低聚壳聚糖衍生物的制备及其抗氧化性能[J].天然产物研究与开发,2008,20(3):530-533.
[9]Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimut agenicity[J].Journal of Agricultural and Food Chemistry,1995,43(1):27-32.
[10]于彭伟,刘登勇,周光宏.木糖-甘氨酸美拉德反应体系光谱特性和抗氧化性能的研究[J].食品科学,2012,33(1):54-58.
[11]Ames J M.Applications of the Maillard reaction in the food industry[J].Food Chemistry,1998,62(4):431-439.
[12]孙丽平,汪东风,徐莹.pH和加热时间对美拉德反应挥发性产物的影响[J].食品工业科技,2009,30(4):122-125.
[13]Matiacevich S B,Pilar Buera M,Lertittikul W,et al.A critical evaluation of fluorescence as a potential marker for the Maillard reation[J].Food Chemistry,2006,95(3):423-430.
[14]Wittayachai L,Soottawat B,Munehiko T.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.
[15]胡云霞,李琬聪,周婷婷,等.1,2,3-三氮唑桥连水杨醛类席夫碱菊糖衍生物的合成及抑菌活性研究[J].化学与生物工程,2014,31(8):27-30.
[16]朱淮武.有机分子结构波谱解析[M].北京:化学工业出版社,2005:52-57.
[17]曾军,石国荣.天然产物抗氧化活性的测定方法和原理[J].安徽农学通报,2008,14(22):35-36.
[18]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(二)[J].食品与发酵工业,2006,32(4):98-102.
[19]Jing H,Kitts D D.Chemical and biochemical properties of casein sugar Maillard reaction products[J].Food and Chemical Toxicology,2002,40(7):1007-1015.
The Maillard reaction of inulin with arginine and the antioxidant activity of inulin derivatives
WU Hui-lun,ZHANG Yi-ming,GUAN Man,JIANG Hai-yun,XIE Jing,SUN Tao*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
The Maillard reaction was occurred by heating inulin and arginine(the ratio of amine group in inulin and carbonyl group in arginine was 1∶5)at 100℃.The products of 10,40 and 70 h were prepared and named IR10,IR40 and IR70,respectively.pH,UV-vis absorbance and fluorescence were determined during Maillard reaction and the derivatives were characterized by FTIR.Their antioxidant activities were evaluated.The results revealed that the pH of the reaction system decreased during Maillard reaction.The UV-vis absorbance at 296 nm increased during the reaction.With 323 nm excited wavelength and 408 nm emission wavelength,the fluorescence intensity increased with the increase of reaction time.Infrared spectrum analysis showed that the Maillard derivatives retained the characteristic absorption peaks of inulin.Three kinds of inulin derivatives had weaker antioxidant activity compared with tea polyphenol,but it was stronger than inulin(its abilities to scavenge DPPH and reducing capacity were almost zero)and the antioxidant activity increased with the increase of reaction time.
inulin;process indicators;Maillard reaction;antioxidant activity
TS201.2
A
1002-0306(2016)06-0179-04
10.13386/j.issn1002-0306.2016.06.028
2015-08-03
吴慧伦(1991-),女,在读硕士研究生,研究方向:多糖的改性,E-mail:963357250@qq.com。
孙涛(1970-),女,博士,副教授,研究方向:多糖的改性及生物功能的开发,E-mail:taosun@shou.edu.cn。
“十二五”国家支撑计划项目(2012BAD38B04)。

