定点突变提高g-谷氨酰转肽酶的pH耐受性及催化活性
彭 清, 姚 忠, 周 治, 王浩绮, 肖 环, 倪 芳, 孙 芸
定点突变提高-谷氨酰转肽酶的pH耐受性及催化活性
彭 清, 姚 忠, 周 治, 王浩绮, 肖 环, 倪 芳, 孙 芸
(南京工业大学 食品与轻工学院, 江苏 南京 211816)
-谷氨酰转肽酶(GGT)是生物体内谷氨酰循环的关键酶,可广泛应用于多种-谷氨酰基化合物的生物合成。但其在体外催化环境下(pH>9.0)极易发生不可逆失活,限制其生物催化领域的实际应用。本实验以枯草芽孢杆菌NX-2 GGT(_GGT)为对象,采用同源建模获得_GGT的3D结构预测模型;分析_GGT大、小亚基表面氨基酸残基的性质、空间位置和保守性,最终选取Asp46、Thr201、Tyr280、Gln322、Glu502和His543为候选位点;通过定点突变将候选位点分别替换为缬氨酸,以期通过提高_GGT大小亚基间的疏水作用,改善其pH耐受性。研究成功实现了6种突变酶(D46V、T201V、Y280V、E502V、Q322V和H543V)的异源表达,并分别研究了其催化活性和稳定性。结果表明:D46V、Y280V、E502V、H543V的m略小于_GGT,且Y280V的cat较_GGT有明显提高;D46V、Y280V和E502V的pH稳定性均较_GGT有所改善,其中Y280V的pH稳定性最高;模型分析显示,在<10Å范围内,Y280V可与附近4个氨基酸残基(Y-283、W-277、I-501和I-497)产生疏水相互作用,这可能是其pH耐受性较强的主要原因。
γ-谷氨酰转肽酶;定点突变;疏水相互作用; pH稳定性;催化性质
1 前 言
-谷氨酰转肽酶(-glutamyltranspeptidase,GGT,EC 2.3.2.2)是生物体内谷氨酰循环的关键酶,广泛存在于细菌、真菌、植物、哺乳类动物中。成熟的GGT是一种异质二聚体酶[1],包含一个大亚基(~40 KDa)和一个小亚基(~20 KDa),是由一个大小约60 KDa的没有催化活性的蛋白前体自主催化分裂而来[2]。
GGT可特异性催化谷胱甘肽的-谷氨酰基断裂, 将其转移至受体分子(如水分子、-氨基酸或二肽)[3]。由于该反应具有位点特异性强,且不消耗ATP等优点,在生物有机合成领域应用广泛。目前,利用GGT反应已成功实现了茶氨酸[4,5]、-谷氨酰-L-多巴[6]、-谷氨酰-L-牛磺酸[7]、-谷氨酰-D-色氨酸[8,9]、-谷氨酰-半胱氨酸[10]等化合物的合成。但由于GGT催化的谷氨酰基转移反应需在碱性(pH>9.0)条件下进行,而枯草芽孢杆菌NX-2 GGT (_GGT)对碱性环境的耐受性普遍较差,限制了GGT反应的工业化应用。
已经证明,大多数寡聚酶的失活往往始于四级结构的变化,即亚基解聚(subunit dissociation)[11]。本课题组在前期的研究中发现,NX-2 GGT在失活过程中也伴随着明显的亚基解聚,且pH值的变化对其多亚基结构的影响尤为显著[12]。
目前,寡聚酶亚基解聚的方法有提高反应压力[13]、酶的物理交联或化学交联[14]、以及酶的固定化[15]等。近年来,利用蛋白质工程手段提高寡聚酶亚基间的相互作用能,提高寡聚酶稳定性的方法逐渐成为研究热点。1987年Klibanov等首次提出了通过定点突变提高寡聚酶亚基间相互作用能的方法,并以磷酸丙糖异构酶(TIM)为对象进行了成功的尝试[16]。此后,Mishra等通过把Cu/Zn SOD二聚体表面一个保守序列上的亮氨酸突变成赖氨酸,降低了二聚体表面的疏水性,加速了其二聚体解聚[17]。Ding等在葡萄糖1-脱氢酶的亚基表面之间导入二硫键,使该酶在pH4.5~10.5保持高度稳定的状态,在50℃下的半衰期为9900min,是野生型酶的1868倍[18];Bjørk等将的苹果酸脱氢酶中的Glu165替换为Gln或Lys,使突变酶在pH 7.5条件下的热稳定性显著提高[19]。Peimbert等将TIM亚基表面上的部分残基(K17,Y46,D48,Q82和D85)替换为非极性氨基酸(Ala、Val、Phe、Tyr、Ile、Leu或Pro),获得了高稳定性的突变酶TIMs,突变酶的m值与野生酶相当,但催化数cat却下降明显[20]。
综上所述,采用蛋白质工程手段,在寡聚酶亚基表面引入二硫键,或增加荷电及疏水性氨基酸,提高亚基的间相互作用能,是提高其稳定性的有效途径。因此,针对野生型GGT的pH耐受性差的缺陷,本文以_GGT 为研究对象,以str.168 GGT晶体结构(PDB ID: 3A75)为模板,通过分析_GGT大、小亚基表面残基的组成、性质及空间位置,筛选得到可能的突变位点,并将其逐一替换为缬氨酸(Valine),以增强GGT亚基间的疏水相互作用;在此基础上,考察了各种突变酶的催化特性及pH耐受性,以验证实际的突变效果。
2 材料与方法
2.1 材料与试剂
用于提取基因组的菌株为NX-2(CGMCC 0833,_GGT编码基因全长为1764 bp,与str.168 GGT基因序列的同源性达99.21%,氨基酸序列一致性达99.15%);表达菌株BL21(DE3)和表达载体质粒pET-22b(+)均为本实验室保藏;DNA聚合酶购自TOYOBO公司;限制性内切酶I、I 及相应缓冲液购至 NEB公司;DNA消化酶I购自Thermo公司;T4 DNA连接酶、标准分子量DNA、标准分子量蛋白购自TaKaRa公司;蛋白定量试剂盒Bio-Rad购自GENERAY公司;其余试剂均为国产分析纯。
2.2 主要实验仪器
蛋白电泳仪、紫外分光光度计Ultrospec 7000(GE healthcare,美国);MyCyceler PCR仪(Bio-Rad,美国);pH计(METTLER TOLEDO,瑞士);蛋白纯化仪 FPLC(GE Healthcare,美国)。
2.3 实验方法
2.3.1 同源建模方法和定点突变位点的选择
采用Discovery studio 2.1 软件(DS2.1 Accelrys Software Inc, San Diego, CA),以str.168 GGT晶体结构(PDB ID: 3A75)为模板经同源建模生成_GGT的3D结构预测模型。借助Pymol软件分析_GGT大、小亚基表面氨基酸残基,筛选合适的突变位点。突变的候选位点需同时满足以下条件:距离_GGT活性中心(T-403)距离>15 Å;保守性<100%;非疏水性氨基酸。
2.3.2 PCR方法
PCR反应体系(50 μL)包括1×DNA 聚合酶缓冲液,20 mmol×L-1Mg2+,10 pmol×L-1正反向引物,50 ng DNA模板和1UDNA 聚合酶。反应条件为:95℃ 5 min;95℃ 30 s;55℃30 s;68℃ 1~7 min,循环28次;68℃ 10 min 结束程序。
2.3.3 GGT突变体质粒的获得和外源表达
根据已公布的str. 168(Genbank: AL009126.3)的GGT基因序列设计合成引物(表1)。在上游引物、下游引物的5′端分别引入相应的酶切位点(下划线),构建重组质粒Pet-22b(+)GGT,并以其为模板,通过互补的正反向引物(见表1)经PCR得到突变重组质粒;用限制性内切酶I酶切去除模板质粒;将酶切的产物转化到表达宿主BL21 (DE3) 感受态细胞中,并涂布在含有氨苄青霉素(50 μg×mL-1)的LB平板,于37℃过夜培养后,挑取克隆转接LB培养基(含氨苄青霉素)培养12 h;以5 %接种量接种于新鲜的LB培养基,至OD600=0.5~0.6后加入终浓度为2.5 g×L-1的乳糖,于25℃下诱导表达12 h。为了验证所表达的突变体编码基因的正确性,每次表达过程中均取5 mL菌液,提取质粒并测序。

表1 模板引物设计和定点突变设计的部分引物
Note:Nucleotide sequence corresponding to the mutated amino acids is bolded
2.3.4 重组_GGT和突变酶的纯化
将诱导表达后的菌液经12000 r×min-1离心后收集菌体;用Tris-HCl (pH 8.0,50 mmol×L-1)缓冲液洗涤菌体,再次离心收集菌体后用Tris-HCl(pH 8.0,50 mmol×L-1)缓冲液重悬菌体,冰浴超声破碎,12000 r×min-1、4℃下离心取上清液,粗酶液中GGT以Ni2+-NTA纯化,并经超滤脱盐后备用。
2.3.5与蛋白浓度的检测
_GGT和突变酶的纯度由SDS-PAGE检测;蛋白浓度由Bradford蛋白定量试剂盒测定,以牛血清蛋白(BSA)为标准蛋白绘制标准曲线。
2.3.6 酶活测定[21]
酶活(U)定义:以-谷氨酰对硝基苯胺(GNA)为供体,以双苷二肽为受体,每分钟催化GNA水解生成1 nmol对硝基苯胺(NA)所需的酶量。
酶活测定方法:配制不同浓度的对硝基苯胺(NA)标准溶液,并在410 nm下测定其吸光值,分别以NA浓度和相应的吸光值为横、纵坐标,绘制标准曲线。取0.5 mL GNA溶液(5 mmol×L-1)、0.5 mL 双苷二肽溶液(100 mol×L-1)、0.5 mL酶液和1.5 mL Tris-HCl缓冲液(50 mmol×L-1,pH 8.0),混匀后于37oC水浴反应10 min。反应液于410 nm下测吸光值,根据标准曲线计算产物浓度和酶活。
2.3.7催化动力学常数的测定
GGT的催化动力学方程为双底物的Michaelis-Menten方程[22],当受体(双甘二肽)浓度远大于供体(GNA)浓度时,该方程可简化为单底物米氏方程:
2.3.8 最适反应pH
按照2.3.6节的酶活测定方法,调节缓冲液的pH值分别为6.0、7.0、8.0、9.0、10.0、11.0,分别测定突变酶及重组_GGT在不同pH条件下的酶活。
2.3.9 pH稳定性
将重组_GGT和突变酶分别置于pH 6.0~11.0的缓冲液中,40℃水浴保温3 h后,分别取样,按2.3.6节的方法测定其残余酶活。设保温前各自的初始酶活为100 %。
将重组_GGT和突变酶分别置于pH 9.0~11.0的缓冲液中,并于40℃下温育,每隔一段时间取样,按2.3.6节的方法测定酶活,并计算残余相对酶活r(%)。假定GGT的失活为一级反应,可得失活反应方程:
2.3.11 重组_GGT和突变酶酰基化反应活化能的测定
由于酶促反应速度可表示为:
根据式(4)和(5),酶促催化反应速率方程可表示为:
3 结果与讨论
3.1 同源建模及突变氨基酸候选位点的筛选
以str. 168 GGT的晶体结构(PDB ID: 3A75)为模板构建了GGT 3D结构的二聚体预测模型(见图1),并运用Ramachandran模块来其进行评估。在构建的预测模型中,98.3 %的残基位于允许范围内,其中91.7 %的残基位于最优化区域,2.0 %位于待优化区域。模型的Profile-3D得分为182分,而预期最高得分为212分,表明该模型能够反映GGT的真实结构,并可用于定点突变位点的选取。
进一步根据2.3.1节的筛选条件,结合_GGT3D结构预测模型,并选取了9条不同来源的GGT序列(;;;;;sp;;;)与模板(NX-2)进行同源性分析,最终选取得到了6个候选的突变位点,分别为A链上的D46、T201、Y280、Q322,和B链上的E502和H543,候选残基的空间位置、保守性,以及距活性中心(T-403)的距离见图1和表2。
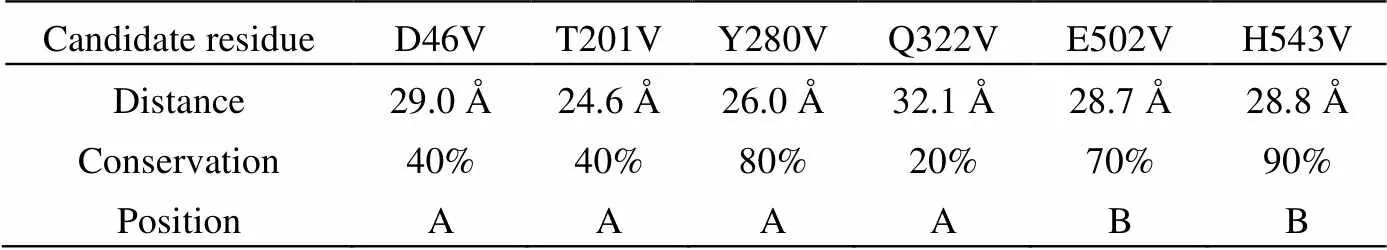
表2 候选突变位点与活性中心(T-403)的距离(Å)、保守性及位置
Note:A and B represent chain A and chain B ofGGT respectively,chain A:1~359;chain B:360~587.
3.2_GGT基因扩增、重组、突变、诱导表达及纯化
按2.3.3节构建突变重组质粒,并转化BL21 (DE3) 感受态细胞;挑选阳性克隆,经测序验证后,对所得突变菌株进行诱导表达;发酵液经离心后收集菌体,经超声破碎后,取上清液进行亲和纯化。
纯化后样品的SDS -PAGE 电泳分析结果显示,6种突变酶在BL21 (DE3)中均可成功表达,表达产物均为二聚体蛋白,大、小亚基的分子量分别在46 kDa和20 kDa左右(图2),与_BGGT一致。
3.3_GGT和突变酶的酶学性质
3.3.1 催化动力学常数的测定
分别配制供体(GNA)浓度为0.5、1、2、3、4、5 mmol×L-1,受体双甘二肽浓度均为100 mmol×L-1的反应液,测定重组_GGT和突变酶的酰基化反应速率(s),并按照2.3.7节的方法,计算_GGT和各种突变酶的催化动力学常数,结果见表3。
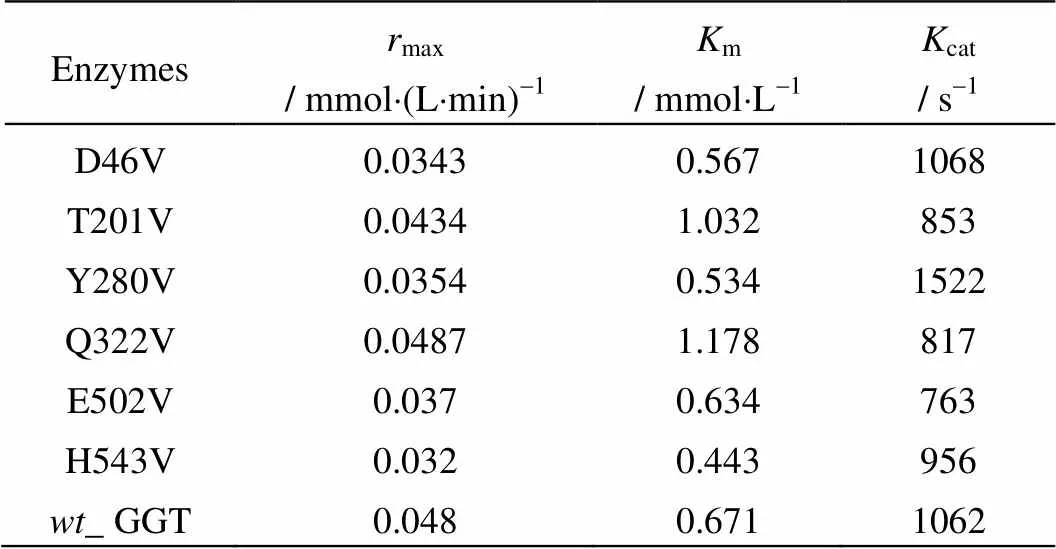
表3 wt_GGT和突变酶的催化动力学常数
由表可知,大多数突变酶的催化常数与_GGT相近,其中D46V、Y280V、E502V、H543V的m略小于_GGT,T201V和Q322V的m较_GGT有所增加;此外,Y280V的cat显著高于_GGT,提高幅度达43.3 %。
3.3.2 酰基反应活化能(a)的测定
根据2.3.11节的方法,在不同温度下(25~50℃)分别测定_GGT及D46V、T201V、Y280V、Q322V、E502V、H543V的NA的生成速率(),以ln对1/作图,得到_GGT和突变酶的酰基化反应活化能a,结果如图3和表4所示。

表4 wt_GGT和突变酶的酰基化反应活化能(Ea)
反应活化能(a)表示GGT启动酰基转移反应所需的能量。如表所示,Y280V和E502V的反应活化能与_GGT相近,而D46V、T201V、Q322V,以及H543V的反应活化能较_GGT均有不同程度的增加。
3.3.3 最适反应pH
分别在pH6.0~11.0的缓冲液中测定_GGT和突变酶D46V、T201V、Y280V、Q322V、E502V、H543V的活力。结果显示,无论_GGT还是突变酶,其最适pH范围均在pH 8.0~10.0,但突变酶酶活在这一范围内的变化均较_GGT更为平缓(图4)。
3.3.4 pH稳定性
将_GGT和突变酶分别置于pH 6.0~11.0的缓冲液中,于40℃下保温3 h后测定酶活,以0时刻的初始酶活为100 %,计算残余酶活r。结果表明,随着pH值的上升,_GGT和突变酶的稳定性均呈下降趋势(图5),但D46V、Y280V和E502V的pH稳定性较_GGT有所提高,其中Y280V在pH 11.0条件下温育3 h后,残余酶活仍可达24.32%,较_GGT提高了58.33%。
3.3.5 不同pH下_GGT、D46V、Y280V和E502V的失活速率常数
分别将_GGT,以及突变酶D46V、Y280V和E502V置于pH 9~11的缓冲液中,并于40℃保温,每隔一定时间取样测定酶活,以0时刻的酶活性为100%,计算相对酶活r。按照2.3.10节的方法计算_GGT和突变酶在不同温度下的失活速率常数d,结果见表6和图6。
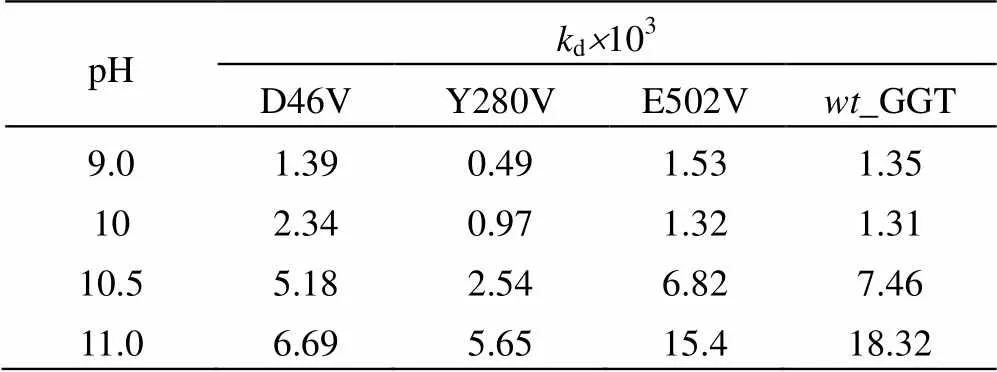
表6 wt_GGT、D46V、Y280V和E502V在不同pH条件下的失活速率常数
由表可知,_GGT、D46V、Y280V和E502V的失活速率均随pH值的升高呈逐渐增加的趋势,但突变酶的pH失活速率常数(d)明显低于_GGT,其中Y280V在pH 11.0条件下的d值仅为5.65×10-3。
3.4 突变酶V-46、V-502和V280与附近氨基酸的相互作用分析
采用Pymol软件分析了D46V、E502V和Y280V突变残基(V-46、V-502和V-280)附近的疏水性氨基酸。如图7所示,在<10 Å距离内,V-46、V-502和V-280附近均存在一定数量的疏水性氨基酸,可与突变残基间发生疏水相互作用,且分别位于A链和B链(图7),这有助于提高突变酶亚基间的相互作用能,并稳定其三、四级结构;其中,V-280可与附近4个氨基酸(Y-283、W-277、I-501和I-497)的侧链产生疏水相互作用,形成的疏水力场更强,从而使Y280V具有更强的pH稳定性。
4 结 论
GGT是由大、小两个亚基构成的二聚体酶,在高pH环境(pH>9.0)下易发生亚基解聚,进而引发酶的不可逆失活。为此,本文提出了采用定点突变的方法,在GGT亚基表面引入疏水性氨基酸,增强亚基间的疏水相互作用。由于疏水相互作用的强度不易受环境pH值影响,因而有助于提高GGT的pH耐受性。得到的具体结论如下:
(1) 采用同源建模的方法得到了_GGT的3D结构预测模型,并通过对_GGT表面氨基酸残基的性质、空间位置,以及保守性的分析,筛选得到了6个候选的突变位点;
(2) 采用定点突变的方法,将候选位点分别替换为缬氨酸,并成功实现了6种突变酶的异源表达;
(3) 分别测定了6种突变酶的酶学性质和催化常数。结果表明,D46V、Y280V、E502V、H543V的m略小于_GGT,而T201V和Q322V的m较_GGT有所增加;Y280V和D46V的cat均较_GGT有所提高,其中Y280V的提高幅度高达43.3 %;
(4) 突变酶中D46V、Y280V和E502V的pH稳定性均较_GGT有所提高,其中Y280V在pH 11.0条件下温育3 h后,残余酶活可达24.32%,较_GGT提高了58.33%;经测定,Y280V在pH 11.0条件下的失活速率常数(d)值仅为5.56×10-3;
(5) 模型分析显示,突变残基V-46、V-502和V-280可分别与位于A链和B链上的多个氨基酸残基产生疏水相互作用,其中V-280与附近氨基酸形成的疏水作用更强,这可能是导致Y280V的pH稳定性最高的主要原因。
[1] Roselyne C, Dany H K. Kinetic characterization and identification of the acylation and glycosylation sites of recombinant humanγ-glutamyltranspeptidase [J]. Biochemistry, 2007, 46(43):12253-12262.
[2] Toshihiro O, Hideyuki S. Crystal structure of the γ-glutamyltranspetidase precursor protein from: Structural changes upon autocatalytic processing and implications for the maturation mechanism [J].J Biom Chem, 2007, 282:2433-2439.
[3] Keillor J W, Castonguay R, Lherbet C. Gamma-glutamyltranspeptidase substrate specificity and catalytic mechanism [J]. Method Enzymol, 2005, 401:449-467.
[4] Suzuki H, Izuka S, Miyakawa N,. Enzymatic production of theanine, an "umami" component of tea, from glutamine and ethylamine with bacterial γ-glutamyltranspeptidase [J].Enzyme Microb Tech, 2002, 31(6): 884-889.
[5] DENG Hai-xia (邓海霞), YAO Zhong (姚忠), ZHOU Zhi (周治),. Enzymatic synthesis of L-theanine a using copper (II)-L-glutamine complexes as donor substrate (以L-谷氨酰胺-铜(Ⅱ)配合物为供体酶法制备茶氨酸) [J]. J Chem Ind and Eng(China) (化工学报), 2008, 59(12): 3115-3119.
[6] Kumagai H, Echigo T, Suzuki H,. Synthesis of gamma-glutamyl-DOPA from L-glutamine and L-DOPA by gamma-glutamyltranspeptidase ofK-12 [J]. Agr Biol Chem, 1988, 52(7): 1741-1745.
[7] Suzuki H, Miyakawa N, Kumagai H,. Enzymatic production of γ-L-glutamyltaurine through the transpeptidation reaction of-glutamyltranspeptidase fromK-12 [J]. Enzyme MicrobTech, 2002, 30(7): 883-888.
[8] Suzuki H, Kato K, Kumagai H. Development of an efficient enzymatic production of D-glutamyl-L-tryptophan (SCV-07), a prospective medicine for tuberculosis, with bacterial-glutamyltranspeptidase [J].J Biotechnol, 2004, 111(3): 291-295.
[9] Suzuki H, Izuka S, Minami H,. Use of bacterial γ-glutamyltranspeptidase for enzymatic synthesis of γ-D-glutamyl compounds [J]. Appl Environ Microb, 2003, 69(11): 6399-6404.
[10] Bridge W J, Zarka M H. Process for the production of-glutamylcysteine :US, 11/887 667[P]. 2012-07-08.
[11] Roberto F-L. Stabilization of multimeric enzymes: Strategies to prevent subunit dissociation [J]. Enzyme Micro Tech2009, 45(6):405-418.
[12] FANG Xin (房鑫), Tian Si-si (田思思), YAO Zhong (姚忠),. Cloning, expression and characterization of-glutamyltranspeptidase fromand(大肠杆菌和枯草芽孢杆菌来源谷氨酰转肽酶的克隆表达和性质比较) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2014, 28(2): 282-289.
[13] Jose A C B, Jose L R S, Gustavo F. pH dependence of the dissociation of multimeric hemoglobin probed by high hydrostatic pressure [J]. Biophysical Chemistry, 2007, 125(2-3): 341-349.
[14] Torchilin V P, Trubetskoy V S. Stabilization of subunit enzymes by intramolecular crosslinking with bifunctional reagents [J]. Ann N Y Acad Sci, 1984, 434: 27-30.
[15] Mateo C, Palomo J M, Fernandez-Lorente G,. Improvement of enzyme activity, stability and selectivity via immobilization techniques [J]. Enzyme Microb Technol, 2007, 40(6):1451-63.
[16] Ahern T J, Casal J I, Petsko G A,. Control of oligomeric enzyme thermostability by protein engineering [J]. Proc Natl Acad Sci (USA), 1987, 84(3):675-9.
[17] Panchanand M, Anshuman D. Mechanistic study of CuZn-SOD from ipomoea carnea mutated at dimer interface: Enhancement of peroxidase activity upon monomerization [J]. Biochimie, 2014, 97:181-193.
[18] Haitao D, Fen G, Danfeng L. Significant improvement of thermal stability of glucose1-dehydrogenase by introducing disulfide bonds at the tetramerinterface [J]. Enzyme and Microbial Technology, 2013,53(6-7): 365-372.
[19] Bjørk A, Dalhus B, Mantzilas D,. Stabilization of a tetrameric malate dehydrogenase by introduction of a disulfide bridge at the dimer–dimer interface [J].J Mol Biol, 2003, 334(4):811-21.
[20] Mariana P, Lenin D-R, D.Alejandro F-V. Hydrophobic rpacking of the dimer interface of triosephosphate isomerase by in Ssilico design and directed evolution [J]. Biochemistry, 2008, 47(20):5556-5564.
[21] YE Li-jing (叶丽静), FANG Xin (房鑫), WANG Hao-qi (王浩琦),. Effect of surface modification with silane coupling agent on enhancing pzc value and enzyme loading capacity of mesoporous TiO2whiskers (介孔TiO2晶须材料的硅烷戌改性及其对载体pzc值和酶负载的影响) [J]. CIESC J (化工学报), 2013, 64(6):2160-2168.
[22] Taniguchi N, Ikeda Y. Gamma-glutamyltranspeptidase catalytic mechanism and gene expression [J]. Adv Enzymol Relat Areas Mol Biol, 1998, 72 :239-278.
Improving pH Stability and Catalytic Activity of-Glutamyltranspeptidase by Site-Directed Mutation
PENG Qing, YAO Zhong, ZHOU Zhi, WANG Hao-qi, XIAO Huan, NI Fang, SUN Yun
(College of Food Science and Light Industry, Nanjing Tech University, Nanjing 211816, China)
-Glutamyltranspeptidase (GGT) is a key enzyme in glutathione metabolism that can synthesize a series of-glutamyl compounds. However, a variety of environmental conditions (especially pH>9.0) can restrain GGT and hence the application of GGT in biocatalysis. The 3D structure of-glutayltranspeptidase fromNX-2 (_GGT) was predicted by a homologous model in this study. In order to improve hydrophobic interaction between two subunits of_GGT and enhance GGT pH tolerance, residues Asp46, Thr201, Tyr280, Gln322, Glu502 and His543 were chosen as the candidates, which were substituted with valine by site-directed mutagenesis after analyzing the spatial position, conservation and properties of those residues on the surface of_GGT. Six mutations were successfully expressed inand the catalytic properties and stabilities of the obtained mutations were investigated. The results show that substitution of Asp46, Tyr280, Glu502 or His543 with Val result in a slight decrease ofmcompared with that of_GGT. Thecatof mutation Y280 is significantly increased. Moreover, the pH stability of mutations D46V, Y280V and E502V are all improved and Y280V is the best. The 3D models of D46V, E502V and Y280V show that V-280 could form a stronger hydrophobic interaction with four hydrophobic residues(Y-283, W-277, I-501 and I-497)within the scope of 10 Å, which may be the main reason for the better tolerance of Y280V under higher pH values.
γ-glutamyltranspeptidase; site-directed mutation; hydrophobic interaction; pH stability; catalytic properties
1003-9015(2016)01-0133-09 网络出版地址:http://www.cnki.net/kcms/detail/33.1141.TQ.20151222.1108.016.html
Q81
A
10.3969/j.issn.1003-9015.2015.00.039
2014-12-16;
2015-04-17。网络出版时间:2015-12-22 11:08:28
国家自然科学基金(21206072);江苏省自然科学基金(BK2012825);江苏省农业支撑计划项目(BE2012399)。
彭清(1990-),男,湖南汩罗人,南京工业大学硕士生。通讯联系人:姚忠,E-mail:yaozhong@njtech.edu.cn

