生物靶区定位在胶质瘤术后放射治疗的临床价值研究
闫文明 王宏伟 郁志龙 宝莹娜 张 剑 林 宇
生物靶区定位在胶质瘤术后放射治疗的临床价值研究
闫文明王宏伟郁志龙宝莹娜张剑林宇
目的探讨生物靶区定位在胶质瘤术后放射治疗的临床价值。方法选取术后行放射治疗的脑胶质瘤患者80例,全部经开颅手术或立体活检确诊。将采用11C-蛋氨酸(11C-Met)-PET/MRI融合图像进行放射靶区勾画的44例患者纳入观察组,将仅采用MRI图像勾画放射靶区的36例患者纳入对照组。对比两组患者放疗后的近期疗效,不良反应和远期疗效。结果两组患者LCR差异无统计学意义(P>0.05)。两组患者的CR、PR和PD比较无显著差异(P>0.05),在SD方面差异显著(P<0.05)。观察组患的治疗过程中不良反应发生率低于对照组(P<0.05)。两组患者1、2、3年OS 分别为63.6%、43.2%、34.1%和58.3%、36.1%、27.8%,差异有统计学意义(P<0.05)。生存曲线表明观察组的预后优于对照组。结论生物靶区定位用于胶质瘤术后放射治疗不良反应发生率低,可以明显提高患者的预后,值得临床推广使用。
生物靶区;胶质瘤;放射治疗
(The Practical Journal of Cancer,2016,31:1349~1351)
胶质瘤是成人最常见的颅脑肿瘤,约占脑肿瘤的45%~60%,其中恶性胶质瘤占到75%以上。手术切除是治疗胶质瘤的首选方法,但是胶质瘤恶性程度高,侵袭性强,与周围组织无明显界限,加上脑部解剖位置特殊,常不能完全清除肿瘤组织,术后几乎全部会复发,预后极差,死亡率高。术后放疗是胶质瘤的标准治疗方法,能够降低术后局部复发率。随着放疗的不断发展革新,放疗技术从普通的常规照射发展到靶区定位的精准放疗。然而肿瘤组织内的活性肿瘤细胞分布不均匀,对于局部结构未发生改变肿瘤病灶CT不能准确的显像,往往出现CT所提供的解剖结构图像资料与实际肿瘤活性细胞分布不一致的情况。分子水平代谢功能显像技术将肿瘤放疗靶区定位进行生物靶区优化定位,致使精准放疗被进一步优化。本研究回顾性分析80例胶质瘤患者术后进行不同方法靶区勾画后行放疗的临床效果,探讨生物靶区定位在胶质瘤术后放射治疗的临床价值。
1 资料与方法
1.1一般资料
选取2011年1月至2013年5月我院脑外科收治的术后行放射治疗的脑胶质瘤患者80例,全部经开颅手术或立体活检确诊。将采用11C-蛋氨酸(11C-Met)-PET/MRI融合图像进行放射靶区勾画的44例患者纳入观察组,将仅采用MRI图像勾画放射靶区的36患者纳入对照组。观察组男性27例,女性17例;年龄9~72岁,平均(39.7±7.8)岁;肿瘤全部切除10例,部分切除30例,仅行活检术4例;肿瘤位于上幕部位33例,位于下幕11例;单发病灶41例,多发病灶3例,无跨小脑幕多发病例;低级(Ⅰ/Ⅱ级)25例,高级(Ⅲ/Ⅳ级)19例。对照组男性22例,女性14例;年龄8~79岁,平均(42.3±8.0)岁;肿瘤全部切除7例,部分切除27例,仅行活检术2例;肿瘤位于上幕部位30例,位于下幕6例;单发病灶35例,多发病灶1例,无跨小脑幕多发病例;低级(Ⅰ/Ⅱ级)20例,高级(Ⅲ/Ⅳ级)16例。两组患者一般情况差异无统计学意义(P>0.05),具有可比性。
1.2研究方法
MRI图像勾画靶区:根据术前及术后MRI的T1增强相、FALIR及T2相所显示的异常区域,勾画出放疗的答题肿瘤靶区(GTV),然后将GTV放大至其边界外2~3 cm作为临床靶区(CTV),包括可能会有肿瘤细胞的解剖扩展区。
11C-Met-PET/MRI融合图像勾画靶区:患者平卧于扫描床,封闭视听,静脉注射11C-Met10-20mCi 20 min后扫描,历时10 min。采集图像时选择11C半衰期进行衰减校正,通过衰减校正后重建PET影像。在11C-Met最浓处的病灶内勾画靶区。若PET未发现异常,在MRI异常区域相应的PET影像区勾画靶区,计算标准摄取值(SUV)。
两组患者对CTV给予45~54 Gy的放射剂量治疗,每次分割剂量为1.8~2.0 Gy。治疗后3个月对所有患者进行MRI复查,观察患者的近期疗效。疗效判定标准:完全缓解(CR):所有靶病灶消失;部分缓解(PR):靶病灶最长径之和与基线状态比较,至少减少30%;病变进展(PD):靶病灶最长径之和与治疗开始之后所记录到的最小的靶病灶最长径之和比较,增加20%,或者出现一个或多个新病灶;病变稳定(SD):介于部分缓解和疾病进展之间。随访3年,观察两组患者的复发率和死亡率和累积生存率(OS)。
1.3统计学方法

2 结果
2.1两组患者放疗后的近期疗效
观察组患者的局部控制率(LCR)为84.1%(37/44),对照组的LCR为83.3%(30/36),两组患者LCR差异无统计学意义(P>0.05)。进一步分析,两组患者的CR、PR和PD比较无显著差异(P>0.05),在SD方面差异显著(P<0.05),见表1。

表1 两组患者放疗后的近期疗效对比(例,%)
2.2不良反应
放射治疗中主要的不良反应为放射性脑水肿症状,如恶心、呕吐、头痛、肢体无力加重等,经甘露醇、地塞米松静脉滴注后症状缓解。其中观察组出现不良反应4例(9.1%),对照组出现不良反应9例(25.0%),两组比较差异有统计学意义(P<0.05)。
2.3两组患者放疗后的远期疗效对比
至随访结束,无失访患者。两组患者的1、2、3年OS 分别为63.6%、43.2%、34.1%和58.3%、36.1%、27.8%,两组患者的3年生存率差异有统计学意义(P<0.05),见表2。在Kaplan-Meimer法中设定终点随访时间为36个月,结果显示观察组和对照组的中位生存时间分别为23.7个月和17.4个月,Log-rank检验结果显示两组差异有统计学意义(P<0.05)。生存曲线表明观察组的预后较对照组好,见图1。
3 讨论
恶性脑胶质瘤是成人常见的颅内肿瘤,死亡率和致残率高,5年生存率不足5%[1]。恶性胶质瘤的侵袭生长能力很强,手术切除往往不能切除所有的肿瘤组织,术后复发率极高,几乎达到了100%。术后放疗已被证实为恶性胶质瘤治疗的标准方法,可以有效的降低术后复发率,提高患者的中位生存时间[2-3]。既往放射治疗的照射范围多为全脑照射,放疗过程中毒性反应发生率高,随着放疗技术与影响技术的发展,胶质瘤的靶区勾画与照射范围有了显著地变化。有研究显示,恶性胶质瘤肿瘤的浸润范围往往在肿瘤部位周围的2 cm范围内[4],瘤体周围低密度水肿带中浸润的肿瘤细胞也多在瘤周3 cm以内,而且80%~90%的复发部位多为于瘤体或周围2 cm的范围内[5]。研究证实,全脑放疗并不能提高患者的生存率,反而因严重的副反应降低了患者的生活质量[6]。
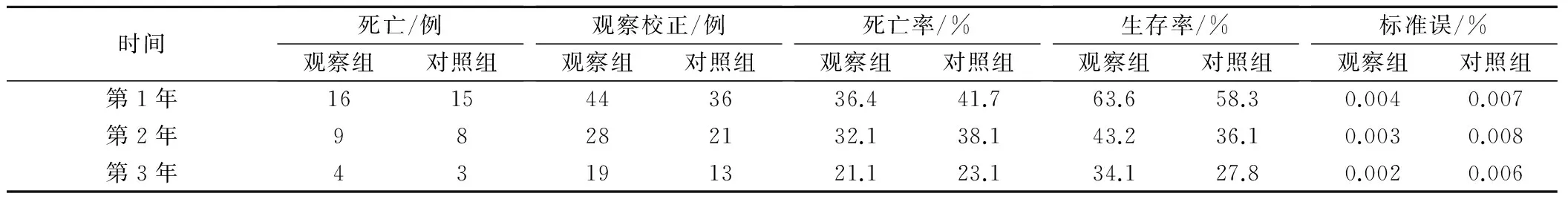
表2 两组患者放疗后寿命表

图1 两组患者放疗后的生存曲线
随着影像学的发展,特别是图像融合技术在临床的逐步使用,生物勾画靶区的概念在放射治疗中突显了应用价值。生物靶区定位综合解剖和功能影像融合定位肿瘤靶区,采用放射性同位素示踪的氨基酸显像的图像融合技术,确定肿瘤病灶内肿瘤活性细胞的分布情况,进而勾画出生物靶区,使放疗更加精准。大部分的颅内肿瘤对氨基酸的摄取率均大于正常脑组织,示踪的氨基酸能顺利的通过血脑屏障,一般情况下这些氨基酸显像剂显示的肿瘤范围比MRI小,通常它们能显示出MRI无法显示出的肿瘤组织,如手术创伤造成的血脑屏障受损和术腔周围组织水肿,MRI无法辨别术后肿瘤残留与手术创伤引起的非特异改变[7]。
本研究采用11C-Met作为示踪氨基酸,Grosu等[8]的研究结果显示采用11C-Met-PET/CT/MRI融合图像进行生物靶区定位对比仅用CT/MRI进行靶区定位患者的放射治疗效果,11C-Met-PET/CT/MRI融合图像定位靶区的患者的中位生存率显著高于仅用CT/MR定位靶区的患者。11C-Met-PET对肿瘤组织的敏感性较高,鉴别低级别胶质瘤时意义较大[9]。另一种常用的示踪氨基酸18F-脱氧葡萄糖(18F-FDG)在放疗靶区定位的价值有限。Gross等的研究结果显示采用18F-FDG-PET与MRI融合图像定位对靶区的影响较小[10]。原因可能是恶性肿瘤细胞与脑组织都具有旺盛的葡萄糖酵解过程,在这些组织中都可表现出放射性物质的高浓聚,故18F-FDG对脑肿瘤的特异性不高。
本研究对比分析了胶质瘤患者放疗前采用11C-Met-PET/MRI融合图像勾画靶区和仅MRI图像勾画靶区的治疗效果。结果显示11C-Met-PET/MRI融合图像勾画靶区的患者SD和中位生存时间显著高于仅MRI图像勾画靶区的患者;而且11C-Met-PET/MRI融合图像勾画靶区的患者其1、2、3年累积生存率均高于仅MRI图像勾画靶区的患者,而且生存曲线显示生物靶区定位的患者预后更好。另外,采用生物靶区精准定位的患者毒性反应的发生率小,不足10%。本研究中两组患者的中位生存时间分别为23.7个月和17.4个月,高于Grosu等[8]的研究结果9个月和5个月,可能是Grosu等的研究纳入的是44例复发胶质母细胞瘤再放疗的患者,而本研究纳入的有初治和复发患者,且有低级别和高级别恶性胶质瘤。
综上所述,生物靶区定位用于胶质瘤术后放射治疗毒性反应发生率低,可以明显提高患者的预后,值得临床推广使用。
[1]Scoccianti S,Magrini SM,Ricardi U,et al.Patterns of care and survival in a retrospective analysis of 1059 patients with glioblastoma multiforme treated between 2002 and 2007:a multicenter study by the Central Nervous System Study Group of Airo(Italian Association of Radiation Oncology)〔J〕.Neurosurgery,2010,67(2):446-458.
[2]魏瑞,张阳德,何剪太,等.30例脑胶质瘤的术后调强适形放射治疗〔J〕.肿瘤防治研究,2010,37(4):453-456.
[3]Deborah TB,Minhee W,Minesh PM,et al.Delay in initiation of radiotherapy may not affect outcome of patients with glioblastoma:a secondary analysis from the radiation therapy oncology group database〔J〕.J Clin Oncol,2009,27(5):733-739.
[4]Hochberg FH,Pruitt A.Assumptions in the radiotherapy of glioblastoma〔J〕.Neurology,1980,30(9):907-911.
[5]Burger PC,Dubois PJ,Schold SC,et al.Computerized tomographic and pathologic studies of the untreated,quiescent,and recurrent glioblastoma multiforme〔J〕.J Neurosurg,1983,58(2):159-169.
[6]Reni M,Cozzarini C,Panucci MG,et al.Irradiation fields and doses in glioblastoma multiforme:are current stantdards adequate〔J〕.Tumori,2001,87(2):85-90.
[7]邓美玲,吴少雄,陈忠平.脑恶性胶质瘤放射治疗临床研究进展〔J〕.中国圣经肿瘤杂志,2008,6(4):265-269.
[8]Grosu AL,Weber WA,Franz M,et al.Re-irradiation of recurrent high grade gliomas using amino-acids-PET(SPECT)/CT/MRI image fusion to determine gross tumor volume for stereotactic fractionated radiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2005,63:511-519.
[9]Lammering G,De Ruysscher D,van Baardwijk A,et al.The use of FDG-PET to target tumors by radiotherapy〔J〕.Strahlenther Oncol,2010,186(9):471-481.
[10]Gross MW,Weber WA,Feldmann HJ,et al.The value of F-18-fluorodeoxyglucose PET for the 3-D radiation treatment planning of malignant gliomas〔J〕.Int J Radiat Oncol Biol Phys,1998,43(5):989-995.
(编辑:吴小红)
Clinical Value of Biological Target Location in the Postoperative Radiotherapy of Glioma
YAN Wenming,WANG Hongwei,YU Zhilong,et al.
Affiliated Hospital of Inner Mongolia Medical University,Hohhot,010050
ObjectiveTo explore the clinical value of biological target location in the postoperative radiotherapy of glioma.Methods80 cases of brain glioma patients were treated with radiotherapy.All patients were confirmed by craniotomy or stereotactic biopsy.44 patients used11C-methionine (11C-Met)-PET/MRI image fusion radiation target delineation made was the study group and 36 patients used only MRI images in the radiation target area was the control group.Short-term efficacy,long-term efficacy and adverse reactions after radiotherapy of the 2 group were compared.ResultsThere was no significant difference in LCR between the 2 groups (P>0.05).There was no significant difference in PD,PR and CR between the 2 groups (P>0.05),and the difference was significant (P<0.05) in SD.The adverse reactions in the observation group was less than that of the control group (P<0.05).1-,2-,and 3-year OS of the 2 groups were 63.6%,43.2%,34.1% and 58.3%,36.1%,27.8%,and the difference was statistically significant (P<0.05).Survival curves showed that the prognosis of the observation group was superior to the control group.ConclusionBiological target position for postoperative radiotherapy has low adverse reactions,and it can significantly improve the prognosis of patients,it is worthy of clinical use.
Biological target;Glioma;Radiotherapy
010050 内蒙古医科大学附属医院
10.3969/j.issn.1001-5930.2016.08.041
R730.264
A
1001-5930(2016)08-1349-03
2015-10-08
2016-02-07)

