低温胁迫对广东含笑嫁接苗生理生化指标的影响
姜春宁,林 伟,黄永芳
(华南农业大学林学与风景园林院,广东 广州 510642)
低温胁迫对广东含笑嫁接苗生理生化指标的影响
姜春宁,林 伟,黄永芳
(华南农业大学林学与风景园林院,广东 广州 510642)
采用盆栽试验法,以广东含笑(Micheliaguangdongensis)1年生嫁接苗为试验材料,研究人工模拟不同时间低温胁迫环境(6 ℃)对嫁接苗生理生化指标的影响。结果表明:①随着低温胁迫时间的延长,苗木的可溶性蛋白含量、脯氨酸含量及POD活性均呈先上升后下降的趋势,而可溶性糖含量、SOD活性、MDA含量和相对电导率均呈显著上升趋势;叶绿素含量呈显著下降趋势;苗木恢复生长48 h后,可溶性蛋白含量、脯氨酸含量、POD活性与叶绿素含量均有所增加,但相对电导率、可溶性糖含量、SOD活性与MDA含量均有所下降。②随着低温胁迫时间的延长,广东含笑嫁接苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)与水分利用率(WUE)均持续下降,胞间CO2浓度(Ci)先下降后上升;恢复生长48 h后,Ci有所下降,其余均不同程度回升。表明广东含笑嫁接苗具有一定的抗寒能力。
广东含笑;嫁接苗;低温胁迫;生理生化指标
广东含笑(Micheliaguangdongensis)为木兰科(Magnoliaceae)含笑属(Michelia)植物,原产于广东英德,常生长于海拔1250~1400 m的中亚热带山地常绿落叶阔叶混交林中。树体高大,树干挺拔,树荫浓密,花香醉人,为较好的园林绿化树种[1],具有广泛的应用前景。但目前,广东含笑种苗较为贫乏,对其研究仅在育苗方面,鲜有关于其抗寒性研究报道[1-2]。自然界中的植物经常会遭遇到各种不良环境因素的影响,低温胁迫为植物非生物胁迫的一种,影响植物的水分状况、质膜透性、光合作用、呼吸作用及植物体内物质代谢等生理代谢过程[3]。许多学者研究结果表明,热带和亚热带树种在低温胁迫时易受到伤害甚至死亡[4],因而低温成为限制植物生长的主要环境因子。本研究以人工气候箱模拟低温环境,比较不同低温时间胁迫下广东含笑的生理生化及光合作用等的差异,探讨苗木对低温响应生理机制,为其引种栽培及园林绿化应用提供参考。
1 材料与方法
1.1 供试材料
1年生广东含笑嫁接苗60株,苗木生长状况良好,形态特征相近,无病虫害,高(33.41±3.81) cm,地径(7.56±0.76) mm。供试植株于2013年9月放置于华南农业大学林学院温室内盆栽培育,所用花盆直径30 cm、高25 cm,盆内基质为华南农业大学树木园内赤红壤,土壤田间持水量为(26.06±1.58)%。
1.2 试验方法
2013年11月初,选择生长健康的苗木进行试验,将苗木放置在RXZ智能型人工气候箱(6 ℃)中进行低温胁迫处理。人工气候箱的光照时间为9∶00—16∶00,光照强度为150 mmol·m-2·s-1,相对湿度为75%~80%。以常温25 ℃(低温处理0 h)为对照。连续低温处理后的第0、24、48、72、96 h以及恢复生长48 h(R)后进行采样,每次取 3 株植株叶片进行试验,共3个重复,采后置于冰盒泡沫箱内带回实验室,用蒸馏水洗净擦干。
1.3 抗寒性指标测定
1.3.1 生理生化指标测定 叶绿素含量采用丙酮溶解法[5]测定;、叶片相对电导率采用电导率仪法[5]测定;可溶性蛋白含量采用考马斯亮蓝G-250法[5]测定;POD活性采用愈创木酚法[5]测定;SOD活性采用氮蓝四唑(NBT)光化还原法[6]测定;MDA含量采用硫代巴比妥酸(TBA)比色法[6]测定;可溶性糖含量采用蒽酮法[6]测定;游离脯氨酸含量采用茚三酮法[6]测定。
1.3.2 光合作用测定 利用带有红蓝光源的Li-6400便携式光合仪,采用开放式气路,设定光照强度为1000 μmol·m-2·s-1,叶温25 ℃。选取供试苗木上部叶位相似、叶龄相对一致的成熟叶片为试材。每次测定3株苗木,每株选取5片叶片,每个叶片重复测定3次,测定叶片的净光合速率(Pn,μmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)、蒸腾速率(Tr,mmol·m-2·s-1),计算水分利用率(WUE,μmol·mmol-1),公式为:WUE=Pn/Tr。
1.4 数据分析与处理
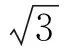
2 结果与分析
2.1 细胞渗透物质对低温胁迫的响应
2.1.1 可溶性蛋白质含量变化 由图1可知,随着低温时间的延长,广东含笑嫁接苗叶片的可溶性蛋白质含量呈先显著上升后下降的趋势。正常条件下,其含量为2.88 mg·g-1,持续低温48 h,其含量达到峰值6.49 mg·g-1,是对照的225.35%,之后略有下降。解除低温胁迫恢复生长48 h后,可溶性蛋白质含量略有上升,为对照的159.38%。
2.1.2 可溶性糖含量变化 持续低温处理后,广东含笑嫁接苗叶片可溶性糖含量呈显著上升趋势(图2)。持续低温96 h后达到峰值37.42 mg·g-1,为对照的141.53%。但苗木在解除低温状态恢复生长48 h后,可溶性糖含量又降为31.74 mg·g-1,为对照的120.05%。
不同小写字母为差异显著。下同。图1 不同低温胁迫时间下嫁接苗叶片可溶性蛋白质含量的变化 图2 不同低温胁迫时间下嫁接苗叶片可溶性糖含量的变化
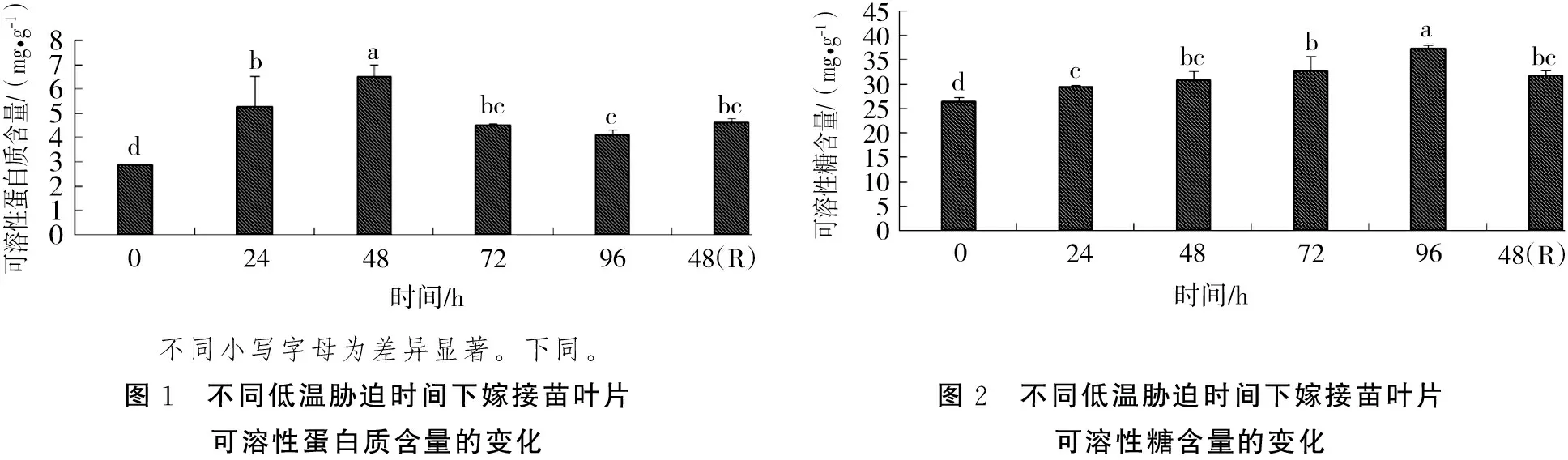
2.1.3 脯氨酸含量变化 由图3可知,随着低温胁迫时间的延长,广东含笑嫁接苗叶片脯氨酸含量呈先上升后下降的趋势。低温胁迫72 h后,脯氨酸含量为对照的206.54%;96 h后为对照的95.88%。但苗木解除低温胁迫恢复生长48 h后,其含量是对照的100.97%。
2.2 保护酶系统对低温胁迫的响应
2.2.1 超氧化物歧化酶(SOD)活性变化 由图4可知,随着低温胁迫时间的延长,广东含笑嫁接苗叶片SOD活性呈显著上升趋势。嫁接苗在低温胁迫96 h后,其活性达到峰值,比对照增加53.10%。当苗木在解除低温胁迫恢复生长48 h后,SOD活性有所下降,为对照的145.25%。
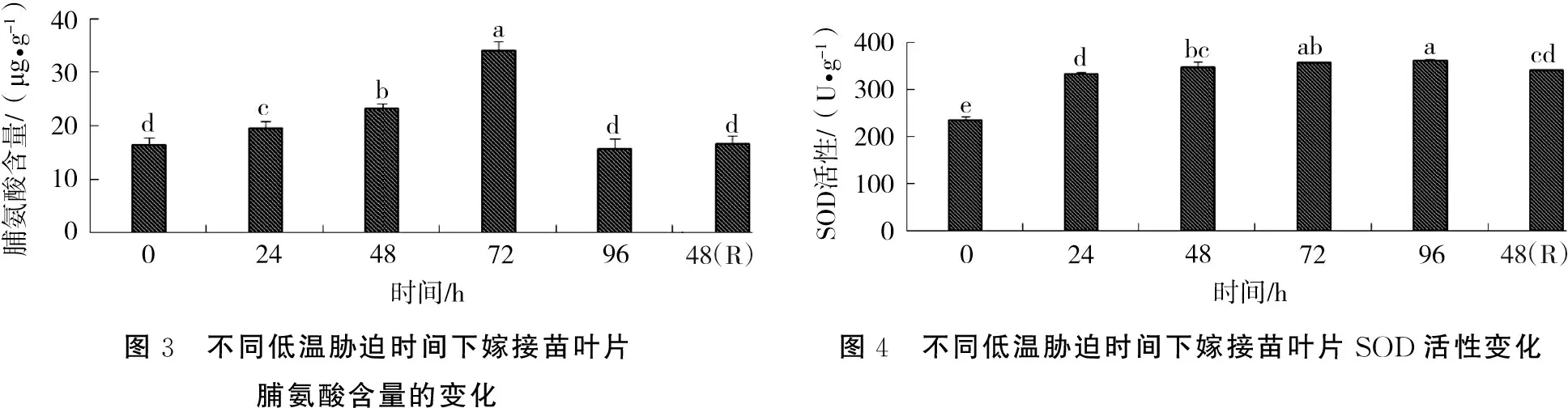
图3 不同低温胁迫时间下嫁接苗叶片脯氨酸含量的变化图4 不同低温胁迫时间下嫁接苗叶片SOD活性变化
2.2.2 过氧化物酶(POD)活性变化 持续低温胁迫下广东含笑嫁接苗叶片过氧化物酶(POD)活性变化情况见图5。随着低温胁迫时间的延长,POD活性逐渐上升,72 h时达峰值,为对照的510.48%。低温胁迫96 h后,其活性又显著下降,为对照的195.92%。当苗木解除低温胁迫恢复生长之后,POD活性又略有上升。
2.3 低温胁迫对膜系统的影响
2.3.1 相对电导率变化 随着低温胁迫时间的延长,广东含笑嫁接苗叶片相对电导率呈逐渐上升趋势(图6),处理96 h后达到最大值;当苗木解除低温胁迫恢复生长之后,植物叶片体内的膜系统损伤减轻,电导率略有下降。
图5 不同低温胁迫时间下嫁接苗叶片POD活性变化图6 不同低温胁迫时间下嫁接苗叶片相对电导率变化
2.3.2 丙二醛(MDA)含量变化 随着低温胁迫时间的延长,广东含笑嫁接苗叶片MDA含量呈递增的趋势(图7)。低温胁迫96 h后,MDA含量达到峰值0.104 μmol·g-1,比对照增加73.33%。而在苗木解除低温胁迫恢复生长48 h后,MDA含量又有所下降。
2.4 低温胁迫对叶绿素含量的影响
随着低温胁迫时间的延长,嫁接苗叶片的叶绿素总含量持续下降(图8)。正常条件下,广东含笑叶绿素总含量为1.42 mg·g-1,低温胁迫96 h后,叶绿素总含量下降23.94%;但苗木在解除低温胁迫正常生长48 h后,叶绿素含量有所上升,为对照的84.51%。
2.5 低温胁迫对光合特性的影响
随着低温胁迫时间的延长,广东含笑嫁接苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和水分利用效率(WUE)均呈持续下降趋势,但叶片的胞间CO2浓度(Ci)呈先下降后上升的趋势(表1)。嫁接苗在低温胁迫96 h后,Pn、Gs、Tr和WUE分别为对照的13.28%、17.24%、35.61%和37.5%;而嫁接苗在低温胁迫解除,恢复生长48 h后,Pn、Gs、Tr和WUE均有不同程度的增加趋势。
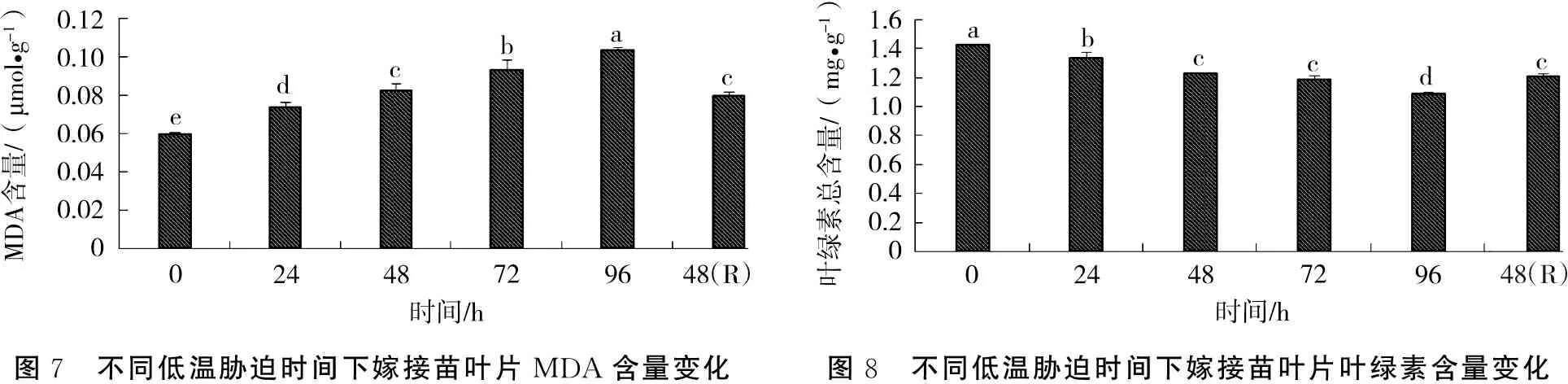
图7 不同低温胁迫时间下嫁接苗叶片MDA含量变化图8 不同低温胁迫时间下嫁接苗叶片叶绿素含量变化
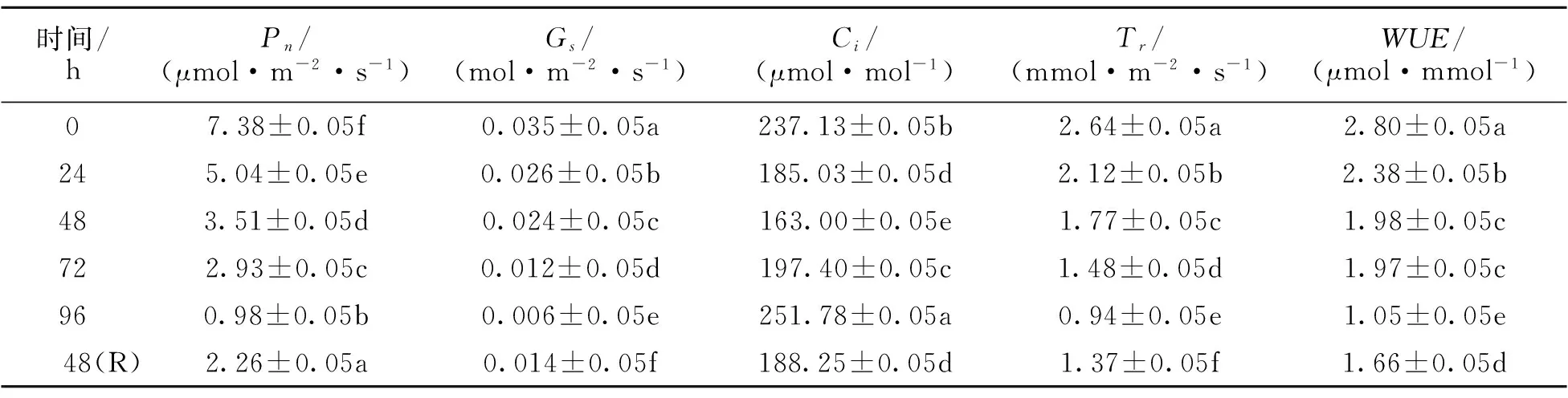
表1 不同低温胁迫时间下嫁接苗的光合特性
*:表中数据为平均值±标准差。
3 结论与讨论
本试验结果表明,广东含笑嫁接苗在低温胁迫下,叶绿素合成和光合作用受到一定限制,但其通过细胞渗透调节物质及保护酶系统的调节来减少自身受到的伤害从而适应低温胁迫。同时,嫁接苗在低温解除后,其正常生理和代谢均会有所恢复。因此,广东含笑嫁接苗具有一定的抗寒能力,但其抗寒性的强弱还需进一步与其他树种进行对比研究。
3.1 渗透调节物质与低温胁迫
植物可以通过调节细胞内的渗透势来维持细胞压力势的作用称渗透调节,而植物通过自身细胞渗透物质的渗透调节可以抵抗外界环境造成的渗透胁迫,渗透调节物质主要包括可溶性蛋白、可溶性糖和游离脯氨酸含量。裴文等[7]研究表明,低温条件下9种木兰科植物可溶性糖和游离脯氨酸含量升高。邵怡若等[8]研究表明,低温胁迫下盐肤木(Rhuschinensis)、假连翘(Durantarepens)、老鸭嘴(Thunbergiaerecta)和葛藤(Puerarialobata)4种嫁接苗的脯氨酸含量持续上升或波动;葛藤嫁接苗的可溶性蛋白质含量先升后降,其余嫁接苗显著上升;4种嫁接苗的可溶性糖呈上升趋势。余丽玲等[9]研究表明,随着低温胁迫时间的延长,西洋杜鹃(Rhododendronhybridum)的脯氨酸含量变化不明显,但可溶性糖含量和可溶性蛋白含量总体呈持续上升趋势律。多数研究者认为:低温胁迫处理下,植物叶片的可溶性蛋白质含量增加,其原因是低温胁迫处理能造成植物基因表达的改变,促进蛋白质含量的积累,从而促进蛋白质参与植物抗寒性胁迫环境[10-12]。李建设等[13]对茄子(Solanummelongena)嫁接苗抗寒性的研究结果揭示了苗木经低温胁迫后游离脯氨酸含量增加的趋势与品种的抗寒性强弱有关,但也有学者认为在低温胁迫下脯氨酸的累积能力与品种的抗冻寒力成负相关[15]。罗焕亮等[14]研究表明,马占相思树(Acaciamangium)QLD19835家系苗木通过细胞内代谢物质,即游离脯氨酸、可溶性糖和可溶性蛋白含量的积累来调节膜透性,从而适应低温胁迫。本研究结果表明,广东含笑嫁接苗的可溶性蛋白含量在低温胁迫48 h后达最高,脯氨酸含量在低温胁迫72 h后达峰值;当嫁接苗在解除低温胁迫48 h后,可溶性蛋白和可溶性糖含量均略有上升,反映了广东含笑嫁接苗也是通过植物体内的渗透调节物质来适应低温胁迫环境,与邵怡若等[8]、余丽玲等[9]研究结果相近。
3.2 保护酶系统与低温胁迫
大量研究表明[16-22],植物在胁迫条件下,SOD和POD的活性均呈上升或先上升后下降的趋势。因植物胁迫程度超过植物耐受范围后,酶活性会遭到抑制而降低。魏湜等[17]、李春燕等[18]研究结果揭示,抗寒性强的植物在低温逆境条件下,植物叶片的SOD、POD、CAT等保护酶系统仍能维持较高的活性水平,具有较高的活性氧自由基的清除能力来适应低温环境。本试验结果表明,广东含笑嫁接苗随低温胁迫时间延长,嫁接苗叶片的SOD活性、POD活性均高于对照,但活性变化趋势不一致,SOD活性呈上升趋势,POD活性呈先升后降趋势,表明嫁接苗可以通过这2个抗氧化酶活性的提高来抵抗逆境带来的伤害。
3.3 相对电导率、MDA、叶绿素含量与低温胁迫
植物叶片的电导率大小可在一定程度上反映出细胞膜受伤害的程度,因此常作为植物抗逆性研究中的重要生理指标[23]。细胞膜的损伤同时造成膜脂过氧化,产生MDA。曹建华等[24]在研究油棕(Elaeisguineensis)嫁接苗对低温胁迫的生理响应及其抗寒力时得出MDA含量和相对电导率是反映油棕低温胁迫的最重要指标,其次是叶绿素和脯氨酸含量,再次为可溶性糖和蛋白质含量。本试验结果表明,在低温胁迫下,广东含笑嫁接苗的叶片相对电导率和MDA含量均呈上升趋势,表明了广东含笑嫁接苗具有较强的抗寒能力,与曹建华等[24]研究结果一致。植物叶绿素含量与光合作用息息相关,本试验结果表明:低温胁迫下,广东含笑嫁接苗叶片叶绿素总含量持续下降。裴文等[7]研究表明叶绿素总含量下降的原因与植物体内的叶绿体色素功能、叶绿体形态结构的受损或叶绿素合成酶活性降低有关。
3.4 光合作用与低温胁迫
温度是植物进行光合作用的一个重要条件[2]。国内外学者对低温胁迫下植物的光合特性进行了大量研究,结果表明,低温胁迫下大多数植物的净光合速率(Pn)显著降低,也揭示了抗寒性较强的植物具有高的净光合速率和水分利用效率[26-27]。郭淑红等[28]研究表明,低温胁迫下,海南红豆(Ormosiapinnata)、南五味子(Kadsuralongipedunculata)、蒲桃(Szygiumjambos)等嫁接苗的Pn、Gs和Tr呈均下降趋势;邵怡若等[8]在研究低温胁迫对盐肤木、假连翘、老鸭嘴和葛藤嫁接苗的光合特性影响时也发现,随低温胁迫的延长,4种嫁接苗的Pn、Gs、Tr也均持续下降,但假连翘的Ci持续上升,其余嫁接苗先降后升,恢复生长48 h后,Pn、Gs和Tr均有不同程度的回升,Ci有不同程度的下降。本文试验结果也表明了广东含笑嫁接苗的Pn、Gs、Tr与WUE均持续下降,而叶片的Ci先下降后上升;当嫁接苗在恢复生长48 h后,Pn、Gs、Tr均不同程度回升,Ci有所下降,表明了低温胁迫对广东含笑的光合作用影响较大。
[1]杨科明,陈新兰.广东含笑的引种繁育与园林应用研究[J].广东园林,2011(1):44-46.
[2]姜春宁,黄永芳.广东含笑嫁接试验[J].广东林业科技,2013,29(2):7-10.
[3]武维华,张蜀秋,袁明,等.植物生理学[M].北京:科学出版社,2003:426-428.
[4]任向荣,薛立,王相娥,等.低温对6种绿化树种幼苗生理过程的影响[J].中南林业科技大学学报,2008,28(6):56-60.
[5]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006.
[6]张立军,樊金娟.植物生理学实验教程[M].北京:中国农业大学出版社,2007.
[7]裴文,李鹏,裴海潮,等.低温条件下9种木兰科植物抗寒性研究[J].河南农业科学研究,2014,43(4):101-105.
[8]邵怡若,许建新,薛立,等.低温胁迫对盐肤木、假连翘、老鸭嘴和葛藤嫁接苗的生理生化影响[J].生态学报,2013(33)14:4237-4247.
[9]余丽玲,何天友,陈凌艳,等.人工低温胁迫下西洋杜鹃生理生化指标的变化[J].农学学报,2014,4(1):48-53.
[10]刘祖祺,林定波.ABA/GAS调控特异蛋白质与柑桔的抗寒性[J].园艺学报,1993,20(4):335-340.
[11]陈杰忠,徐春香,梁立峰.低温对香蕉叶中蛋白质及脯氨酸的影响[J].华南农业大学学报,1999,20(3):54-58.
[12]Haitao Shi,Tiantian Y,Bao Zhong,et al.Comparative proteomic and metabolomic analyses reveal mechanisms of improved cold stress tolerance in bermudagrass (Cynodon dactylon(L.) Pers.) by exogenous calcium[J].Journal of Integrative Plant Biology,2014,56(11):1064-1079.
[13]李建设,耿广东,程智慧.低温胁迫对茄子嫁接苗抗寒性生理生化指标的影响[J].西北农林科技大学学报,2003,31(1):91-96.
[14]罗焕亮,徐位力,李建忠,等.马占相思对低温胁迫适应性的研究[J].华南农业大学学报:自然科学版,2002,23(2):51-53.
[15]王小华,庄南生.脯氨酸与植物抗寒性的研究进展[J].植物保护科学,2008,24(11):398-402.
[16]杨宁,丁芳霞,王程亮,等.低温胁迫对高山离子芥试管苗渗透调节物质及保护酶系的影响[J].四川大学学报:自然科学版,2014,51(2):385-390.
[17]魏湜,罗宁,李晶,等.低温胁迫下玉米苗期根系保护酶活性及内源激素变化[J].东北农业大学学报,2014,45(9):1-8.
[18]李春燕,陈思思,徐雯,等.苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响[J].作物学报,2011,37(12):2293-2298.
[19]Hashempour,A (Hashempour,Abuzar),Ghasemnezhad,M (Ghasemnezhad,Mahmood),Ghazvini,RF (Ghazvini,Reza Fotouhi),et al.Olive (Olea europaea L.) freezing tolerance related to antioxidant enzymes activity during cold acclimation and non acclimation[J].Acta Phydiol Plant,2014,36(12):3231-3241.
[21]Fan,JB (Fan,Jibiao),Ren,J (Ren,Jing),Zhu,WX (Zhu,Weixi),et al.Antioxidant responses and Ggene expression in bermudagrass under cold stress[J].Journal of The American Society For Horticultural Science,2014,139(6):699-705.
[22]Leila Nejadsadeghi,Reza Maali-Amiri,Hassan Zeinali,et al.Comparative Analysis of Physio-Biochemical Responses to Cold Stress in Tetraploid and Hexaploid Wheat[J].Cell Biochem Biophys,2014,70(1):399-408.
[23]陶大立,何兴元.内植物环境胁迫研究应注意的几个基本问题[J].生态学杂志,2009,28(1):102-107.
[24]曹建华,李静,陶忠良,等.油棕嫁接苗对低温胁迫的生理响应及其抗寒力评价[J].热带农业科学,2014,34(8):8-12.
[25]Bao-Qing Zhang,Li-Tao Yang,Yang-Rui Li.Physiological and Biochemical Characteristics Related to Cold Resistance in Sugarcane[J].Sugar Tech,2015,17(1):49-58.
[26]Urban MO,Klima M,Vitamvas P,et al.Significant relationships among frost tolerance and net photosynthetic rate,water use efficiency and dehydrin accumulation in cold-treated winter oilseed rapes[J].Journal of Plant Physiology,2013,170(18):1600-1608.
[27]Li-Yan Wang,Dong Li,Yong-Sheng Deng,et al.Antisense-mediated depletion of tomato GDP-l-galactose phosphorylase increases susceptibility to chilling stress[J].Journal of Plant Physiology,2013,170(3):303-314.
[28]郭淑红,薛立,张柔,等.4种嫁接苗对低温胁迫的光合生理响应[J].华南农业大学学报,2012,33(3):373-377.
Effects of Low-temperature Stress on Physiological-biochemical Indexes ofMicheliaguangdongensisGrafted Seedlings
JIANG Chun-ning,LIN Wei,HUANG Yong-fang
(CollegeofForestryandLandscapeArchitecture,SouthChinaAgriculturalUniversity,Guangzhou510642,Guangdong,China)
Under the different time of low-temperature stress environments (6 ℃) by manual simulation,the effects on physiological and biochemical indexes of annual grafted seedlings ofM.guangdongensisin pots were studied.The results showed that with increasing low-temperature time for the grafted seedlings,the soluble protein content,proline content and POD content decreased followed by an increase.The contents of soluble sugar,SOD,MDA and the relative electrolytic leakage increased remarkably,while the chlorophyll content showed significant reduction.After low-temperature relieving,with the recovery growth of 48 h,the soluble protein content,proline content,POD content and chlorophyll content increased,on the other side,the relative electrolytic leakage,soluble sugar,SOD and MDA content decreased.ThePn,Gs,TrandWUEof grafted seedlings decreased continuously with the extension of low-temperature stress.TheCirised after declining.With the recovery growth of 48 h,thePn,Gs,TrandWUEincreased exceptCi.The results demonstrated that the annual grafted seedlings ofM.guangdongensishad a certain cold tolerance.
Micheliaguangdongensis;grafted seedlings;low-temperature stress;physiological and biochemical index
10.13428/j.cnki.fjlk.2016.02.023
2015-06-12;
2015-07-09
广东省林业科技创新专项资金项目(2012KJCX001-07)
姜春宁(1980—),女,山东烟台人,华南农业大学林学与风景园林院讲师,从事植物学、植物生理学、植物发育学等研究。E-mail:cnjiang@126.com。
黄永芳(1963—),女,华南农业大学林学与风景园林院教授。E-mail:hyfang@scau.edu.cn。
S718.43
A
1002-7351(2016)02-0123-06

