雌激素对 ERα-/ERβ-乳腺癌细胞增殖和侵袭的调节作用及分子机制
陈坚平,康凯夫,周园园,吴国标
(顺德第一人民医院病理科,广东 顺德 528300)
雌激素对ERα-/ERβ-乳腺癌细胞增殖和侵袭的调节作用及分子机制
陈坚平,康凯夫,周园园,吴国标
(顺德第一人民医院病理科,广东顺德528300)
目的 研究雌激素对ERα-/ERβ-乳腺癌细胞增殖和侵袭的调节作用及分子机制。方法 选择乳腺癌细胞株SKBR-3(GPR30+,ERα-/ERβ-)进行研究,用不同水平的雌二醇进行处理,同时将GPR30的siRNA和阴性对照的siRNA转染进入细胞。处理24h后,检测细胞的增殖情况和侵袭情况。结果 雌二醇处理能够以剂量依赖的方式增加细胞活力以及侵袭细胞的数目;转染GRP30-siRNA能够显著降低GPR30的mRNA含量,抑制效率为75.42%;雌二醇处理组的细胞活力以及侵袭数目均高于对照组,雌二醇联合GRP30-siRNA组的细胞活力以及侵袭数目均低于雌二醇处理组(P<0.05)。结论 雌激素能够促进ERα-/ERβ-乳腺癌细胞的增殖和侵袭,受体GPR30可能是雌激素发挥作用的分子机制。
乳腺癌; 雌激素; 雌激素受体; GPR30
乳腺癌是我国女性最常见的恶性肿瘤,雌激素在乳腺癌的发生发展过程中扮演了重要角色,雌激素受体ER介导了雌激素的多种生物学效应。ER受体阳性的乳腺癌患者通过内分泌治疗和Her-2靶向治疗能够取得较为理想的效果[1]。近年来,ER阴性乳腺癌患者的发生率逐年升高,该类患者缺乏内分泌治疗以及Her-2靶向治疗的指征,而抗VEGFR、 EGFR治疗的效果并不理想[2]。ER-乳腺癌患者多见于绝经前女性以及年龄较小的人群,这也提示雌激素可能在病情发展过程中发挥了重要作用[3]。由于ER阴性,因此雌激素可能不通过ER受体途径发挥生物学效应。目前,关于雌激素调节ER阴性乳腺癌细胞的分子机制以及受体途径仍未完全阐明[4]。在下列研究中,我们对雌激素对ERα-/ERβ-乳腺癌细胞增殖和侵袭的调节作用及分子机制进行了分析。
DOI:10.11748/bjmy.issn.1006-1703.2016.04.030
收稿日期:2015-09-30;修回日期:2015-11-14
材料和方法
1 材料
乳腺癌细胞株SK-BR-3(GPR30+,ERα-/ ERβ-)购买于中科院细胞库,细胞培养相关试剂均购买于Gibco公司,MTT试剂购买于Sigma公司,Transwell细胞培养板购买于Corning公司,DAPI细胞核染液购买于碧云天公司。酶标仪为Bio-tek公司生产,荧光显微镜为Nikon公司产品。
2 免疫组化检测方法
免疫组化检测取经福尔马林固定、石蜡包埋原发乳腺癌组织,作4μm厚连续切片。二甲苯浸泡(10min)-二甲苯(10min)-100%酒精(3min)-100%酒精(3min)-95%酒精(3min)-95%酒精(3min)-80%酒 精(3min)-80% 酒 精(3min)-80% 酒 精(3min)-75%酒精(3min)-75%酒精(3min)逐级浸泡切片,PBS冲洗3次,每次5min。
采用微波炉将1mmol/L枸椽酸钠缓冲液加热到980C,放入切片,持续10~20min,取出冷却,PBS冲洗3次,每次5min。
滴加3%H2O2去离子水50μL,370C孵育10min,PSB冲洗3次,每次5min;滴加50μL聚合物辅助剂,370C孵育20min,PSB冲洗3次,每次5min;滴加50μL DAB溶液,控制显色时间;复染、脱水、透明、封片。
3 细胞培养方法
从液氮罐中取出乳腺癌细胞株SK-BR-3,放置在37℃的水浴锅中迅速震荡使之融化,将融化后的细胞悬液离心、弃上清并得到细胞沉淀,用含有10%胎牛血清的培养基5~6 mL重悬细胞,接种在培养瓶中。待细胞生长至70%~80%左右的密度时,用胰酶消化细胞,消化得到的细胞接种在细胞培养板中,待细胞生长后用于下一步处理。
4 细胞转染方法
取细胞板中的细胞进行处理,对照组用不含血清的培养基处理;雌二醇处理组用不同水平的雌二醇处理;转染siRNA时,用Invitrogen公司转染试剂将GPR30的siRNA和阴性对照的siRNA转染进入细胞。处理24h后,进行细胞增殖和侵袭指标的检测。
5 细胞活力检测
细胞处理24h后,弃去全部培养基,加入MTT溶液孵育4h,而后弃去MTT溶液,加入DMSO后迅速震荡,最后在酶标仪上读取490nm处的吸光值。
6 细胞侵袭检测
取Transwell培养板进行细胞侵袭检测,在小室中涂布基质胶,待基质胶交联后接种200μL细胞悬液,培养24h后进行不同条件的处理,最后观察从小室内侧进入小室外侧的细胞数目,具体方法如下:擦去小室内侧的细胞,取下小室内的微膜,用DAPI染液对小室外侧的细胞进行染色,而后在显微镜下观察3个随机视野,记录细胞数目。
7 统计学处理
采用SPSS20.0软件进行处理,细胞活力、侵袭细胞数目等计量资料用(x±s)表示,两组间计量资料的比较采用t检验,多组间计量资料的比较采用方差分析,P<0.05,差异有统计学意义。
结 果
1 ERα、ERβ在乳腺癌组织中表达特点
ERα、ERβ在乳腺癌组织中表达特点ERα均表达于细胞核,而ERβ多表达于细胞核,少表达于胞浆与间质。见图1。
2 雌激素对癌细胞增殖和侵袭的调节作用
雌二醇处理能够以剂量依赖的方式增加细胞活力以及侵袭细胞的数目,见表1。
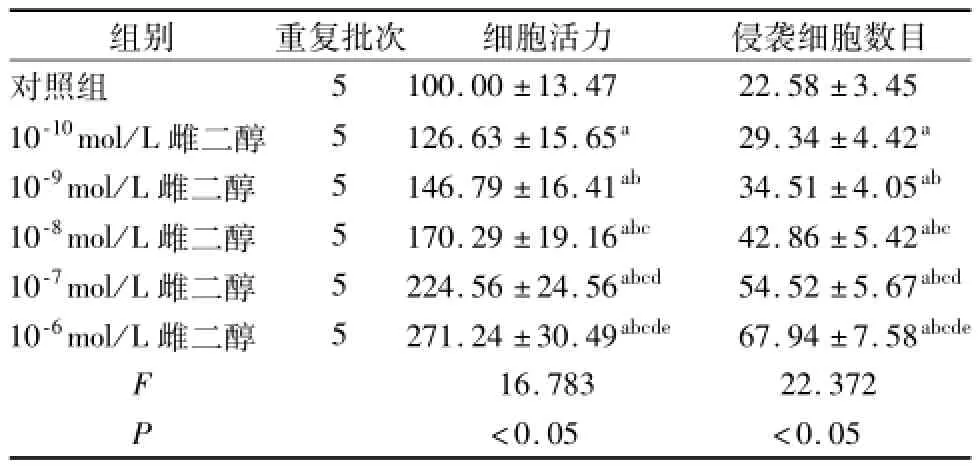
表1 雌激素对癌细胞增殖和侵袭的调节作用(x±s)
3 GRP30-siRNA的转染效率
转染GRP30-siRNA组细胞中 GPR30的 mRNA含量为24.58±3.45,显著低于转染阴性对照siRNA组细胞中GPR30的mRNA含量100±14.85(t= 11.256,P<0.05)。转染GRP30-siRNA对GPR30 mRNA含量的抑制效率为75.42%。
4 转染GRP30-siRNA后雌激素对癌细胞增殖和侵袭的调节作用
雌二醇处理组的细胞活力以及侵袭数目均高于对照组,雌二醇联合GRP30-siRNA组的细胞活力以及侵袭数目均低于雌二醇处理组(P<0.05)。见表2。
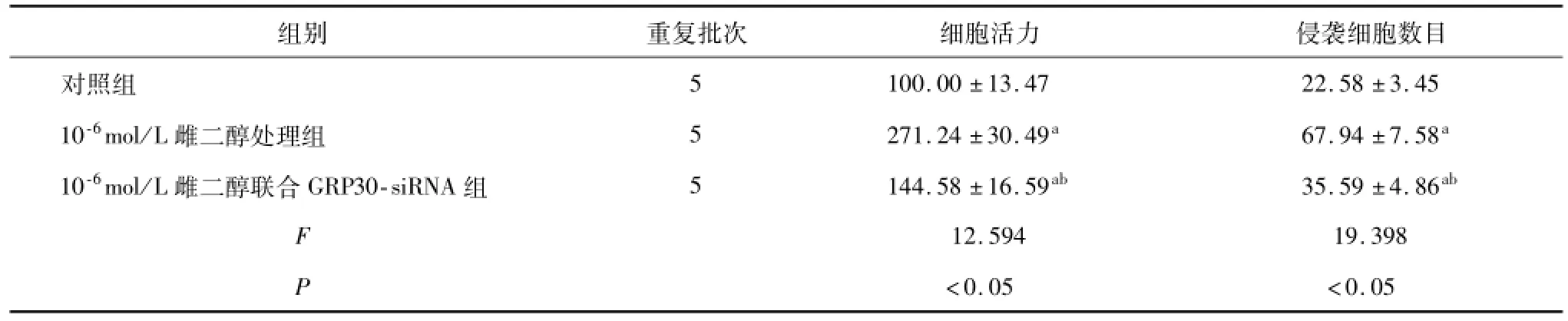
表2 转染 GRP30-siRNA后雌激素对癌细胞增殖和侵袭的调节作用(x±s)
讨 论
三阴乳腺癌是较为特殊的一类乳腺癌,由于肿瘤组织内ER、PR均阴性,对内分泌治疗以及Her-2靶向治疗的敏感性较差[5]。近年来的流行病学调查显示,绝经前女性和年轻人群是ER阴性乳腺癌患者的高发人群,这也提示雌激素在ER阴性乳腺癌的病情进展过程中发挥了重要作用[6]。雌激素发挥生物学效应的经典方式是与ER结合并启动下游多种靶基因的表达,进而造成癌细胞增殖、迁移、侵袭[7]。但是,对于ER阴性乳腺癌患者而言,雌激素并不通过ER来发挥对癌细胞的调节作用[8]。目前,关于雌激素调节ER阴性乳腺癌细胞的分子机制以及受体途径仍未完全阐明[9]。
在本研究中,我们首先分析了雌激素对ER阴性乳腺癌细胞增殖以及侵袭的调节作用。我们选择ERα-/ERβ-乳腺癌细胞株作为研究对象,给予不同水平的雌二醇处理后检测细胞的活力以及侵袭细胞的数目。MTT法是检测细胞活力的常用方法,噻唑蓝能够被活细胞线粒体内的琥珀酸脱氢酶还原为Formazan,为不溶于水的蓝紫色结晶,通过读取特定波长的吸光值能够反映细胞活力;Transwell是检测细胞侵袭的常用方法,通过测定小室内侧侵袭并迁移至小室外侧的细胞数目能够反映侵袭能力[10]。本文研究中,雌二醇能够以剂量依赖的方式促进ERα-/ERβ-乳腺癌细胞的增殖和侵袭,与Scaling等[11]报道基本相似。
GRP30是近年来新发现的雌激素受体,相关研究认为GRP30是预测乳腺癌患者预后的独立因素,雌二醇与GPR30具有极高的亲和力且能够独立介导雌激素的生物学效应[12-13]。为了明确雌激素是否通过GRP30来发挥对ERα-/ERβ-乳腺癌细胞增殖和侵袭的调节,我们采用 siRNA转染的方式敲低GRP30,而后通过敲低GPR30联合雌二醇的方式来处理细胞,进而检测细胞的活力以及侵袭细胞的数目。由分析结果可知,雌二醇处理组的细胞活力以及侵袭数目均高于对照组,雌二醇联合GRP30-siRNA组的细胞活力以及侵袭数目均低于雌二醇处理组。这就说明10-6mol/L的雌二醇能够促进细胞的增殖和侵袭,而敲低GRP30能够逆转雌二醇对细胞的调节作用,由此证实GRP30是雌激素调节ERα-/ERβ-乳腺癌细胞增殖和侵袭的分子机制。
综上所述,雌激素能够促进ERα-/ERβ-乳腺癌细胞的增殖和侵袭,受体GPR30可能是雌激素发挥作用的分子机制。其作用机制还有待于更多的临床研究与基础研究去证实。
[1]查中青,元敏,吴巧胜,等.雌激素受体β对于乳腺癌细胞生长特性及内分泌治疗的影响.中国现代医学杂志,2013,23(31):18-22
[2]Chen Y,Li Z,He Y,et al.Estrogen and pure antiestrogen fulvestrant (ICI 182 780)augment cell-matrigel adhesion of MCF-7 breast cancer cells through a novel G protein coupled estrogen receptor (GPR30)-to-calpain signaling axis.Toxicol Appl Pharmacol,2014,275(2):176-181
[3]余腾骅,罗浩军,严玉钊,等.GPR30介导雌激素对三阴性乳腺癌MDA-MB-468细胞系增殖的影响.第三军医大学学报,2014,36(14):1467-1471.
[4]游昕超,王庭槐.4-羟基他莫芬通过雌激素受体GPR30激活ezrin蛋白促进人乳腺癌MCF-7细胞迁移.中国病理生理杂志,2014,35(5):804-809
[5]牛丽辉,赵亚男,时志民,等.三阴乳腺癌中C-myc和PTTG的表达与意义.中国热带医学,2013,13(1):33-35
[6]陈伟钰,程杨,李平,等.GPR30在雌激素促乳腺癌细胞迁移和侵袭中的作用机制研究.解剖学研究,2015,37(2):93-96.
[7] Chimento A,Csaburi I,Rosano C,et al.Oleuropeinand hydroxytyrosol activate GPER/GPR30-dependent pathways leading to apoptosis of ER-negative SKBR3 breast cancer cells.Mol Nutr Food Res,2014,58(3):478-489.
[8]Sjostrom M,Hartman L,Grabau D,et al.Lack of G protein-coupled estrogen receptor(GPER)in the plasma membrane is associated with excellent long-term prognosis in breast cancer.Breast Cancer Res Treat,2014,145(1):61-71.
[9]张巍,方艳秋,刘媛,等.GPR30及其信号通路在乳腺癌中的研究进展.中国妇幼保健,2011,26(8):1273-1275.
[10]赵征,刘志刚,雷光焰,等.雌激素受体GPR30RNAi干扰载体的构建及在耐药乳腺癌细胞MCF-7R中的效果验证.现代肿瘤医学,2012,20(4):679-681
[11]Scaling A L,Prossnitz E R,Hathaway H J.GPER mediates estrogeninduced signaling and proliferation in human breast epithelial cells and normal and malignant breast.Horm Cancer,2014,5(3):146-160
[12]朱克鹏,杨光伦,涂刚.GPR30在乳腺癌内分泌治疗耐受中的作用研究.中国癌症杂志,2011,21(8):648-653.
[13]Ohshiro K,Schwartz A M,Levine P H,et al.Alternate estrogen receptors promote invasion of inflammatory breast cancer cells via non-genomic signaling.PLoS One,2012,7(1):e30725.
(潘子昂编辑)
Modulation Effect of Estrogen on Proliferation and Invasion of ERα-/ERβ-Breast Cancer Cells and Its Molecular Mechanisms
CHEN Jian-ping,KANG Kai-fu,ZHOU Yuan-yuan,WU Guo-biao
(Department of Pathology,Shunde First People Hospital,Shunde 528300,China)
Objective To study the modulation effect of estrogen on proliferation and invasion of ERα-/ERβbreast cancer cells and its molecular mechanisms.Methods Breast cancer cell line SK-BR-3(GPR30+,ERα-/ERβ-)were collected for study.The cell line were treated with different concentrations of estradiol,while GPR30 siRNA and negative control siRNA were transfected into cells.After treatment for 24h,cell proliferation and invasion were detected.Results Estradiol treatment can increase cell viability and invasive cells numbers by dose-dependent manner.Transfection of GRP30-siRNA can significantly reduce the content of GPR30 mRNA,inhibition efficiency was 75.42%.Cell viability and invasive cells numbers of estradiol-treated group were higher than that in control group;cell viability and invasive cells numbers of estradiol combined with GRP30-siRNA group were lower than estradiol treated group(P<0.05).Conclusion Estrogen can promote ERα-/ ERβ-breast cancer cell proliferation and invasion,estrogen receptor GPR30 may play a role in the molecular mechanism.
Breast cancer; Estrogen; Estrogen receptor; GPR30

