发育期大鼠惊厥后血清丙二醛、促红细胞生成素及髓鞘碱性蛋白的变化及意义*
朱淑霞 孙瑞丽 张燕燕 王行健
滨州医学院附属医院儿科 滨州 256603
发育期大鼠惊厥后血清丙二醛、促红细胞生成素及髓鞘碱性蛋白的变化及意义*
朱淑霞孙瑞丽张燕燕王行健
滨州医学院附属医院儿科滨州256603
目的探讨发育期大鼠惊厥发作后血清丙二醛(MDA)、促红细胞生成素(EPO)及髓鞘碱性蛋白(MBP)的变化及意义。方法发育期大鼠64只随机分为正常对照组(n=15)和高热组(n=49)。高热组又随机分为3个亚组:高热未惊厥组(惊厥次数<1,n=15)、一般惊厥组(1≤惊厥次数≤5,n=17)、反复惊厥组(惊厥次数>5次,n=17)。采用热水浴法反复诱导发育期大鼠惊厥,记录每组惊厥潜伏期、惊厥开始发作时肛温、惊厥持续时间及惊厥发作级别;采用ELISA分别测定各组大鼠丙二醛、促红细胞生成素、髓鞘碱性蛋白的表达水平。结果 一般惊厥组发育期大鼠惊厥后24 h血清MDA水平高于正常对照组及高热未惊厥组(P<0.05);一般惊厥组发育期大鼠惊厥后12 h、24 h、48 h、72 h血清EPO水平高于正常对照组及高热未惊厥组(P<0.05);反复惊厥组发育期大鼠惊厥后12 h、24 h、48 h、72 h血清MDA、EPO水平均高于一般惊厥组(P<0.05);髓鞘碱性蛋白表达水平变化各组之间比较无明显变化(P>0.05)。结论血清丙二醛、促红细胞生成素是发育期惊厥脑损伤的敏感指标,反复惊厥更容易造成脑损伤,可通过其观察生化指标的动态变化来了解发育期脑损伤情况。
惊厥;脑损伤;丙二醛;促红细胞生成素;髓鞘碱性蛋白
热性惊厥是小儿最常见的急症,好发于6个月~5岁儿童,患病率为2%~5%[1]。反复及长时间惊厥发作可造成脑损伤,遗留认知障碍等后遗症,给家庭及社会带来沉重负担。本研究通过建立热性惊厥大鼠发育期动物模型来探讨发育期大鼠惊厥发作后丙二醛、促红细胞生成素及髓鞘碱性蛋白等生化指标的水平变化,了解大鼠惊厥发作后脑损伤的情况,为临床诊断及治疗提供帮助。
1 材料与方法
1.1材料
1.1.1实验动物及分组清洁级15日龄SD大鼠共64只,体质量50~90 g,购买于济南实验动物中心,然后置滨州医学院附属医院SPF饲养室喂养。饲养条件:24 h昼夜循环,通风,避光及噪声,自由摄水,温度适宜(25℃左右),相对湿度70%。按随机数字表法分为正常对照组(n=15)和实验组(n=49),实验组分为高热未惊厥组(惊厥<1,n=15)、一般惊厥组(1≤惊厥≤5次,n=17)、反复惊厥组(惊厥>5次,n=17)。
1.1.2主要试剂EPO、MBP酶联免疫分析试剂盒及MDA试剂盒,均购自武汉博士德生物工程有限公司。
1.2方法
1.2.1惊厥模型制备根据文献[2]建立热性惊厥大鼠模型:热水浴箱(30 cm×30 cm×60 cm)自行设计,委托北京长风公司制作,灵敏度高。浴箱内的水深以大鼠沿壁站立仅露出头部为标准。采用44.5℃温水定时5 min,把SD大鼠浸浴5 min,如不惊厥则取出,归为高热未惊厥组,5 min内发生惊厥者,以后惊厥隔天诱发1次,共10次。按惊厥发作次数分组:≤5次归为一般惊厥组,>5次归为反复惊厥组。造模成功后各组大鼠相应时间点麻醉(10%的水合氯醛,0.3 g/kg,腹腔内注射麻醉),随后右心室静脉取血。正常对照组水浴温度37℃,其他处置方法同高热组。同时记录鼠惊厥的潜伏期、肛温、惊厥持续时间及惊厥的级别。
1.2.2大鼠惊厥程度分级标准[3]0级:无惊厥发作;Ⅰ级:仅面部抽动;Ⅱ级:节律性点头;Ⅲ级:前肢阵挛抽搐;Ⅳ级:全身强直伴站立;Ⅴ级:全身强直。
1.2.3标本采集4组大鼠分别在惊厥后12 h,24 h,48 h,72 h右心室静脉采血各采取1 mL,3 000r/min离心10 min,取上清液-80℃保存。
1.2.4标本检测MDA采用硫代巴比妥酸反应比色法测定:具体操作步骤如下:①首先把试管编号:标准管、标准空白管、测定管、测定空白管。分别把0.1 mL标准品及无水乙醇加入标准管及标准空白管,测试样品各0.1 mL加入测定管和测定空白管。将厂家配置的试剂各加入4个管,每管0.1 mL。将试剂用混匀器混匀;②用保鲜膜扎紧试管口,并扎一小孔,放在95℃的恒温水浴箱内进行水浴80 min;③流水冷却,进行离心,4 000r/min,10 min;④取上清,对蒸馏水调零,532 nm处,1 cm光径,测各管OD值;⑤血清MD对照含量计算公式:血清中MD对照含量(nmol/mL)=(测定管OD值-对照OD值)/(标准OD值-空白OD值)×样品浓度(10 nmol/mL)×样品测试前稀释倍数。
EPO采用酶联免疫吸附法(ELISA测定:具体操作步骤如下:①标准品的稀释与加样;②加样40 μL;③37℃温育30 min;④30倍稀释配液;⑤加洗涤液反复洗涤5次;⑥除空白孔之外每孔加50 μL酶标试剂;⑦再次封膜37℃温育30 min;⑧如上述方法再次洗涤5遍;⑨每孔分别加上对照、B显色剂各50 μL;⑩每孔加入终止液50 μL终止反应;加入终止液15 min之内,以空白孔调零,450 nm波长依序测量吸光度(OD值)。
采用ELISA测定MBP操作步骤类似ELISA测定EPO步骤。
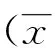
2 结果
2.1热水浴诱导惊厥的大鼠行为特点对照组37℃水浴15只SD大鼠均未出现惊厥;实验组44.5℃水浴49只SD大鼠,15只高热未惊厥,15只出现一般惊厥,15只反复惊厥,实验过程中死亡4只。其他行为学特点见表1。
2.2各组大鼠丙二醛水平比较一般惊厥组发育期大鼠惊厥后24 h血清MDA水平高于正常对照组及高热未惊厥组(P<0.05);反复惊厥组发育期大鼠惊厥后12 h、24 h、48 h、72 h血清MDA水平均高于一般惊厥组(P<0.05),差异具有统计学意义(见表2)。
注:与正常对照组及高热未惊厥组比较,△P<0.05;与一般惊厥组比较,▽P<0.05
2.3各组大鼠促红细胞生成素水平比较一般惊厥组发育期大鼠惊厥后12 h、24 h、48 h、72 h血清EPO水平高于正常对照组及高热未惊厥组(P<0.05);反复惊厥组发育期大鼠惊厥后12 h、24 h、48 h、72 h血清EPO水平均高于一般惊厥组(P<0.05)(见表3)。
注:与正常对照组及高热未惊厥组比较,△P<0.05;与一般惊厥组比较,▽P<0.05
2.4各组大鼠髓鞘碱性蛋白水平比较各组之间血清MBP及12 h、24 h、48 h、72 h各时间点之间血清MBP水平均无明细变化(P>0.05)(见表4)。
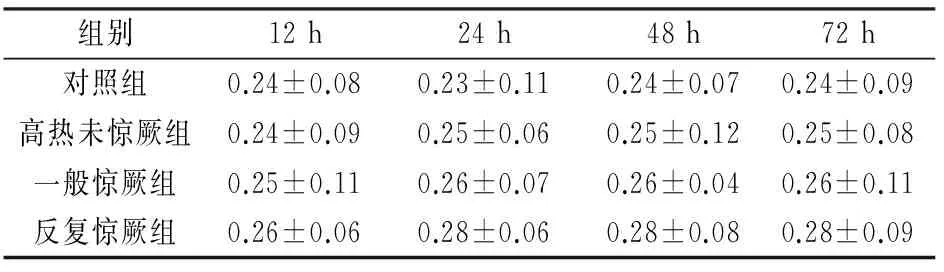
表4 各组大鼠髓鞘碱性蛋白水平比较 ng/mL
3 讨论
惊厥是小儿常见疾病,反复或处于持续状态惊厥可造成脑功能障碍及颞叶癫痫易感性[4-5]。我们采用发育期的SD大鼠通过热水浴法建立惊厥动物模型,对于SD大鼠的脑发育情况,15 d大鼠相当于1岁儿童的脑发育状况,15~36 d发育期的SD大鼠与小儿热性惊厥好发年龄相似。通过建立动物模型,能较好控制对照组选择及样本采集的问题,该诱导方法较成熟,简单易行、能较好模拟惊厥发作,有助于促进对惊厥脑损伤的进一步研究。
近些年氧自由基在惊厥脑损伤中的研究成为热点之一[6]。惊厥发作时,脑组织及其他脏器缺血缺氧,引起超氧阴离子自由基增多,导致机体脂质过氧化物增多,其分解产物丙二醛进一步增多,损害细胞器、细胞膜、细胞核及胞内酶,影响细胞功能及代谢。丙二醛的浓度反映了超氧阴离子自由基的浓度,间接反映了脑损伤的严重程度。本实验研究发现,发育期大鼠一般惊厥发作12 h MDA开始升高,24 h达到高峰,后逐渐下降;反复惊厥组发现,高峰一直持续到48 h。一般惊厥对脑损伤小,血清 MDA短暂升高,惊厥 48 h时与高热未惊厥组比较已无明显差别;反复惊厥发作脑损伤严重,其可造成神经元损伤及凋亡,同时测定反复惊厥中SD大鼠血清丙二醛的含量最高,且持续时间也较一般惊厥长,与理论上MDA的变化趋势相符。因此,血清MDA 能全面反映惊厥发作脑损伤的程度,同时抑制氧化应激对治疗惊厥发作可能是新的治疗方案。
促红细胞生成素(EPO)起初从肾脏分离出来,研究证实,EPO及其受体(EPO-R)在许多组织、器官及细胞都有表达,包括血管内皮细胞及胶质细胞[7]。在脑缺血、缺氧时,缺氧诱导因子(HIF-1)反转录激活,诱导EPO-R、其他生长因子受体的表达,活化JAK-2/Stat5通路阻止神经元的凋亡发挥内源性神经保护作用[8-9]。另外研究发现EPO可通过减少新生大鼠脑组织中Fas及FasL的表达,抑制脑组织缺血缺氧损伤后细胞凋亡[10]。EPO还可抑制线粒体Bax的迁移,抑制神经细胞凋亡[11]。本研究发现:反复惊厥发作,大鼠脑损伤存在动态变化。另外已Wu等[12]研究报道,外源性注射EPO,可明显减轻脑损伤,对治疗脑损伤来说是一种新的突破。
髓鞘碱性蛋白(MBP)是少突细胞和雪旺细胞合成的一种强碱性膜蛋白,维持髓鞘结构和脑发育,是判断有无髓鞘脱失的特异性生化指标。目前研究MBP的研究主要在自身免疫性疾病及脑外伤方面[13-15],如多发性硬化、格林-巴利、脑挫裂伤。然而在惊厥脑损伤方面鲜见报道。本研究发现,惊厥发作后血清MBP浓度变化不明显,各组之间无统计学意义。推测惊厥后未出现脱髓鞘病变,也可能脑损害后72 h后血液中MBP才有升高。
目前关于惊厥的研究多数是通过对大鼠脑组织相关因子的测定,在临床应用中不太符合实际,而本次研究采取小鼠的血液进行研究,更易用于临床诊断和预后判断。通过本实验证实了丙二醛、促红细胞生成素参与了惊厥脑损伤的发生、发展过程,且与脑损伤严重程度相关,故两者为疾病的判断及治疗提供了理论依据。
[1] Patterson J L,Carapetian S A,Hageman J R,et al.Febrile seizures[J].Pediatr Ann,2013,42(12):249-254.
[2] 伊文霞,韩颖,赵阳,等.内源性一氧化碳对反复热性惊厥脑损伤大鼠内质网应激PERK信号通路的调控作用[J].中华实用儿科临床杂志,2013,28(19):1502-1506.
[3] Jiang W,Duong T M,de Lanerolle N C.The neuropathology of hyperthermic seizures in the rat[J].Epilepsia,1999,40(1):5-19.
[4] Park K I,Chu K,Jung K H,et al.Role of cortical dysplasia in epileptogenesis following prolonged febrile seizure[J].Epilepsia,2010,51(9):1809-1819.
[5] Dubé C M,Ravizza T,Hamamura M,et al.Epileptogenesis provoked by prolonged experimental febrile seizures: mechanisms and biomarkers[J].J Neurosci, 2010,30(22):7484-7494.
[6] Wang S J,Zhao X H,Chen W,et al. Sirtuin 1 activation enhances the PGC-1α/mitochondrial antioxidant system pathway in status epilepticus[J]. Mol Med Rep,2015,11(1):521-526.
[7] 谢红志,葛剑,徐海涛,等.大鼠创伤性颅脑损伤后EPO及受体的表达与意义[J].中华神经外科疾病研究杂志,2010,9(3):249-253.
[8] Merelli A, Czornyj L, Lazarowski A,et al. Erythropoietin: a neuroprotective agent in cerebral hypoxia, neurodegeneration, and epilepsy[J].Curr Pharm Des,2013,19(38):6791-6801.
[9] Souvenir R,Fathali N,Ostrowski R P,et al.Tissue inhibitor of matrix metalloproteinase-1 mediates erythropoietin-induced neuroprotection in hypoxia ischemia[J].Neurobiol Dis,2011,44(1):28-37.
[10] 张晶,黄蕊,郝玲,等.促红细胞生成素对缺氧缺血性脑损伤新生大鼠脑组织 Fas/FasL表达的影响[J].中国临床药理学杂志.2015,31(12):1146-1149.
[11] Ge X H,Zhu G J,Geng D Q,et al.Erythropoietin attenuates 6-hydroxydopamine-induced apoptosis via glycogen synthase kinase 3β-mediated mitochondrial translocation of Bax in PC12 cells[J].Neurol Sci,2012,33(6):1249-1256.
[12] Wu Y W,Gonzalez F F.Erythropoietin:a novel therapy for hypoxic-ischaemic encephalopathy?[J].Dev Med Child Neurol,2015,57(3):34-39.
[13] Mir S,Ali F,Chauhan D,et al.Accumulation of reactivity to MBP sensitizes TRAIL mediated oligodendrocyte apoptosis in adult sub cortical white matter in a model for human multiple sclerosis[J].Metab Brain Dis,2016,31(2):299-309.
[14] Zhang C J,Zhai H,Yan Y,et al. Glatiramer acetate ameliorates experimental autoimmune neuritis[J].Immunol Cell Biol, 2014,92(2):164-169.
[15] Strathmann F G,Schulte S,Goerl K,et al.Blood-based biomarkers for traumatic brain injury: evaluation of research approaches,available methods and potential utility from the clinician and clinical laboratory perspectives[J].Clin Biochem,2014,47(10-11):876-888.
Change and significance of malondialdehyde, erythropoietin and myelin basic protein in serum of developmental rats after seizures
ZHU ShuxiaSUN RuiliZHANG YanyanWANG Xingjian
Department of Pediatrics,Binzhou Medical University Hospital,Binzhou 256603, P.R.China
ObjectiveTo discuss the change and significance of malondialdehyde(MDA),erythropoietin(EPO) and myelin basic protein(MBP) in serum of developmental rats after seizures.MethodsSixty-four developing rats were randomly divided into normal control group (n=15) and high fever group (n=49).High fever group was randomly divided into 3 subgroups:fever but not convulsive group(FC<1,n=15), general seizure group (1≤FC≤5,n=17) and recurrent seizure group (FC>5,n=17) respectively. We use hot water bath method repeatedly induced developmental stages of rat convulsion. The seizure latency, rectal temperature,seizures duration and convulsion levels were recorded. The expressions of malondialdehyde, erythropoietin and myelin basic protein in serum were recorded by using Elisa.ResultsThe serum MDA concentrations of general convulsion group were higher than those of the normal control group and febrile convulsion group at 24 h after seizure (P<0.05).The serum EPO levels of 12 h,24 h,48 h and 72 h after seizure of general convulsion group were higher than those of normal control group and febrile convulsion group (P<0.05). The expressions of EPO and MDA in recurrent convulsion group were higher than those of the general convulsions group at 12 h,24 h,48 h and 72 h after seizure (P<0.05).There was no significant difference between the groups in the expression of myelin basic protein (P>0.05).ConclusionMDA and EPO are sensitive indicators of brain injury in developmental stage. Recurrent seizures are more likely to cause brain damage. We can observe the dynamic changes of biochemical indexes to understand brain injury.
serizures,brain injury,malondialdehyde,erythropoietin, myelin basic protein
滨州医学院科技计划(BY2010KJ029)
R720.597
A
1001-9510(2016)04-0251-04
2015-12-31)
朱淑霞,E-mail:zhusx2003@163.com

