柴胡皂苷提取物灌胃给予大鼠后肺组织中移形成分的LC-MS分析
乔亚荣, 张 峰, 方 媛, 贾金萍, 闫 艳, 田俊生, 秦雪梅, 高晓霞*
(1山西大学中医药现代研究中心,太原 030006; 2山西大学化学化工学院; 3山西大学大型科学仪器中心; *通讯作者, E-mail:gaoxiaoxia@sxu.edu.cn)
柴胡皂苷提取物灌胃给予大鼠后肺组织中移形成分的LC-MS分析
乔亚荣1,2, 张峰1,2, 方媛1, 贾金萍3, 闫艳1, 田俊生1, 秦雪梅1, 高晓霞1*
(1山西大学中医药现代研究中心,太原030006;2山西大学化学化工学院;3山西大学大型科学仪器中心;*通讯作者, E-mail:gaoxiaoxia@sxu.edu.cn)
目的初步探讨柴胡皂苷类成分在大鼠肺组织的代谢,为更好地揭示柴胡皂苷类成分在体内过程提供依据。 方法采用液相质谱联用仪分析柴胡皂苷提取物灌胃给药后大鼠肺组织中的成分,得到各成分的总离子流图和二级质谱图,结合文献与对照品对照对各色谱峰进行鉴定。色谱条件:采用BEH-C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相为乙腈(A)-水(B),梯度洗脱(0-4 min,25%A→37%A;4-10 min,37%A;10-18 min,37%A→50%A;18-22 min,50%A→90%A;22-25 min,90%A→90%A;25-26 min,90%A→25%A),流速0.4 ml/min。质谱条件:电喷雾电离离子源;正负离子扫描模式;温度450 ℃,质量扫描范围:m/z 150-1 500。结果以柴胡皂苷类化合物的质谱裂解规律为指导,共鉴定出15种化合物。其中10种药材原型成分,分别为柴胡皂苷(SS)a,SSc,SSf,SSd,SSb2,SSe, 3″-O-乙酰化柴胡皂苷 a,6″-O-乙酰化柴胡皂苷 a,3″-O-乙酰化柴胡皂苷d,6″-O-乙酰化柴胡皂苷d;5种代谢物分别为柴胡次皂苷F,柴胡次皂苷 D,柴胡次皂苷 G,去糖氧化柴胡皂苷a,去糖氧化柴胡皂苷d。结论通过柴胡皂苷提取物肺中成分分析,初步确认了柴胡皂苷提取物在肺中的柴胡皂苷类成分以及代谢产物,为柴胡发挥解热镇痛作用的物质基础提供依据。
LC-MS;柴胡皂苷类;代谢产物;体内分析
柴胡,为伞形科植物柴胡BupleurumchinenseDC.或狭叶柴胡BupleurumscorzonerifoliumWilld.的干燥根,始载于《神农本草经》,列为上品[1],被历版《中国药典》[2]收载,是一种常用的中药材[3],有悠久的应用历史,具解表和里、疏肝解郁、升提中气之功效[4],性味苦,微寒,归肝、胆、肺经。研究表明,柴胡皂苷类成分具有解热、镇痛、镇静、抗炎、保肝、止咳、抗病毒、抗溃疡等多种药理活性[6],是柴胡发挥解热镇痛作用的主要药效成分[5]。但是,柴胡皂苷结构不稳定,极易转化,生物利用度较低,在体内主要以代谢产物的形式存在[7,8]。近年来,关于柴胡皂苷药动和代谢的研究越来越多[9-11],主要集中在血液和肝组织中的分布和代谢[12]。柴胡皂苷有解热作用[13],解热作用与肺组织关系密切,故本实验将首次探究柴胡皂苷类成分在肺组织的分布和代谢,为柴胡发挥解热镇痛作用的物质基础提供依据。
1 材料与方法
1.1实验材料
1.1.1仪器超高效液相色谱与质谱联用仪(Thermo Scientific Q Exactive LC-MS,美国Thermo),Xcalibur 2.0数据分析软件,Sartorius电子分析天平(德国赛多利斯Sartorius有限公司),高速冷冻离心机(TGL-6,长沙湘仪离心机有限公司),真空干燥箱(上海跃进医疗器械厂),氮吹仪(实验室自制),UP-250 超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.1.2试药与试剂柴胡(1408259131)购于山西省华阳药业有限公司,经山西大学中医药现代研究中心秦雪梅教授鉴定为红柴胡BupleurumchinenseDC,且留样于山西大学中医药现代研究中心。柴胡皂苷a(SSa)(批号:14111902)、柴胡皂苷d(SSd)(批号:14071710)对照品购自中国药品生物制品检定所;柴胡皂苷c(SSc)(批号:MUST-14102812)、柴胡皂苷b1(SSb1)(批号:MUST-14080110)、柴胡皂苷b2(SSb2)(批号:MUST-14041012)对照品购自成都曼斯特生物科技有限公司。
乌拉坦购自国药集团化学试剂有限公司;95%乙醇、甲醇、乙腈、羧甲基纤维素钠均为分析纯,购自北京化工厂;纯净水购自杭州娃哈哈集团有限公司;色谱级甲醇和乙腈购自Fisher Scientific(USA)。
1.1.3实验动物健康雄性SD大鼠12只,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京2012-0001)。将大鼠置于昼夜节律光照条件下,自由进食进水,饲养7 d适应环境,每天触摸动物以适应实验人员的操作。
1.2实验方法
1.2.1柴胡皂苷提取物的制备参照柴胡总皂苷的提取方法[14],取柴胡200 g,加8倍量80%乙醇,回流提取3次,第1,2次每次2 h,第3次1 h,合并提取液,滤过,回收乙醇至无醇味,加水分散,浓缩至浸膏,然后加入等体积的石油醚,萃取,弃去并石油醚层后浓缩至浸膏,置于水浴锅(60 ℃)上干燥,即得柴胡皂苷提取物。
1.2.2对照品溶液的制备称取SSa,SSc,SSd,SSb1和SSb2对照品约2.5 mg,精密称定,分别置于5 ml量瓶中,加甲醇溶解并稀释至刻度,摇匀即得SSa 0.500 mg/ml、SSc 0.490 mg/ml、SSd 0.485 mg/ml、SSb10.510 mg/ml、SSb20.495 mg/ml的对照品贮备液。精密量取各贮备液适量,加甲醇稀释至适当浓度,进样前0.22 μm微孔滤膜滤过。
1.2.3灌胃液的制备柴胡皂苷提取物用0.1%羧甲基纤维素钠水超声溶解制得灌胃液,质量浓度为30 g/ml(按生药量计),各成分的含量分别为:SSc 0.042 mg/g,SSa 0.090 mg/g,SSd 0.385 mg/g,SSb20.102 mg/g,SSb10.098 mg/g(按生药量计)。
1.2.4组织样本的采集SD大鼠12只,分成2组,每组6只,分别为空白组和给药组。实验前禁食12 h,自由饮水。按照1 ml/100 g体质量,分别灌胃给予空白溶媒和柴胡皂苷提取物的灌胃液。给药后30 min,按大鼠体重腹腔注射20%乌拉坦0.01 ml/g麻醉,取肺组织,-80 ℃冷藏备用。
1.2.5组织样本的处理称取肺组织样本约1.000 g,精密称定,置10 ml EP离心管中,加入2倍体积的生理盐水,匀浆,取匀浆液2 ml,用甲醇沉淀蛋白的方法除去蛋白,即加入甲醇6 ml,涡旋混合3 min,3 000 r/min离心15 min,取上清液置于另一10 ml EP离心管中,常温下N2流吹干,残渣加入150 μl甲醇溶解,超声3 min,涡旋2 min,转移至0.5 ml EP离心管中,4 ℃下13 000 r/min离心10 min,取上清液,进样分析。
1.2.6色谱条件与质谱条件色谱条件:BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为水(A)-乙腈(B);梯度洗脱:0-4 min,25%A→37%A;4-10 min,37%A;10-18 min,37%A→50%A;18-22 min,50%A→90%A;22-25 min,90%A→90%A;25-26 min,90%A→25%A;体积流量0.4 ml/min;柱温40 ℃;进样量1 μl;全波长扫描。
质谱条件:电喷雾电离离子源,正负离子模式,毛细管电压3 kV,锥孔电压40 V,离子源温度120 ℃,脱溶剂气温度350 ℃,脱溶剂气流量600 L/h,采用全扫描质谱和二级质谱测定,全扫描质量扫描范围m/z100-1 500。
采用高分辨质谱在正负电离模式下测定后,得到对照品LC-MS的总离子流图和二级质谱图以及空白组和给药组肺组织的LC-MS的总离子流图和二级质谱图。将得到的结果用Xcalibur 2.0数据分析软件处理,得到给药后肺组织扣除空白组背景后的总离子流图,然后对其成分进行分析。
2 结果
2.1柴胡皂苷类成分对照品质谱结果分析
SSa对照品的负离子模式下一级质谱图中可见[M-H+HCOOH]-m/z825.462 65和[M-H]-m/z779.456 67,二级质谱图见图1A,可见其主要的碎片离子为丢失葡萄糖162 D所得的碎片离m/z617.404 97,进一步丢失岩藻糖146 D和CH3OH 32 D所得的碎片离子m/z439.320 13。SSd对照品的负离子模式下一级、二级质谱图同SSa。
对照品SSb1和SSb2具有相同的质谱行为(见图1B),负离子模式下一级质谱图中可见[M-H+HCOOH]-m/z825.456 30 和[M-H]-m/z779.451 78,二级质谱图主要的碎片离子为丢失葡萄糖162 D所得的碎片离m/z617.404 97,进一步丢失岩藻糖146 D、CH2O 30 D和H2O 18 D所得的碎片离子m/z423.322 94。
SSc对照品的负离子模式下一级质谱图中可见[M-H+HCOOH]-m/z971.513 06 和[M-H]-m/z925.507 02,二级质谱图见图1C,可见其主要的碎片离子为丢失葡萄糖162 D所得的碎片离m/z763.457 28,丢失岩藻糖146 D所得的碎片离子m/z779.451 66,进一步丢失葡萄糖162 D所得的碎片离子m/z617.400 15。
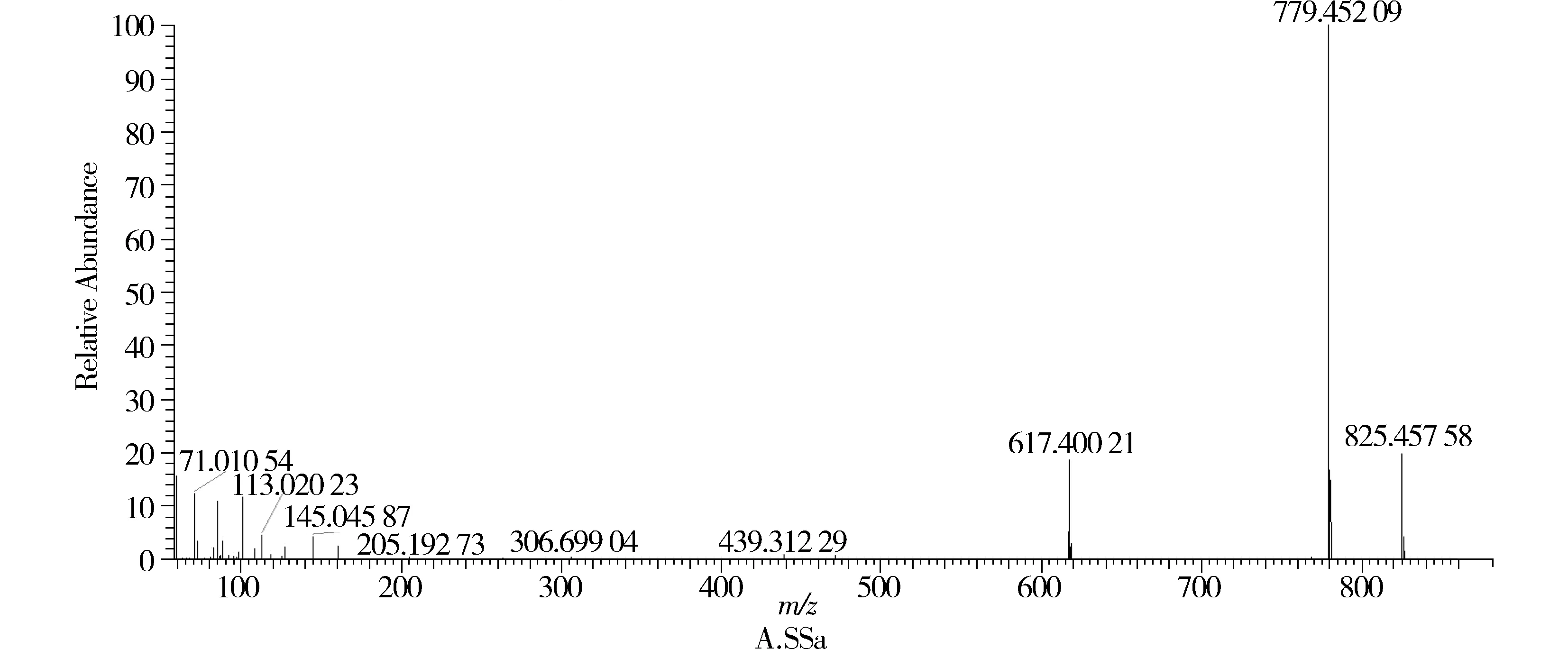
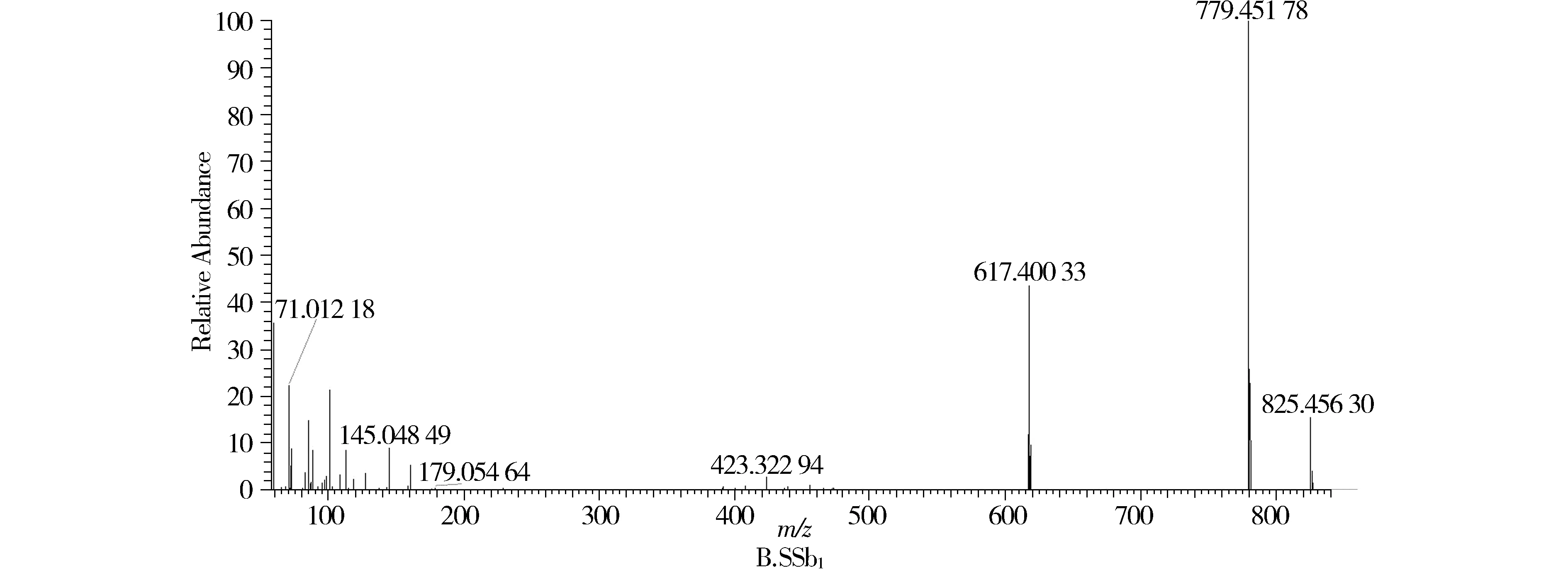
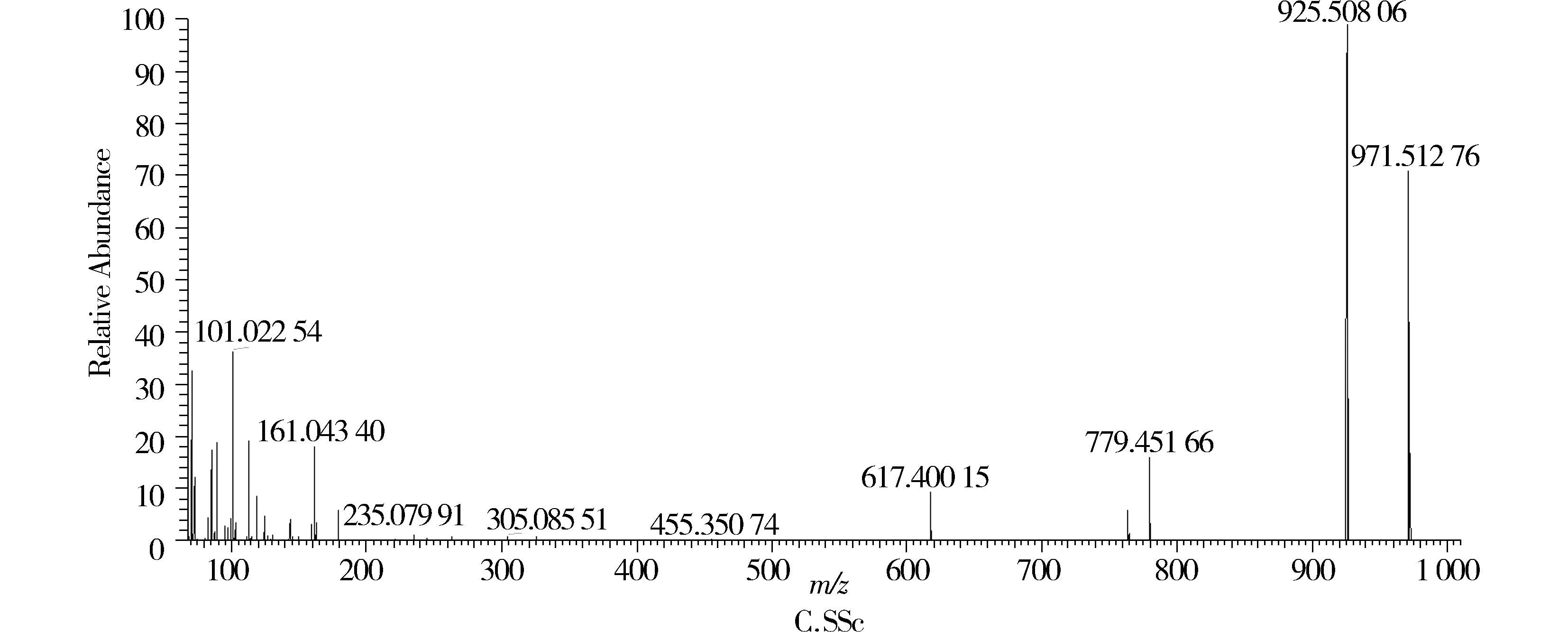
图1 对照品SSa,SSb1和SSc二级质谱图Figure 1 The MS/MS chromatogram of standard SSa,SSb1 and SSc
2.2柴胡皂苷类成分及代谢物的指认
灌胃给予大鼠柴胡皂苷提取物后,在大鼠的肺中总共检测到17种成分(见表1),其中9种为药材原型成分,8种为代谢产物。鉴定出15种成分,提取m/z600-1 000的离子流图(见图2),图中标记了鉴定出的15种成分。
表1给药后组织中柴胡皂苷类成分及代谢物的LC-MS分析结果
Table 1The bupleurum saikosaponins and metabolites in rat tissue after administration by LC-MS

序号tR[M-H]+(m/z)(+)MS(m/z)MS2(m/z) [M-H]-(m/z)(-)MS(m/z)MS2(m/z) 化合物 15.40927.52805949.51080[M+Na]+909.52155[M+H-H2O]+803.45264[M+Na-Fuc]+925.51483971.51781[M-H+HCOOH]-779.45691[M-Fuc]-617.40430[M-Fuc-Glc]-柴胡皂苷c*25.66929.54572951.52881[M+Na]+927.53329973.53558[M-H+HCOOH]-781.47101[M-Fuc]-619.42084[M-Fuc-Glc]-柴胡皂苷f38.33781.47156803.45428[M+Na]+619.41962[M+H-Glc]+455.35141[M+H-Glc-Fuc-H2O]+779.45667825.46265[M-H+HCOOH]-617.40497[M-Glc]-439.32013[M-H-Glc-Fuc-CH3OH]-柴胡皂苷a*48.66781.47192803.45435[M+Na]+619.41962[M+H-Glc]+455.35141[M+H-Glc-Fuc-H2O]+779.45636825.46265[M-H+HCOOH]-617.40497[M-Glc]-柴胡皂苷b2*515.42781.47150803.45398[M+Na]+619.41479[M+H-Glc]+473.36179[M+H-Glc-Fuc-]+455.35107[M+H-Glc-Fuc-H2O]+779.45648825.46289[M-H+HCOOH]-617.40497[M-Glc]-439.31534[M-H-Glc-Fuc-CH3OH]-柴胡皂苷d*613.87823.48120845.46362[M+Na]+805.47101[M+H-H2O]+473.11438[M+H-CH2CO-Glc-Fuc]+455.35089[M+H-CH2CO-Glc-Fuc-H2O]+821.46819867.47237[M-H+HCOOH]-779.45587[M-CH3CO]-761.45020[M-CH3CO-H2O]-617.40405[M-CH3CO-Glc]-3″-O-乙酰化柴胡皂苷a714.36823.48236同6821.46774同66″-O-乙酰化柴胡皂苷a816.95823.48145同6821.46822同63″-O-乙酰化柴胡皂苷d918.95823.48175同6821.46698同66″-O-乙酰化柴胡皂苷d1010.69619.41937641.40155[M+Na]+601.40875[M+H-H2O]+455.35196[M+H-Fuc-H2O]+437.34085[M+H-Fuc-2H2O]+617.40356663.41193[M-H+HCOOH]-471.34680[M-Fuc]-439.32251[M-Fuc-CH3OH]-柴胡次皂甙F1111.16619.41876同10617.40417同10柴胡次皂甙D1217.36619.41925同10617.40503同10柴胡次皂甙G1312.74617.40338639.38544[M+Na]+455.35120[M+H-Fuc-O]+437.34082[M+H-Fuc-O-H2O]+615.38892661.39459[M-H+HCOOH]-585.37872[M-H-CH3OH]-439.32147[M-H-Fuc-CH3OH]-去糖氧化柴胡皂苷a1418.13617.40326同13615.39505同13去糖氧化柴胡皂苷d1512.57787.45862[M+Na]+455.35123[M+H-Fuc-Glc-2H]+763.46024809.467419[M-H+HCOOH]-601.41034[M-H-Glc]-柴胡皂苷e168.08673.42719601.40869649.43091695.43622663.40991未知1712.04507.27240325.18341279.23406未知
*通过对照品指认的成分,其余根据质谱规律,结合参考文献推测
2.2.1柴胡皂苷类成分1,3,4,5与对照品的一级、二级质谱图的对比,保留时间确定成分1,3,4,5分别为SSc,SSa,SSb2,SSd。成分2,15的主要碎片离子见表1,根据其裂解规律,推测其为为SSf,SSe。
2.2.2乙酰化柴胡皂苷类成分6的负离子模式下的一级质谱图中可见m/z867.47237和m/z821.467 74,在二级质谱图可见m/z779.455 87,m/z761.450 20,m/z617.404 05,m/z439.321 93,根据其一级和二级质谱的数据,推测m/z821.467 74为[M-H]-,丢失C2H2O 42 D得到碎片离子m/z779.455 87,再丢失H2O 18 D得到m/z761.450 20,m/z779.455 87丢失葡萄糖162 D得m/z617.404 05,进一步失去一分子岩藻糖146 D和CH3OH 32 D得m/z439.321 93,成分7-9呈现同样的裂解规律,正负离子模式下的碎片离子见表1,推测其分别为SSa和SSd乙酰化后的化合物,即3″-O-乙酰化柴胡皂苷a,6″-O-乙酰化柴胡皂苷a,3″-O-乙酰化柴胡皂苷d,6″-O-乙酰化柴胡皂苷d。正离子模式下的碎片离子见表1,验证了负离子模式下的推测结果。
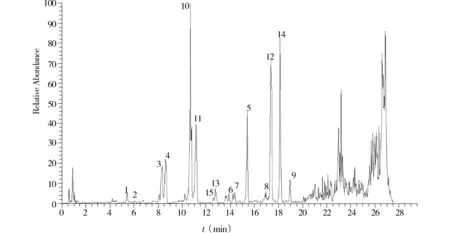
1.SSc;2.SSf;3.SSa;4.SSb2;5.SSd;6.3″-O-乙酰化柴胡皂a;7.6″-O-乙酰化柴胡皂苷a;8.3″-O-乙酰化柴胡苷d;9.6″-O-乙酰化柴胡苷d;10.柴胡次皂甙F;11.柴胡次皂甙D;12.柴胡次皂甙G;13.去糖氧化柴胡皂苷a;14.去糖氧化柴胡皂苷d;15.SSeB.给药组图2 空白组和给药组肺组织LC-MS分析负离子模式下提取的离子流图Figure 2 Ion chromatogram in the negative mode of lung tissues in the blank sample and drug spiked sample
2.2.3柴胡皂苷代谢物成分10-14在灌胃液和空白组的肺组织中均未检测到,但在给药组的肺组织样本中检测到,故推测其为代谢物。
成分10的负离子模式下的一级质谱图中可见m/z663.411 93和m/z617.403 56,在二级质谱图可见m/z471.346 80,m/z439.322 51,推测m/z617.403 56为[M-H]-,丢失岩藻糖146 D得到碎片离子m/z471.346 80,进一步失去CH3OH 32 D得m/z439.321 93,成分11,12呈现同样的裂解规律,推测其分别为SSa,SSd,SSb2失去一分子葡萄糖所得,即柴胡次皂甙F、柴胡次皂甙D、柴胡次皂甙G。正离子模式下的碎片离子见表1,验证了负离子模式下的推测结果。
成分13的负离子模式下的一级质谱图和二级质谱图中可见m/z661.394 59,m/z615.388 92,m/z585.378 72和m/z439.321 47,推测m/z615.388 92为[M-H]-,丢失CH2O 30 D得到碎片离子m/z585.378 72,进一步失去岩藻糖146 D得m/z439.321 47,成分14呈现同样的裂解规律,根据其在色谱图中的出峰顺序推测其分别SSa和SSd失去一分子葡萄糖氧化所得,即去糖氧化柴胡皂苷a和去糖氧化柴胡皂苷d。正离子模式下的碎片离子见表1,验证了负离子模式下的推测结果。
3 讨论
根据柴胡皂苷类成分的结构和对照品的裂解规律,总结发现:柴胡皂苷类成分先失去m/z146鼠李糖/岩藻糖、m/z162葡萄糖/半乳糖等糖链结构,得到失去一分糖或者两分子糖的碎片离子;进一步失去所有的糖链得到苷元结构;苷元结构进一步失去m/z32 CH3OH和不同数目的m/z18 H2O得到碎片离子。这一裂解规律为柴胡皂苷类成分和代谢物的指认提供依据。
组织样品采集时间的确定:大鼠灌胃给予柴胡皂苷提取物后,分别在15,30,45,60 min时取肺组织,然后经LC-MS分析后,发现30 min时组织中柴胡皂苷类成分及代谢物含量较高。
本实验通过LC-MS分析了柴胡皂苷类成分进入大鼠体内后在肺组织的行为分布,鉴定出10种原型成分和5种代谢产物,为柴胡皂苷类成分在体内的分布及代谢过程提供依据。但是,中药成分在体内的代谢过程复杂,柴胡皂苷类成分的体内代谢需要更多的实验来揭示其在体内复杂的代谢过程。
[1]刘灿坤,李文涛.柴胡的本草研究[J].时珍国医国药,1999,10(1):40-42.
[2]国家药典委员会.中华人民共和国药典一部[M].北京:中国医药科技出版社,2010:263.
[3]郭晓擎,田俊生,史碧云,等.南柴胡和北柴胡组成的逍遥散抗抑郁作用1H-NMR代谢组学研究[J].中草药,2012,43(11):2209-2216.
[4]孙世君.柴胡的药理学分析以及临床应用[J].中国医药指南,2010,8(29):210-211.
[5]唐智芳.锥叶柴胡化学成分和质量研究[D].北京:北京中医药大学,2010.
[6]吕晓慧,孙宗喜,苏瑞强,等.柴胡及其活性成分药理研究进展[J].中国中医药信息杂志,2012,19(12):105-107.
[7]Dobashi I,Tozawa F,Horiba N,etal.Central administration of saikosaponin-D increases corticotropin-releasing factor mRNA levels in the rat hypothalamus[J].Neurosci Lett,1995,197(3):235-238.
[8]王一飞,郝琨,王广基,等.柴胡皂苷类物质体内代谢研究进展[J].医学综述,2012,18(16):2621-2623.
[9]刘史佳.柴胡皂苷a的药动学及药物相互作用研究[D].南京:南京中医药大学,2010.
[10]Meselhy R.Human intestinal bacteria responsible for the metabolism of saikosaponins[J].J Trandition Med,2000,17(1):1-11.
[11]李秀琴.柴胡质量评价方法及相关成分的药动学研究[D].沈阳:沈阳药科大学,2006.
[12]Lei Xu,Song R,Tian JX.Analysis of saikosaponins in rat plasma by anionic adducts-based liquid chromatography tandem mass spectrometry method[J].Biomed Chromatogr,2011,26(7):808-815.
[13]薛燕,白金叶.柴胡解热成分的比较研究[J].中药药理与临床,2003,19(1):11-12.
[14]张国松,封传华,罗晓健,等.柴胡总皂苷提取工艺的优化[J].中国实验方剂学杂志,2011,17(12):17-20.
LC-MS analysis of saikosaponins in rat lung tissues after oral administration of bupleurum saikosaponin extract
QIAO Yarong1,2, ZHANG Feng1,2, FANG Yuan1, JIA Jinping3, YAN Yan1, TIAN Junsheng1, QIN Xuemei1, GAO Xiaoxia1*
(1ModernResearchCenterforTraditionalChineseMedicine,ShanxiUniversity,Taiyuan030006,China;2CollegeofChemistryandChemicalEngineering,ShanxiUniversity;3ScientificInstrumentCenter,ShanxiUniversity;*Correspondingauthor,E-mail:gaoxiaoxia@sxu.edu.cn.)
ObjectiveTo explore the metabolic profile of saikosaponins in rat lung tissues, and provide evidences for the profile of saikosaponinsinvivo.MethodsA rapid,sensitive LC-MS was developed to explore the components of bupleurum saikosaponin extract in rat lung tissues after oral administration. The LC-MS full scan and MS/MS were established to identify the components in rat lung tissues. The separation was performed on an BEH C18(2.1 mm×100 mm, 1.7 μm), with acetonitrile-water as the mobile phase. The gradient profile was as follows: 0-4 min,25%A→37%A;4-10 min,37%A;10-18 min,37%A→50%A;18-22 min,50%A→90%A;22-25 min,90%A→90%A;25-26 min,90%A→25%A. The flow rate was maintained at 0.4 ml/min. MS method was set with ESI ion, positive and negative ions mode and temperature of 450 ℃, and the full mass range was from 150 to 1 500.ResultsBased on the MS pattern of saikosaponins, 15 compounds were identified in rat lung tissues, including saikosaponin a(SSa), SSc, SSf, SSd, SSb2, SSe, 3″-O-acetylsaikosaponin a, 6″-O-acetylsaikosaponin a, 3″-O-acetylsaikosaponin d, 6″-O-acetylsaikosaponin d, prosaikogenin F, prosaikogenin D, prosaikogenin G.ConclusionLC-MS results indicate that the active constituents in bupleurum saikosaponin extract in lung are confirmed, and provide an evidence for the antipyretic effects of saikosaponinsinvivo.
LC-MS;saikosaponin;metabolite;analysisinvivo
国家自然科学基金项目(81001688,81473415);国际科技合作资助项目(2011DFA32630);“重大新药创制”科技重大专项资助项目(2012ZX09103201-035);山西省振东制药研究生教育创新中心硕士研究生实践教学模式探索项目
乔亚荣,女,1990-11生,硕士,E-mail: qiaoyarong1990@sina.cn
2015-10-20
284
A
1007-6611(2016)03-0264-06
10.13753/j.issn.1007-6611.2016.03.015

