黑龙江地区向日葵核盘菌致病性分化研究
刘 佳, 张匀华, 孟庆林, 石凤梅,马立功, 李易初, 刘春来, 左豫虎
(1. 黑龙江八一农垦大学, 大庆 163319; 2. 黑龙江省农业科学院植物保护研究所, 哈尔滨 150086)
黑龙江地区向日葵核盘菌致病性分化研究
刘佳1,2,张匀华2,孟庆林2,石凤梅2,马立功2,李易初2,刘春来2,左豫虎1*
(1. 黑龙江八一农垦大学, 大庆163319; 2. 黑龙江省农业科学院植物保护研究所, 哈尔滨150086)
本文对黑龙江省的100株向日葵核盘菌(39个亲和组)的致病力、菌落生长速率、草酸产量及总酸产量(pH)进行了测定,并分析了菌株致病力与菌落生长速率、草酸产量及总酸产量(pH) 3个因子的相关性。结果表明: 菌株的致病力与草酸产量成正相关(r=0.758,P<0.01);与总酸产量(pH)之间成负相关(r=-0.794,P<0.01);草酸产量与总酸产量(pH)之间呈显著负相关关系(r=-0.639,P<0.01)。
核盘菌;致病性;向日葵;相关性
(1.HeilongjiangBayiAgriculturalUniversity,Daqing163319,China; 2.InstituteofPlantProtection,HeilongjiangAcademyofAgriculturalSciences,Harbin150086,China)
核盘菌[Sclerotinia sclerotiorum (Lib.)deBary]是一种世界性分布的病原真菌,寄主范围非常广,能对油菜、向日葵、大豆、胡萝卜、拟南芥等超过400种作物造成不同程度的危害[1]。历史上菌核病曾导致中国内蒙古地区向日葵[2]、爱尔兰马铃薯[3]、加拿大豆类作物[4]大面积受侵染,尤其是1985年-1987年间,我国黑龙江省的一般地块向日葵菌核病发病率达到30%~60%,严重地块达到90%以上,甚至绝产[5],造成严重的经济损失。2009年—2014年,黑龙江省农业科学院植物保护研究所对黑龙江省向日葵产区菌核病的发生情况进行了连续6年的实地调查,结果显示菌核病的年平均发病率在30%~50%,有些地块发病率达到80%以上。对于这种具有广泛地理分布的病原菌种群内是否存在致病性分化,前人已有一些研究,有报道表明不同核盘菌菌株的致病性没有质的分化,也有学者认为该病原菌种群内不同菌株间存在致病性分化[6-9]。本研究仅对黑龙江省内的100株核盘菌(39个亲和组)的致病力、菌落生长速率、草酸及总酸含量进行测定,并探讨菌株致病力与菌落生长速率、草酸产量及总酸产量(pH)3个因子间的相关性,明确黑龙江省内核盘菌种群内是否存在致病性分化,以及这种分化与菌株来源是否有关,从而为黑龙江省向日葵菌核病的防治和抗病育种提供依据。
1 材料与方法
1.1核盘菌菌株致病力测定
1.1.1供试向日葵品种
抗病品种‘丰葵杂1号’,由黑龙江省农业科学院植物保护研究所免疫室提供 。
1.1.2供试菌株
对采自黑龙江省10个地区29个市县5种寄主的100个菌株经过菌丝融合群试验进行了亲和分组测定,共分成39个亲和组(见表1)。
1.1.3菌株培养
将活化好的核盘菌菌株接种到PDA培养基上,放于25℃恒温培养箱中黑暗培养,待菌落生长至培养皿直径的80%时备用。
1.1.4离体叶片法测定核盘菌对‘丰葵杂1号’的致病性
取长方形塑料盘,用75%乙醇棉擦拭盘面,在盘底部铺两层灭菌的湿润滤纸。取苗龄为30d、长势及面积较为一致的‘丰葵杂1号’叶片,自来水冲洗干净,用吸水滤纸吸干叶片上多余水分,然后将叶片均匀地置于塑料盘内湿润滤纸上,叶片背面朝上。用打孔器在菌落的边缘打取直径4mm的菌丝块接种在叶片主叶脉的两侧,每处理3个叶片,每个叶片接种1个菌丝块,以没有接菌的琼脂块作为对照。接种后,用保鲜膜封住塑料盘,置于恒温培养箱中培养(23~25℃)。48h后观察发病情况并拍照,用十字交叉法量取病斑直径大小。数据采用SPSS11.5软件进行方差分析。
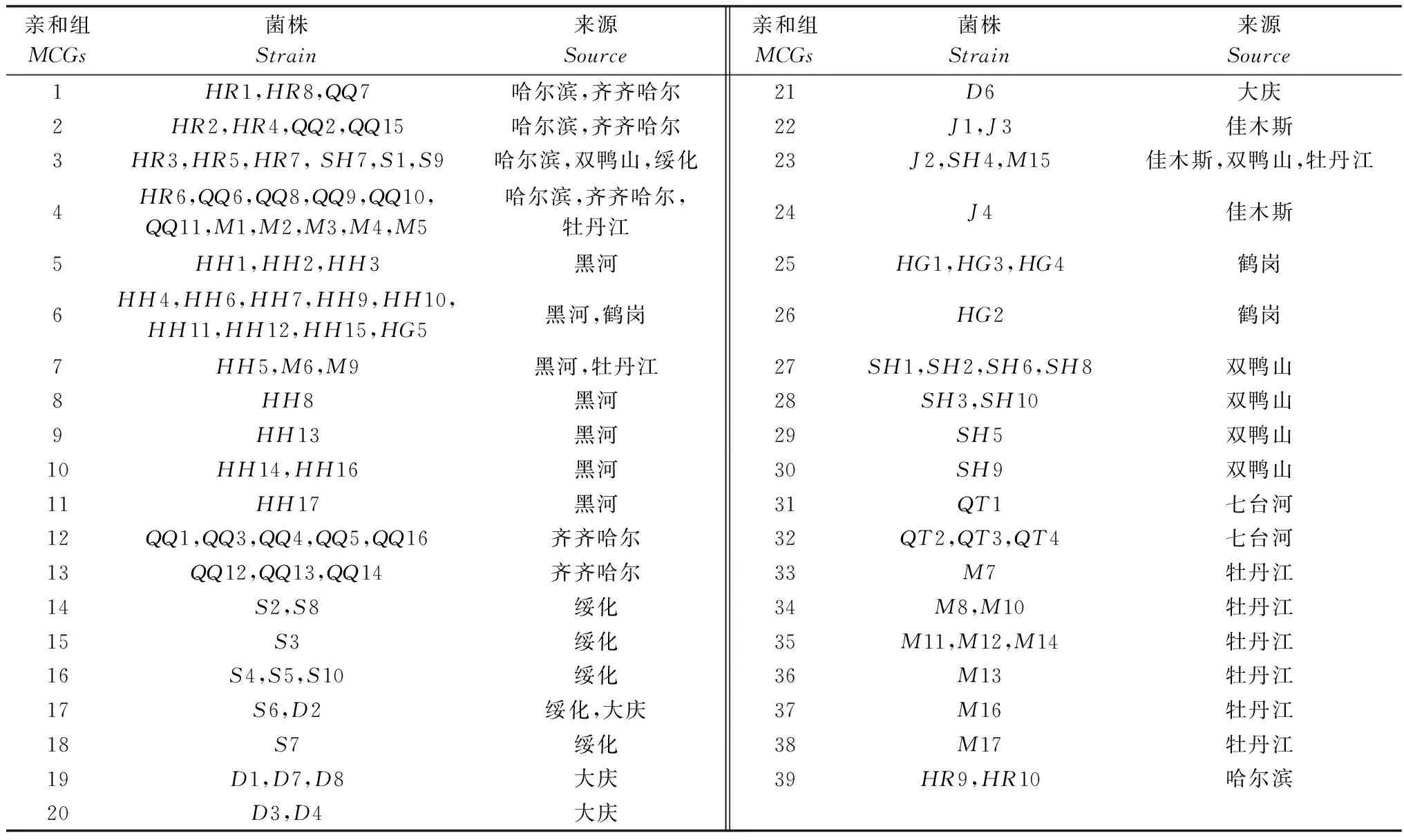
表1 亲和组所含菌株及来源Table 1 Strains in mycelial compatibility groups and its source
1.2核盘菌的不同亲和组菌落生长速率测定
将纯化的菌株接入含50mg/L溴酚蓝(BPB)的PDA平板上,培养2~3d后,于菌落边缘打取7mm的菌碟,转至含50mg/LBPB的PDA平板的中央,接种后的培养皿用封口膜封好,放于恒温培养箱中 23~25℃黑暗培养48h后,测量菌落直径,各菌株重复3次,以确定不同菌落生长速率的差异。
1.3菌株产草酸(OA)能力和pH测定
于菌落边缘打取7mm的菌碟,转至30mLPDB中(含2%葡萄糖和0.4%马铃薯汁),室温静止培养3d。真空抽滤,得到的菌丝体在鼓风干燥箱中干燥至恒重,并测得菌丝体的干重。上清液用于OA和pH(用pH计)的测定。
反应液的配制:0.2mL样品液,0.11mLBPB(1mmol/L),0.198mL硫酸(1mol/L),0.176mL重铬酸钾(100mmol/L),4.8mL蒸馏水。
将混合物放入60℃的水浴锅中,10min后,用0.5mL(1.0mol/L)氢氧化钠溶液终止反应。测定600nm处的吸光值,以PDB溶液作为对照。通过标准曲线计算出OA含量(μg草酸/mg干菌丝)。
2 结果与分析
2.1不同亲和组核盘菌致病力测定结果
利用菌碟贴接离体向日葵叶片,经保湿培养,12h后在叶片上出现明显的水浸状病斑,随保湿时间的延长病斑生长迅速。如表2所示,侵染48h后MCG27(46.2mm)和MCG39(45.1mm)的病斑直径较大;MCG28(37.5mm)和MCG1(34.4mm)的病斑直径居中;而MCG21(10.8mm)和MCG31(9.0mm)的病斑直径较小,不同亲和组间病斑直径的变化范围为9.0~46.2mm,最大差幅达到37.2mm。经过方差分析可知MCG27和MCG39显著高于MCG28,及病斑直径小于MCG28的所有亲和组,极显著高于MCG1,及病斑直径小于MCG1的所有亲和组。另外,通过测定结果可以看出不同亲和组间致病力的差异与菌株的地理来源无关。
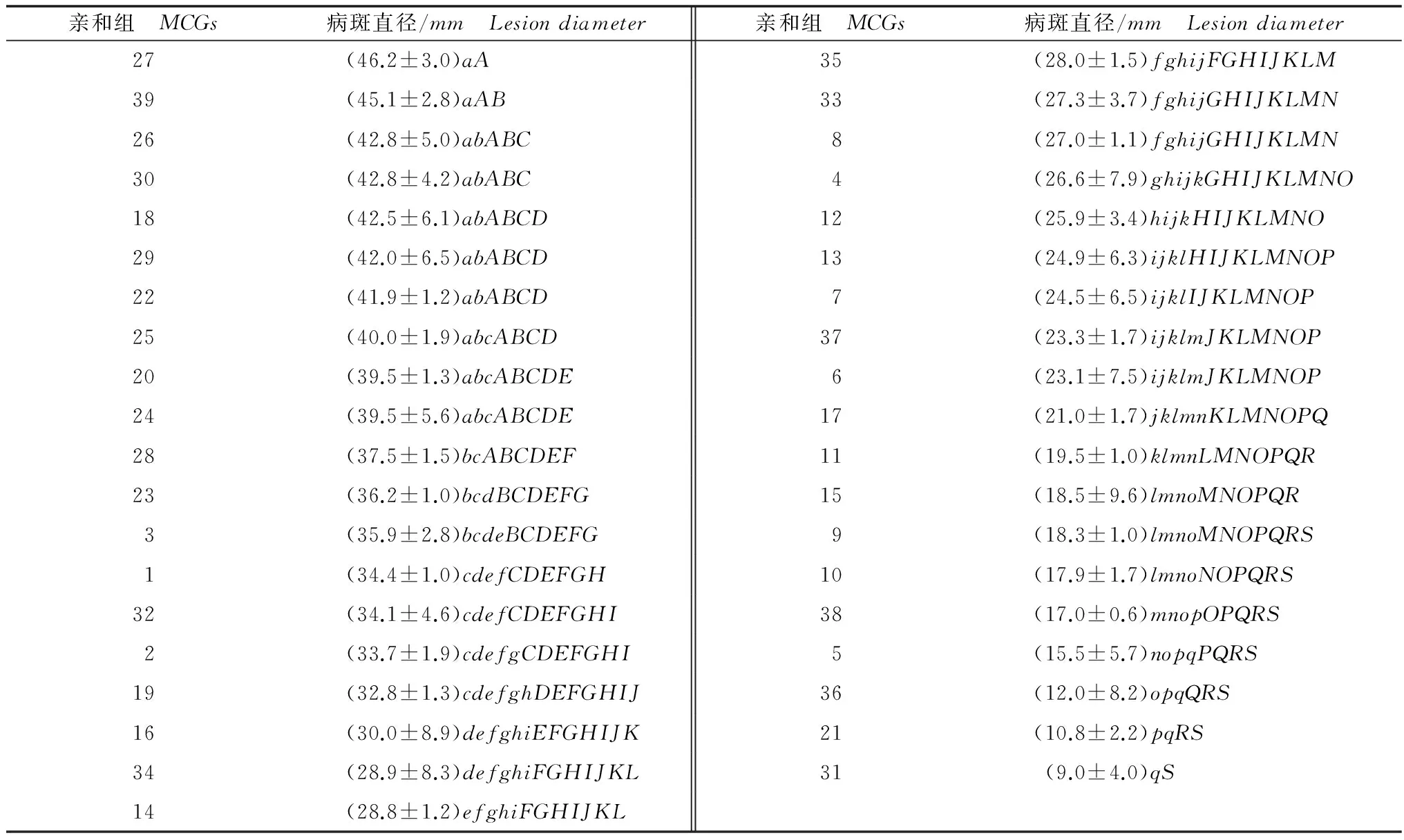
表2 不同亲和组核盘菌菌株在向日葵叶片上产生的病斑直径(48 h)1)Table 2 Lesion diameters produced by different MCGs Sclerotinia sclerotiorumstrains on the sunflower leaves 48 hours after inoculation
1) 同列不同小写英文字母代表在0.05水平有显著差异,不同大写字母代表在0.01水平有极显著差异;下同。Differentlowercaselettersinthesamecolumnindicatesignificantdifferenceat0.05level;differentcapitallettersindicateextremelysignificantdifferenceat0.01level.Thesamebelow.
2.2核盘菌不同亲和组菌落平均生长速率的差异
供试菌株亲和组在PDA(含BPB)培养基上培养后,菌丝均生长迅速,但不同亲和组之间存在较大差异。如表3所示,培养48h后,MCG24(86.6mm)和MCG26(85.7mm)的菌落直径较大;MCG32(74.7mm)和MCG19(71.7mm)的菌落直径居中;而MCG21(22.7mm)和MCG36(23.1mm)的菌落直径较小,不同亲和组群间菌落直径的差别范围是22.7~86.6mm,最大差幅达到63.9mm。经过方差分析可知MCG24和MCG26显著高于MCG32及菌落直径小于其的所有亲和组;极显著高于MCG19及菌落直径小于MCG19的所有亲和组。同时通过测定结果可以看出不同亲和组间菌落生长速率的差异与菌株的地理来源无关。

表3 不同亲和组核盘菌菌株在PDA培养基上培养48 h后菌落平均直径Table 3 Colony diameters of different Sclerotinia sclerotiorum strains of MCGs cultured on PDA for 48 hours
2.3菌株亲和组产草酸(OA)能力和pH
如表4所示,从菌株亲和组间看,MCG31产草酸量最小,为3.84μg/mg干菌丝,MCG39产草酸量最大,为27.56μg/mg干菌丝。亲和组间草酸产生能力差别较大,其中MCG39、MCG30、MCG27、MCG22的产草酸量都超过了20μg/mg干菌丝;MCG36、MCG9、MCG38、MCG31的产草酸量都低于5μg/mg干菌丝。方差分析结果表明各不同亲和组之间存在显著差异。同时,研究发现菌株产生草酸能力的差异不仅出现在亲和组间,也出现在亲和组内。
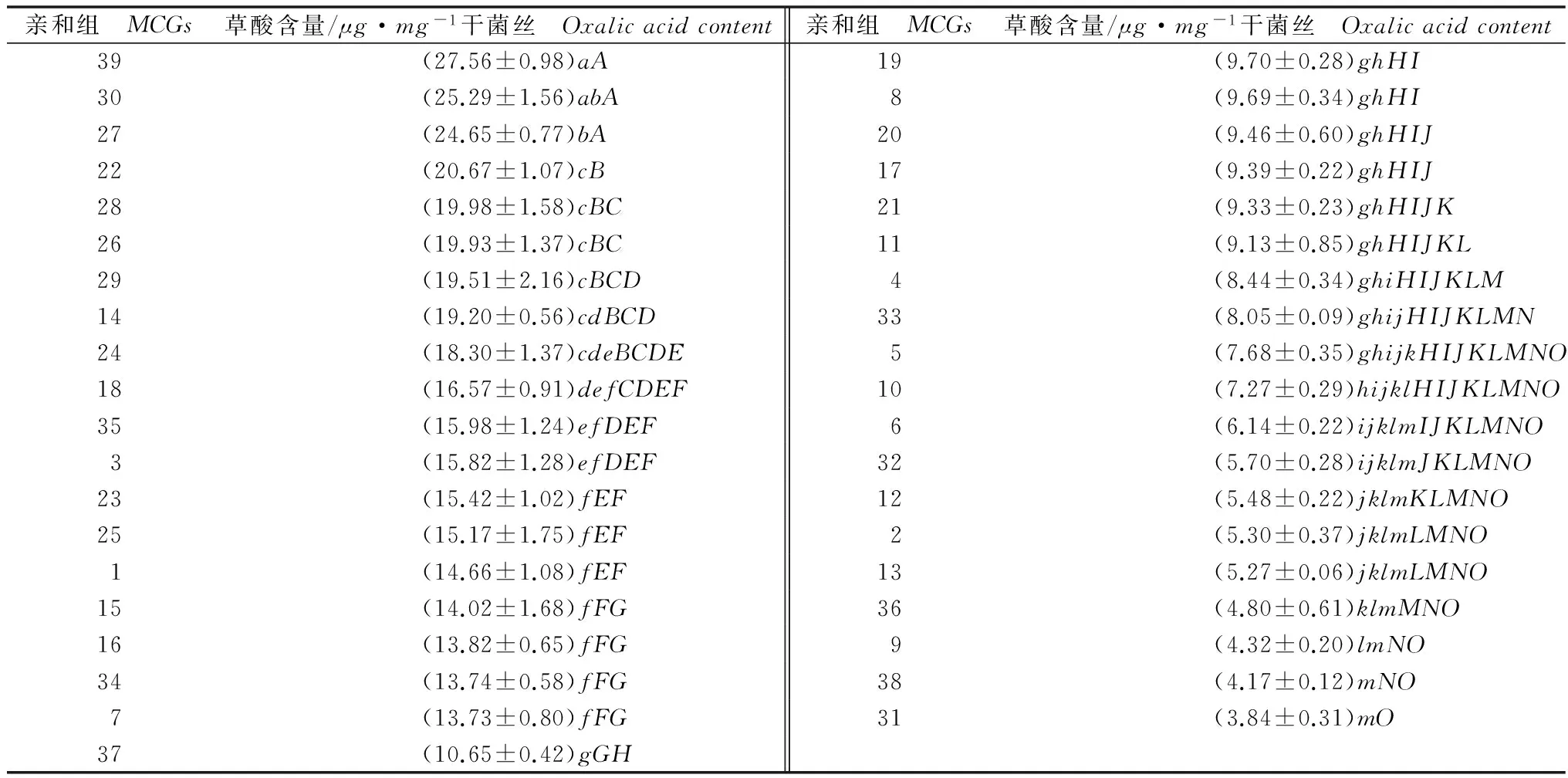
表4 不同亲和组核盘菌菌株在PDB培养液中草酸产量Table 4 Oxalic acids production produced by different Sclerotinia sclerotiorum strains of MCGs in PDB media
菌株在液体培养的过程中除产生草酸外,还可能产生其他未知酸类物质,致使培养液的pH产生很大的变化。由表5可知,接入菌后培养液的pH最小达到了3.64(MCG39),最高为4.83(MCG31),经测定未接入菌碟前原始培养液(CK)的平均pH为5.03。如果利用pH的变化来衡量亲和组间产生的总酸产量时,在不同亲和组间总酸的产量也呈现出显著性差异,方差分析结果表明,MCG31、MCG9、MCG38和MCG10的pH显著高于MCG1及pH小于MCG1的所有亲和组;极显著高于MCG26及pH小于MCG26的所有亲和组。
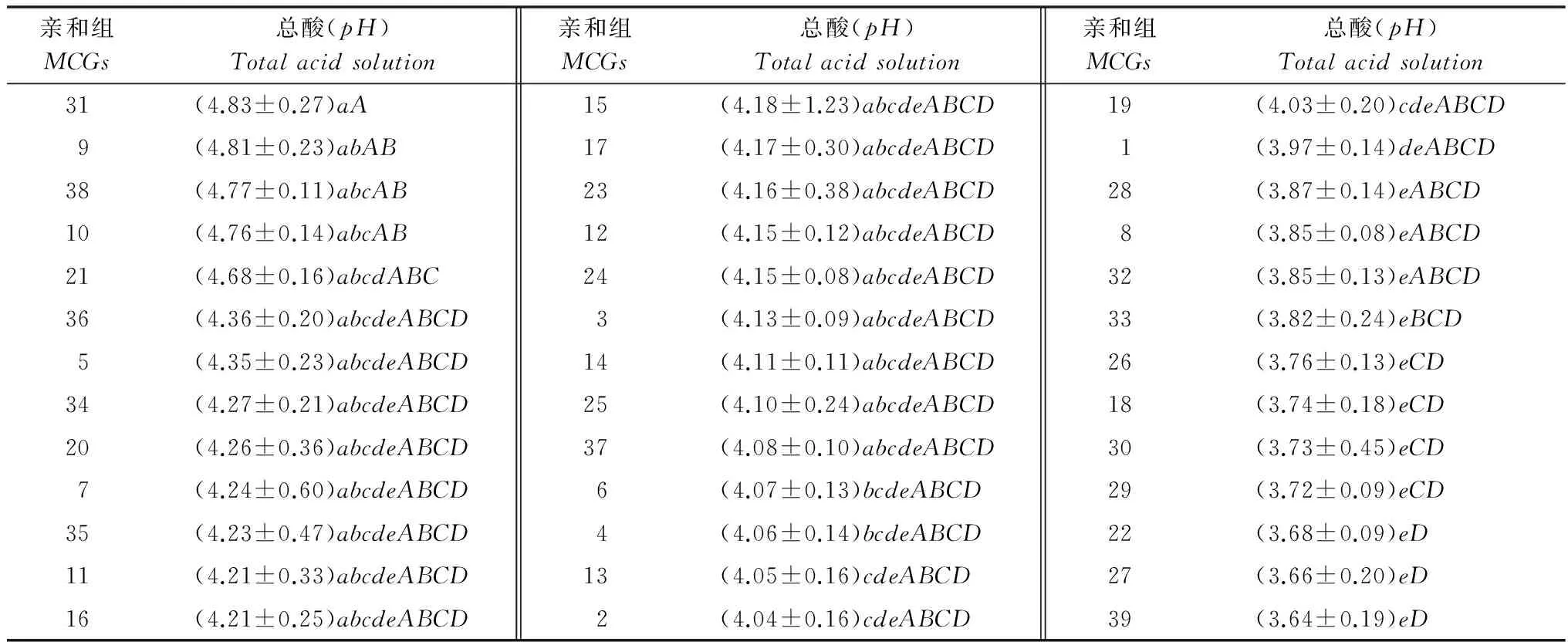
表5 不同亲和组核盘菌菌株在PDB培养液中产生的总酸量Table 5 Total acid production produced by different Sclerotinia sclerotiorum strains of MCGs cultured in PDB media
2.4与致病力有关的3个因子的相关性分析
通过对与致病力有关的菌落生长速率、草酸产量及总酸产量(pH)3个因子进行相关性分析表明,菌株的致病力与草酸产量成正相关(r=0.758,P<0.01);与总酸产量(pH)之间成负相关(r=-0.794,P<0.01);草酸产量与总酸的pH之间呈显著负相关(r=-0.639,P<0.01),证明了 S.sclerotiorum分泌的总有机酸里主要成分是草酸。
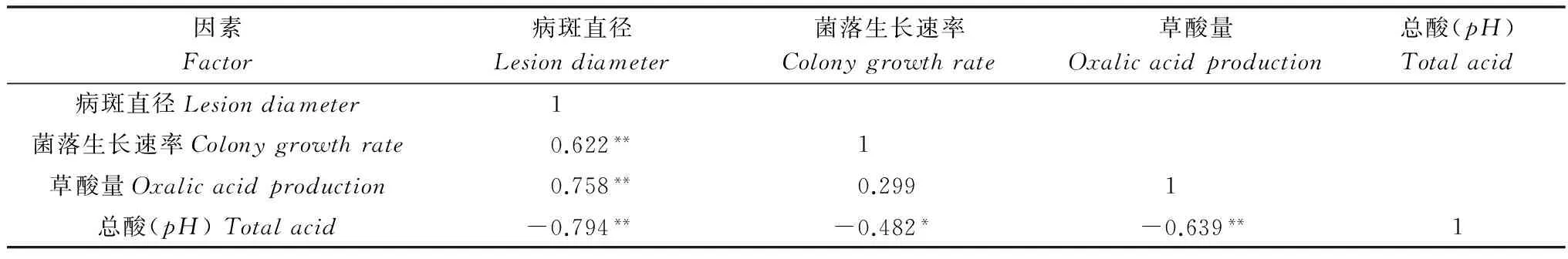
表6 不同菌丝亲和组间病斑直径、菌落生长速率、草酸量、总酸的相关性分析1)Table 6 Correlation analysis among lesion diameter of Sclerotinia sclerotiorum isolates, colony growth rate,oxalic acid production and total acid from different MCGs
1)*代表相关显著性水平P<0.05;**代表相关显著性水平P<0.01。
*: P<0.05;**: P<0.01.
3 结论与讨论
病原物在与寄主共进化的过程中,其致病性也在不断分化,到目前为止,已经发现小麦锈菌、黑粉菌、白粉菌,水稻稻瘟病菌等存在致病性分化,而对于核盘菌种群内有无致病性分化,迄今尚无肯定的结果[10-11]。Anderson等人对阿根廷160个S.sclerotiorum菌株的50 个MCGs在离体芹菜茎接种测定其致病性的研究中发现,菌丝亲和组之间的致病力没有差异[12-13];刘春来对采集于内蒙古和黑龙江省不同地区的20个向日葵核盘菌分离物进行了致病性测定,结果表明不同来源核盘菌菌株间致病性存在着显著差异,且这种致病性分化与菌株来源没有明显的相关性[14],也有学者指出向日葵核盘菌菌株在不同寄主上的致病特异性应该是它与寄主长期相互作用的结果,它们相互作用的时间越长,其特异性可能越明显,同时在同一寄主上的菌株其致病性也存在分化现象[7]。王玉杰对不同亲和组核盘菌致病性与草酸、总酸、多聚半乳糖醛酸酶及菌落生长速率进行相关性分析,结果表明菌株致病力与草酸、多聚半乳糖醛酸酶成正相关,与总酸的pH成负相关,而与菌落生长速率无关[15]。
本文对采自黑龙江省10个地区29个市县5种寄主的100个菌株(39个亲和组)进行了比较研究,亲和组间菌落的生长速率达到了显著性差异,同时发现来源于同一地区间、不同地区间及亲和组内的菌株菌落生长速率的差异很大,说明菌株的生长速度呈现出多样性,并与地理来源无关,亲和组间致病力的差异未发现与菌株的地理来源有关。通过相关性分析表明,菌株的致病力与草酸产量呈正相关,与总酸产量(pH)之间呈负相关,与菌落的生长速率无关;草酸产量与总酸的pH之间呈显著负相关。
[1]BolandGJ,HallR.IndexofplanthostofSclerotinia sclerotiorum [J].CanadianJournalofPlantPathology,1994,16:93-108.
[2]黄绪堂. 向日葵抗菌核病育种研究现状[J]. 中国油料, 1993(2): 78-80.
[3]PartykaRE,MaiWF.EffectsofenvironmentandsomechemicalsonSclerotinia sclerotioruminlaboratoryandpotatofield[J].Phytopathology, 1962, 52(8):766-770.
[4]TuJC.Integrateddiseasecontrolofwhitemold(Sclerotinia sclerotiorum)innavybean(Phaseolus vulgaris) [J].MededelingenvandeFaculteitLandbouwwetenschappen,RijksuniversiteitGent, 1986, 51: 731-740.
[5]黄绪堂.向日葵菌核病抗性的遗传机制与育种研究进展[J].黑龙江农业科学, 1999(2):45-46.
[6]李国庆,王道本,黄鸿章,等.来源于佳木斯茄子上的核盘菌菌株多样性的研究[J].植物病理学报,1996,26(3):237-242.
[7]李建厂, 李永红, 陈文杰, 等. 向日葵核盘菌菌株致病性研究及其温度效应[J]. 西北农业学报, 2003, 12(1): 114-117.
[8]李永红,王灏,李建厂,等.核盘菌对油菜、向日葵和大豆的侵染及其致病性分化研究[J].植物病理学报,2005,35(6):486-492.
[9]刘勇, 刘红雨, 曾正宜. 油菜菌核病菌系致病性研究[J]. 中国油料作物学报, 2001, 23(3): 54-56.
[10]李振歧.植物免疫学[M].北京:中国农业出版社,1995:22-31.
[11]刘晓红,周航,姬红丽,等.四川蔬菜核盘菌种群结构初步研究[J].西南农业学报,2004,17(5):618-623.
[12]AndersonFN,SteadmanJR,CoyneDP,etal.TolerancetowhitemoldinPhaseolus vulgarisdryediblebeantypes[J].PlantDiseaseReport, 1974, 58(9): 782-784.
[13]Gracia-GarzaJA,NeumannS,VynTJ,etal.InfluenceofcroprotationandtillageonproductionofapotheciabySclerotinia sclerotiorum[J].CanadianJournalofPlantPathology, 2002, 24(2): 137-143.
[14]刘春来, 刘兴龙, 王爽, 等. 不同来源向日葵菌核病分离物致病性分化研究[J].黑龙江农业科学, 2013(4): 37-40.
[15]王玉杰. 向日葵菌核病病原菌遗传多样性及致病力分化的研究[D].呼和浩特:内蒙古农业大学, 2011.
(责任编辑:杨明丽)
DifferentiationinpathogenicityofSclerotinia sclerotiorum
onsunflowerinHeilongjiangProvince
LiuJia1,2,ZhangYunhua2,MengQinglin2,ShiFengmei2,MaLigong2,LiYichu2,LiuChunlai2,ZuoYuhu1
Thepathogenicity,colonygrowthrate,oxalicacidproductionandtotalacid(pH)of100sunflowerSclerotinia sclerotiorumstrainsbelongto39mycelialcompatibilitygroupsfromdifferentregionsofHeilongjiangProvinceweremeasured.Thecorrelationbetweenpathogenicityandcolonygrowthrate,oxalicacidproduction,totalacid(pH)wereanalyzed.Theresultsshowedthatlesiondiameterofsunflowerleavesafterinoculationhadapositivecorrelationwithoxalicacid(r=0.758, P<0.01),buthadanegativecorrelationwiththetotalacid(pH)value(r=-0.794, P<0.01).Oxalicacidproductionalsowasnegativelycorrelatedtothetotalacid(pH)value(r=-0.639, P<0.01).
Sclerotinia sclerotiorum;pathogenicity;sunflower;correlation
2014-11-17
2014-12-22
国家现代农业(向日葵)产业技术体系(CARS-16)
E-mail:zuoyhu@163.com
S435.655
ADOI:10.3969/j.issn.0529-1542.2016.01.021

