芝麻枯萎病菌毒素成分分析及其对芝麻幼苗的毒性
朱强宾, 张海洋, 段迎辉, 常淑娴, 魏利斌, 李 春, 苗红梅*
(1. 南京农业大学作物遗传与种质创新国家重点实验室, 南京 210095;2. 河南省农业科学院芝麻研究中心, 郑州 450002)
研究报告
芝麻枯萎病菌毒素成分分析及其对芝麻幼苗的毒性
朱强宾1,张海洋2,段迎辉2,常淑娴2,魏利斌2,李春2,苗红梅2*
(1. 南京农业大学作物遗传与种质创新国家重点实验室, 南京210095;2. 河南省农业科学院芝麻研究中心, 郑州450002)
芝麻枯萎病(sesameFusariumwilt, SFW)是由尖孢镰刀菌芝麻专化型[FusariumoxysporumSchl. f.sp.sesami(Zap.),FOS]引起的一种土传真菌病害,严重影响着我国芝麻生产。为确定FOS是否产生毒素以及毒素成分,利用液相色谱和液质联用等技术分离并分析了FOS菌株培养滤液的主要组成物质。研究发现FOS能够产生4种特异物质,分别为镰刀菌酸(5-丁基吡啶甲酸,FA),及C10H13NO4(FA+O2)、C10H13NO3(FA+O)和C10H11NO2(FA-H2)3种镰刀菌酸类似物。在Richard培养基上强致病力和弱致病力FOS菌株均可获得毒素,不同致病力的菌株所产生 4种物质的含量和比例存在差异。芝麻幼苗生长试验结果证明含有上述特异物质的FOS培养滤液能够对幼苗生长产生抑制作用;而随着FOS毒素浓度的增大,芝麻幼苗受毒害程度增大。但在含相同FA浓度的FOS培养滤液处理下,不同芝麻品种幼苗生长受抑制程度无显著差异。该结果为进一步研究FOS致病机理及芝麻-FOS互作奠定了技术和理论基础。
芝麻枯萎病;毒素;镰刀菌酸;液相色谱;液质联用
芝麻(SesamumindicumLinn.,2n=26)属胡麻科胡麻属,是世界上最古老的优质油料作物,也是我国重要的特色油料作物。芝麻枯萎病(sesameFusariumwilt)由尖孢镰刀菌芝麻专化型(Fusariumoxysporumf.sp.sesami,FOS)侵染引起,与茎点枯病并称为芝麻两大主要真菌病害[1]。芝麻枯萎病在中国、印度、苏丹、埃及、巴基斯坦等芝麻生产国发生普遍[2-5]。我国芝麻枯萎病害主要发生在东北、华北、西北、黄淮以及江淮部分地区,常年发生率在15%左右,严重影响芝麻产量和品质。为探明芝麻枯萎病菌致病机理,国内外先后开展了枯萎病菌分离、鉴定以及病原菌致病力鉴定方法等研究[2, 6-7]。2009年以来,我国采用人工单一枯萎病圃率先开展了芝麻枯萎病抗性鉴定与评价以及抗病分子标记筛选研究(数据未公开发表);仇存璞等首次建立了芝麻枯萎病菌致病力室内鉴定技术体系,为芝麻FOS致病以及芝麻抗枯萎病机理研究提供了技术支撑[2]。已有研究结果显示,尖孢镰刀菌在侵入植株组织后多能产生毒素,并对植株造成毒害作用[8-11]。2006年台莲梅等利用尖孢镰刀菌毒素滤液评价了不同大豆品种对根腐病的抗病性,并将该方法用于大豆抗病植株的初筛工作[12]。近期初步研究表明,芝麻枯萎病菌FOS同其他尖孢镰刀菌相似,侵染芝麻后,菌丝体逐渐堵塞维管束,切断水分及营养物质供应,从而导致植株发病。同时,FOS能够产生果胶酶、纤维素酶等水解酶,对芝麻植株起到侵染作用(河南省农业科学院科研档案记载)。但至今人们尚未明确芝麻枯萎病菌是否能够产生毒素,亦未见有关FOS毒素成分及其对芝麻毒害症状的公开报道。为此,本文开展了芝麻枯萎病菌FOS毒素主要成分研究,并分析了FOS菌液对芝麻幼苗的毒害特征,为下一步开展FOS致病机理及芝麻-FOS互作研究奠定技术和理论基础。
1 材料与方法
1.1材料
尖孢镰刀菌芝麻专化型强致病力菌株HSFO09100和弱致病力菌株HSFO07021(表1)由河南省农业科学院芝麻研究中心植物病理室分离并保存。
用于FOS毒素毒性检测的芝麻品种‘豫芝11号’、‘郑芝98N09’、‘荣县黑芝麻’和‘冀9014’的种子由河南省农业科学院芝麻研究中心种质资源库提供。
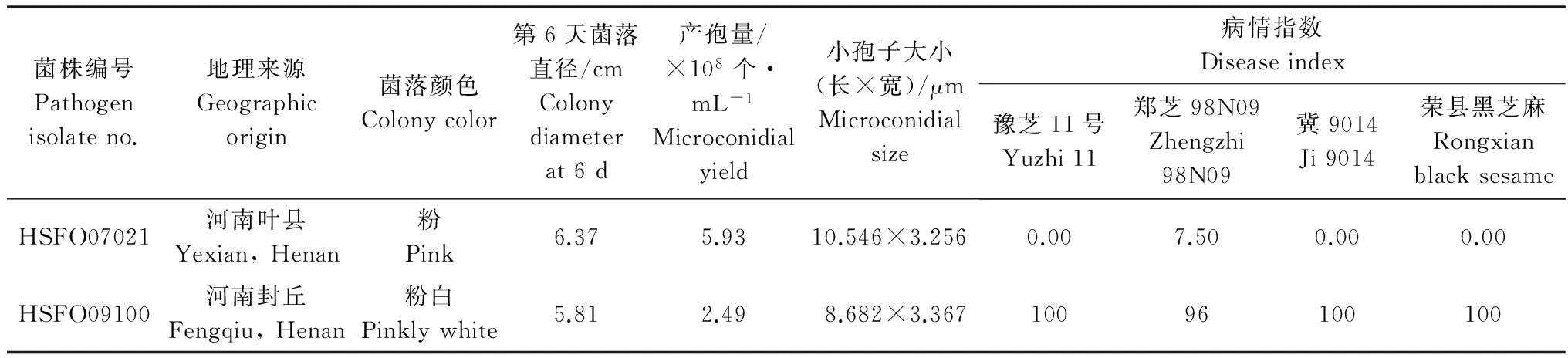
表1 所用尖孢镰刀菌芝麻专化型菌株特征特性1)
1) 菌株HSFO07021及HSFO09100由河南省农业科学院芝麻研究中心病理室分离保存。菌株均使用PDA培养基同等条件下培养并完成特征特性观察。菌株致病力评价参照仇存璞等[2]的方法进行。
The two FOS isolates HSFO07021 and HSFO09100 are collected and conserved by Laboratory of Sesame Pathology, Henan Sesame Research Center, China. The pathogens are cultured on PDA medium and the characters are recorded. The pathogenic level of the two FOS isolates is measured according to the method of Qiu et al[2].
1.2FOS培养滤液的制备
挑取HSFO09100和HSFO07021菌株(-70℃保藏)的少量菌丝,于28℃下,在PDA平板上培养7 d。用无菌打孔器在菌落边缘打出直径为8 mm的菌片3~5个,接入装有Richard培养液的三角瓶内,28℃、120 r/min下振荡培养20 d。用灭菌纱网过滤去除大部分菌丝后,用0.22 μm滤膜滤除残留菌丝和孢子,滤液用于FOS毒素分析和毒性检测。
1.3FOS毒素成分分析
选用Agilent 1100液相色谱仪和AichromBond-AQ C18(4.6 mm×250 mm,5μm)色谱柱对1.2制备的FOS菌株滤液进行毒素成分分析和分离。以Richard培养液作为空白对照。流动相为A(乙酸水溶液,pH=3)和B(乙腈);进样量为25 μL;梯度洗脱程序:① 0~5 min,A为95%,B为5%;② 5~22 min,A为95%~68%,B为5%~32%;③ 22~25 min,A为68%~95%,B为32%~5%;流速为1.0 mL/min,柱温30℃,检测波长为270 nm。记录菌液色谱图特异峰;将各收集液旋转蒸发浓缩,即得到较纯的FOS毒素溶液。
1.4FOS毒素主要成分的LC-ESI-MS图谱鉴定与结构分析
使用液质联用质谱仪(UPLC-QTOF,xEVO G2,美国)对分离纯化的特异峰物质进行分析。液相条件同上。质谱测试条件:离子源为电喷雾ESI,正离子扫描;喷雾电压1 600 V,离子源温度120℃,离子进料毛细管温度350℃;鞘气30 L/min;辅助气10 L/min。分辨率为70 000;扫描范围为150~1 800 M/Z。根据FOS提取物中各推测物质的分子式,通过仪器自动搜索分析,推测确定活性物质的结构信息[5]。
1.5镰刀菌酸标准曲线制作及含量检测
以超纯水为溶剂,选用镰刀菌酸(FA)标准品(Sigma,美国)配制60、150、300、500、800和1 200 μg/mL梯度标样溶液,每个浓度重复3次。以峰面积为x坐标,FA质量浓度为y坐标,建立FA标准曲线。选用Agilent 1260型高效液相色谱仪确定测试FOS滤液的FA含量。液相色谱使用条件同上。
1.6FOS培养液对芝麻幼苗的毒性评价
采用1.2方法,以Richard培养液培养并获得HSFO09100和HSFO07021菌株过滤液,将适量菌株滤液加入MS培养液,使MS培养液中的镰刀菌酸浓度分别为1、5和10 μg/mL,然后在每1 L MS培养液中加入5 g琼脂粉,121℃高压灭菌后冷却待用;以无菌水和加入新鲜Richard培养液的MS固体培养基为空白对照。
挑选饱满健康的‘豫芝11号’、‘荣县黑芝麻’、‘郑芝98N09’和‘冀9014’种子各500粒,清水冲洗种子表面3~5遍。将种子浸泡于75%乙醇30 s,无菌水冲洗3遍;随后用3%次氯酸钠浸泡10 min,无菌水冲洗种子3~4遍;将消毒后的种子放入装有10 mL无菌水的三角瓶中振荡培养2 h。挑选露白的芝麻种子,分别接种在上述MS固体培养基上,25℃、L∥D=14 h∥10 h下培养。每个处理设3个重复,每个重复接种10粒种子,2周后测量芝麻幼苗鲜重、根长、苗高,并拍照记录。
2 结果与分析
2.1尖孢镰刀菌芝麻专化型菌株培养液分析
先前研究结果表明,多个尖孢镰刀菌种在侵入植物组织后均可产生毒素,并对植株造成毒害作用[8-11]。为明确尖孢镰刀菌芝麻专化型是否产生毒素以及毒素成分,我们首先选用Richard液体培养基培养强致病力菌株HSFO09100和弱致病力菌株HSFO07021,20 d后将2份培养液中的孢子和菌丝等活体滤除,对滤液分别进行Agilent 1100液相色谱分析,以新鲜液体培养基作空白对照(图1)。菌液液相色谱比对结果显示,与空白培养液相比,HSFO09100和HSFO07021的菌株滤液色谱均存在4个明显的特异峰(图1a~b)。弱致病力菌株HSFO07021中4个特异峰位置分别为保留时间4.35 min(Ⅰ)、9.06 min(Ⅱ)、17.45 min(Ⅲ)和20.78 min(Ⅳ)(图1a);强致病力菌株HSFO09100中的4个特异峰位置分别为4.31 min(Ⅰ)、9.13 min(Ⅱ)、17.50 min(Ⅲ)和20.65 min(Ⅳ)(图1b)。a~d各特异峰在两个菌株滤液中出现的时间极其接近。
图1 FOS菌株Richard培养滤液液相色谱分析Fig.1 HPLC chromatogram analysis of the filtered FOS suspension cultured in Richard solution
进一步比较两个FOS菌株去孢子滤液的液相色谱图,可以看出,4个峰物质的面积存在差异(表2)。在弱致病力菌株HSFO07021中,保留时间为9.06 min(Ⅰ)、17.45 min(Ⅲ)和20.78 min(Ⅳ)的峰面积大于保留时间4.35 min(Ⅰ)的峰面积值,保留时间20.78 min(Ⅳ)的峰面积最大;在强致病力菌株HSFO09100中,保留时间20.65 min(Ⅳ)的峰面积最大,显著大于其他3个特异峰面积。此外,比较两个菌株滤液中4个特异峰的峰面积发现(表2),菌株HSFO07021中特异峰Ⅰ~Ⅲ的峰面积均大于菌株HSFO09100,而HSFO07021中特异峰Ⅳ的峰面积(7 913 mAU·s)则小于菌株HSFO09100(28 386 mAU·s),峰面积比率为1∶3.59。随后依据该物质标准曲线,初步确定特异峰物质Ⅳ在HSFO07021滤液中的实际含量为569 μg/g,在HSFO09100中的实际含量为1 927 μg/g。上述结果表明,在同一培养条件下,不同致病力FOS菌株所产生4种特异物质的量有明显差异。

表2 FOS菌株Richard培养滤液中特异峰Ⅰ~Ⅳ的峰面积
2.2尖孢镰刀菌芝麻专化型菌毒素成分
为分析特异峰物质结构,利用Agilent 1100分别收集了上述FOS滤液中的Ⅰ~Ⅳ特异峰物质,浓缩后进行LC-ESI-MS分析(图2)。在HSFO07021菌株滤液分析结果中,4个特异峰(Ⅰ~Ⅳ)对应的4种物质分子离子峰m/z分别为212.092 3、196.097 3、178.087 0和180.102 4,分子量较为接近;且在HSFO09100菌株滤液中各特异物质分子离子峰出现的时间与菌株HSFO07021中保持一致。

图2 HSFO07021菌株Richard培养滤液Ⅰ~Ⅳ特异峰物质的质谱分析Fig.2 Mass spectrometry analysis of the four isolated components in the filtered Richard culture solution of HSFO07021 strain
推测分析显示,在HSFO07021菌株产生的4种峰物质中,保留时间为20.78 min的Ⅳ峰物质分子量为180.102 4,与镰刀菌酸(fusaric acid, FA)的分子量大小一致;推测其分子式为C10H13NO2,结构式为5-丁基吡啶甲酸。为进一步判定Ⅳ峰物质是否为镰刀菌酸,我们选用FA标准品(Sigma)水溶液为对照,对HSFO07021和HSFO09100菌株滤液进行了液相色谱比对。分析发现,FA标准品的特异峰值出现在20.5 min,与两个菌株滤液的Ⅳ特异峰的误差小于±5%,保留时间较为一致(图略)。
我们进一步分析了Ⅰ~Ⅲ 3个主要特异峰物质的LC-ESI-MS图谱,并计算了各物质的分子量(表3)。从表中可以看出,Ⅰ~Ⅲ峰物质与FA均具有相似解离基团,与FA的结构差异在于增加1~2个O原子或者减少2个H原子,物质分子式分别为C10H13NO4(FA+O2)、C10H13NO3(FA+O)、C10H11NO2(FA-H2)和C10H13NO2(FA)。4种物质的质量测定值和理论质荷比数据极为接近,差异在0~0.000 5。由此,我们确定FOS菌株能够产生镰刀菌酸FA及多种镰刀菌酸类似物,这些物质统称为FOS毒素。

表3 HSFO07021菌株培养滤液中4个主要峰物质的HPLC-ESI-MS检测
2.3FOS毒素对芝麻幼苗的毒性分析
为评价FOS菌株产生的FA和FA类似物对芝麻的毒害作用,分别用含有1、5和10 μg/mL FA的HSFO07021和HSFO09100菌株滤液处理萌发的‘豫芝11号’、‘郑芝98N09’、‘荣县黑芝麻’和‘冀9014’种子,2周后调查统计幼苗生长情况(图3,表4)。
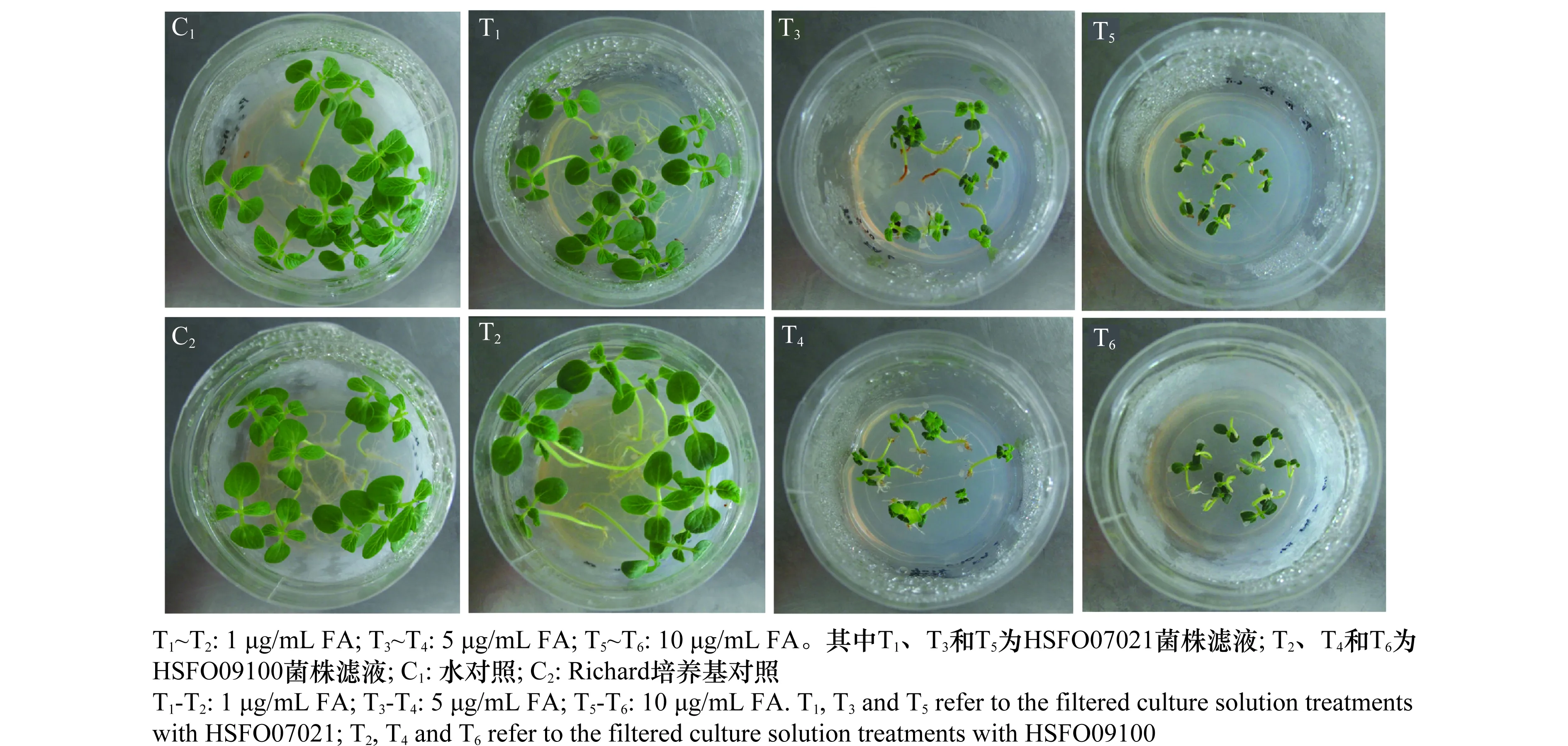
图3 不同FOS菌株滤液及浓度对‘豫芝11号’芝麻幼苗生长的影响Fig.3 Growth inhibition effects of the filtered culture solutions of different FOS strains with various FA concentrations on sesame seedlings of ‘Yuzhi 11’ variety
结果显示,当FOS滤液中FA含量为1~10 μg/mL时,处理2周后芝麻幼苗无死亡现象。菌液对芝麻幼苗的抑制作用主要表现为子叶和真叶展开缓慢,叶片小而卷曲,茎秆细短,生根缓慢;部分处理表现根部红褐(图3,T3~T4)。从表4中可以看出,当菌株滤液中FA的浓度为1 μg/mL时,芝麻幼苗的生长受抑制程度不明显或不受抑制;而当菌株滤液中FA的浓度为5~10 μg/mL时,芝麻幼苗的生长则受到不同程度的抑制;且随着菌液中FA含量的增大,幼苗生长受抑制明显。其中,当HSFO09100滤液中的FA含量由1 μg/mL增加到10 μg/mL时,‘豫芝11号’鲜重由0.197 g降为0.038 g,根长由12.2 cm降为0.2 cm,苗高由8.6 cm降为2.0 cm,差异显著。

表4 FOS菌株去孢子滤液对芝麻幼苗生长的抑制1)
1) 表中数据为平均值±标准误。同列数据后不同的小写字母表示经Duncan’s方差分析,在P=0.05水平上差异显著。
Data in the table are mean±SE.The data followed by different lowercase letters indicate significant difference atP=0.05 level.
进一步比较上述HSFO07021和HSFO09100菌株的Richard培养滤液对4个芝麻品种的作用,可以发现在同等FA浓度处理下,除个别指标有显著差异外,4个芝麻品种幼苗生长的受抑程度相似。利用含有5 μg/mL FA的HSFO09100滤液处理4个芝麻品种,植株鲜重变化范围为0.053~0.067 g,苗高变化范围为2.9~3.8 cm,处理间差异不明显。
3 讨论
3.1FOS毒素成分分析
尖孢镰刀菌(F.oxysporum)是侵染经济作物的一类主要病原菌[10],其产生的镰刀菌酸,可对植株造成毒害作用。台莲梅等曾使用活性炭法较好地提取了尖孢镰刀菌毒素[8]。芝麻枯萎病由尖孢镰刀菌芝麻专化型(FOS)侵染引起,至今未见有关FOS毒素成分分析及其对芝麻毒害作用的报道。在真菌毒素研究中,人们多采用液相色谱和液质联用技术分离、纯化真菌毒素。采用GC-MS技术可以检测到谷物、谷类食品、饲料、猪排泄物中的T-2毒素[13]。李赤等利用液相色谱、气相色谱仪和质谱等技术从香蕉枯萎病菌毒素里分离出了7种活性成分[14]。本试验利用液相色谱和液质联用技术成功分析了FOS产生的4种特异物质,分别为镰刀菌酸(5-丁基吡啶甲酸,FA)和其他3个类似物(C10H13NO4(FA+O2)、C10H13NO3(FA+O)、C10H11NO2(FA-H2))。镰刀菌酸是一种常见镰刀菌属毒素,最早由Yabuta等从异孢镰孢(FusariumheterosporumNees)中分离得到[15]。本研究结果进一步证实FOS病菌能够产生镰刀菌酸和3种FA类似物,这些物质对芝麻生长有毒害作用。随着镰刀菌酸(1~10 μg/mL)的增加,FOS培养滤液对芝麻幼苗生长的抑制和毒害作用加大,表明芝麻枯萎病菌FOS能够产生有毒害作用的毒素。此外,我们进一步分析了不同培养液条件下强致病力菌株HSFO09100和弱致病力菌株HSFO07021产生的毒素种类。结果显示强、弱致病力FOS菌株在Czapek、Richard和低碳Richard等培养基中均能够产生FA以及FA+O2、FA+O和FA-H2等3种FA类似物(数据未公开)。上述研究结果为深入开展芝麻枯萎病菌致病机理及生物防控技术研究提供了目标靶向。
3.2FOS毒素作用与菌株致病性的关系
大量研究表明真菌毒素在病害发生、发展过程中起着重要作用。毒素能够抑制寄主的生长,破坏寄主细胞质膜、细胞器等结构,对植株光合作用、核酸代谢、蛋白合成等功能造成影响。吴洪生等研究证明了镰刀菌酸能够严重损坏叶细胞,且随着毒素处理时间的延长和毒素浓度的增加,细胞受到的伤害更快、更重[16]。郭新梅等研究表明毒素浓度越大,品种(系)的膜透性增加,毒素对细胞膜的伤害愈严重[17]。但有研究认为镰刀菌毒素在低浓度时具有类激素活性效应,高浓度时则表现为毒害作用[9]。Seong选用5个棉花枯萎病菌株的培养液滤液处理芝麻种子,发现低浓度滤液对芝麻种子萌发和幼苗生长有促进作用,高浓度滤液对芝麻萌发和生长有抑制作用[9]。本研究结果显示,弱致病力菌株HSFO07021和强致病力菌株HSFO09100均可产生镰刀菌酸及其类似物;当菌株滤液中的FA浓度为1~10 μg/mL时,菌株滤液对4个芝麻品种的幼苗生长造成了显著性抑制作用。幼苗表现为真叶发育、植株高度均受影响;植株生长受抑程度与菌液中的FA浓度呈正相关。
毒素在病原菌致病过程发挥着重要作用,但人们在病原菌毒素产量与其致病力关系方面的研究结果不尽相同。蒋荷等[11]研究认为黄瓜种传尖孢镰刀菌的毒素产量与菌株是否具有致病性并不一定相关;另有部分研究认为菌株粗毒素产量、毒性与致病力强弱正相关[18-19]。在先前的芝麻枯萎病菌致病性研究中,我们发现HSFO09100在‘豫芝11号’、‘郑芝98N09’、‘荣县黑芝麻’和‘冀9014’中均表现出强致病性的特征,而HSFO07021在上述4个品种中均表现为弱致病性。本研究中,我们对HSFO07021和HSFO09100的毒素成分和毒害作用进行了比较分析。虽然HSFO07021和HSFO09100产生的毒素种类相同,但不同毒素物质的含量和比例存在明显差异。与HSFO07021相比, 在菌株HSFO09100的Richard培养液中以镰刀菌酸为主,其他3个FA类似物含量较少。用镰刀菌酸浓度相同的2个菌株滤液处理芝麻时,其毒害作用无显著差异。该结果或许表明FOS菌株的致病力强弱与产毒能力有一定关系。此外,研究中我们发现,在Czapek、Richard、低碳Richard等不同培养条件下,同一菌株产生的毒素数量也有差异(数据未公开)。下一步我们将研究芝麻枯萎病菌产毒条件和调控,探明不同FOS菌株产毒能力与致病力强弱的内在关系。
[1]Verma M L, Mehta N, Sangwan M S.Fungal and bacterial diseases of sesame [M]∥Saharan G S, Mehta N, Sangwan M S.Diseases of oilseed crops. New Deli: B.B.N Printers, 2005: 269-303.
[2]仇存璞, 张海洋, 常淑娴, 等. 芝麻枯萎病病原菌致病力室内鉴定方法[J]. 植物病理学报, 2014, 44(1): 26-35.
[3]Cho E K, Choi S H.Etiology of half stem rot in sesame caused byFusariumoxysporum[J]. Korean Journal of Plant Protection, 1987, 26(1): 25-30.
[4]El-Shakhess S A M, Khalifa M M A.Combining ability and heterosis for yield, yield components, charcoal-rot andFusariumwilt disease in sesame [J]. Egyptian Journal of Plant Breeding, 2007, 11(1): 351-371.
[5]Fallahpori A, Aminian H, Hosseini S A E.Evaluation of peroxidase activity in two resistant and susceptible sesame germplasms toFusariumdamping-off caused byFusariumoxysporumf.sp.sesami[J]. Iranian Journal of Plant Pathology, 2013, 49(1): 113-118.
[6]苏银玲, 苗红梅, 魏利斌, 等. 芝麻枯萎病病原菌分离和纯化方法研究[J]. 河南农业科学, 2012, 41(1): 92-95.
[7]黎冬华, 王林海, 张艳欣, 等. 中国芝麻主产区枯萎病病原菌生物学特性分析[J]. 中国农学通报, 2012, 28(3): 245-252.
[8]台莲梅, 许艳丽, 高凤昌. 尖孢镰刀菌毒素的初步研究[J]. 黑龙江八一农垦大学学报, 2004, 16(4): 9-12.
[9]Seong P J.Studies on the effects of culture-filtrates of sesame-wilt organism (Fusariumoxysporumf.vasinfectum) on the germination of sesame seeds and the growth of sesame seedlings [J]. Korean Journal of Applied Entomology, 1962, 1: 3-10.
[10]陆家云. 病原植物真菌学[M]. 北京: 中国农业出版社, 2001:360-440.
[11]蒋荷, 郑慧慧, 曹莎,等. 黄瓜种传镰刀菌粗毒素检测及其致害作用[J]. 中国农业大学学报, 2013, 18(3): 101-107.
[12]台莲梅, 许艳丽, 闫凤云. 应用尖孢镰刀菌毒素滤液鉴定大豆品种抗病性初探[J]. 植物保护, 2006, 32(3): 49-52.
[13]Schollenberger M, Lauber U, Jara H T, et al. Determination of eight trichothecenes by gas chromatography-mass spectrometry after sample clean-up by a two-stage solid-phase extraction[J]. Journal of Chromatography A, 1998, 815(1): 123-132.
[14]李赤, 黎永坚, 于莉, 等. 香蕉枯萎病菌毒素的成分分析及其生物测定[J]. 果树学报, 2010, 27(6): 969-974.
[15]Yabuta L, Kambe K, Hayashi T.Biochemistry of the bakanae-fungus, I. Fusaric acid, a new product of the bakanae-fungus [J]. Journal of Agricultural Chemistry, 1934, 10: 1059-1068.
[16]吴洪生, 尹晓明, 刘东阳, 等. 镰刀菌酸毒素对西瓜幼苗根细胞跨膜电位及叶细胞有关抗逆酶的抑制[J]. 中国农业科学, 2008, 41(9): 2641-2650.
[17]郭新梅, 陈耀锋, 任慧莉, 等. 禾谷镰刀菌毒素对小麦花药培养特性的影响研究[J]. 西北农林科技大学学报, 2003, 31(5): 5-8.
[18]张华东. 立枯丝核菌毒素的产生及与致病力的关系[D]. 扬州: 扬州大学, 2003: 1-5.
[19]刘朝辉. 玉米弯孢菌产毒条件、产毒能力及毒素作用机理的研究[D]. 雅安: 四川农业大学, 2004: 30-35.
(责任编辑:田喆)
Identification of the toxin of sesame Fusarium wilt pathogen and its toxic effect on sesame seedlings
Zhu Qiangbin1,Zhang Haiyang2,Duan Yinghui2,Chang Shuxian2,Wei Libin2,Li Chun2,Miao Hongmei2
(1.State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing210095,China; 2. Henan Sesame Research Center, Henan Academy of Agricultural Sciences, Zhengzhou450002, China)
SesameFusariumwilt (SFW) caused byFusariumoxysporumf.sp.sesami(FOS) is a soil-borne fungus disease in sesame and has an effect on sesame production. In order to reveal whether FOS could produce toxin and determine the toxin components, we separated and analyzed the filtered culture solution of FOS strains by using HPLC and HPLC-MS techniques. Four separate peak masses in the main FOS filtered components were identified as fusaric acid (5-butylpicolinic acid, FA) and three fusaric acid analogues, namely C10H13NO4(FA+O2), C10H13NO3(FA+O) and C10H11NO2(FA-H2). With Richard culture medium, both the highly pathogenic strain (HSFO09100) and the lowly pathogenic strain (HSFO07021) could produce toxins; however, the content and ratios of the four main toxins varied evidently. The results proved that the FOS filtered solutions containing fusaric acid and the three analogues could inhibit the growth of the sesame seedlings. Moreover, as the concentration of fusaric acid in the filtered solutions increased from 1 to 10 μg/mL, the toxic effects to sesame seedlings became obvious. Growth comparison results indicated that no significant difference existed among the four sesame varieties under the treatments of FOS filtered solutions containing the same FA concentration. The results provide the technical and theoretical basis for further study on FOS pathogenicity mechanism and the interaction of FOS and sesame.
sesameFusariumwilt;toxin;fusaric acid;HPLC;HPLC-MS
2015-08-04
2015-08-30
国家现代农业(芝麻)产业技术体系(CARS-15);国家自然科学基金(U1204318,U1304321,31301653)
E-mail: miaohongmeichina@yahoo.com
S 435.653
A
10.3969/j.issn.0529-1542.2016.04.004
Research Reports

