染色质重塑及其参与植物病害防御应答的研究进展
洪 林, 魏召新, 魏文辉, 谭 平*
(1. 重庆市农业科学院果树研究所, 重庆 402260; 2. 中国农业科学院油料作物研究所,农业部油料作物生物学与遗传育种重点实验室, 武汉 430062)
专论与综述
染色质重塑及其参与植物病害防御应答的研究进展
洪林1,魏召新1,魏文辉2,谭平1*
(1. 重庆市农业科学院果树研究所, 重庆402260; 2. 中国农业科学院油料作物研究所,农业部油料作物生物学与遗传育种重点实验室, 武汉430062)
转录相关因子与特异DNA位点结合受染色质空间构象变化的调节,通过染色质重塑机制可以解除染色质高度紧密的折叠状态,改变组蛋白与DNA链间的作用力,控制基因的表达与沉默。ATP依赖的染色质重塑复合物、组蛋白的乙酰化/去乙酰化和甲基化/去甲基化共价修饰等是染色质修饰的主要类型,植物能通过染色质重塑复合物和组蛋白修饰酶复合物直接或间接介导的染色质重塑作用调控防御基因的转录,控制植物对病原体侵染的防御应答。本文结合近年来的研究进展,对植物染色质重塑如何调控防御相关基因的表达及病原体蛋白T3SEs、6b和VirE等如何利用染色质重塑干预植物防御系统的分子机制进行了论述。
植物;核小体;染色质重塑;防御应答
真核生物基因组DNA通常由146 bp的染色质DNA围绕H2A、H2B、H3、H4形成的核心组蛋白八聚体包装成核小体结构,组蛋白H1再结合于各核小体间的连接DNA上,最终形成串珠样结构[1]。染色质高级结构的组装、维持及构象改变则是通过核小体高度有序的自我调节来调控的,而核小体因其结构的特殊性,能阻碍转录因子与染色质上靶基因的特异识别位点结合并起始特定基因的表达。然而,真核生物能借助于一些具有酶活性的复合物的作用来改变染色质的结构形态,通过染色质高级结构的各种变化增加基础转录装置与启动子的可接近性,对染色质赋予的生物学功能进行调控。
染色质重塑是目前表观遗传领域的研究热点之一,它能驱动核小体的置换或重新排列,改变染色质的空间构象。组蛋白H3和H4的甲基化、乙酰化修饰,ATP依赖的染色质构象变化等是染色质重塑的主要方式,均能使染色质特定区域对核酶的稳定性发生变化,调控基因转录[2]。染色质重塑在植物防御相关基因的表达调控中发挥着关键作用,病原体侵染植物组织后,组蛋白修饰酶、ATP依赖性染色质重塑相关因子和其他一些调节蛋白被招募到防御相关基因的转录控制区域。参与染色质重塑复合体形成的许多蛋白亚基影响MAPK级联信号、SA信号转导、ABA信号转导等途径,进而由PTI(PAMP-triggered immunity) 和ETI(effector-triggered immunity)介导转录水平上的重编程,激活或抑制植物的防御系统[3-4]。本文就染色质重塑的主要方式,染色质重塑调控植物防御应答的机制,病原体如何调控染色质重塑干扰植物防御系统等方面予以综述,并展望该领域存在的问题及未来发展方向。
1 染色质重塑的方式
目前在动植物中发现至少有两类高度保守的染色质修饰类型。第一类是通过水解ATP提供能量形成ATP依赖的染色质重塑复合物,进而改变核小体的位置,增强DNA 序列与转录因子的相互作用程度,改变组蛋白与DNA链之间的空间构象[5];第二类是组蛋白尾部赖氨酸的乙酰化和泛素化,苏氨酸和丝氨酸的磷酸化,精氨酸的甲基化,谷氨酸的多聚ADP 核糖基化等共价修饰形成组蛋白修饰酶复合物(histone-modifying complex),破坏了基因组DNA与核小体、组蛋白尾部间的结构,间接引起染色质的重塑[6-7]。
1.1ATP依赖的复合物介导染色质重塑过程
ATP依赖的染色质重塑复合物为大分子量的多组分复合体,包含4~17个不同种类的亚基,且在真核生物中高度保守。ATPase亚基为其中一类最重要的蛋白质成分,具有催化和转位酶活性,属于SNF2超家族,存在于已知的ATP依赖的染色质重塑复合物中[8]。核心ATPase亚基的保守结构域由DExx和HELICc组成,两个保守基序被一段长度存在变异的连接序列所间隔,基于各自独特结构域将ATPase亚基至少可分为SWI/SNF(yeast mating-type switching/sucrose non-fermenting)、INO80、ISWI、CHD等4个亚家族,关于SWI/SNF复合物方面的研究最多[9](图1)。
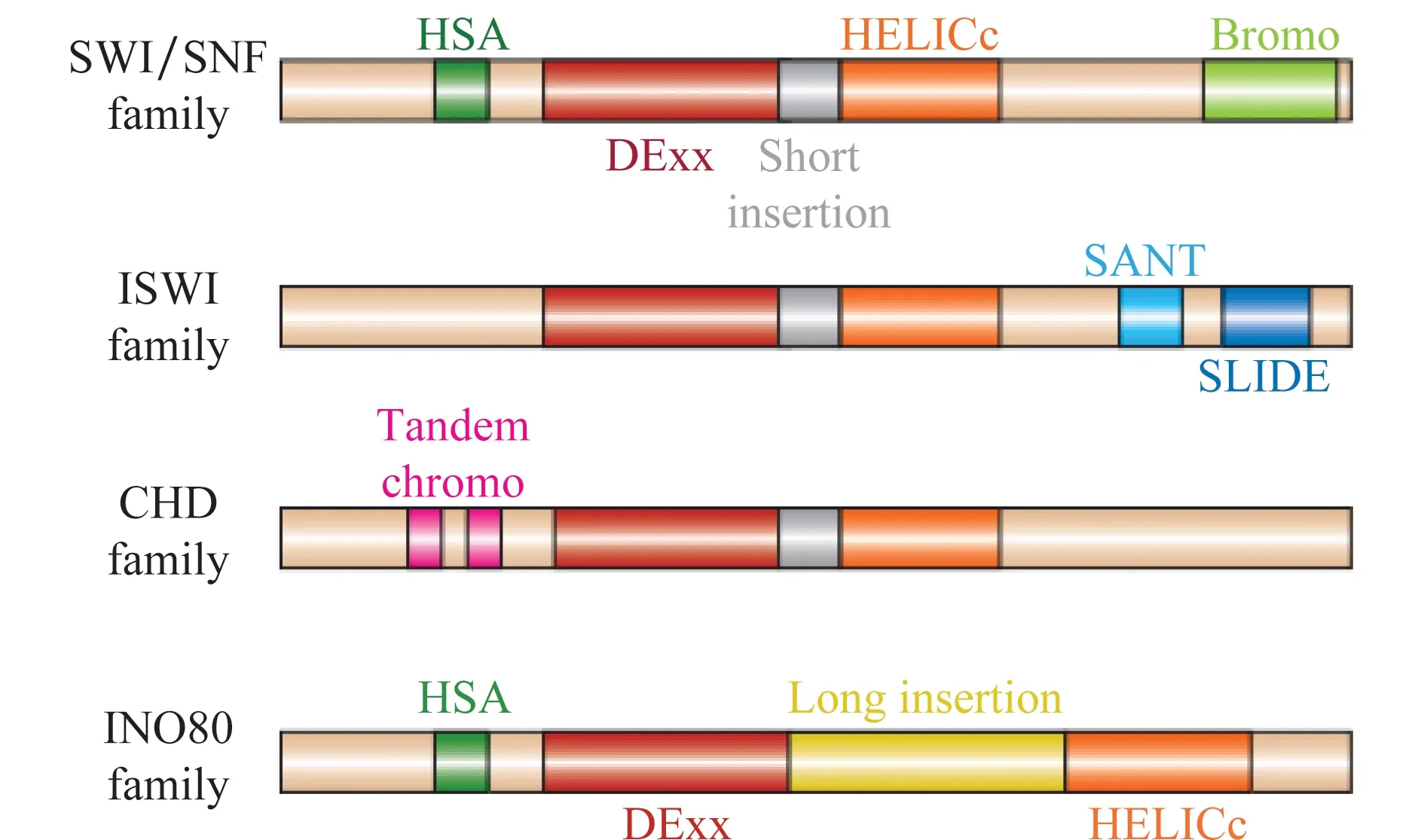
图1 ATPase亚基家族的结构域比较[9]Fig.1 The comparison of protein domains in ATPase family[9]
SWI/SNF复合物最早是从酵母(Saccharomycescerevisiae)中纯化得到的[10]。该复合物由8~14个蛋白亚基组成,分子量约1.5 MDa[11]。酵母主要有SWI/SNF和RSC两种复合物类型,前者以SWI2或SNF2为ATPase催化亚基,而后者为Sth1[10]。拟南芥(Arabidopsisthaliana) SWI/SNF的组成亚基主要有SPLAYED (SYD)、BRAHMA(BRM)、CHR12、CHR23、ATBRCA1、BRG1、ATSWI3A、ATSWI3B、ATSWI3C和ATSWI3D等[12]。果蝇(Drosophilamelanogaster)中也发现与酵母SWI/SNF具有较高同源性的BRAHMA结合相关蛋白BAP和溴区相关的BAP两种形式的重塑复合物,BRAHMA、Moira、SNR1、BAP60、BAP55等5种亚基为共有的核心组分,OSA亚基、溴区(bromodomain)及BAP170亚基在两类复合体间表现一定的特异性。此外,BAP111亚基尽管未在酵母中被鉴定出,但却被认为可能与果蝇染色质的高级形态结构相关联[13]。人类SWI/SNF同源复合体为BAF和PBAF,分子量约为2 MDa,两者同源性达到74%,BAF包含hBRM和BRG1两个ATPase催化亚基,但PBAF的形成没有hBRM亚基的参与,两者在体外试验中表现出相似的生化活性,但在许多细胞代谢途径中发挥不同的功能[14]。目前关于BRG1及其同源基因的功能研究报道较多,BRG1结构域包括一个进化上保守的ATP水解酶活性区域、C端溴区、AT-hook基序及N端QLQ、HAS和BRK等。参与机体内的多种生理和病理调控过程[15]。其中,C端溴区能够特异性识别组蛋白H3和H4末端乙酰化的赖氨酸[16]。总体来看,真核细胞SWI/SNF 复合物基于SWI/SNF/BAP/BAF和RSC/PBAP/PBAF两种模式而建立,可能还有特异性亚基和其他因子参与的多种形式共存。
关于SWI/SNF复合物调控染色质的重塑机制仍未被阐明,科学家认为重塑可能与启动子特性、染色质状态、SWI/SNF复合物的浓度、DNA结合因子等有关。目前主要有以下3种假说:滑动模型、组蛋白突变体交换模型、重获环模型[17-18]。
1.2组蛋白共价修饰参与染色质重塑
组蛋白修饰是染色质重塑的关键调控方式之一。乙酰化、甲基化、泛素化、磷酸化、苏素化等多种共价修饰常发生在组蛋白N端,组蛋白H3和H4的共价修饰直接影响染色质结构。乙酰化和甲基化是最主要的修饰方式,且此过程是可逆的。
1.2.1组蛋白乙酰化与去乙酰化
乙酰化修饰引起的染色质结构重塑是基因转录调控的重要调节因素,组蛋白乙酰基转移酶(HATs)和组蛋白去乙酰基酶(HDACs)共同控制组蛋白末端的乙酰化水平,激活或抑制基因转录。目前已经发现的与真核生物染色质重塑相关的HATs有GCN5、P300/CBP、TAFII250、MYST、PCAF等[19];HDACs主要有RPD3、HDAC1、HDAC2、HDAC3、HD1BI、HD1BII、HD2等,参与NCoR/SMRT、SIN3、NuRD及CoREST等HDACs复合物的组装[20]。
核小体核心组蛋白的N末端尾部保守的赖氨酸(K)是组蛋白的乙酰化位点,组蛋白乙酰化状态呈多样性,能使ATP依赖的重塑复合物更加紧密地与DNA模板结合。组蛋白N末端尾部的赖氨酸乙酰化能中和其正电荷,促使染色质形成能与调控蛋白结合的特定结构,进而引发转录起始[21]。研究发现单一的HAT能乙酰化游离组蛋白,然而核小体组蛋白的乙酰化则需要包含HAT的多蛋白复合物介导下才可能实现,如FACT、HMG14等染色质修饰因子也参与不同核心组蛋白赖氨酸的乙酰化过程[22]。重组的GCN5仅乙酰化修饰组蛋白H3、H4单体,而含有GCN5的两大复合物ADA和SAGA才能将核小体结构中组蛋白H3、H4乙酰化[23],PRZ1能通过调节GCN5活性影响GCN5/HAG1复合物参与的染色质重塑效率[24]。组蛋白乙酰化与去乙酰化能改变临近组蛋白甲基化修饰状态,H3K9和H3K14的乙酰化修饰可以加强转录因子TFⅡD与H3K4me3间的作用[25]。ING4作为HBO1组蛋白乙酰转移酶复合体的一个重要亚基,却能与H3K4me3位点结合,招募HBO1复合体,乙酰化修饰靶基因启动子区的组蛋白,改变染色质结构,影响特定基因的表达[26]。
1.2.2组蛋白甲基化与去甲基化
组蛋白甲基化修饰在基因转录调控中发挥十分重要的作用。赖氨酸和精氨酸(R)残基为主要的修饰位点。H3K4、H3K9、H3K27、H3K36、H3K79、H4K20等位点甲基化修饰后参与染色质结构重塑和基因表达调控,其中H3K4、H3K36、H3K79的甲基化修饰激活基因转录,而H3K9、H3K27、H4K20甲基化修饰抑制转录;H3R2、H3R8、H3R17、H3R26、H4R3是精氨酸甲基化的修饰位点。此外同一位点可能分别有一甲基化(me1)、二甲基化(me2)、三甲基化(me3)三种方式[27]。组蛋白甲基化修饰也往往与组蛋白乙酰化、DNA甲基化等其他表观遗传学修饰协同作用,共同调节染色质结构,影响基因转录。
组蛋白的甲基化修饰由一类含SET结构域的甲基转移酶介导。目前已经发现和证实真核生物中存在数十种组蛋白赖氨酸甲基转移酶(HKMTs)和精氨酸甲基转移酶(PRMTs),它们参与染色质结构的形成、基因组印记及转录调控等多种生理功能的执行[28]。H3K9位点的甲基化修饰频率较高,如Su(var)3-9可以特异地甲基化修饰H3K9,招募HP1与组蛋白H3结合,影响染色质构象[29],而SETDB1催化的H3的N末端甲基化可以增强HP1与H3的结合能力[30]。HP1和甲基化的染色质相互作用,抑制基因转录[31],SET2、SET1、NSD1、PCG、Dot1等其他HKMTs也在染色质表观遗传调控中起关键作用。
目前,已从真核生物中鉴定出约11种PRMTs。PRMT2、10和11不具有催化精氨酸甲基化的功能, PRMT1和PRMT4的甲基化修饰激活基因的转录,而PRMT5和PRMT6与转录抑制相关。PRMT5与PRMT1、PRMT4(也称为CARM1)均能与染色质重塑复合物发生作用,调节染色质构象变化[32]。PRMT1和CARM1结合组蛋白乙酰化酶,并与染色质重塑复合物发生相互作用,导致染色质结构的解体并激活转录,而PRMT5则募集组蛋白去乙酰化酶HDAC,降低转录效率[33]。
但去甲基化酶的数量仍然较少,已发现与精氨酸相关的有PADI4、JMJD6;与赖氨酸相关的有LSD1、JHDM1、JHDM2、JHDM3/JMJD2、JARID1[34]。是否存在其他特异酶参与组蛋白的去甲基化,去甲基化酶家族成员的多样性,去甲基修饰后激活或抑制转录的机制等为未来工作的重点。
2 染色质重塑调节植物的防御机制
2.1ATP依赖的染色质重塑因子调控植物防御应答
至今为止,科学家已从拟南芥中分离鉴定出42个SNF2家族ATP酶亚基,这些亚基聚类为24个不同的亚族。它们之中SNF2亚族的SPLAYED(SYD)和BRAHMA (BRM)、SWR1亚族的PIE1、LSH亚族的DDM1和AGO4等被认为具有调节植物防御应答的能力[35]。
SYD和BRM具有特异性和相同的防御相关基因靶位点,两者均能与ATSWI3B和ATSWI3C互作,但仅SYD的N端能选择性结合ATSWI3A。高通量转录组分析发现,SYD和BRM调控拟南芥全基因组1%的基因表达[36]。SYD-2突变体受病原菌丁香假单胞菌番茄致病变种(Pseudomonassyringaepv. Tomato DC3000, Pst DC3000)侵染后促使SA应答基因PR1的上调表达,暗示SYD可能为SA信号途径的负调控子,SYD结合特异性分子伴侣,以复合物形式参与防御相关基因的启动子目标区域的调节。SYD突变型植株仍能对PstDC3000的侵染作出防御应答,这可能与PstDC3000分泌T3SEs有关[36]。PR1基因在BRM-101突变株中的表达增强,但仍然缺乏BRM直接参与植株抗性调节的证据。T3SS功能缺失突变的细菌性斑点病菌丁香假单胞菌(Pseudomonassyringae)可能是研究SYD和BRM在植物防御反应中如何发挥作用的经典试材,BRM能在体外与组蛋白H3和H4结合,BRM结构域中包含有1个溴区及3个不同序列特征的DNA结合区域,缺少其中1个DNA结合区的突变体的表型介于野生型和完全突变型之间,进一步表明BRM的完整生物学功能的实现依赖于3个特征DNA结合域[37]。许多染色质重塑蛋白(CHR)结构域中含有溴区,可特异性识别组蛋白H3和H4末端乙酰化的赖氨酸位点,通过乙酰化和随后染色质的组装参与信号依赖性的、非基础性的基因转录调控[38]。溴区直接介导组蛋白乙酰转移酶相关的共激活子与组蛋白之间的互作,乙酰化的赖氨酸残基为特异性作用位点[39]。进一步深入研究溴区结构域是否存在其他染色质结合热点对建立和阐明BRM在植物免疫反应中的作用模式具有重要的指导意义。
PIE1是PstDC3000激发的植物防御应答反应过程中的负调节子。研究发现PIE1突变体的许多防御相关基因组成性表达,通常病原体侵染后这些基因的转录被抑制[40]。PIE1与组蛋白变体H2A.Z的共价修饰有关,且H2A.Z在染色质PIE1调控位点的募集需要PIE1参与,PIE1或H2A.Z突变体均表现对PstDC3000的抗性增强,推测PIE1介导H2A.Z与防御相关的靶基因位点结合可能抑制染色质转录状态[40-41]。H2A.Z通常结合在核小体侧翼转录起始位点,调节热响应基因的转录,控制不同环境温度条件下植物的生长发育[42]。
DDM1包含一个保守的SNF2-ATP酶结构域,至今未发现其含有SET结构域或甲基转移酶活性[43]。但是DDM1具有维持甲基化和转座子沉默的能力[44],这可能是通过DDM1的染色质重塑活性来调节甲基转移酶和去甲基化酶结合染色质转录区实现[45-46]。DDM1突变植株全基因组发生低甲基化,大大抑制基因沉默现象[47]。突变导致DDM1功能丧失,染色质结构改变,PR1和PR2组成性表达,抗病基因SNC1表达上调,因此DDM1表现为防御应答的负调控因子[48]。至于植物DDM1基因调控病原激发的防御反应机制仍有许多不明之处。此外,在拟南芥中还发现另外一种蛋白AGO4,该蛋白调节RNA介导的DNA甲基化(RdDM)和基因沉默,正调控植物对病原体的主动防御[49]。
2.2组蛋白甲基化介导的植物防御应答
与乙酰化相比,甲基化的效应更加多样化。组蛋白H3甲基化依赖于精氨酸和赖氨酸特定残基的修饰能发挥激活或抑制转录的双重作用[50]。植物中已报道的调节防御应答的组蛋白甲基化修饰酶有ATX1(arabidopsis homolog of trithorax 1)和SDG8(SET domain group 8)两种。
ATX1属于Trithorax家族成员,含有非常保守的SET结构域[51]。H3K4的低水平三甲基化会引起ATX1靶基因的表达整体下调[52],但ATX1本身只影响染色质某些特定部位的核小体H3K4甲基化修饰[53]。研究发现拟南芥ATX1在PstDC3000的T3SS功能缺失突变体激发的植物基础抗性系统中起正调控作用,ATX1激活WRKY70表达,WRKY70是SA及JA/ET介导的防御信号途径中的关键转录因子[54]。ChIP试验结果表明WRKY70可能为ATX1执行组蛋白甲基化酶功能的初级靶因子,SA应答基因PR1、JA应答基因THI2.1为次级靶因子,PR1和THI2.1维持染色质相应区域保持开放的修饰状态,促进防御相关基因的转录[55]。SDG8在PstDC3000激发的植物防御反应中扮演“分子开关”的角色,调节NB-LRR类基因的LAZ5和RPM1表达,但不影响RPS2、RPS4等基因的转录。SDG8能特异性催化H3K36的二甲基化和三甲基化修饰[56],研究发现病原体侵染过程中染色体LAZ5区域H3K36三甲基化程度变高[57]。
植物组蛋白修饰突变体改变了自身的抵抗力,但对于防御相关基因靶位点的特异性和相关染色质特征信号的研究仍不明确。组蛋白多样性的修饰及时空组合与生物学功能的关系可作为一种重要的表观标志,即“组蛋白密码”。组蛋白修饰以协同或渐进的动态转录调控方式诱导植物特异的下游防御应答。
2.3组蛋白去乙酰化调控植物防御应答
组蛋白H3和H4的乙酰化修饰与基因活化密切相关。乙酰化酶和去乙酰化酶选择性修饰使组蛋白乙酰化水平保持平衡状态[50]。
研究发现两类HDACs在植物免疫调节中发挥作用,细菌性斑点病菌PstDC3000能增强HDA19的表达,HDA19作为防御反应的正调控因子,而转录因子WRKY38和WRKY62负调控病程相关基因PR的表达,WRKY38和WRKY62募集HDA19形成复合物结合于水杨酸响应位点(SArlc),降低组蛋白H3和H4的乙酰化水平并抑制转录。对HDA19催化突变体的研究发现去乙酰化活性对于HDA19介导的植物防御相关基因表达是关键条件[58-59]。
SRT2为拟南芥中发现的另外一种HDAC,抑制SA生物合成基因的转录活性,而SA是植物抵抗细菌性斑点病菌和活体营养性病原等反应中的关键信号分子[60]。PstDC3000感染后诱导SRT2表达下调,促进SA合成和防御相关基因的转录[61]。
2.4其他参与植物防御应答的染色质相关蛋白
植物中还存在其他一些染色质相关蛋白,这些蛋白也直接参与植物防御应答。科学家通过遗传筛查分析发现RAD51(SSN1)、SSN2、BRCA2(SSN3)等与植物抗性调节相关[62-63]。SSN2包含一个SWI2/SNF2和MuDR(SWIM)结构域,主要定位于细胞核。敲除拟南芥SSN2基因会引起PR基因表达量降低,表现不抗P.syringae[64]。系统获得性抗性(SAR)是植物从转录和DNA同源重组(HR)两个水平上产生防御应答的结果,SAR启动植物基因组中10%的基因转录。SNI1负调节SAR和HR,而SSNs(suppressor of SNI1)抑制SNI1的表达,RAD51D(RAD51的5种同源物之一)、SSN1和BRCA2A(BRCA2同源物)共同形成蛋白复合体在TGA转录因子的协同作用下与染色质中PR基因的启动子区相结合,调控基因转录[65]。拟南芥BRCA2和RAD51对遗传毒性物质和病原体感染非常敏感,通过基因组微列阵和CHIP-Seq技术证明BRCA2/RAD51复合物在植物防御应答中发挥关键作用,认为RAD51D、BRCA2A、SSN2可能参与染色质重塑复合物调节SNI1和其他PR基因的转录事件[63]。
3 病原体通过染色质重塑干预植物防御系统
病原体采用多种策略来干扰植物先天免疫系统最终侵染植物体,染色质重塑复合物在进化过程中相当保守,这对于活体营养型和半活体营养型病原体在侵染初期维持稳定的共生关系尤为重要。
最早报道的有玉米炭色旋孢腔菌,该菌能产生HC毒素,HC毒素抑制组蛋白去乙酰化活性,导致组蛋白高度乙酰化,直接调节植物染色质重塑过程[66]。HC毒素还原酶能削弱其毒性并恢复玉米对病原体的抗性[67],但有关组蛋白去乙酰化活性的抑制介导病原体侵染的分子机制仍知之甚少。
3.1根癌农杆菌毒性蛋白VirE和6b
拟南芥和根癌农杆菌是研究病原体毒性因子如何与寄主染色质相关蛋白互作的两种模式生物。根癌农杆菌能将自身的一段T-DNA整合到植物基因组中,T-DNA包含有生长素和细胞分裂素合成相关基因的编码序列,促进植物细胞分裂和生长。同时T-DNA还包含冠瘿碱合成相关基因,冠瘿碱为根癌农杆菌提供营养来源[68]。研究证实核心组蛋白、组蛋白修饰酶、组蛋白分子伴侣、染色质组装蛋白等在T-DNA整合过程中发挥关键作用[69-70]。
根癌农杆菌毒性蛋白VirE2具有调节染色质结构和促进T-DNA整合的功能。拟南芥中,VirE2互作蛋白VIP1(VirE2-interacting protein 1)直接与H2A等核心组蛋白发生作用,VIP1增强VirE2与核小体之间的作用[71]。通过此途径,VirE2指导T-DNA以复合物形式与寄主染色质结合,从而整合到植物基因组中[72]。此外,VirE2互作蛋白VIP2 (VirE2-interacting protein 2)能调控组蛋白基因的转录[73]。研究发现植物通过上调许多组蛋白基因的表达来抵御根癌农杆菌侵染[74]。VirE3已被证实具有转录激活子功能,它与pCsn5-1和pBrp两种蛋白形成复合物,在GAL4-BD蛋白因子的协同下与DNA结合,改变染色质结构,调节寄主防御相关基因的转录[75]。是否存在其他的根癌农杆菌毒性因子有待深入研究。
毒性蛋白6b是根癌农杆菌诱发植物异常发育和冠瘿瘤形成的关键因子,与组蛋白H3、micro RNA途径相关蛋白等多种染色质蛋白存在相互作用[76-77],6b可能为一种组蛋白分子伴侣,协同染色质重塑因子影响核小体的组装、组蛋白置换、基因特异性转录[76]。最近蛋白结构分析发现6b还具有ADP核糖基化活性[77]。尽管6b与组蛋白H3之间确实存在联系,但6b如何修饰H3及6b介导组蛋白H3可能发生的ADP核糖基化如何影响防御基因的转录仍知之甚少。
3.2Ⅲ型分泌效应因子(Type Ⅲ secreted effectors,T3SEs)
Ⅲ型分泌效应因子是一种目前研究较多的毒性蛋白。革兰氏阴性菌借助于T3SEs进入真核细胞,抑制寄主免疫反应[78]。进入细胞质后,一方面与胞质中合成的核蛋白发生作用;另一方面,T3SEs在核定位信号序列(NLS)的引导下进行入核运输,调节染色质构象的变化和基因转录。例如,黄单胞菌TAL(transcription activator-like)因子绑定特定启动子序列位点,直接激活防御应答负调控基因的表达,加速病原体侵染和病症表现的进程[79]。目前,仅在黄单胞菌中发现TAL因子具有直接的基因转录调节作用,因此尚需发掘更多的能通过染色质重塑改变基因转录状态的其他T3SEs。
OspF蛋白为一种Ⅲ型分泌系统的后期效应分子,能诱导组蛋白H3去磷酸化和去乙酰化,重塑染色质,降低免疫应答相关基因的表达水平[80],同时Rb(retinoblastoma)蛋白和OspF蛋白以复合体形式参与此分子调控网络[81]。OspF蛋白还具有磷酸丝氨酸水解酶活性,不可逆地将MAPK通路中的蛋白去磷酸化[82],丁香假单胞菌能合成一种与OspF类似的效应因子HopAI1,定位于细胞核,通过MPK3和MPK6的去磷酸化修饰干扰PAMP诱导的植物防御信号途径[83],其是否参与植物组蛋白的修饰过程尚未得到试验证实。
科学家从甘蓝黑腐病黄单胞菌中鉴定出一种效应分子XopD,XopD蛋白具有染色质重塑活性和小泛素样修饰蛋白(small ubiquitin-like modifier,SUMO)酶活性。通过拟南芥全基因组水平上的蛋白质研究,已经鉴定出多种SUMO底物,包括组蛋白修饰酶类、染色质重塑复合物成分及免疫相关的转录因子[84-85]。SUMO E3连接酶SIZ1突变体内免疫响应基因呈组成型表达,伴随着SA积累的增加[86],暗示苏素化(sumoylation)在免疫调节过程中扮演重要的角色。除具有SUMO蛋白酶活性,XopD还包含一个EAR基序,EAR基序富含亮氨酸,具有双亲性,是赋予转录因子抑制功能的一段保守序列,可以通过染色质修饰、激活子调节等途径实现对防御和衰老相关基因的抑制[87],EAR型转录抑制子为植物特有的一类转录抑制子,适配子蛋白SIN3和SAP18能增强EAR基序招募HDA19辅阻遏复合体的能力,使H3K9、H3K27、H4K5和H4K8位点发生去乙酰化,促进基因沉默[88],EAR基序是XopD蛋白实现抑制转录的生物学功能的必要条件,番茄中的研究表明EAR基序能将HDA19同源物招募至XopD绑定的基因启动子区,抑制特定基因的表达。HDA19为苏素化(SUMO)底物之一,XopD蛋白利用SUMO蛋白酶活性作用降低HDA19自身的SUMO化水平,从而提高HDA19的去乙酰化活性,重塑染色质构象,抑制植物防御应答基因的转录[85]。
4 展望
染色质构象动态改变是基因功能调控的关键点。目前对染色质重塑的修饰类型及机制的研究较多,特别是ATP依赖的重塑复合物、乙酰化、甲基化等,但欠缺系统性。大量的研究证据表明基于这些不同的染色质重塑方式能直接或间接在植物防御应答反应中发挥重要作用,模式植物拟南芥SYD、BRM、PIE1、DDM1、AGO4等蛋白具有防御调节功能的ATP酶亚基已被成功鉴定出,但相对于SNF2超家族庞大数量的蛋白亚基而言,仍是冰山一角,寻找同源或新的与染色质重塑有关的蛋白显得尤为急切,重塑相关蛋白通过什么机制精确修饰植物染色质仍需深入解析。组蛋白修饰对于病原体侵染激发的植物信号转导来说也非常关键,但分离的组蛋白甲基化、乙酰化相关因子的数量极其有限,发现的特异或保守的修饰位点数量较少,甲基化与乙酰化等共价修饰如何通过修饰酶复合物的介导来调控染色质结构仍不明晰,病原体VirE、6b、T3SEs等蛋白分子如何与重塑复合物、乙酰化修饰复合物等共同作用于植物免疫系统的分子机制知之甚少。因此,许多问题有待系统解决,今后的研究将更多地致力建立并完善染色质层面上植物与病原体互作的信号传导网络,为最终通过基因工程等技术提升植物抗病能力奠定基础。
[1]Tremethick D J.Higher-order structures of chromatin: the elusive 30 nm fiber [J]. Cell, 2007, 128(4): 651-654.
[2]Lena H, Crabtree G R.Chromatin remodelling during development [J]. Nature, 2010, 463(7280): 474-484.
[3]Block A, Li Guangyong, Fu Zhengqing, et al. Phytopathogen type Ⅲ effector weaponry and their plant targets [J]. Current Opinion in Plant Biology, 2008, 11(4): 396-403.
[4]Jones J D G, Dangl J L.The plant immune system [J]. Nature, 2006, 444(7117): 323-329.
[5]Racki L R, Narlikar G J.ATP-dependent chromatin remodeling enzymes: two heads are not better, just different [J]. Current Opinion in Genetics & Development, 2008, 18(2): 137-144.
[6]Strahl B D, Allis C D. The language of covalent histone modifications [J]. Nature, 2000, 403(6765): 41-45.
[7]Taverna S D, Li H, Ruthenburg A J, et al. How chromatin-binding modules interpret histone modifications: Lessons from professional pocket pickers [J]. Nature Structural & Molecular Biology, 2007, 14(11): 1025-1040.
[8]Saha A, Wittmeyer J, Cairns B R.Chromatin remodelling: the industrial revolution of DNA around histones [J]. Nature Reviews Molecular Cell Biology, 2006, 7(6): 437-447.
[9]Clapier C R, Cairns B R.The biology of chromatin remodeling complexes [J]. Annual Review of Biochemistry, 2009, 78: 273-304.
[10]Sudarsanam P, Winston F.The Swi/Snf family nucleosome-remodeling complexes and transcriptional control [J]. Trends in Genetics, 2000, 16(8): 345-351.
[11]Vignali M, Hassan A H, Neely K E, et al. ATP-dependent chromatin-remodeling complexes[J]. Molecular and Cellular Biology, 2000, 20(6): 1899-1910.
[12]Bezhani S, Winter C, Hershman S, et al. Unique, shared, and redundant roles for theArabidopsisSWI/SNF chromatin remodeling ATPases BRAHMA and SPLAYED [J]. Plant Cell, 2007, 19(2): 403-416.
[13]Wang G G, Allis C D, Chi P. Chromatin remodeling and cancer, partⅡ: ATP-dependent chromatin remodeling [J]. Trends in Molecular Medicine, 2007, 13(9): 373-380.
[14]Wu J L, Lessard J, Crabtree G R.Understanding the words of chromatin regulation [J]. Cell, 2009, 136(2): 200-206.
[15]Trotter K W, Archer T K.The BRG1 transcriptional coregulator [J]. Nuclear Receptor Signaling, 2008, 6: e004.
[16]Shen Weiqun, Xu Chao, Huang Wei, et al. Solution structure of human Brg1 bromodomain and its specific binding to acetylated histone tails [J].Biochemistry,2007,46(8): 2100-2110.
[17]Dechassa M L, Zhang B, Horowitz-Scherer R, et al. Architecture of the SWI/SNF-nucleosome complex [J]. Molecular and Cellular Biology, 2008, 28(19): 6010-6021.
[18]Fan Huaying, He Xi, Kingston R E, et al.Distinct strategies to make nucleosomal DNA accessible [J]. Molecular Cell, 2003, 11(5): 1311-1322.
[19]Brownell J E, Zhou Jianxin, Ranalli T, et al. Tetrahymena histone acetyltransferase A: a homolog to yeast Gcn5p linking histone acetylation to gene activation [J]. Cell, 1996, 84(6): 843-851.
[20]Cunliffe V T.Eloquent silence: developmental functions of Class I histone deacetylases [J]. Current Opinion in Genetics & Development, 2008, 18(5): 404-410.
[21]Kouzarides T.Chromatin modifications and their function [J]. Cell, 2007, 128(4): 693-705.
[22]Barski A, Cuddapah S, Cui Kairong, et al. High-resolution profiling of histone methylations in the human genome[J]. Cell, 2007, 129(4): 823-837.
[23]Anzola J M, Sieberer T, Ortbauer M, et al. PutativeArabidopsistranscriptional adaptor protein (PROPORZ1) is required to modulate histone acetylation in response to auxin [J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(22): 10308-10313.
[24]Kornet N, Scheres B.Members of the GCN5 histone acetyltransferase complex regulate PLETHORA-mediated root stem cell niche maintenance and transit amplifying cell proliferation inArabidopsis[J]. The Plant Cell,2009,21(4):1070-1079.
[25]Vermeulen M, Mulder K W, Denissov S, et al. Selective anchoring of TFIID to nucleosomes by trimethylation of histone H3 lysine 4 [J]. Cell, 2007, 131(1): 58-69.
[26]Shi Xiaobing, Gozani O.The fellowships of the INGs [J]. Journal of Cell Biochemistry, 2005, 96(6): 1127-1136.
[27]宋博研, 朱卫国. 组蛋白甲基化修饰效应分子的研究进展[J]. 遗传, 2011, 33(4): 285-292.
[28]Xu Shutong, Wu Jian, Sun Bingfa, et al. Structural and biochemical studies of human lysine methyltransferase Smyd3 reveal the important functional roles of its post-SET and TPR domains and the regulation of its activity by DNA binding [J]. Nucleic Acids Research, 2011, 39(10): 4438-4449.
[29]Nakayama J, Rice J C, Strahl B D, et al. Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly [J]. Science, 2001, 292(5514): 110-113.
[30]Schultz D C, Ayyanathan K, Negorev D. SETDB1: a novel KAP-1-associated histone H3, lysine 9-specific methyltransferase that contributes to HP1-mediated silencing of euchromatic genes by KRAB zinc-finger proteins [J]. Genes & Development, 2002, 16(8): 919-932.
[31]Loyola A, LeRoy G, Wang Y H, et al. Reconstitution of recombinant chromatin establishes a requirement for histone-tail modifications during chromatin assembly and transcription [J]. Genes & Development, 2001, 15(21): 2837-2851.
[32]Pal S, Yun R, Datta A, et al. mSin3A/histone deacetylase 2-and PRMT5-containing Brg1 complex is involved in transcriptional repression of the Myc target genecad[J]. Molecular and Cellular Biology, 2003, 23(21): 7475-7487.
[33]Socka J, Allis C D, Coonrod S.Histone arginine methylation and its dynamic regulation [J]. Front Bioscience, 2006, 11(1): 344-355.
[34]Sukada Y, Fang J, Erdjument-Bromage H, et al. Histone demethylation by a family of JmjC domain-containing proteins[J]. Nature, 2006, 439(7078): 811-816.
[35]Flaus A, Martin D M, Barton G J, et al. Identification of multiple distinct Snf2 subfamilies with conserved structural motifs[J]. Nucleic Acids Research, 2006, 34: 2887-2905.
[36]Walley J W, Rowe H C, Xiao Yanmei, et al. The chromatin remodeler SPLAYED regulates specific stress signaling pathways [J]. PLoS Pathogens, 2008, 4(12): e1000237.
[37]Farrona S, Hurtado L, Reyes J C.A nucleosome interaction module is required for normal function ofArabidopsisthalianaBRAHMA [J]. Journal of Molelular Biology, 2007, 373(2): 240-250.
[38]Finkemeier I, Laxa M, Miguet L, et al. Proteins of diverse function and subcellular location are lysine acetylated inArabidopsis[J]. Plant Physiology, 2011, 155(4): 1779-1790.
[39]Owen D J, Ornaghi P, Yang J C, et al. The structural basis for the recognition of acetylated histone H4 by the bromodomain of histone acetyltransferase Gcn5p[J]. The EMBO Journal, 2000, 19(22): 6141-6149.
[40]Noh Y S, Amasino R M.PIE1, an ISWI family gene, is required forFLCactivation and floral repression inArabidopsis[J]. Plant Cell, 2003, 15(7): 1671-1682.
[41]Deal R B, Topp C N, McKinney E C, et al. Repression of flowering inArabidopsisrequires activation ofFLOWERINGLOCUSCexpression by the histone variant H2A.Z [J]. Plant Cell, 2007, 19(1): 74-83.
[42]Kumar S V, Wigge P A.H2A.Z-containing nucleosomes mediate the thermosensory response inArabidopsis[J]. Cell, 2010, 140(1): 136-147.
[43]Singer T, Yordan C, Martienssen R A.Robertson’s mutator transposons inA.thalianaare regulated by the chromatin-remodeling gene decrease in DNA methylation (DDM1)[J]. Genes & Development, 2001, 15(5): 591-602.
[44]Gendrel A V, Lippman Z, Yordan C, et al. Dependence of heterochromatic histone H3 methylation patterns on theArabidopsisgeneDDM1 [J]. Science, 2002, 297(5588): 1871-1873.
[45]Brzeski J, Jerzmanowski A.Deficient in DNA methylation 1(DDM1) defines a novel family of chromatin-remodeling factors [J]. The Journal of Biological Chemistry, 2003, 278(2): 823-828.
[46]Zemach A, Li Y, Wayburn B, et al. DDM1 bindsArabidopsismethyl-CpG binding domain proteins and affects their subnuclear localization [J]. Plant Cell, 2005, 17(5): 1549-1558.
[47]Hirochika H, Okamoto H, Kakutani T.Silencing of retrotransposons inArabidopsisand reactivation by theddm1 mutation [J]. Plant Cell, 2000, 12(3): 357-369.
[48]Li Yingzhong, Tessaro M J, Li Xin, et al. Regulation of the expression of plant resistance geneSNC1 by a protein with a conserved BAT2 domain [J]. Plant Physiology, 2010, 153(3): 1425-1434.
[49]Agorio A, Vera P.Argonaute4 is required for resistance toPseudomonassyringaeinArabidopsis[J]. Plant Cell, 2007, 19(11): 3778-3790.
[50]Berger S L.The complex language of chromatin regulation during transcription [J]. Nature, 2007, 447(7143): 407-412.
[51]Alvarez-Venegas R, Avramova Z.SET-domain proteins of the Su(var)3-9, E(z) and trithorax families[J]. Gene, 2002, 285(1/2): 25-37.
[52]Alvarez-Venegas R, Pien S, Sadder M, et al. AnArabidopsishomolog of trithorax has histone methylase activity and activates flower homeotic genes [J]. Current Biology, 2003, 13: 627-637.
[53]Alvarez-Venegas R, Avramova Z.Methylation patterns of histone H3 Lys4, Lys9 and Lys27 in transcriptionally active and inactiveArabidopsisgenes and inatx1 mutants[J]. Nucleic Acids Research, 2005, 33(16): 5199-5207.
[54]Alvarez-Venegas R, Abdallat A A, Guo M, et al. Epigenetic control of a transcription factor at the cross section of two antagonistic pathways [J]. Epigenetics, 2007, 2(2): 106-113.
[55]Alvarez-Venegas R, Sadder M, Hlavacka A, et al. TheArabidopsishomolog of trithorax, ATX1, binds phosphatidylinositol 5-phosphate, and the two regulate a common set of target genes [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(15): 6049-6054.
[56]Cazzonellia C I, Cuttrissa A J, Cossettoa S B, et al. Regulation of carotenoid composition and shoot branching inArabidopsisby a chromatin modifying histone methyltransferase, SDG8 [J]. Plant Cell, 2009, 21(1): 39-53.
[57]Palma K, Thorgrimsen S, Malinovsky F G, et al. Autoimmunity inArabidopsisacd11 is mediated by epigenetic regulation of an immune receptor [J]. PLoS Pathogens, 2010, 6(10): e1001137.
[58]Kim K C, Lai Z, Fan B, et al.ArabidopsisWRKY38 andWRKY62 transcription factors interact with histone deacetylase 19 in basal defense [J]. Plant Cell, 2008, 20(9): 2357-2371.
[59]van den Burg H A, Takken F L W.Does chromatin remodeling mark systemic acquired resistance [J].Trends in Plant Science, 2009, 14(5): 286-294.
[60]Vlot A C, Dempsey D A, Klessig D F. Salicylic acid, a multifaceted hormone to combat disease [J]. Annual Review of Phytopathology, 2009, 47: 177-206.
[61]Wang Chunzheng, Gao Feng, Wu Jianguo, et al.Arabidopsisputative deacetylase AtSRT2 regulates basal defense by suppressingPAD4,EDS5 andSID2 expression [J]. Plant Cell Physiology, 2010, 51(8): 1291-1299.
[62]Durrant W E, Wang S, Dong X.ArabidopsisSNI1 and RAD51D regulate both gene transcription and DNA recombination during the defense response[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(10): 4223-4227.
[63]Wang S, Durrant W E, Song J, et al.ArabidopsisBRCA2 and RAD51 proteins are specifically involved in defense gene transcription during plant immune responses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(52): 22716-22721.
[64]Song Junqi, Durrant W E, Wang Shui, et al. DNA repair proteins are directly involved in regulation of gene expression during plant immune response [J]. Cell Host & Microbe, 2011, 9(2): 115-124.
[65]Wang D, Amornsiripanitch N, Dong X.A genomic approach to identify regulatory nodes in the transcriptional network of systemic acquired resistance in plants [J]. PLoS Pathogens, 2006, 2(11): e123.
[66]Brosch G, Ransom R, Lechner T, et al. Inhibition of maize histone deacetylases by HC toxin, the host-selective toxin ofCochlioboluscarbonum[J]. Plant Cell, 1995, 7(11): 1941-1950.
[67]Hayashi M, Takahashi H, Kawai-Yamada M, et al. Maize plants mutated in NAD(P)H-dependent HC-toxin reductase gene (Hm1) is vulnerable to H2O2stress [J]. Plant Biotechnology, 2005, 22(1): 69-70.
[68]Escobar M A, Dandekar A M.Agrobacteriumtumefaciensas an agent of disease [J]. Trends in Plant Science, 2003, 8(8): 380-386.
[69]Lacroix B, Citovsky V.Agrobacterium aiming for the host chromatin: Host and bacterial proteins involved in interactions between T-DNA and plant nucleosomes[J]. Communicative Integrative Biology, 2009, 2(1): 42-45.
[70]Tzfira T, Citovsky V.Agrobacterium-mediated genetic transformation of plants: biology and biotechnology [J]. Trends in Cell Biology, 2002, 12(3): 121-129.
[71]Li Jianxiong, Krichevsky A, Vaidya M, et al. Uncoupling of the functions of theArabidopsisVIP1 protein in transient and stable plant genetic transformation byAgrobacterium[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(16): 5733-5738.
[72]Lacroix B, Loyter A, Citovsky V.Association of theAgrobacteriumT-DNA-protein complex with plant nucleosomes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(40): 15429-15434.
[73]Anand A, Krichevsky A, Schornack S, et al.ArabidopsisVIRE2 INTERACTING PROTEIN2 is required for Agrobacterium T-DNA integration in plants[J]. Plant Cell, 2007, 19(5): 1695-1708.
[74]Veena, Jiang Hongmei, Doerge R W, et al. Transfer of T-DNA and Vir proteins to plant cells byAgrobacteriumtumefaciensinduces expression of host genes involved in mediating transformation and suppresses host defense gene expression [J]. Plant Journal, 2003, 35(2): 219-236.
[75]Garcia-Rodriguez F M, Schrammeijer B, Hooykaas P J.The Agrobacterium VirE3 effector protein: a potential plant transcriptional activator[J]. Nucleic Acids Research, 2006, 34(22): 6496-6504.
[76]Terakura S, Ueno Y, Tagami H, et al. An oncoprotein from the plant pathogen agrobacterium has histone chaperone-like activity [J]. Plant Cell, 2007, 19(9): 2855-2865.
[77]Wang W, Barnaby J Y, Tada Y, et al. Timing of plant immune responses by a central circadian regulator[J]. Nature, 2011, 470(7332): 110-114.
[78]Galan J E.Common themes in the design and function of bacterial effectors [J]. Cell Host & Microbe, 2009, 5(6): 571-579.
[79]Mahfouz M M, Li Lixin, Shamimuzzaman M, et al. De novo-engineered transcription activator-like effector (TALE) hybrid nuclease with novel DNA binding specificity creates double-strand breaks [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(6): 2623-2628.
[80]Arbibe L, Kim W, Batsche E, et al. An injected bacterial effector targets chromatin access for transcription factor NF-kappaB to alter transcription of host genes involved in immune responses [J]. Nature Immunology, 2007, 8(1): 47-56.
[81]Zurawski D V, Mumy K L, Faherty C S, et al.Shigellaflexneritype Ⅲ secretion system effectors OspB and OspF target the nucleus to downregulate the host inflammatory response via interactions with retinoblastoma protein [J]. Molecular Microbiology, 2009, 71(2): 350-368.
[82]Chen X L, Silver H R, Xiong L, et al. Topoisomerase I-dependent viability loss in saccharomyces cerevisiae mutants defective in both SUMO conjugation and DNA repair [J]. Genetics, 2007, 177(1): 17-30.
[83]Li Xinyan, Lin Huiqiong, Zhang Weiguo, et al. Flagellin induces innate immunity in nonhost interactions that is suppressed byPseudomonassyringaeeffectors [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(36): 12990-12995.
[84]van den Burg H A, Takken F L W.SUMO-, MAPK-, and resistance protein-signaling converge at transcription complexes that regulate plant innate immunity[J]. Plant Signaling and Behavior, 2010, 5(12): 1597-1601.
[85]Miller M J, Barrett-Wilt G A, Hua Z, et al. Proteomic analyses identify a diverse array of nuclear processes affected by small ubiquitin-like modifier conjugation inArabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(38): 16512-16517.
[86]Lee J, Nam J, Park H C, et al. Salicylic acid-mediated innate immunity inArabidopsisis regulated by SIZ1 SUMO E3 ligase[J]. Plant Journal, 2007, 49(1): 79-90.
[87]Kim J G, Taylor K W, Hotson A, et al. XopD SUMO protease affects host transcription, promotes pathogen growth, and delays symptom development inXanthomonas-infected tomato leaves [J]. Plant Cell, 2008, 20(7): 1915-1929.
[88]Benhamed M, Bertrand C, Servet C, et al.ArabidopsisGCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression[J]. Plant Cell, 2006, 18(11): 2893-2903.
(责任编辑:田喆)
Advances in chromatin remodeling and its regulation of plant defense response to diseases
Hong Lin1,Wei Zhaoxin1,Wei Wenhui2,Tan Ping1
(1. Fruit Research Institute, Chongqing Academy of Agricultural Sciences, Chongqing402260, China;2. Research Institute of Oil Crops, Chinese Academy of Agricultural Sciences, Key Laboratory of Oil Crop Biology and Genetic Breeding of the Ministry of Agriculture, Wuhan430062, China)
Transcription-related factors can be integrated into specific DNA sites, and this molecular process is regulated by the configuration changes of chromatin. However, highly condensed chromatin is relieved through chromatin remodeling of itself with the alteration of covalence power between histone and DNA chain, and this mechanism may control gene expression and silencing. There are at least two primary modification types which contain ATP-dependent chromatin remodeling complex and covalent modifications of histone tails by histone modification complexes; the later type is made up of methylation/demethylation and acetylation/ deacetylation of histone. Upon pathogen infection, the transcription of defense-related genes is regulated directly and indirectly by chromatin remodelers under the force given by chromatin remodeling in plants, and then the immune response becomes effective. This paper reviews the mechanisms by which plant chromatin remodeling regulates expression of defense-related gene and the three proteins T3SEs,6b,VirE evade plant immune system by the pathway of modifying the chromatin structure according to recent studies.
plant;nucleosome;chromatin remodeling;defense response
2015-09-06
2015-10-15
国家自然科学基金(30671312);重庆市科委基本科研项目(2012CSTSJBJY00510)
E-mail: tanp_168@163.com
Q 993.2,S 432.2
A
10.3969/j.issn.0529-1542.2016.04.002
Reviews

