硫酸铵沉淀分离富硒大豆蛋白的初步研究
赵小莉,付 洋,赵 强,宁方建,熊 华
(南昌大学 食品科学与技术国家重点实验室,江西南昌 330047)
硫酸铵沉淀分离富硒大豆蛋白的初步研究
赵小莉,付洋,赵强*,宁方建,熊华
(南昌大学 食品科学与技术国家重点实验室,江西南昌 330047)
本文采用碱提酸沉法从天然富硒大豆中提取分离蛋白(SPI),再分别用质量分数为40%、60%、80%的硫酸铵溶液对其进行分级沉淀,比较研究分离得到的不同富硒SPI组分间的差异,以探讨硫酸铵分离富硒SPI的方法。结果表明:浓度为60%硫酸铵溶液分离得到的富硒SPI组分中总硒含量和可溶性蛋白含量最高;圆二色光谱和SDS-PAGE结果表明不同浓度硫酸铵溶液分离的富硒SPI组分的二级结构和亚基组成有明显不同;通过X-射线衍射分析和原子力显微观察,发现三种富硒蛋白组分的晶型和表面形态也区别较大。因此,硫酸铵法对于沉淀分离富硒SPI的差异组分,是一种有效的初筛方法,且以60%的硫酸铵浓度为较佳。
大豆富硒蛋白,硫酸铵沉淀,二级结构,SDS-聚丙烯酰胺凝胶电泳,表面形态
硒是人体必需的微量元素,作为谷胱甘肽过氧化物酶、硫氧还蛋白还原酶、脱碘酶、硒蛋白W和硒蛋白P等酶或蛋白的活性中心或必要组分,发挥抗氧化作用[1-2]。缺硒是导致人体克山病、大骨病的主要原因。由于硒的地理分布不均匀,全世界70%的地区缺硒,我国就有72%的地区缺硒[3]。因此,研究开发富硒食品或富硒蛋白食品添加剂具有重要的意义。况冲等人[4]利用黄豆的发芽过程,采用喷淋和浸泡硒酸盐溶液的人工富硒方式实现了黄豆对硒元素的生物富集,制备出的富硒黄豆芽粉富硒量为42.46 μg/g,且分离得到含硒量为21.24 μg/g的富硒大豆蛋白。然而,人工富硒的方式一般不易控制,易使硒元素在植物体内蓄积过量,且主要为无机硒[5]。江西丰城被誉为“中国生态硒谷”,富硒土壤中硒元素平均含量为0.28 μg/g,天然富硒大豆总硒含量可达到0.13 μg/g,为天然富硒蛋白的研究提供了基础条件。
分离纯化植物蛋白的方法有超速离心、EDTA加MgCl2分级沉淀、离子交换、利用HPLC分离制备等,但是这些方法操作复杂,费时,且费用昂贵。硫酸铵盐析沉淀分离蛋白法因其操作简便,价格低廉,可用于大规模生产,且对蛋白有保护作用而被广泛应用。因此,采用硫酸铵沉淀法分离富硒大豆蛋白具有一定的适用性。然而,分离纯化蛋白的硫酸铵溶液质量分数怎样确定及相应的富硒大豆蛋白分离组分的含硒量、结构特性如何,目前尚未见文献报道。本文通过不同质量分数的硫酸铵溶液对富硒大豆分离蛋白进行分级沉淀,分析其各分离组分的可溶性蛋白含量、硒含量、亚基组成,二级结构特点以及蛋白晶型和表面形态的差异,以获得纯化富硒大豆蛋白较佳的硫酸铵沉淀方法,为富硒蛋白的开发提供数据支持。
1 材料与方法
1.1材料与仪器
富硒大豆江西丰城富硒基地提供;预染标准分子量Mark(10~170 ku)美国Promega公司;丙烯酰胺(Acr)、甘氨酸、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、甲叉双丙烯酰胺、考马斯亮蓝(R-250)等美国Sigma公司;β-巯基乙醇、硫酸铵、硝酸、硫酸等国药集团化学试剂有限公司,化学试剂均为分析纯。
DELTA 320 pH计梅特勒-托利多仪器(上海)有限公司;PerkinElmer Lambda 25紫外可见分光光度计美国珀金埃尔默公司;Mini PROTEAN® 电泳仪美国Bio-Rad 公司;TGL-16C高速离心机上海安亭科学仪器有限公司;D8-Focus X-衍射仪德国布鲁克公司;230E-原子荧光光度计北京海光仪器有限公司;Agilent 5500原子力显微镜美国安捷伦公司。
1.2实验方法
1.2.1富硒大豆分离蛋白的制备及硫酸铵沉淀分离硫酸铵分级沉降富硒大豆分离蛋白的操作参照吴永尧等人[6]的方法并做适当修改。脱脂大豆粉按1∶15(m/v)加入去离子水并搅拌,用1 mol/L NaOH溶液调pH至8.0,室温下低速搅拌2 h,4800 r/min离心20 min,残渣重复提取,合并上清液用1 mol/L HCl调pH至4.5,静置30 min后再次离心分离,弃上清液,收集沉淀水洗两次,并将沉淀加水完全溶解,1 mol/L NaOH调pH至7.0,边搅拌边加入40%(m/v)硫酸铵粉末,完全溶解后放置4 ℃冰箱4 h,然后离心,沉淀即为40%-SPI;上清液加硫酸铵到60%,待溶解后置于4 ℃冰箱中2 h,离心,沉淀即为60%-SPI;上清液加硫酸铵至80%,操作同上,沉淀即为80%-SPI。分离得到的三种蛋白组分加原溶解液10%体积蒸馏水溶解并透析24 h,期间更换透析液多次直至滴入BaCl2溶液无白色沉淀析出为止,冷冻干燥,待用。
1.2.2分离蛋白中硒含量及可溶性蛋白含量的测定蛋白组分中硒含量的测定参考GB 5009.93-2010[7]中的原子荧光法进行。分别称取冻干样各0.1000 g,置于消化瓶中,加10.0 mL混合酸(V硝酸-V高氯酸=9-1),盖上表面皿,次日于电热板上加热,并及时补加硝酸。当溶液变为清亮无色并伴有白烟时,再继续加热至剩余体积为2 mL左右,不可蒸干。冷却,定容至25 mL,混匀待测,同时做空白实验。可溶性蛋白含量用Folin-酚法测定[8]。
1.2.3SDS-PAGE分析SDS-PAGE分析参考Laemmli报道的方法[9],浓缩胶和分离胶的质量浓度分别为5%和12.5%。蛋白质样品溶于0.05 mol/L Tris-HCl缓冲溶液(含质量分数1%的SDS,1%的β-巯基乙醇,50%的甘油和0.02%的溴酚蓝)中配制成质量浓度1 mg/mL的溶液,样品上样前煮沸5 min,离心(10000 r/min,10 min)。取上清液10 μL进样,电泳在室温下进行,浓缩胶中的电流恒定为25 mA,当样品前沿到达分离胶时电流改为30 mA。电泳结束后,凝胶染色采用0.25%考马斯亮蓝(R-250),脱色采用含甲醇和醋酸的去离子水溶液。
1.2.4圆二色光谱分析(CD)称取一定量的样品,用pH7.4磷酸盐缓冲液配制浓度为1 mg/mL的蛋白溶液。扫描远紫外区域(190~250 nm),速度为50 nm/min,光谱间隔0.1 nm,测得圆二色光谱。数据经origin 8.5进行拟合,并用分析网站(http://dichroweb.cryst. bbk.ac.uk/html/process.shtml)对蛋白二级结构进行模拟分析。
1.2.5X-射线衍射(XRD)XRD的测定参照Naidja[10]和Guerrero[11]等人报道的方法。蛋白样品的XRD模式,运用D8-Focus X-衍射仪进行测定。仪器参数:Cu Kα石墨单色器。电压40 kV,在2~50度范围内扫描速度为0.1°/s。
1.2.6原子力显微镜分析(AFM)参考耿胜荣等人[12]的方法并稍作修改。将冻干的蛋白粉用蒸馏水分别配成30 μg/mL和50 μg/mL的溶液,搅拌过夜。静置待不溶颗粒沉淀,分别吸取20 μL上清液,滴在各自新剥离的云母片(面积1.0 cm×1. 0 cm)上,自然晾干待用。样品准备应无任何污染,保证扫描的准确和探针的洁净。
1.2.7数据分析采用origin 9.2软件One-Way ANOVA对测试数据进行统计分析,p<0.05,Tukey test检验。
2 结果与分析
2.1硒含量及可溶性蛋白含量的分析
目前,常用的蛋白质含量测定方法有凯氏定氮法,Folin-酚试剂法(Lowry法),双缩脲法和紫外分光光度法[13]。Folin-酚试剂法蛋白质测定范围是25~250 μg,有操作简便,灵敏度高等优点,故而本实验采用Folin-酚法及原子荧光法分别测定了富硒蛋白的可溶性蛋白含量和总硒含量(如图1)。从图中可以看出,随着硫酸铵溶液盐析蛋白浓度的增大,可溶性蛋白含量逐渐下降,尤其是质量分数达到80%时,可溶性蛋白含量显著下降(p<0.05),其蛋白含量依次为0.749、0.714、0.704、0.596 g/g;同时,其硒含量依次为0.281、0.270、0.318、0.228 mg/kg,当硫酸铵溶液分离浓度为60%时,硒含量相对最高。因此,采用质量分数为60%的硫酸铵溶液分离富硒大豆蛋白,可溶性蛋白含量高,且硒含量较高(实际上,60%-SPI的产率还远大于其它组分)。
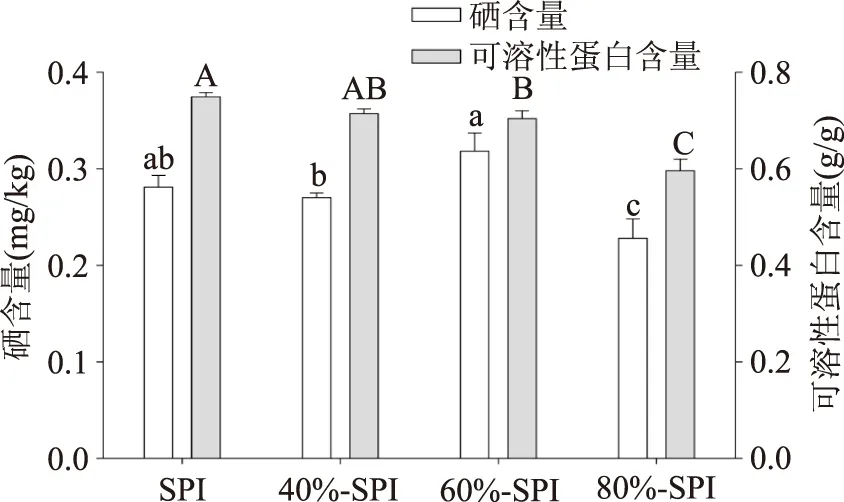
图1 SPI及其分离组分的蛋白含量及硒含量分布Fig.1 Selenium contents and protein content of SPIs
2.2SDS-PAGE分析
SPI经不同质量浓度硫酸铵溶液分离得到组分的亚基组成,通过SDS-PAGE鉴定如图2所示。从图中可以看到,在还原条件下富硒大豆蛋白结构中的二硫键断裂,主要形成8条蛋白亚基条带,40%-SPI和粗分离SPI的亚基组成没有明显变化,60%-SPI在35~40 ku以下的亚基条带颜色加深,说明这些亚基含量相对较多;80%-SPI中40~100 ku的条带灰度加深即蛋白亚基含量增加,40 ku以下则蛋白亚基含量减少。胡居吾等[14]研究发现富硒大豆分离蛋白质量分数在15~25 ku的蛋白亚基硒含量最高,质量分数在70~100 ku的亚基硒含量最低,而60%-SPI分子量主要在15~40 ku,80%-SPI分子量主要在40~80 ku,这与前面60%-SPI硒含量最高相一致,表明当硫酸铵质量分数为60%时分离得到的蛋白中硒含量最高。此外,60%-SPI和80%-SPI与negano法[15]得到的7S和11S的蛋白亚基条带相似,即60%-SPI与11S球蛋白(17505~40459 u),80%-SPI与7S球蛋白(56242~77740 u)分别有相似的电泳条带。60%和80%质量分数硫酸铵分离得到的蛋白是否是11S和7S还有待进一步研究,但是此方法也可以用于7S和11S的纯化。
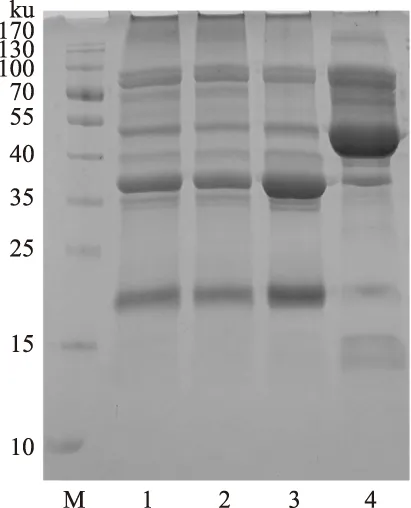
图2 大豆蛋白及其分离组分的SDS-PAGE电泳图Fig.2 SDS-PAGE profiles of SPIs 注:M:标准蛋白;1、2、3、4分别为SPI、40%-SPI、60%-SPI、80%-SPI。
2.3圆二色光谱(CD)分析
CD图谱在190~240 nm紫外波段可反映蛋白质等生物大分子的主链构象,能表现出各种二级结构的光谱之和即α-螺旋、β-折叠、β-转角和无规则卷曲结构的线性叠加。参考SPI二级结构的相关文献可知,具有α-螺旋构象的分子在190 nm附近有正峰,在208 nm和220 nm附近呈负峰;β-折叠存在于216 nm附近的负峰和185~200 nm的正谱带;β-转角在206 nm附近有一正峰;无规则卷曲构象在198 nm附近有负峰,在220 nm附近有小而宽的正峰[16]。SPI及其分离组分的CD拟合图见图3,且通过软件计算得到的二级结构信息见表1。
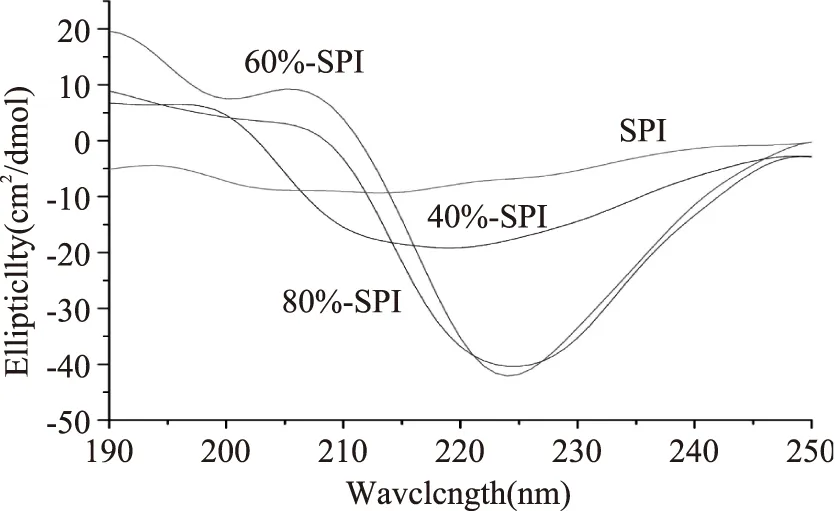
图3 SPI及其分离组分的CD拟合图Fig.3 CD fit figure of SPIs
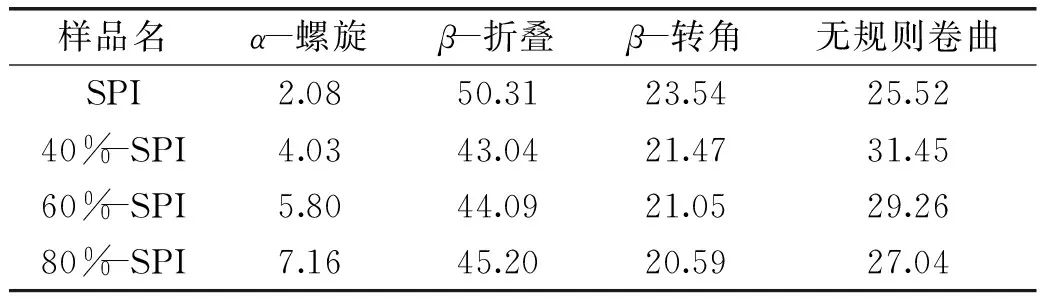
样品名α-螺旋β-折叠β-转角无规则卷曲SPI2.0850.3123.5425.5240%-SPI4.0343.0421.4731.4560%-SPI5.8044.0921.0529.2680%-SPI7.1645.2020.5927.04
α-螺旋和β-折叠代表蛋白质分子的有序性[17],β-折叠结构组成变化是蛋白质二级结构变化的一个主要特征[18],β-转角和无规则卷曲结构均反映蛋白质分子松散程度[19]。研究表明,硒和硫有相同的代谢途径,故在蛋白质的合成过程中硒代替了甲硫氨酸或半胱氨酸中的硫或取代了二硫键中的硫以GSHSeGSH,SeMet,MeSeCys,或γGluMeSeCys,CysSeSeCys的形式存在。如果硒取代了C-S-S-C中的硫以C-Se-Se-C的形式存在必将影响蛋白质的二级结构。实验结果显示,不同质量分数硫酸铵分离得到的富硒大豆蛋白组分相对于粗提富硒SPI,均出现α-螺旋和无规则卷曲含量增加,β-折叠、β-转角含量减小。且随着硫酸铵溶液浓度的增加,α-螺旋和β-折叠含量均逐渐增加,β-转角和无规则卷曲结构均逐渐较少,说明随着硫酸铵含量的增加,分离得到的富硒大豆蛋白的有序性得到提高,可能的原因,主要是由于盐析的蛋白组份的不同造成蛋白结构的变化,而二级结构的变化是否由硒的取代所引起还需要做进一步的研究。
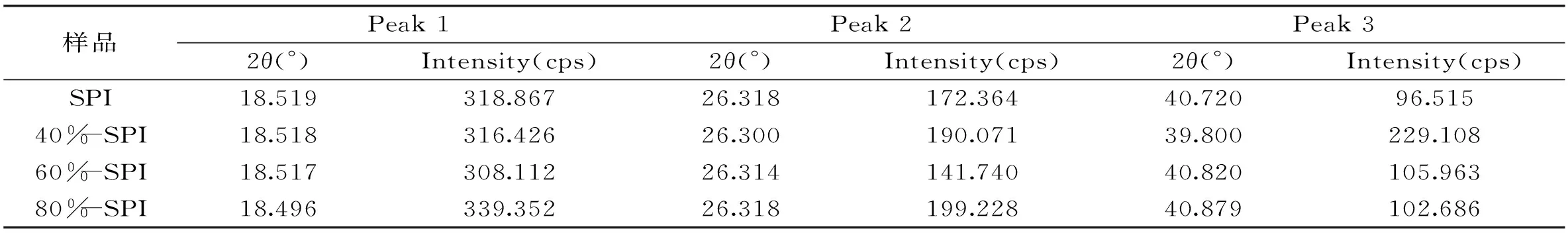
表2 SPIs的XRD图上的峰值参数
2.4X-射线衍射(XRD)
X射线衍射已经成为研究晶体物质和某些无定形态物质微观结构的有效方法。在本实验中采用了X射线衍射技术,研究富硒SPI及其硫酸铵分离蛋白组分衍射的差异,结果见图4及表2。从图4中可以看出,无论是SPI或其分离组分晶面主衍射峰为2θ≈18.5°附近的位置。这表明不同质量分数硫酸铵处理对大豆富硒蛋白的晶型没有形成明显影响,即没有改变晶层的距离。此外,相对于SPI,40%-SPI、80%-SPI在2θ≈26.3°和2θ≈40°处的衍射峰增强且峰变窄,说明在此衍射角处的晶体较多;且60%、80%浓度硫酸铵处理对大豆富硒蛋白的衍射角在2θ≈40°处均有右移的迹象,40%浓度硫酸铵处理蛋白组份衍射峰整体向左移动,这些现象说明不同质量分数硫酸铵分离得到的富硒大豆蛋白组分的晶型有所差异,即蛋白之间存在差别,这与电泳得到的结果相一致。
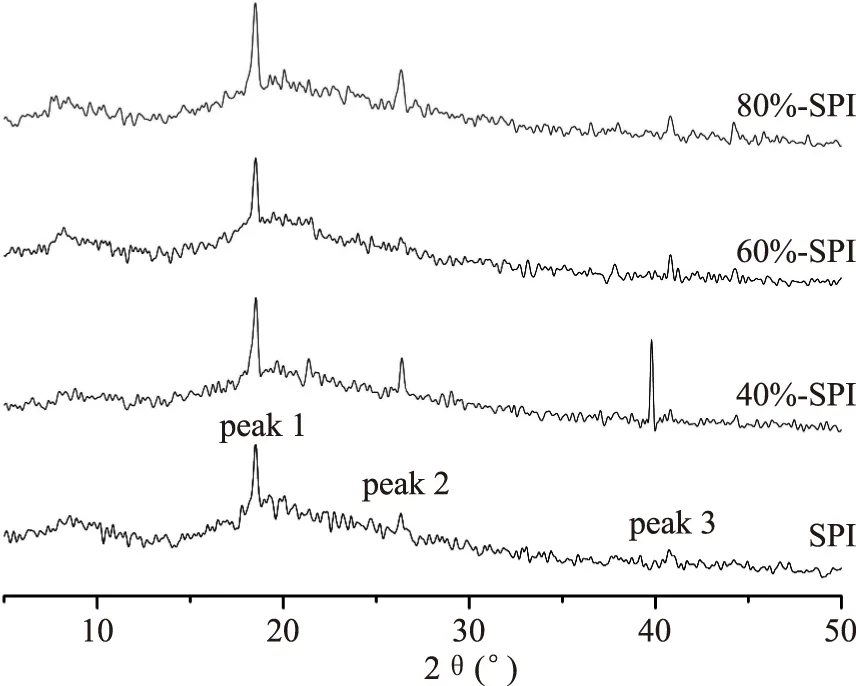
图4 SPI及其分离组分的XRD图Fig.4 XRD analysis of SPIs
2.5原子力显微镜分析(AFM)
图5A是富硒SPI及其硫酸铵处理组分配制成50 μg/mL蛋白溶解液的原子力显微镜三维图,图5B是其二维图。从图中可以直观的看到样品表面的高低起伏,可以看出不同质量分数硫酸铵分离得到的富硒大豆蛋白组分的表面形态有较大的差异,且蛋白组分之间随着硫酸铵含量的增加,富硒大豆蛋白颗粒逐渐变小;图中还可以看出40%-SPI的颗粒最大,聚集度高,表面凸起较高(40 nm),60%-SPI有尖锐凸起且密度很高,从80%-SPI的三维图中可以看到凸起的蛋白颗粒很少,且高度只有4.4 nm相对40%-SPI的40 nm其颗粒很小。结果表明随着硫酸铵含量的增加,分离得到的大豆蛋白的颗粒越来越小,这与上文CD结果“随着硫酸铵含量的增加得到的分离蛋白组分的结构有序性增加”存在一致性。

图5 SPI及其分离组分的AFMFig.5 AFM analysis of SPIs 注:a~d:SPI,40%-SPI,60%-SPI,80%-SPI。
3 结论
不同质量分数硫酸铵溶液分级沉淀得到的大豆富硒蛋白组分存在着较大差异,60%-SPI的可溶性蛋白含量,硒含量都较高。硫酸铵处理后的SPI组分α-螺旋含量增加,β-折叠、β-转角含量均减小,说明硫酸铵分离得到的蛋白的结构有序性得到提高。X-射线衍射和原子力显微镜结果表明大豆富硒蛋白组分的晶型和表面形态也存在较大差异。综合来看,分离纯化大豆富硒蛋白,较佳的硫酸铵质量分数为60%。
[1]Allan C B,Lacourciere G M,Stadtman TC. Responsiveness of selenoproteins to dietary selenium[J]. Annual Review of Nutrition,1999,19:1-16.
[2]Letavayova L,Vlckova V,Brozmanova J. Selenium:From cancer prevention to DNA damage[J]. Toxicology,2006,227(1-2):1-14.
[3]向天勇.大豆硒蛋白的生理功能及抗肿瘤活性研究[D].长沙:湖南农业大学,2003.
[4]况冲,郭晓玲,张永忠,等.富硒大豆蛋白的研制[J].食品工业科技,2008,6:194-194.
[5]Hladun KR,DR Parker JT. Trumble. Selenium accumulation in the floral tissues of two Brassicaceae species and its impact on floral traits and plant performance[J]. Environmental and Experimental Botany,2011,74:90-97.
[6]吴永尧,罗泽民,陈建英,等.水稻硒蛋白及其硒结合形态研究[J].华中师范大学学报,2000,6(34):224-225.
[7]中华人民共和国卫生部GB5009.93-2010食品安全国家标准-食品中硒的测定[S].北京:中国标准出版社,2010(3).
[8]Lowry O H,Rosebrough N J,Farr A L,et al.(1951). Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,193(1):265-275.
[9]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,277:680-685.
[10]Naidja A,Liu C,Huang P M. Formation of protein-birnessite complex:XRD,FTIR,and AFM analysis[J]. Journal of Colloid and Interface Science,2002,251(1):46-56.
[11]Guerrero P,Beatty E,Kerry J P,et al. Extrusion of soy protein with gelatin and sugars at low moisture content[J]. Journal of Food Engineering,2012,110(1):53-59.
[12]耿胜荣,李新.用AFM分析魔芋辐照接枝聚合物的构效关系[J].原子能科学技术,2010,8:1020-1022.
[13]吴梧桐.生物化学[M].北京:第4版,人民卫生出版社,2001,81-82.
[14]Hu J,Zhao Q,Cheng X,et al. Antioxidant activities of Se-SPI produced from soybean as accumulation and biotransformation reactor of natural selenium[J]. Food Chemistry,2014,146:531-537.
[15]王孝英,张雪旺,刘汉灵.7S和11S大豆球蛋白的分离研究[J].中国食品添剂,2006:75-77.
[16]Venkateswarlu U,Boopalan K,Mohan R,et al. Studies on chemically modified hen egg white and gelatin composites[J]. Journal of Applied Polymer Science,2006,100(1):318-322.
[17]Hatanaka Y,Yamauchi A,Kobayashi,et al. Electron microscopic analysis of the effects of tea extract on strength improvement of egg white gels[J]. Food Science and Technology Research,2009,15(1):5-10.
[18]孙冰玉,刘琳琳,张光,等. 高温高湿对大豆分离蛋白二级结构及乳化性的影响[J].大豆科技,2014,4:26-31.
[19]杨万根.蛋清蛋白水解物的制备、结构及其生物活性研究[D].无锡:江南大学,2008.
Preliminary study on ammonium sulfate precipitation of selenium-enriched soybean protein isolate
ZHAO Xiao-li,FU Yang,ZHAO Qiang*,NING Fang-jian,XIONG Hua
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
In this study,soybean protein isolate(SPI)was extracted by alkali extraction and acid precipitation from natural selenium-enriched soybean,and SPI was sequentially precipitated by 40%,60%,and 80% of ammonium sulfate to obtain three protein fractions,which were 40%-SPI,60%-SPI,and 80%-SPI. In order to explore ways of selenium-enriched SPI fractionation by ammonium sulfate,the differences among the protein fractions were compared. The results showed that 60%-SPI had highest protein purity and selenium content. CD spectroscopy and SDS-PAGE results showed that the secondary structure and subunit composition were significantly different among the fractions. Through X-ray diffraction and atomic force microscopy,it found that crystal morphology and surface protein composition of the three fractions also varied widely. Therefore,ammonium sulfate salting precipitation was an effective primary screening method for separating selenium-enriched SPI with difference components,and 60% ammonium sulfate concentration was preferred.
Selenium-enriched soybean protein;ammonium sulfate precipitation;secondary structure;SDS-PAGE;Surface morphology
2016-01-14
赵小莉(1991-),女,硕士研究生,研究方向:大豆含硒蛋白化学与功能,E-mail:1303781824@qq.com。
赵强(1981-),男,博士,副研究员,研究方向:植物蛋白质化学与营养、食品资源开发与综合利用、乳液及微胶囊等,E-mail:qiangzhao@ncu.edu.cn。
国家自然科学基金项目(31301436)。
TS202.3
A
1002-0306(2016)13-0092-05
10.13386/j.issn1002-0306.2016.13.010

