家蚕血淋巴体外黑化观察及相关黑色素合成催化酶基因
李田,张亮,申琦,赵威,李黎,吕银,蒋贵兵,闫登峰,肖俊杰,陈萍
1 西南大学 生物技术学院,重庆 4007162 重庆市蚕业管理总站,重庆 400716
农业生物技术
家蚕血淋巴体外黑化观察及相关黑色素合成催化酶基因
李田1,张亮1,申琦1,赵威1,李黎1,吕银1,蒋贵兵2,闫登峰1,肖俊杰1,陈萍1
1 西南大学 生物技术学院,重庆 400716
2 重庆市蚕业管理总站,重庆 400716
李田, 张亮, 申琦, 等. 家蚕血淋巴体外黑化观察及相关黑色素合成催化酶基因. 生物工程学报, 2016, 32(8): 1093-1103.
Li T, Zhang L, Shen Q, et al. In vitro observation of haemolymph melanization and melanin-related biosynthesis enzyme genes in silkworm, Bombyx mori. Chin J Biotech, 2016, 32(8): 1093-1103.
观察不同生长期家蚕幼虫血淋巴在体外的黑化速度和对大肠杆菌生长的影响结果显示,随食桑生长幼虫血淋巴的黑化速度逐渐变快,对大肠杆菌生长的抑制作用逐渐增强。RT-PCR实验显示,黑色素合成催化酶BmTan、BmPo-1、BmYellow-f和BmDdc等的基因在家蚕5 L 3 d血淋巴中表达量高,BmBlack、BmYellow 和BmPah等的基因也有明显表达。qPCR分析显示,黑化病蚕中Bmtan、Bmddc、Bmyellow、Bmebony和Bmblack,尤其Bmddc表达发生了显著上调。与对照相比,Ddc酶的抑制剂能显著抑制脂多糖对血淋巴的诱导黑化作用。用大肠杆菌注射家蚕幼虫,血淋巴中多巴和多巴胺的含量明显上升。这些表明家蚕幼虫血淋巴黑化与防御免疫有关,Bmddc很可能在幼虫血淋巴的免疫黑化中发挥作用。
家蚕血淋巴,黑化反应,黑色素合成催化酶,免疫应答
昆虫是地球上最庞大的生物种群,分布于除深海外的各种自然环境中[1],具有极强的环境适应能力和防御免疫能力。昆虫为开放式血液循环,所有组织器官浸浴在血淋巴中,当外源物攻破昆虫体壁这个物理屏障后,首先面对的是血淋巴,血淋巴是昆虫免疫防卫的重要组织。昆虫免疫防御中常有黑化现象。黑色素形成过程中产生的自由氧 (ROI)、自由氮 (RNI) 以及醌类等多种有毒分子物质,对核酸、蛋白质和细胞膜等有破坏作用[2-3]。在昆虫体内被黑化的细菌置于固体培养基上几乎不会生长[4],注入烟草天蛾Manduca sexta体内的荧光微球体被血淋巴黑化包裹[5],用含大肠杆菌Escherichia coli或金黄色葡萄球菌 Staphylococcus aureus的钨丝针穿刺黑腹果蝇Drosophila melanogaster胸部,伤口处的细菌被黑化[6]。埃及伊蚊Aedes aegypti中发现的免疫黑化蛋白酶 (Immune melanization proteases,IMP-1和IMP-2) 可以通过调控血淋巴黑化来抑制病原物生长[7]。这些表明,黑化反应不仅是昆虫免疫应答的一个伴随现象,而且是昆虫进行免疫防卫的一种手段。
家蚕Bombyx mori是重要的经济昆虫,也是研究鳞翅目的模式昆虫,有关家蚕的免疫防御机制受到高度关注。在免疫黑化方面,许平震等[8]克隆鉴定出家蚕14个模式识别受体编码基因,其中包括10个肽聚糖识别蛋白 (PGRP) 基因和4个β-葡聚糖识别蛋白 (βGRP) 基因。赵萍等[9]从家蚕基因组上共鉴定了 143个家蚕丝氨酸蛋白酶基因,80种丝氨酸蛋白酶抑制剂基因。最近徐曼等[10]认为Bm lz基因能够通过诱导酚氧化酶原的表达增强血淋巴黑化作用。这些研究多集中于黑色素合成上游酚氧化酶原级联反应及调控过程。对于黑色素合成下游相关催化酶基因的研究,在所有昆虫中果蝇Drosophila研究的最为清楚[11]。2011年于红松等[12]通过生物信息学方法从家蚕基因组中搜索到与果蝇同源的 9个黑色素合成途径相关基因并进行了鉴定与分析。有研究证明家蚕黑色素代谢途径上催化酶酪氨酸羟化酶 (Tyrosine hydroxylase,Th)、 N-β-丙酰多巴胺合成酶 (N-βalanyldopam ine synthetase,Ebony)、N-β-丙酰多巴胺水解酶 (N-β-alanyldopam ine hydrolase,Tan)、芳香烷基N-乙酰转移酶(Arylalkylam ine-N-acetyl transferase,Dat)、苯丙氨酸羟化酶 (Phenylalanine hydroxylase,Pah)和鸟苷三磷酸环化水解酶 (Guanosine triphosphate cyclohydrolase,GTPCH I) 等编码基因的表达与体壁斑纹黑色素的形成及沉积相关[13-18]。本研究调查了不同生长期家蚕幼虫血淋巴的黑化能力及其免疫防卫能力,分析了黑色素合成催化酶基因及其编码产物与家蚕血淋巴免疫的关系,为进一步全面揭示家蚕免疫防御机制提供更多的信息和基础。
1 材料与方法
1.1供试材料
供试家蚕品种大造 (由本实验室保存),幼虫常规条件下用桑叶饲养。大肠杆菌为本实验室保存菌种,实验中使用的大肠杆菌为过夜活化的新鲜菌液 (OD600约为0.8)。
1.2总RNA的提取、cDNA合成及引物设计
参照Trizol (Invitrogen公司) 试剂盒说明书提取总RNA。将组织用液氮研磨后加入Trizol,室温放置5 m in充分裂解后12 000 r/m in离心5 m in,取上清并加入200 µL氯仿振荡混匀,放置10 m in后12 000 r/m in离心15 m in,吸取上层水相并加入 500 µL异丙醇混匀,室温放置15 m in后12 000 r/m in离心10 m in,弃上清,RNA沉淀用75%乙醇洗涤2次,室温晾干后用DEPC水溶解RNA沉淀,利用微量紫外分光光度计测定RNA浓度。利用M-MLV反转录酶 (Promega公司),合成cDNA第一链[19]。基于家蚕基因组数据库设计引物,引物序列见表1,实验用引物均由上海生物工程技术服务有限公司合成。
1.3RT-PCR分析
PCR反应条件:94 ℃预变性4 m in;94 ℃变性40 s,54 ℃退火45 s,72 ℃延伸50 s,33个循环;72 ℃延伸10 m in,12 ℃保存。对PCR扩增产物进行1%琼脂糖凝胶电泳,溴化乙锭染色观察。
1.4荧光定量PCR检测
利用家蚕转录起始因子4A基因(BGIBMGA003186) 作为内参。荧光定量 PCR反应仪器为ABI7500Fast,反应体系为20 µL,热启动程序为95 ℃30 s;95 ℃5 s,60 ℃30 s,共40个循环。其中每个模板进行3次重复实验,将获得的数据采用 2-ΔΔCt法进行基因相对表达分析。
1.5HPLC测定多巴和多巴胺含量
多巴、多巴胺样品制备:收集家蚕血淋巴并加入等体积盐酸缓冲液。在4 ℃、10 000 r/m in条件下离心10 m in后取上清液煮沸10 min,冷却后加入等体积氯仿并颠倒混匀,4 ℃、10 000 r/min离心15 m in,取上清液过滤 (0.22 µm滤膜) 后作为上机样品。

表1 引物序列Tab le 1 Prim er sequences
HPLC测定条件:色谱柱为C18柱,流动相为甲醇-水 (体积比为8∶100),流速为0.8 m L/min。物质检测的激发波长为 280 nm,吸收波长为320 nm,检测温度为30 ℃。
标准曲线绘制:先制备质量浓度为1 g/L母液,再将母液稀释成不同浓度梯度后上机,根据浓度梯度和对应的峰面积做标准曲线。多巴和多巴胺标准品测得 R2值分别为 0.999和0.996,说明标准曲线的拟合度较好 (图1),可以用于实验测定。
多巴、多巴胺含量计算:采用峰保留值比较法和叠加法进行定性分析,利用外标法测峰面积对应标样的回归方程计算含量。
1.6大肠杆菌生长观察
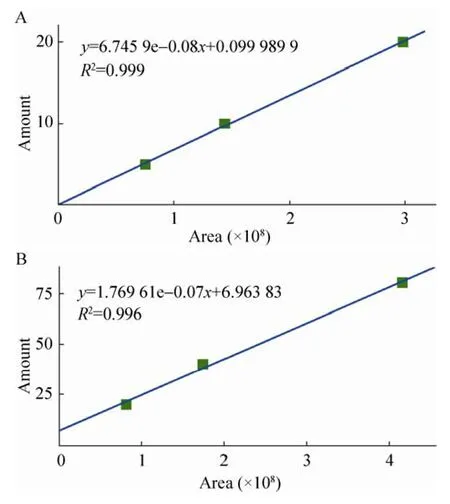
图1 多巴 (A)、多巴胺 (B) 标准曲线Fig. 1 Dopa and Dopam ine standard curve. (A) Dopa. (B) Dopam ine.
在毛细针中将家蚕血淋巴与大肠杆菌新鲜菌液混合 6 h后通过无菌空气尽可能把其中所有液体打出涂板,37 ℃人工气候培养箱中培养12 h,统计菌落数。每组实验重复3次。
2 结果与分析
2.1不同龄期家蚕血淋巴体外黑化观察
我们选取4龄第1天至5龄第6天的幼虫来调查家蚕不同生长时期血淋巴黑化是否有差异,以及在不同保护温度下血淋巴黑化是否有差异。观察仍在毛细针中进行[20],血淋巴体积为10 µL。
对于4龄期共4 d的血淋巴来说 (图2A),体外放置0.5 h时均保持透明状态;放置12 h时,4龄第1天 (4 L 1 d) 的血淋巴仍保持透明状态,但4 L 2 d的血淋巴能在毛细针粗端看到颜色略微加深,且4 L 3 d和4 L 4 d的血淋巴能在毛细针粗端看到明显黑褐色;放置24 h时,4 L 1 d的血淋巴就能看到毛细针粗端颜色加深,4 L 2 d、4 L 3 d和4 L 4 d的血淋巴有明显的黑褐色,并有随幼虫食桑生长经过时间增加黑化程度更强的趋势。
对于5龄期共6个不同生长时间的幼虫血淋巴,体外放置0.5 h时,除低温4 ℃保持透明状态外,在室温和高温37 ℃保护的毛细针粗端均出现明显的黑褐色,且黑褐色随幼虫经过时间增加逐渐加深并向毛细针细端扩展;放置12 h时,除5 L 1 d在4 ℃保护的血淋巴未见明显变色外,其他样品都有明显的黑褐色,并有随幼虫食桑生长和样品的保护温度提高、血淋巴变黑程度越深范围越广的初步特征;放置24 h时,所有血淋巴样品都见黑褐色,从5龄初到5龄盛食期以及5龄上蔟前,血淋巴黑化程度和黑化范围随幼虫经过时间逐步变得更深更广,这个现象特征比前面更加明显突出 (图2B)。

图 2 毛细针管内不同龄期家蚕血淋巴黑化的过程观察Fig. 2 M elanization of haemolymph using different instars of silkworm in the capillary w ith time. (A) Days 4th instar larvae haemolymph. (B) Days 5th instar larvae haemolymph. RT: room temperateure.
总之,血淋巴在毛细针中的黑化速度和程度与家蚕幼虫不同生长时期以及保护温度都有明显关系。5龄期的血淋巴比4龄期的黑化快;同一龄期内,龄初的血淋巴黑化较慢,龄末的血淋巴黑化较快;低温 4 ℃保护的血淋巴变黑速度最慢,其次是室温,37 ℃黑化最快。
2.2不同龄期家蚕血淋巴对大肠杆菌生长的影响
为了探究家蚕血淋巴黑化作用的强弱与其杀灭外源微生物的能力是否相关,我们根据前面不同生长期幼虫血淋巴的体外黑化观察实验,分别选取4 L 3 d和5 L 6 d两个龄期的幼虫血淋巴进行实验。用7.5 µL血淋巴与2.5 µL大肠杆菌混合6 h后,观察大肠杆菌生长状况。同等条件下用7.5 µL PBS缓冲液 (pH 7.4) 代替家蚕血淋巴作对照。大肠杆菌与4 L 3 d幼虫血淋巴混合反应6 h后,平均菌落数为32个,与5 L 6 d家蚕血淋巴混合后平均菌落数为 8个,与 PBS混合 (对照) 后的平均菌落数为51个。大肠杆菌与家蚕血淋巴混合后生长受到抑制,菌落数目明显减少,达到统计学上的显著性;黑化较强的5 L 6 d家蚕血淋巴对大肠杆菌生长的抑制作用比黑化较弱的4 L 1 d血淋巴的抑制作用更强、效果更好,它们之间的差异达到统计学上的极显著水平。结果如图 3所示。这些暗示家蚕幼虫血淋巴的黑化作用与防御免疫作用有关。
2.3血淋巴中黑色素合成相关催化酶基因表达分析
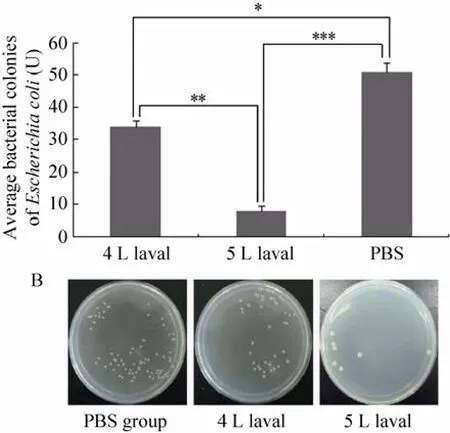
图 3 不同龄期家蚕血淋巴对体外培养大肠杆菌增殖的影响Fig. 3 Influence of haemolymph using different instars of silkworm on the proliferation of Escherichia coli cultured in vitro. (A) The statistical analysis on the bacteria colonies between 4 L 3 d instar larvae haemolymph and 5 L 6 d instar larvae haemolymph. *P<0.05, **P<0.01 and ***P<0.001. (B) Direct-view ing the bacteria colonies.
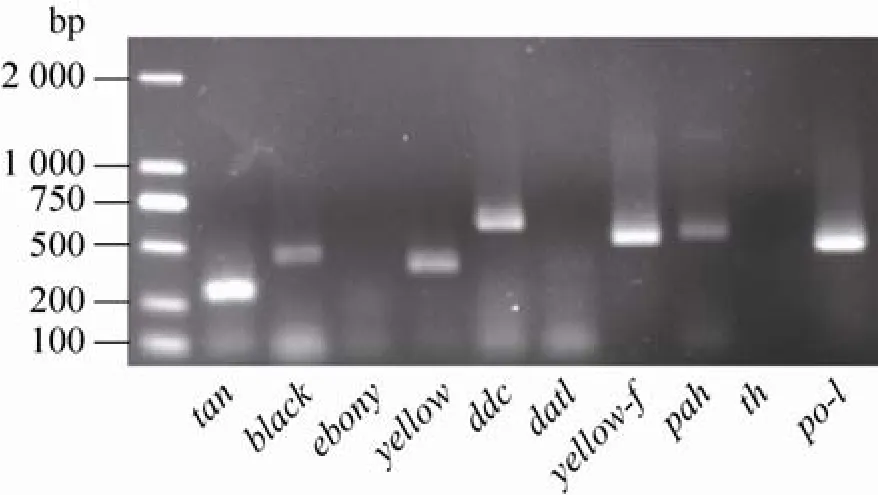
图4 黑色素合成相关催化酶基因在5 L 3 d家蚕血淋巴中的表达模式Fig. 4 Expression pattern of enzyme genes related to melanin biosynthesis in 5 L 3 d instar larvae haemolymph.
黑色素合成需要多个步骤、多个酶参与一系列催化反应,其中各个步骤的催化酶是黑色素合成的关键。家蚕造血器官功能发挥在5 L 3 d有一个高峰[21]。我们用RT-PCR分析5 L 3 d家蚕血淋巴中目前已报道的与黑色素合成相关的 Bmpah、Bmth、Bmblack、Bmyellow、Bmyellow-f、Bmdat1、Bmebony、Bmtan、Bmpo-1和Bmddc等10个基因的表达量。结果显示 (图 4),Bmtan (283 bp)、Bmpo-1 (500 bp)、Bmyellow-f (549 bp) 和Bmddc (663 bp) 等4个基因在正常血淋巴中均有高量表达,Bmblack (487 bp)、Bmyellow (464 bp) 和Bmpah (566 bp) 等 3个基因有清楚的扩增带,未发现Bmth、Bmebony和Bmdat1等3个基因明显的扩增带。
2.4黑色素合成催化酶基因在黑化病蚕与正常蚕之间的表达差异分析
被蝇蛆寄生的家蚕,体壁上都有一个病原物进入体腔的黑色创口 (图5A)。发病严重的幼虫通体透出黑褐色,体腔内所有组织器官浸浴在黑褐色体液中,有腐烂趋势,容易断离。
为了探究黑化病蚕与黑色素合成催化酶基因是否有关,我们选取 5龄相同生长期的健康幼虫 (熟蚕) 和被蝇蛆寄生通体透出黑褐色的幼虫 (图5B),用q-PCR比较相关黑色素合成催化酶基因的表达差异。结果显示,Bmpah、Bmth、Bmblack、Bmddc、Bmyellow和Bmebony等6个基因在两种蚕体中的表达量均发生明显变化。除Bmpah在黑化病蚕中的表达量减少外,其余5个基因的表达水平在黑化病蚕中显著增加,尤其是Bmddc表达发生显著上调,表明黑化的病蚕能够引起黑色素代谢相关基因表达量的变化。
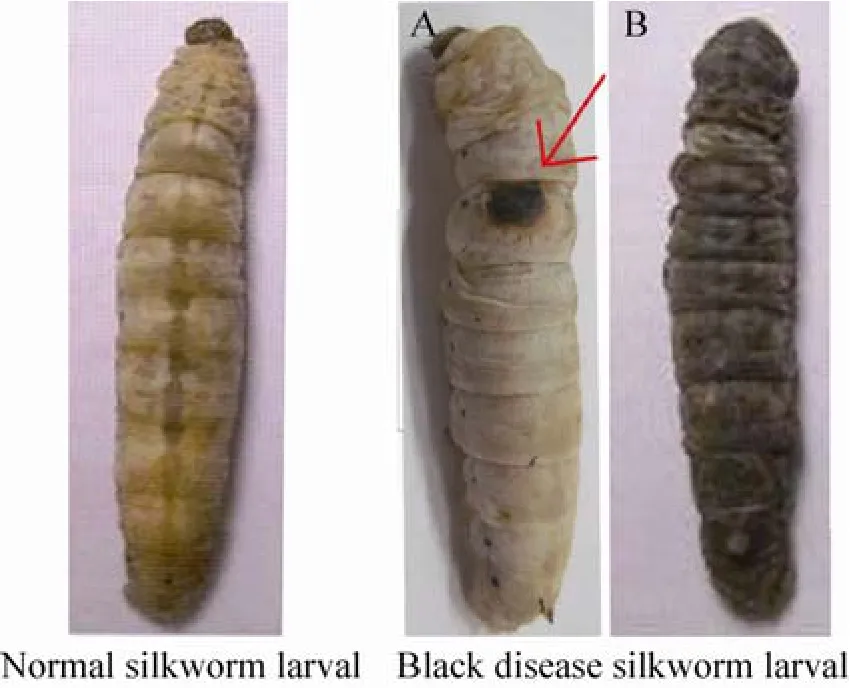
图5 正常上蔟蚕和黑化病蚕图Fig. 5 Normal and black disease silkworm larval. (A)The early stage of silkworm being bit by flies. (B) The later stage of silkworm being bit by flies. The red arrow refers to flies bites.

图 6 黑化病蚕中黑色素合成相关催化酶基因的表达分析Fig. 6 Effects of black disease silkworm on the relative expression of enzyme genes related to melanin biosynthesis. *P<0.05, **P<0.01 and ***P<0.001,compared to the relative expression in normal silkworm.
2.5多巴脱羧酶 (Ddc) 抑制剂对血淋巴黑化的影响
多巴脱羧酶 (Ddc) 基因在5 L 3 d家蚕血淋巴中高量表达,在黑化病蚕中相比正常蚕体表达上调极显著。为了探究 Ddc是否在家蚕血淋巴黑化中发挥催化作用,我们用 Ddc酶活性的特异抑制剂卡比多巴 (大连美仑) 来进行实验。革兰氏阴性菌胞壁主要成分脂多糖 (LPS,Sigma) 能够迅速诱导家蚕体外血淋巴发生黑化反应[20]。用5 L 3 d家蚕血淋巴7.5 µL与2.5 µL卡比多巴 (10 mg/m L,PBS为溶剂) 及2.5 µL LPS (1 mg/m L) 混合,PBS代替卡比多巴作为对照。观察记录时间点为混合后0、0.5、24 h。
由图7中我们可以看出0 h时两组毛细针中血淋巴呈透明状,几分钟后PBS组毛细针粗端能看到颜色稍有加深,0.5 h后LPS诱导血淋巴明显变黑,而加入卡比多巴的毛细针在0.5 h才见粗端血淋巴颜色有微弱加深,在24 h时PBS组整个毛细针管中血淋巴变为黑褐色并逐渐向细端延伸,而加入卡比多巴的血淋巴在24 h时呈黄色,整个过程中没有出现血淋巴黑化现象。表明卡比多巴能够抑制家蚕血淋巴黑化作用,即Ddc与家蚕血淋巴黑化作用有关。
2.6血淋巴中多巴 (Dopa) 和多巴胺(Dopam ine)含量
Ddc是使Dopa转化成Dopam ine的重要催化酶[22]。Dopa和Dopam ine是黑色素合成的重要前驱物,对微生物的生长具有抑制作用[20]。用5 µL大肠杆菌注射5 L 3 d家蚕,然后用HPLC检测幼虫血淋巴中Dopa和Dopam ine含量,检测时间为注射后6 h和24 h。以PBS代替大肠杆菌注射幼虫为对照。每组重复3次,Dopa和Dopam ine含量是3次结果的平均。

图7 卡比多巴对家蚕血淋巴黑化的影响Fig. 7 Influence of carbidopa on melanization of silkworm haemolymph.

图8 多巴和多巴胺的色谱图Fig. 8 Chromatograms of Dopa and Dopam ine. (A) The standards. (B) The experimental group.
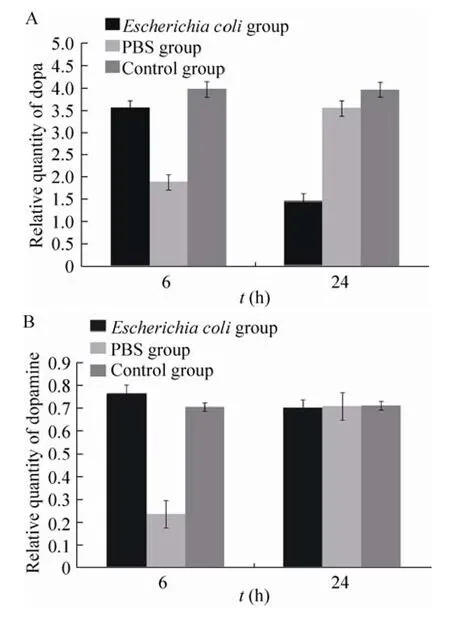
图 9 大肠杆菌感染后血淋巴中多巴和多巴胺含量检测Fig. 9 Dopa and Dopam ine content detection in silkworm haemolymph induced by Escherichia coli. (A) Dopa. (B) Dopam ine.
正常条件下家蚕体内 Dopa含量远远高于Dopamine含量。未注射 (对照组) 时家蚕体内Dopa和Dopam ine含量保持稳定;注射PBS后6 h,Dopa和Dopam ine含量均明显降低,且24 h时基本恢复正常水平;注射大肠杆菌后6 h相比PBS组来说,Dopa含量升高了88.5%,Dopam ine含量升高了2.3倍,24 h时Dopam ine含量恢复正常而Dopa含量相比PBS组降低了59.0%。
3 讨论
不同生长期家蚕幼虫的血淋巴在体外黑化的速度不同:5龄幼虫血淋巴比4龄的黑化速度快,同一龄期内末龄幼虫血淋巴比龄初幼虫血淋巴黑化快。4 L 3 d和5 L 6 d的幼虫血淋巴对大肠杆菌生长均有抑制作用,其中5 L 6 d的幼虫血淋巴抑制作用比4 L 3 d更强。这些表明随家蚕幼虫食桑生长,血淋巴黑化速度变快,其防御免疫能力变强。这与先前认为家蚕幼虫对病原物的抵抗能力随生长发育增强的主要原因是由于体重的增加稀释了病原物而引起的观点[23]不一致。
家蚕幼虫生长发育到5龄第3天,其造血器官功能发挥达到顶峰,此时血淋巴中基因的表达情况与血淋巴功能的发挥可能具有联系。RT-PCR实验显示,黑色素合成催化酶Bm Tan、BmPo-1、BmYellow-f和BmDdc等的基因在家蚕5 L 3 d血淋巴中有较高的表达,Bm Black、BmYellow和BmPah等的基因在5 L 3 d血淋巴中也有明显表达。差异分析显示,黑化病蚕中Bm tan、Bmddc、Bmyellow、Bmebony和Bmblack,尤其Bmddc表达发生了显著上调。这些基因在其他昆虫的免疫黑化研究中也有报道,如苯丙氨酸羟化酶基因 (pah) 和 ddc在埃及伊蚊 Ae. Aegypti和骚扰阿蚊Armigeres subalbatus[24-25]、酪氨酸羟化酶基因 (th) 在甜菜夜蛾Spodoptera exigua[26]、N-β丙酰多巴胺合成酶基因 (ebony)和 ddc在地中海实蝇 Ceratitis capitata[27-28]、ebony在拟步行虫Tenebrio molitor[27]等。
Ddc酶的抑制剂能显著抑制LPS对血淋巴的诱导黑化作用,说明 Ddc酶与家蚕血淋巴免疫黑化作用有关。BmDdc定位于家蚕BmN细胞中靠近核周围的细胞质中[29]。地中海实蝇中的ddc参与先天免疫反应,调控血细胞的吞噬、小结和黑化作用[28]。结合Bmddc在家蚕5 L 3 d血淋巴中高量表达以及在黑化病蚕中表达显著上调,我们认为,Bmddc在家蚕血淋巴的免疫黑化中扮演了重要角色。
Dopa和 Dopam ine是黑色素合成的重要前体物质,能有效抑制大肠杆菌的生长[20]。当大肠杆菌注射家蚕后6 h,这两种物质在血淋巴中的含量明显上升,暗示这两种物质与幼虫血淋巴免疫相关。当侵染24 h后,Dopam ine含量恢复正常,而Dopa含量明显低于正常。我们猜测:当家蚕血淋巴受到浸染时,免疫应答系统启动黑色素合成,Dopa和 Dopam ine作为合成黑色素的重要原料被大量生产,导致含量上升;随着体内病原物减少,血淋巴的免疫应答机制逐渐停止,最终恢复常态,由于在黑色素合成中Dopa比 Dopam ine有更多的消耗途径,致使侵染24 h后血淋巴中Dopa含量还未恢复常态。
REFERENCES
[1] Lu XF, Yang XY, Cheng JQ, et al. Progresses in insect antimicrobial peptides. Acta Pharm Sin,1999, 34(2): 156-160 (in Chinese).
卢晓风, 杨星勇, 程惊秋, 等. 昆虫抗菌肽及其研究进展. 药学学报, 1999, 34(2): 156-160.
[2] Nappi AJ, Christensen BM. Melanogenesis and associated cytotoxic reactions: applications to insect innate immunity. Insect Biochem Mol Biol,2005, 35(5): 443-459.
[3] Herrera-Ortíz A, Lanz-Mendoza H, Martínez-Barnetche J, et al. Plasmodium berghei ookinetes induce nitric oxide production in Anopheles pseudopunctipennis m idguts cultured in vitro. Insect Biochem Mol Biol, 2004, 34(9): 893-901.
[4] Leem JY, Nishimura C, Kurata S, et al. Purification and characterization of N-β-A lanyl-5-S-glutathionyl-3, 4-dihydroxyphenylalanine, a novel antibacterial substance of Sarcophaga peregrina (Flesh Fly). J Biol Chem, 1996, 271(23): 13573-13577.
[5] Ling EJ, Yu XQ. Prophenoloxidase binds to the surface of hemocytes and is involved in hemocyte melanization in Manduca sexta. Insect Biochem M ol Biol, 2005, 35(12): 1356-1366.
[6] Tang HP. Regulation and function of the melanization reaction in Drosophila. Fly, 2009,3(1): 105-111.
[7] Zou Z, Shin SW, A lvarez KS, et al. Distinct melanization pathways in the mosquito Aedes aegypti. Immunity, 2010, 32(1): 41-53.
[8] Xu PZ, Zhang MR, Cheng TC, et al. Molecular cloning and expression profile analysis genes encoding pattern recognition receptors PGRP and βGRP in the silkworm, Bombyx mori. Sci Sericult,2010, 36(3): 383-390 (in Chinese).
许平震, 张美蓉, 程廷才, 等. 家蚕模式识别受体 PGRP、βGRP编码基因的克隆鉴定及表达谱分析. 蚕业科学, 2010, 36(3): 383-390.
[9] Zhao P, Dong ZM, Duan J, et al. Genome-w ide identification and immune response analysis of serine protease inhibitor genes in the silkworm,Bombyx mori. PLoS ONE, 2012, 7(2): e31168.
[10] Xu M, Wang X, Tan J, et al. A novel Lozenge gene in silkworm, Bombyx mori regulates the melanization response of hemolymph. Dev Comp Immunol, 2015, 53(1): 191-198.
[11] W ittkopp PJ, Carroll SB, Kopp A. Evolution in black and white: genetic control of pigment patterns in Drosophila. Trends Genet, 2003, 19(9): 495-504.
[12] Yu HS, Shen YH, Yuan GX, et al. Evidence of selection at melanin synthesis pathway loci during silkworm domestication. Mol Biol Evol, 2011,28(6): 1785-1799.
[13] Liu C, Yamamoto K, Cheng TC, et al. Repression of tyrosine hydroxylase is responsible for the sex-linked chocolate mutation of the silkworm,Bombyx mori. Proc Natl Acad Sci USA, 2010,107(29): 12980-12985.
[14] Futahashi R, Sato J, M eng Y, et al. yellow and ebony are the responsible genes for the larval color mutants of the silkworm Bombyx mori. Genetics,2008, 180(4): 1995-2005.
[15] Futahashi R, Banno Y, Fujiwara H. Caterpillar color patterns are determ ined by a two-phase melanin gene prepatterning process: new evidence from tan and laccase2. Evol Dev, 2010, 12(2): 157-167.
[16] Dai FY, Qiao L, Tong XL, et al. M utations of an arylalkylam ine-N-acetyltransferase, Bm-iAANAT,are responsible for silkworm melanism mutant. J Biol Chem, 2010, 285(25): 19553-19560.
[17] Chen P, Li L, Wang JY, et al. BmPAH catalyzes the initial melanin biosynthetic step in Bombyx mori. PLos ONE, 2013, 8(8): e71984.
[18] Chen P, Wang JY, Li HY, et al. Role of GTP-CHI links PAH and TH in melanin synthesis in silkworm, Bombyx mori. Gene, 2015, 567(2): 138-145.
[19] Biosciences Q. Compositions and methods for cDNA synthesis: US, 08420324. 2013-04-16.
[20] Li T, Jiang GB, Lv Y, et al. In vitro induction of Bombyx mori haemolymph melanization by three types of m icrobes and their cell wall ingredients. Sci Sericult, 2015, 41(2): 278-285 (in Chinese).
李田, 蒋贵兵, 吕银, 等. 3种微生物及其胞壁物质体外诱导家蚕血液黑化反应的观察. 蚕业科学, 2015, 41(2): 278-285.
[21] Tan J, Xu M, Zhang K, et al. Characterization of hemocytes proliferation in larval silkworm, Bombyx mori. J Insect Physiol, 2013, 59(6): 595-603.
[22] Trf W. The genetics of biogenic am ine metabolism,sclerotization, and melanization in Drosophila melanogaster. Adv Genet, 1987, 24: 127-222.
[23] Xiang ZH. Silkworm's Heredity and Breeding. Beijing: China Agricultural Press, 1991: 228-243 (in Chinese).
向仲怀. 家蚕遗传育种学. 北京: 中国农业出版社, 1991: 228-243.
[24] Infanger LC, Rocheleau TA, Bartholomay LC, et al. The role of phenylalanine hydroxylase in melanotic encapsulation of filarial worms in two species of mosquitoes. Insect Biochem M ol Biol,2004, 34(12): 1329-1338.
[25] Liu CT, Hou RF, Ashida M, et al. Effects of inhibitors of serine protease, phenoloxidase and dopa decarboxylase on the melanization of Dirofilaria immitis microfilariae w ith Armigeres subalbatus haemolymph in vitro. Parasitology,1997, 115(Pt 1): 57-68.
[26] Liu SS, Wang M, Li XC. Overexpression of tyrosine hydroxylase and dopa decarboxylase associated w ith pupal melanization in Spodoptera exigua. Sci Rep, 2015, 5: 11273.
[27] Schachter J, Pérez MM, Quesada-A llué LA. The role of N-β-alanyldopam ine synthase in the innate immune response of two insects. J Insect Physiol,2007, 53(11): 1188-1197.
[28] Sideri M, Tsakas S, Markoutsa E, et al. Innate immunity in insects: surface-associated dopa decarboxylase-dependent pathways regulate phagocytosis, nodulation and melanization in medfly haemocytes. Immunology, 2008, 123(4): 528-537.
[29] Wang MX, Cai ZZ, Lu Y, et al. Expression and functions of dopa decarboxylase in the silkworm,Bombyx mori was regulated by molting hormone. Mol Biol Rep, 2013, 40(6): 4115-4122.
(本文责编 郝丽芳)
November 25, 2015; Accepted: February 17, 2016
Ping Chen. Tel/Fax: +86-23-68250084; E-mail: chenping1918@swu.edu.cn
In vitro observation of haemolym ph melanization and melanin-related biosynthesis enzyme genes in silkworm, Bombyx mori
Tian Li1, Liang Zhang1, Qi Shen1, Wei Zhao1, Li Li1, Yin Lü1, Guibing Jiang2, Dengfeng Yan1, Junjie Xiao1, and Ping Chen1
1 College of Biotechnology, Southwest University, Chongqing 400716, China
2 Sericulture Management Station of Chongqing, Chongqing 400716, China
The observation statistics suggested that the haemolymph melanization speed of larvae became fast and the grow th inhibition of Escherichia coli was strong as the quantities of feeding on mulberry leaves increased. The RT-PCR result showed that the mRNA expressions of melanin biosynthesis enzyme Bm Tan, BmPo-1, BmYellow-f and BmDdc were high in the haemolyph of 5 L 3 d larvae. The q PCR analysis showed Bmtan, Bmddc, Bmyellow, Bmebony and Bmblack, especially Bmddc expression were significantly higher in black disease larvae than in normal larvae. Compared w ith control, Ddc inhibitors drastically inhibited the lipopolysaccharide-induced haemolymph melanization. In addition, the content of Dopa and Dopam ine markedly rose after E. coli injection. These indicated that haemolymph melanization was linked to immune defenses and Bmddc may play a role in melanization response of haemolymph immune in silkworm.
haemolymph of Bombyx mori, melanization, melanin biosynthesis enzyme, immune response
Supported by: Natural Science Fundation of Chongqing (No. 2013jjB80004), Graduate Student Innovative Research Projects of Chongqing (No. CYS14048), National Special Fund for Silk Development of Chongqing in 2015.
重庆市自然科学基金重点项目 (No. 2013jjB80004),重庆市研究生科研创新项目 (No. CYS14048),重庆市2015国家茧丝绸发展专项资金资助。
网络出版时间:2016-03-07 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160307.1410.004.html

