鄱阳湖7个河口水体中细菌多样性和组成特征
圣平,于一尊,田晓娟,黄江丽,张志红,2,丁建南*
(1.江西省科学院生物资源研究所,江西 南昌330096;2. 江西省鄱阳湖重点实验室,江西 南昌 330096)
鄱阳湖7个河口水体中细菌多样性和组成特征
圣平1,于一尊1,田晓娟1,黄江丽1,张志红1,2,丁建南1*
(1.江西省科学院生物资源研究所,江西 南昌330096;2. 江西省鄱阳湖重点实验室,江西 南昌 330096)
本文对鄱阳湖7个河口(赣江、抚河、信江、乐安河、昌江、饶河和修河)水体的理化特性进行了分析,并采用细菌16S rRNA基因MiSeq测序的方法对其多样性和组成进行了研究。结果表明,乐安河水体总氮含量最高,信江水体总磷含量最高。乐安河、修河和饶河水体细菌丰度高于其它河口,而修河、昌江和饶河水体细菌多样性则相对较高。水体细菌群落组成分析结果表明,在7个河口水体中变形菌门细菌均占优势,其次为放线菌门和拟杆菌门细菌。而在纲水平,在7个河口水体中β-变形菌纲细菌占优势,其次为α-变形菌纲细菌和放线菌纲细菌。相关性分析结果表明,水体pH和细菌群落多样性呈显著负相关关系,而总氮和氨态氮含量和细菌群落多样性呈显著正相关性。
鄱阳湖;7大河口;不同河口水样;细菌多样性;细菌群落组成
圣平, 于一尊, 田晓娟, 黄江丽, 张志红, 丁建南. 鄱阳湖7个河口水体中细菌多样性和组成特征[J]. 农业现代化研究,2016, 37(3): 606-612.
Sheng P, Yu Y Z, Tian X J, Huang J L, Zhang Z H, Ding J N. Bacterial diversities and compositions in seven different estuarine water columns of Poyang Lake[J]. Research of Agricultural Modernization, 2016, 37(3): 606-612.
河口地段是鄱阳湖的生态敏感部位,一些重要的污染参数会在河口部位得到集中体现,对河口地段进行监控,可以为湖区水环境状况的预测预报提供重要依据。本研究旨在通过研究鄱阳湖七大河口水样中微生物的组成和多样性,并研究不同河口水样环境因子对微生物种类组成和多样性的影响,以期为准确、快速地评价和预测鄱阳湖整体环境状况提供重要依据,为鄱阳湖生态功能的维护提供指导。
1 材料与方法
1.1 样地选择、样品采集和处理
本试验选择赣江(116°02′E,29°19′N)、抚河(116°09′E,28°46′N)、信江(116°43′E,28°72′N)、乐 安 河(116°69′E,28°97′N)、 昌 江(116°70′E,28°97′N)、饶河(116°46′E,29°01′N)和修河(116°02′E,29°19′N)七大河口进行研究,采样时间为2014年10月底,处于几大河口和鄱阳湖的枯水期,样品采集点如图1,采用GPS进行定位。采集水样后,分成两部分,一部分用于理化性质测定,另一部分用于细菌基因组DNA提取和分析。

图1 鄱阳湖7个河口水样取样点Fig. 1 Collection sites of seven estuarine water samples of Poyang Lake
1.2 水样理化性质测定
水样的温度采用便携式温度计进行测定,pH值采用校准的pH计(Sartorius PB-10)测定。水样的总氮和总磷采用过硫酸钾氧化法测定[12]。氨态氮采用奈氏比色法测定,硝态氮和亚硝态氮含量分别采用紫外分光光度法和重氮偶合分光光度法测定[13]。全部测定均进行三次重复。
1.3 样品细菌收集及其基因组DNA提取
将部分水样先用8 μm孔径的定性滤纸过滤以去除颗粒物以及真核生物,然后通过聚碳酸酯膜(0.2 μm,Whatman)真空抽滤[10],然后用无菌水冲洗2次,将滤膜取出剪成碎片,装入1.5 ml的离心管中,-80℃保存备用。
样品细菌基因组DNA的提取采用细菌基因组DNA提取试剂盒(天根生化科技有限公司)完成,具体步骤参照试剂盒说明书,1.2%琼脂糖凝胶电泳检测所提取的基因组DNA。Nanodrop 1000测定所提取DNA的浓度以及纯度。DNA于-80 ℃保存备用,符合要求的DNA样本进行后续MiSeq测序。
1.4 样本PCR扩增
以稀释后的DNA为模板,采用带有Barcode的通用引物515F和806R对细菌16S rRNA基因的V4区域进行扩增,引物序列为515F:5'-GTTTCGGTGC CAGCMGCCGCGGTAA-3',806R:5'-GTGAAAGG ACTACHVGGGTWTCTAAT -3'。PCR扩增条件为:98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃复性60 s,30个循环,最后72 ℃延伸l0 min,4 ℃保存。每个样品3个重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用北京天根生化科技有限公司琼脂糖凝胶DNA回收试剂盒(DP209)切胶回收PCR产物,Tris-HCL洗脱。
1.5 文库构建及测序
测序文库的构建采用NEB Next® Ultra™ DNA Library Prep kit for Illumina(NEB,美国)建库试剂盒完成,具体步骤参照试剂盒说明书。构建好的文库经过Qubit定量和文库检测,合格后,使用MiSeq进行上机测序。
1.6 生物信息学分析
采用FLASH软件进行DNA片段的双末端序列拼接[14]。序列分析采用UPARSE软件包进行(Uparse v7.0.1001,http://drive5.com/uparse/)[15],算法采用UPARSE-OTU和UPARSE- OTUref。
OTU(Operational Taxonomic Units,操作分类单元)聚类分析:在97%的相似水平下,应用QIIME软件中Usearch对所有序列进行OTU划分。具体分析方法:1)使用Uparse(version 7.1 http:// drive5.com/uparse/)方法进行OTU聚类,OTU中序列相似性设为97%,得到OTU的代表序列[16];2)使用Uchime(version 4.2.40 http://drive5.com/usearch/ manual/uchime_algo.html)检测PCR扩增中产生的嵌合体序列并从OTU中去除[15];3)使用Usearch_ global方法将优化序列map比对回OTU代表序列,得到OTU各样品序列丰度统计表。
分类学分析:为了得到每个OTU对应的物种分类信息,采用RDP classifer贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,选用Silva(Release115 http://www.arb-silva.de)数据库进行比对。软件及算法:Qiime平台(http://qiime.org/ scripts/assign_taxonomy.html),RDP Classifer (version 2.2 http: //sourceforge.net/projects/rdp-classifer/),置信度阈值为0.7[17]。基于分类学分析结果,在Excel中编辑作群落结构组分图。
多样性指数(Alpha-diversity)计算:在97%(0.97)的相似水平下,采用Mothur软件(version v.1.30.1 http://www.mothur. org/wiki/Schloss_ SOP#Alpha_ diversity),计算菌群丰度指数Chao1以及菌群多样性指数Shannon指数[18]。
群落聚类分析:采用Qiime软件计算群落间非加权的UniFrac距离,采用的是非加权配对算术平均法。
1.7 统计分析
不同河口水样环境因子和微生物多样性之间的相关性分析采用SPSS 16.0软件进行。同时,采用Canoco软件分析环境因子对不同类群细菌分布的影响。
2 结果与讨论
2.1 鄱阳湖7个河口水样理化性质
鄱阳湖不同河口水体温度、pH、总氮、氨态氮、亚硝态氮、硝态氮、总磷含量如表1所示。从表1可以看出,乐安河水样pH最低,偏酸性,为6.19,其余河口水样pH均在6.41-6.86间波动,乐安河水样偏酸性,可能与德兴铜矿废水的排放有关。从总氮和氨态氮含量结果可以看出,乐安河水样中含量最高,分别为8.08 mg/L和6.06 mg/L,饶河含量次之,分别为5.74 mg/L和4.12 mg/L,污染较为严重。其原因可能是由于乐安河下游鄱阳县大量的水产养殖以及生活污水的排放,从而导致水体中总氮和氨态氮含量偏高[19],且乐安河汇入饶河,其水质在一定程度上会影响饶河的水质。信江水样中总磷含量最高,为0.51 mg/L,这可能受到上饶市朝阳磷矿生产废水的影响,从而导致信江下游总磷含量偏高[20]。
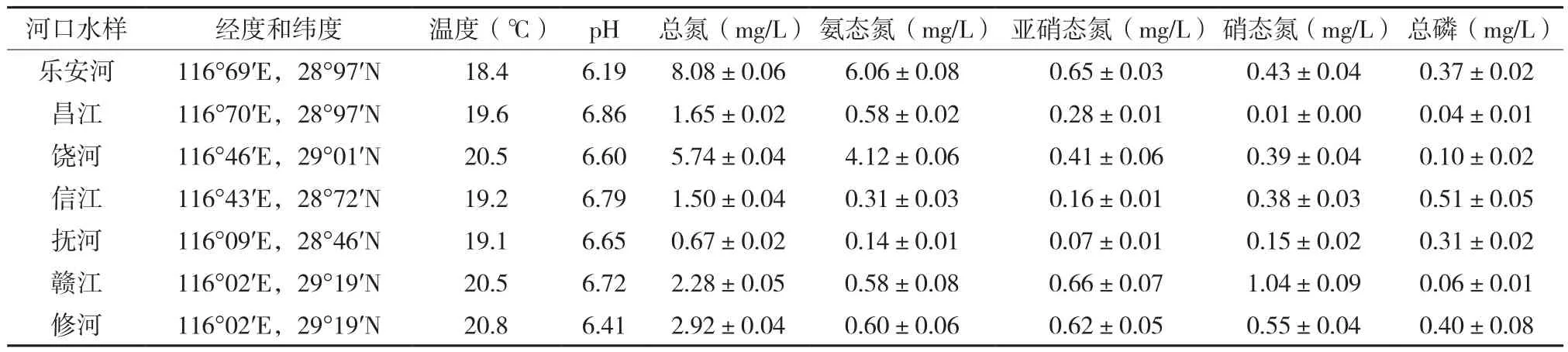
表1 鄱阳湖7个河口水样理化特性Table 1 Physicochemical properties of seven estuarine water columns of Poyang Lake and local meteorological conditions at their sampling sites
2.2 鄱阳湖7个河口水样中微生物多样性和组成
2.2.1 水样样本α多样性 在所研究的7组样本中,修河水样的操作分类单元(OTU)数目最多(为851个),饶河及昌江样本所含的操作分类单元数目次之,分别为825和772个,抚河水样样本所含的操作分类单元数目则相对较少,为698个(表2)。进一步通过种群丰富度指数(Chao1)对各样本微生物丰度进行了评估,研究发现乐安河样本种群丰富度指数最高(为1069.50),其次是修河(为998.02)、饶河(为982.13),信江样本种群丰富度指数最低(为782.03)(表2)。该结果说明乐安河、修河和饶河河水微生物物种丰度较高,信江河水中微生物物种丰度低。相比较而言,乐安河、修河和饶河的水质较其它河口差,氮含量相对较高,且三者微生物丰度较高,表明其水体中可能含有大量的参与氮循环的微生物。此外,乐安河汇入饶河,其水质会对饶河的水质造成一定影响。
本研究同时通过香农指数(Shannon index)对微生物的多样性进行了评估,研究发现7大河口河水样本均有着较高的生物多样性,其中,修河河水样本香农指数(9.06)最高,其次为昌江(6.88)和饶河(6.79),信江样本(6.32)香农指数最小(表2)。该实验结果表明,修河、昌江、饶河水样中细菌群落多样性较其他河口高,信江水样中细菌群落多样性最低。
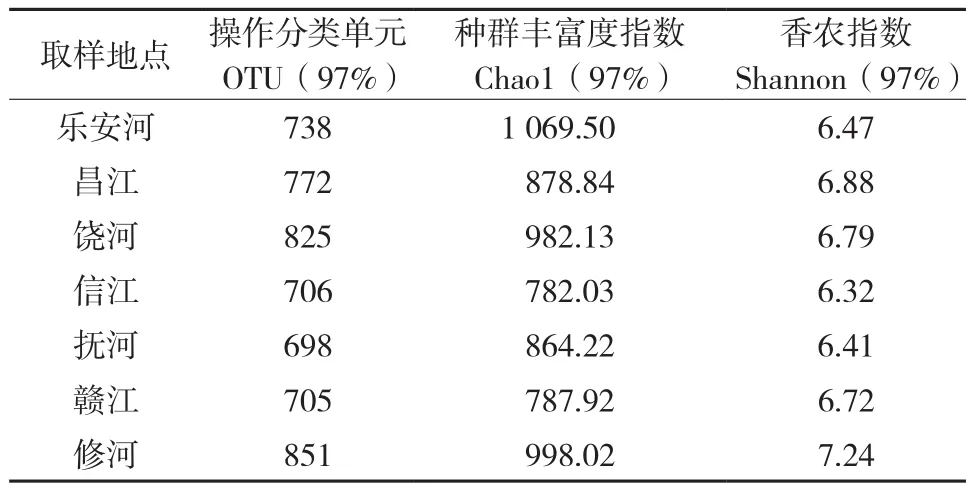
表 2 河口水样样本α多样性Table 2 Alpha diversity of all samples
2.2.2 水样细菌群落组成 进一步对各样本细菌群落组成进行分析,由图2可知,7大河口样本中,变形菌门为主要的细菌类群(各样本所占比例为62.65%-79.03%),放线菌门(2.11%-18.32%)和拟杆菌门(5.05%-9.08%)细菌所占比例次之。其中乐安河、信江和饶河样本中放线菌门细菌含量要显著低于其它河口。赣江样本中放线菌门细菌含量(18.32%)最高。之前研究结果也表明,变形菌门、放线菌门和拟杆菌门为湖泊生态系统的优势菌门,它们参与了环境中污染物的生物降解[21-23]。该结果与其他研究人员对其他淡水湖泊水体细菌多样性研究结果相似。吴兰[10]通过对鄱阳湖水体微生物群落组成进行研究发现,变形菌门为优势菌群,拟杆菌门和放线菌门有少量分布。Wu等[7]研究了太湖梅梁湖区的水体细菌群落遗传组成,结果显示,梅梁湖区水体细菌群落组成随季节而变化,其主要以变形菌门、拟杆菌门和放线菌门为主。

图2 7个河口水样细菌群落组成(门水平)Fig. 2 Bacterial composition of these communities in seven estuarine water samples(Phylum level)
从纲水平来看,7大河口水样中β-变形菌纲细菌占据绝对优势(33.8%-50.4%),α-变形菌纲(11.9%-33.3%)和放线菌纲(1.7%-16.2%)细菌所占比例次之。其中,乐安河水样中β-变形菌纲细菌相对其他河口最高(50.4%),α-变形菌纲细菌含量则相对较低(16.4%),而抚河样本中β-变形菌纲细菌含量最低(33.8%),α-变形菌纲细菌则含量最高(33.3%)(图3)。根据以前关于β-变形菌纲的报道指出,在大部分淡水系统中,其都有着大量的分布,它们的新陈代谢活动在淡水湖泊生态系统中可能起重要作用,其参与淡水系统的氮代谢,具有降解复杂有机大分子的能力,其丰富度与低分子量的营养物含量相关。α-变形菌则主要存在于相对寡营养的环境中,拟杆菌的丰富度与水体的水华程度密切相关[24]。因此,该研究结果进一步揭示了乐安河水体的主要营养物可能以低分子量物质居多,而抚河含沙量大,相对提供给微生物的营养偏少,α-变形菌纲细菌所占比例较高。此外,各大河口中高丰度的β-变形菌纲细菌可能在各自生态系统中发挥着重要的功能。
除此之外,我们还发现赣江样本中放线菌纲细菌含量(16.2%)要显著高于其它样本(图3)。在淡水系统中放线菌纲细菌是一类独立的微生物种群,水体中溶解有机碳含量与放线菌纲细菌的含量呈负相关关系[25]。但是我们的研究中由于缺少溶解有机碳含量的数据,因此无法解释赣江中放线菌纲细菌含量显著高于其它几个河口的原因。

图3 7个河口河水样本细菌群落组成(纲水平)Fig. 3 Bacterial composition of these communities in seven estuarine water samples(Class level)
2.3 细菌群落结构和多样性比较分析
采用加权UniFrac距离来衡量两两样本之间的相异系数,值越小,表示这两个样品在物种多样性方面存在的差异越小。由图4可知,修河和赣江河水样本之间的相异系数最小(0.136),乐安河和抚河样本之间的相异系数最大(0.351),修河和抚河的相异系数(0.306)次之,该结果与河口水体环境因子聚类结果相一致,表明水体环境因子对于其中微生物多样性存在影响。
对这7个河口河水样本细菌群落组成进行聚类分析,结果表明,赣江、修河和乐安河样本的微生物组成相似,聚在一起,其中赣江和修河样本微生物组成更相似,昌江和抚河样本微生物群落组成相似,聚在一起,信江和饶河样本细菌组成相似,两者聚在一起(图5)。

图4 Beta多样性指数热图Fig. 4 Heatmap analysis based on the dissimilaritycoefficient between sets of two samples
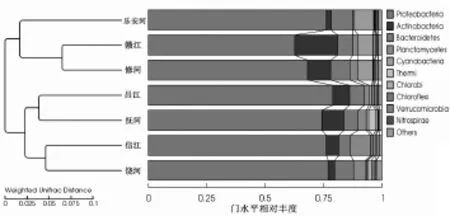
图5 鄱阳湖7个河口河水样本微生物群落组成聚类图Fig. 5 UPGMA cluster analysis of these bacterial community compositions in seven estuarine water samples of Poyang Lake(Weighted UniFrac distance)
2.4 环境因子对细菌群落组成和多样性的影响
采用SPSS 16.0软件分析河口水样微生物多样性和水样理化性质及气候因子的相关性。结果显示,水样中pH、总氮和氨态氮含量与河口水样中细菌种群丰富度存在显著的相关性(表3),其中pH和细菌群落丰度呈显著的负相关性(rs=-0.786),总氮和氨态氮含量和细菌群落丰度呈显著的正相关性(rs=0.786和0.829)。此外,我们也分析了不同河口水样微生物群落组成与水样理化性质及气候因子的相关性,研究结果表明,温度、总氮以及亚硝态氮在一定程度上影响着环境中微生物的群落组成。放线菌门细菌与温度呈显著的正相关性(rs=0.883),浮霉菌门与氨态氮呈显著的负相关性(rs=-0.757),蓝细菌与总氮、氨态氮和亚硝态氮呈显著的正相关性(rs=0.893,0.847和0.929),Thermi门细菌与温度呈显著的正相关性(rs=0.883),绿菌门细菌与亚硝态氮呈显著的负相关性(rs=-0.829),绿弯菌门细菌与总氮和氨态氮呈显著的负相关性(rs=-0.857,-0.829)(表3)。
之前大量研究也表明,生境中环境因子显著影响该生境中微生物种类组成和多样性。Zhang等[26]在高原淡水湖微生物种类组成和多样性的研究中也发现了类似的结果。生境中氮、氨态氮等含量可以直接影响微生物的种类组成,例如,蓝细菌含量与环境中氮含量呈显著的正相关性,蓝细菌含量越高,环境富营养化程度越严重[27],此外,环境中的营养成分也可通过影响其它浮游生物从而间接影响微生物的组成[28],当环境中营养成分增加,浮游植物、藻类和细菌种类也会相应增加,他们之间存在着互利共生的关系[29]。我们的研究结果似乎支持了以前的研究报告,细菌群落组成和多样性一定程度上取决于环境因素[30],此外也进一步证明了可以通过检测特定功能性微生物的组成和多样性从而间接的反映相应的环境变化。
3 结论
通过对鄱阳湖不同河口水体环境因子进行分析,发现乐安河水体中总氮、氨态氮含量均最高,其次为饶河,表明两者污染较严重。从总磷含量来看,信江水体含量最高,其次为乐安河。
7大河口水体微生物多样性和丰度均有着一定的差异,乐安河、修河、昌江和饶河水体中微生物群落多样性和丰度较其他河口高。水体细菌群落组成分析结果表明,变形菌门、放线菌门和拟杆菌门细菌为所有河口水体中的优势菌群。其中,β-变形菌纲、α-变形菌纲和放线菌纲细菌为所有河口水体中的优势菌纲。该研究结果表明这些细菌可能在河口水生态系统中发挥着重要的功能。此外,河口水体微生物种群丰富度指数和水体环境因子的相关性研究结果显示,水体pH、总氮和氨态氮含量与细菌种群丰富度存在显著的相关性,其中pH和细菌种群丰富度呈显著的负相关性,总氮和氨态氮含量和细菌种群丰富度呈显著的正相关性。该研究结果进一步证明了环境因子的改变是影响环境微生物群落组成的因素之一。
[1] Wu L, Ge G, Zhu G F, et al. Diversity and composition of the bacterial community of Poyang Lake (China) as determined by 16S rRNA gene sequence analysis[J]. World Journal of Microbiology and Biotechnology, 2012, 28(1): 233-244.
[2] Wu L, Li M, Guo Y, et al. Influence of three gorges project on water quality of Poyang Lake[J]. Procedia Environmental Sciences, 2011, 10(1): 1496-1501.
[3] 刘聚涛, 游文荪, 丁惠君. 鄱阳湖流域农村水环境污染防治对策研究[J]. 江西水利科技, 2014, 40(2): 97-100. Liu J T, You W S, Ding H J. Study on the countermeasures of rural water environment pollution in Poyang Lake basin[J]. Jiangxi Hydraulic Science and Technology, 2014, 40(2): 97-100.
[4] 胡悦之. 试论鄱阳湖流域水环境污染问题及其改善策略[J]. 环境与生活, 2014, 79(20): 11-12. Hu Y Z. Study on the water pollution problem and its improvement strategy of Poyang Lake[J]. Green living, 2014, 79(20): 11-12.
[5] Zhao D Y, Huang R, Zeng J, et al. Diversity analysis of bacterial community compositions in sediments of urban lakes by terminal restriction fragment length polymorphism (T-RFLP)[J]. World Journal of Microbiology and Biotechnology, 2012, 28(11): 3159-3170.
[6] Wu Q L, Zwart G, Schauer M, et al. Bacterioplankton community composition along a salinity gradient of sixteen high mountain Lakes located on the Tibetan Plateau[J]. Applied and Environmental Microbiology, 2006, 72(8): 5478-5485.
[7] Wu L, Kellogg L, Devol A H, et al. Microarray-based characterization of microbial community functional structure and heterogeneity in marine sediments from the Gulf of Mexico[J]. Applied and Environmental Microbiology, 2008, 74(14): 4516-4529.
[8] Tijdens M, Hoogveld H L, Kamst-van Agterveld M P, et al. Population dynamics and diversity of viruses, bacteria and phytoplankton in a shallow eutrophic lake[J]. Microbial Ecology,2008, 56(1): 29-42.
[9] 余德辉. 我国环境科技发展现状及机遇[J]. 中国环境管理,2001, 3(1): 4-6. Yu D H. Our environmental technology development status and opportunities[J]. Chinese Journal of Environmental Management,2001, 3(1): 4-6.
[10] 吴兰. 鄱阳湖水体细菌物种多样性研究[D]. 南昌: 南昌大学,2009. Wu L. Studies on the bacterial species diversity in Lake Poyang[D]. Nanchang: Nanchang University, 2009.
[11]张钰. 湖泊沉积物微生物多样性和厌氧氨氧化菌鉴别研究[D].武汉: 华中农业大学, 2012. Zhang Y. Study on microbial diversity and anammox bacteria identification in Lake sediments[D]. Wuhan: Huazhong Agricultural University, 2012.
[12] Song Y Y. Improvement in total nitrogen determination by using potassium persulfate oxidation method[J]. Environmental Science Survey, 2012, 3(31): 80-82.
[13] American Public Health Association, American Water Works Association, Water Environment Federation. Standard Methods for the Examination of Water and Waste Water[M]. American Public Health Association, Washington, D C, 1992: 515-516.
[14] Magoč T, Salzberg S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011,27(21): 2957-2963.
[15] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
[16] Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics,2011, 27(16): 2194-2200.
[17] Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): 590-596.
[18] Schloss P D, Gevers D, Westcott S L. Reducing the effects of PCR amplifcation and sequencing artifacts on 16S rRNA-based studies[J]. PLoS One, 2011, 6(12): e27310.
[19]刘聚涛, 钟家有, 付敏, 等. 鄱阳湖流域农村生活区面源污染特征及其影响[J]. 长江流域资源与环境, 2014, 23(7): 1012-1018. Liu J T, Zhong J Y, Fu M, et al. Study on the characteristics and impact of rural living area pollution in Poyang Lake basin[J]. Resources and Environment in the Yangtze Basin, 2014, 23(7): 1012-1018.
[20] 张维球. 解决用朝阳磷矿湿法生产过磷酸钙水分超标的问题[J].磷肥与复肥, 2000, 15(1): 22-23. Zhang W Q. Solving the problem of excessive moisture of superphosphate production using Chaoyang phosphate wet production method[J]. Phosphate and Compound Fertilizer, 2000,15(1): 22-23.
[21] Song H, Li Z, Du B, et al. Bacterial communities in sediments of the shallow Lake Dongping in China[J]. Journal of Applied Microbiology, 2012, 112(1): 79-89.
[22] Cupples A M. RDX degrading microbial communities and the prediction of microorganisms responsible for RDX bioremediation[J]. International Biodeterioration and Biodegradation, 2013, 85(7): 260-270.
[23] Fuentes S, Mendez V, Aguila P, et al. Bioremediation of petroleum hydrocarbons: catabolic genes microbial communities and applications[J]. Applied Microbiology and Biotechnology, 2014,98(11): 4781-4794.
[24] Kirchman D L. The ecology of Cytophaga-Flavobacteria in aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91-100.
[25] Burkert U, Warnecke F, Babenzien D, et al. Members of a readily enriched beta-proteobacterial clade are common in surface waters of a humic lake[J]. Applied and Environmental Microbiology, 2003, 69(11): 6550-6559.
[26] Zhang J X, Yang Y Y, Zhao L, et al. Distribution of sediment bacterial and archaeal communities in plateau freshwater lakes[J]. Applied Microbiology and Biotechnology, 2015, 99(7): 3291-3302.
[27] Reynolds C S. Cyanobacterial water blooms[J]. Advance in Botanical Research, 1987, 13(4): 67-143.
[28] Hietala J, Vakkilainen K, Kairesalo T. Community resistance and change to nutrient enrichment and fsh manipulation in a vegetated lake littoral[J]. Freshwater Biology, 2004, 49(12): 1525-1537.
[29] Hietala J, Vakkilainen K, Kairesalo T. Community resistance and change to nutrient enrichment and fsh manipulation in a vegetated lake littoral[J]. Freshwater Biology, 2004, 49(12): 1525-1537.
[30] Yannarell A C, Triplett, E W. Geographic and environmental sources of variation in lake bacterial community composition[J]. Applied and Environmental Microbiology, 2005, 71(1): 227-239.
(责任编辑:王育花)
Bacterial diversities and compositions in seven different estuarine water columns of Poyang Lake
SHENG Ping1, YU Yi-zun1, TIAN Xiao-juan1, HUANG Jiang-li1, ZHANG Zhi-hong1, 2, DING Jian-nan1*
(1. Institute of Biological Resources, Jiangxi Academy of Sciences, Nanchang, Jiangxi 330096, China; 2. Poyang Lake Key Laboratory of Jiangxi, Nanchang, Jiangxi 330096, China)
In this study, we analyzed environmental factors of seven different estuarine water columns of Poyang Lake (Gan, Fu, Xin, Le'an, Chang, Rao, and Xiu River), and the bacterial community compositions in these different estuarine sediments were analyzed using the 16S rRNA gene targeted metagenomic approach. Our results showed that Le'an River had the highest total nitrogen content, and Xin River had the highest total phosphorus content. For the bacterial richness and diversity in these seven different estuaries, we found that Le'an, Xiu and Rao rivers showed the higher bacterial richness than other estuarines. Xiu, Chang and Rao rivers showed higher bacterial diversities than others. Bacterial composition analysis indicated that Proteobacteria phylum was dominant in all water samples, followed by Actinobacteria and Bacteroidetes. At the class level, all samples were numerically dominated by members of the Betaproteobacteria, Alphaproteobacteria and Actinobacteria. Furthermore, according to the Spearman's correlation analysis, we found that there were signifcant negative relationships between the Chao1 species richness index and pH. Besides, total nitrogen and ammonia concentrations showed signifcant positive effect on bacterial community richness. Key words: Poyang Lake; seven estuaries; different estuarine water columns; bacterial diversity; bacterial community composition
鄱阳湖是我国最大的淡水湖,地处长江中下游南岸。其上承赣、抚、信、饶、修五河之水,下接长江,其中乐安河和昌江汇入饶河,流入鄱阳湖。鄱阳湖湿地生态环境好,是世界上最大的鸟类保护区[1]。但是,近年来,由于工业、农业和城市污水的大量排放,加上降水逐年减少,导致入湖河流以及湖泊的自净能力下降,使得湖泊氮磷浓度持续升高、湖泊富营养化程度不断加深[2-4],对湖泊周边环境造成严重的威胁。
在湖泊生态系统中,微生物在湖泊物质循环和能量循环中起着重要的作用,同时也是各种新型生物活性物质的潜在来源[5]。由于湖泊水体生境类型不同,使得生境中微生物的多样性也不同。研究表明,湖泊盐度、湖水深度、湖水和底泥pH、营养成分、有机质等均会影响生境中微生物的组成[6]。因此,由于自然和人类活动引起自然环境的改变最终也会引起环境微生物种类组成的改变[7-8]。我国是个湖泊众多的国家,约有两万多个湖泊,其中约三分之一为淡水湖泊,其水资源占中国城镇饮用水的50%以上[9-10]。但是随着资源的破坏性开发,环境的恶化,世界各地湖泊富营养化进程加速,水质日趋恶化[11],湖泊生物资源包括湖泊微生物种类与多样性研究己成为各国科学家共同关注的热点。
The special funds of National Academy Alliance for Academy Construction (2012-1), Science and Technology Plan of Jiangxi Province (2008BB26100), The Special Funds of Jiangxi Academy of Sciences (2013-19-01).
DING Jian-nan, E-mail: jiannanding@aliyun.com.
26 June, 2015;Accepted 24 February, 2016.
X172
A
1000-0275(2016)03-0606-07
10.13872/j.1000-0275.2016.0050
全国科学院联盟专项重点项目(2012-1);江西省科技支撑计划项目(2008BB26100);江西省科学院专项项目(2013-19-01)。
圣平(1987-),女,湖北荆州人,博士,助理研究员,主要从事微生物学与分析生物学研究,E-mail:shengping_1014@163. com;通讯作者:丁建南(1955-),男,湖南衡阳人,博士,研究员,主要从事微生物生态学研究,E-mail: jiannanding@aliyun.com。
2015-06-26,接受日期:2016-02-24

