噬菌体SYJ4及其对肉鸡痢疾治疗效果的初步探究
孙宇杰,柳佳志,王智柔,雷琎,林连兵
(昆明理工大学生命科学与技术学院,云南 昆明650500)
噬菌体SYJ4及其对肉鸡痢疾治疗效果的初步探究
孙宇杰,柳佳志,王智柔,雷琎,林连兵*
(昆明理工大学生命科学与技术学院,云南 昆明650500)
为了分离以致病性痢疾志贺菌(Shigella dysenteriae)CMCC (B) 51105为宿主菌的烈性噬菌体,并分析其生物学特性及其对患痢疾肉鸡的治疗效果,采用双层平板法从水样中分离纯化获得烈性噬菌体SYJ4,其最佳感染复数(MOI)为0.1,最适感染温度为37 ℃,最适感染pH范围在6-8;一步生长曲线表明噬菌体SYJ4裂解量约为50,潜伏期约为20 min,裂解期约为120 min;将无菌噬菌体富集液通过灌喂方式作用于由S. dysenteriae CMCC (B)51105导致的出现明显白痢症状的病鸡中并与链霉素治疗效果进行比较,结果表明噬菌体SYJ4对痢疾志贺菌(S. dysenteriae)CMCC (B) 51105引起的鸡痢疾具有一定治疗效果,其治疗效果与链霉素相仿,并在控制鸡肠道志贺氏菌群数量上优于链霉素。研究表明对于将噬菌体应用于肉禽细菌性肠道疾病治疗研究具有一定的参考价值。
噬菌体;痢疾志贺菌;噬菌体治疗;肉禽;痢疾
孙宇杰, 柳佳志, 王智柔, 雷琎, 林连兵. 噬菌体SYJ4及其对肉鸡痢疾治疗效果的初步探究[J]. 农业现代化研究, 2016,37(3): 601-605.
本试验旨在通过分离鸡致病性痢疾志贺氏菌S. dysenteriae CMCC (B) 51105 敏感的烈性噬菌体,并利用分离到的噬菌体对患痢疾肉鸡进行治疗试验并与链霉素治疗效果进行比较,探究噬菌体在禽类肠道细菌感染的应用价值。
1 材料与方法
1.1 试验材料
采样样品的富集培养采用GN增菌培养基(GN BROTH,HAJNA),宿主细胞的培养和后续的噬菌体分离采用LB(Luria-Bertani)培养基。
痢疾志贺菌S. dysenteriae CMCC (B) 51105为昆明理工大学邓先余博士惠赠。以1%接种量将活化后的痢疾志贺菌接入GN增菌液中,37 ℃,150 rpm震荡培养至生长对数期(OD600≈0.2)后,4 ℃冷藏备用。
GN增菌液:胰蛋白胨20 g;葡萄糖1 g;甘露醇2 g;柠檬酸钠5 g;去氧胆酸钠0.5 g;磷酸氢二钾4 g;磷酸二氢钾1.5 g;氯化钠5 g;蒸馏水1 000 ml;pH = 7.0±0.2;半固体培养基加入终浓度为0.4%琼脂,固体培养基加入终浓度为2%琼脂,经115 ℃高压蒸汽灭菌15 min后使用。
1.2 噬菌体的富集、分离及其生物学特征
采集校园污水厂的泥水混合物50 ml,充分震荡后,静置沉降10 min后取上清5 ml,接入200 ml 由GN增菌液配置成的宿主细菌菌液(OD600≈0.2)中,37 ℃,160 rpm恒温摇床中培养24 h,之后8 000×g离心20 min。取上清用0.22 μm滤膜过滤除菌后,4 ℃冷藏备用。采用双层琼脂平板法分离噬菌体[8],取100 μl 噬菌体富集液与100 μl 宿主菌液混合,静置吸附15-20 min,后向其中倾入4.0 ml 于40 ℃预热的LB半固体琼脂培养基,颠倒混匀后平铺于事先准备好的下层LB固体琼脂培养基,待半固体培养基完全凝固后,胶带封口,在37 ℃恒温培养箱中倒置隔夜培养。若出现透明圆圈则说明筛选到以痢疾志贺氏菌为宿主菌的噬菌体,挑取噬菌斑进行四次纯化获得单株噬菌体[9]。
培养宿主菌痢疾志贺菌至对数期前期(OD546= 0.214),菌体浓度约为1.5×107cfu/ml。按照感染复数为0.001,0.01,0.1,1,10,加入噬菌体纯培养液和宿主菌菌液,添加LB液体培养基使每管液体体积相同。设置3个重复,同时加设不加噬菌体的宿主菌和不加宿主菌的噬菌体作为为空白对照,于37 ℃,160 rpm恒温摇床中培养3.5 h,用双层平板法测定噬菌体滴度,以产生最高噬菌体滴度所对应的MOI作为最佳感染复数[10]。
取宿主细菌菌液5 ml(1.6×1010),加入噬菌体液使MOI=0.1,37 ℃静置吸附15 min后12 000×g离心30 s,弃上清,使用LB液体培养基洗涤2次,加入同体积37 ℃预热的LB液体培养基并充分混匀,迅速置于恒温摇床培养(37 ℃,160 rpm),每隔10 min测定培养液中噬菌体滴度,以感染时间为横坐标,噬菌体滴度为纵坐标,绘制一步生长曲线[11]。
将一定滴度的噬菌体液分别置于0 ℃,4 ℃,20 ℃,37 ℃,50 ℃,65 ℃,80 ℃下存放1 h,后分别测定其噬菌体滴度[12],分析温度对噬菌体活性的影响。
配制pH值分别为3,4,5,6,7,8,9,10,11的缓冲液体系(柠檬酸缓冲液,磷酸盐缓冲液,Tris-HCl缓冲液,Na2CO3缓冲液)各取990 μl加入1.5 ml的无菌Eppendorf管中,再向各管中加入10 μl滴度为1×108pfu/ml的噬菌体纯培养液,37 ℃静置1 h后进行滴度测定[13],分析pH对噬菌体活性的影响。
1.3 噬菌体治疗试验
选用120日龄的健康AA肉鸡15羽,平均体重为1.65 kg,随机分配为3组,每组5个重复,每个重复1羽。均饲喂基础日粮,基础日粮参照美国NRC(1994)肉鸡营养需要充分混合成颗粒状全价饲料。饲喂水源为0.9% NaCl溶液,所有试验组均为自由摄食[13]。
试验组分为3组,命名为A,B,C。试验前先停止水源供给4 h,后人工灌喂痢疾志贺菌菌液(处于生长稳定期)40 ml,4 h后进行如下分组处理:
A组:人工灌喂20 ml噬菌体纯培养液(滴度为4.00×1010pfu/ml);
B组:人工灌喂20 ml链霉素溶液(浓度为0.2%);
C组:人工灌喂20 ml经过灭活处理(湿热灭菌锅中,121 ℃,30 min)的噬菌体培养液。
在收集粪样时同时观察粪样形态及肉鸡的活动状态,样品收集时使用50 ml灭菌处理的离心管收集每个试验组的粪便,称量粪样重量后,加入20 ml灭菌处理的4 ℃、0.9% NaCl溶液。充分震荡使粪样完全分散,静置5-10 min后取上清供分析。
采用SS培养基分析以上样品中志贺菌的含量,以时间为横坐标,单位重量样品细菌含量为纵坐标绘制出志贺菌数量变化曲线。
2 结果与分析
2.1 噬菌体分离及其生物学特征
使用双层平板法分离获得噬菌体的噬菌斑形态(图1)。噬菌斑透明,边缘清晰,直径为2.0-3.0 mm,可见此噬菌体为烈性噬菌体,对宿主菌有很强的裂解作用,命名为SYJ4。

图1 噬菌斑形态Fig. 1 Bacteriophage plaques on the double-layer plate
按照感染复数(MOI)为0.001,0.01,0.1,1,10加入噬菌体纯培养液和宿主细菌菌液,培养3.5 h后所测定的滴度结果见表1。当MOI=0.1时,测得滴度为7.52×1010pfu/ml,为5个试验组中的最大值,因此最佳感染复数为0.1,说明噬菌体SYJ4具有较强的侵染能力。
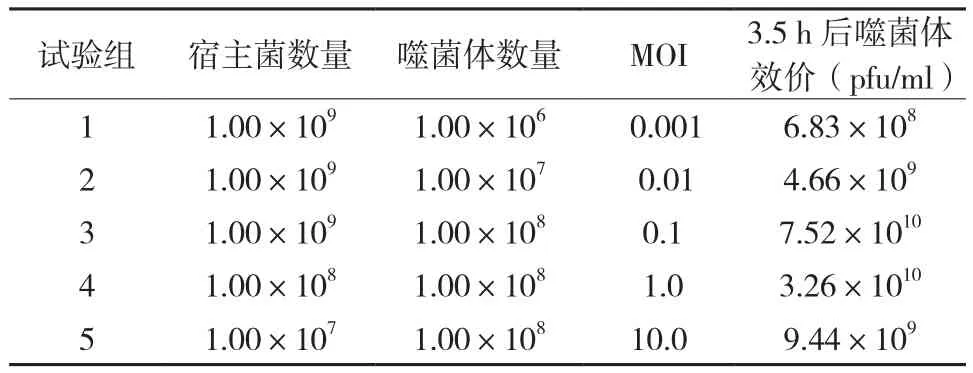
表1 噬菌体SYJ4最佳感染复数测定Table 1 The determination of bacteriophage SYJ4 on optimal multiplicity of infection (MOI)
通过噬菌体SYJ4的一步生长曲线(图2)可知,噬菌体潜伏期约为20 min,裂解期约为120 min,经计算,噬菌体感染宿主菌的裂解量约为50。噬菌体SYJ4的潜伏期、裂解期和裂解量和大肠杆菌噬菌体类似,裂解量高更有利于提高侵染的速率。
使用不同温度处理噬菌体SYJ4后进行感染实验表明(图3),37 ℃处理后噬菌体滴度剩余最大,而低温下噬菌体滴度减少不大,随着温度的升高,噬菌体的存活率开始下降,50 ℃和60 ℃处理60 min后滴度分别降至67%和19%,80 ℃处理60 min后噬菌体失活,说明噬菌体SYJ4热稳定性较差,在37 ℃有很好的稳定性同样有助于其在肠道中的生存。
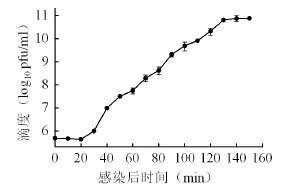
图2 噬菌体SYJ4的一步生长曲线Fig. 2 One-step growth curve of bacteriophage SYJ4
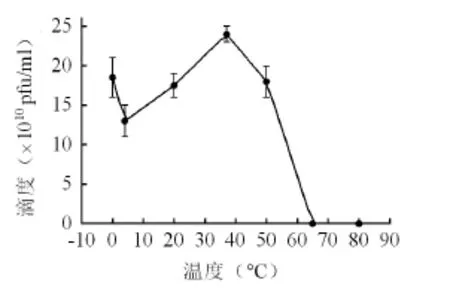
图3 温度对噬菌体活性的影响Fig. 3 Effect of temperature on bacteriophage activity
噬菌体SYJ4的最适pH范围为6-8(图4),在7.3左右剩余滴度最高,在pH≥10和pH≤6时噬菌体滴度下降较快,当pH=10.82时,噬菌体的滴度剩余6×108pfu/ml,仅为起始噬菌体活性的8%,pH为4-7时噬菌体的滴度下降较pH为7-10时更加快,表明SYJ4噬菌体对碱性环境的耐受性较酸性环境更强一些,噬菌体SYJ4的pH值适应性有助于其在肠道pH环境中生存。
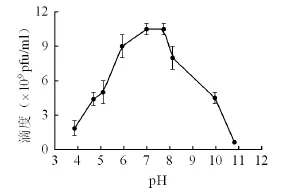
图4 pH对噬菌体活性的影响Fig. 4 Effect of pH value on bacteriophage activity
2.2 噬菌体治疗试验
对所有试验组在饲喂菌液4 h后的症状观察表明(表2),它们均出现下痢症状,同时开始减少进食量直至停止进食,活动量减少至几乎不再运动。饲喂菌液12 h后,A,B组均开始逐步增加进食量,活动量逐步恢复至饲喂菌液前水平,粪便逐步由水样转变为绿便,最终转变为黄色大颗粒状,而C组则恢复缓慢,粪样均为水样或绿便。可见,噬菌体和链霉素均具有明显的治疗。
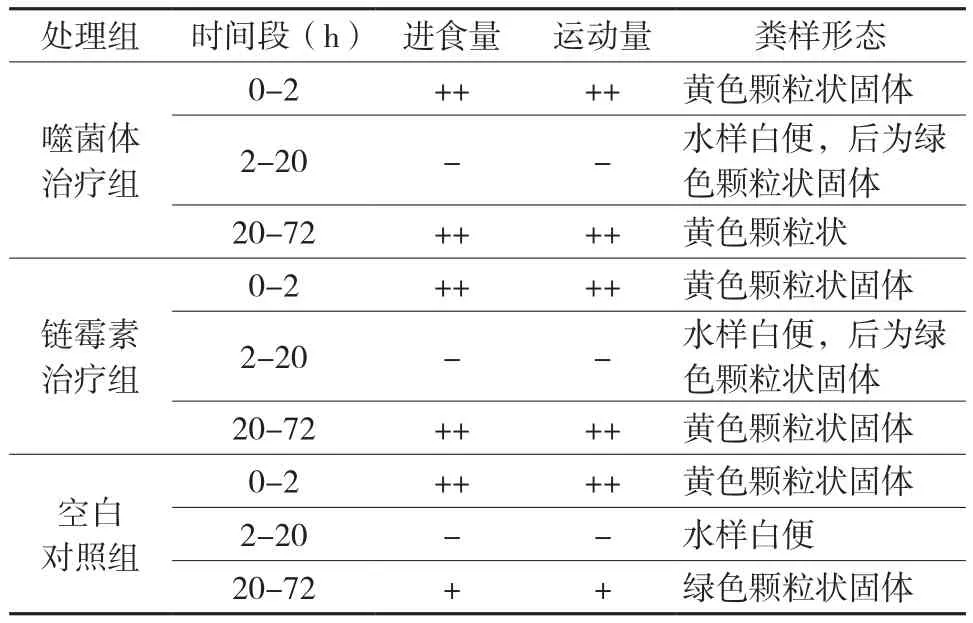
表2 不同试验组症状变化比较Table 2 The comparison of symptom changes in the different treatment groups
进一步对不同试验组粪便样品中志贺氏细菌数量变化研究表明,A组(噬菌体治疗组)饲喂菌液约2 h后,单位重量粪样的志贺氏活菌量开始显著上升,于约8 h后达到最高值,达到3×107cfu/g(鲜重),之后志贺氏活菌量开始下降,在10-12 h时间段内,平均下降速度约为1×105cfu/(g.min),15 h后基本稳定至103cfu/g(图5),为喂菌前水平。
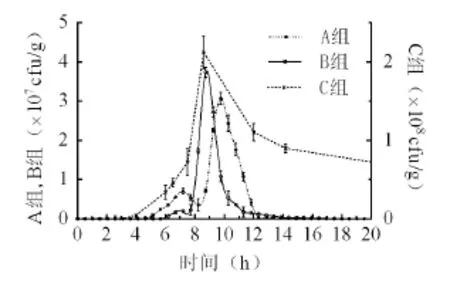
图5 试验组志贺氏细菌变化Fig. 5 The concentration change of Shigella during the treatment time
B组(链霉素治疗组)饲喂菌液约3 h后,单位重量粪样的志贺氏活菌量开始显著上升,于约8 h后达到最高值,达到4×107cfu/g(鲜重),之后志贺氏活菌量开始下降,在8-10 h时间段内,平均下降速度约为3×105cfu/(g.min),16 h后基本稳定至103cfu/g,为喂菌前水平。
C组(空白对照组)饲喂菌液约2 h后,单位重量粪样的志贺氏活菌量开始显著上升,于约6 h后达到最高值,达到2×108cfu/g(鲜重),之后志贺氏活菌量开始缓慢下降,在8-20 h时间段内,平均下降速度约为1.78×105cfu/(g.min),饲喂菌液后在16 h内未能恢复至喂菌前水平。
对A组(噬菌体治疗组)中噬菌体数量变化分析表明(图6),噬菌体呈阶梯上升,于约11 h达到峰值,最高时滴度达到6×108pfu/g(鲜重)左右,随后开始下降,随着志贺氏菌量的急剧减少,噬菌体数量随后也显著下降,并维持在较低的水平,这有利于进一步控制志贺氏菌的增殖。
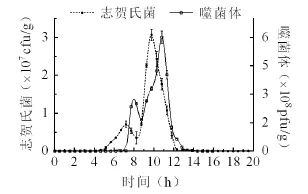
图6 A组噬菌体和志贺氏细菌变化Fig. 6 The concentration changes of Shigella and phages in group A
志贺氏菌是重要的食源性病原菌之一,目前临床主要以抗生素治疗痢疾,但耐药菌株的出现和增加,局限了抗生素治疗方式[14]。而噬菌体与传统的抗生素比较,具有特异杀菌特点,且可随宿主菌共同进化,因此不易产生抗性菌株。Gohary等[15]将噬菌体喷洒在鸡舍中来阻止肉鸡的大肠杆菌病,使肉鸡死亡率显著下降(P≤0.05),Kim等[16]研究了将噬菌体作为肉鸡日粮添加剂后对不同饲养环境中肉鸡生长状况和盲肠菌群变化的影响情况,表明噬菌体可以促进肉鸡生长并可以降低宿主病原菌的数量,Kim等[17]评价了肠炎沙门氏菌噬菌体作为肉鸡饲料来抑制肠炎沙门氏菌的效果,表明除了可以降低肠炎沙门氏菌造成的死亡率外,将噬菌体以0.2%的浓度加入饲料中对肉鸡生长不会造成消极影响。
本试验测定了SYJ4的生理特性,当以感染复数(MOI)为0.1时接种,滴度较高,为7.52×1010pfu/ml,在一步生长曲线中可以看出,噬菌体SYJ4
3 讨论
的潜伏期较短,为20 min,长于张辉等[18]报道的痢疾志贺氏菌S. dysenteriae噬菌体(潜伏期为10 min),但短于Turner等[19]介绍的沙门氏噬菌体vB_ SenS-Ent1(潜伏期为20 min),与大肠杆菌噬菌体平均潜伏期(25-27 min)相似[18]。
本试验表明,痢疾志贺氏菌S. dysenteriae CMCC (B) 51105可导致肉鸡出现明显下痢症状。而链霉素和噬菌体SYJ4均对其有类似的治疗效果,且噬菌体SYJ4在控制鸡肠道志贺氏菌群数量上有一定的优势。综上所述,本实验所分离到的噬菌体能为取代抗生素用于控制禽畜肠道致病菌提供可行的办法。
[1] Ugorakova J, Bukovska G. Lysins and holins: Tools of phageinduced lysis[J]. Biologia, 2003, 58(3): 327-334.
[2] 高成秀, 严亚贤. 噬菌体治疗制剂的研究进展[J]. 中国兽医科学, 2007, 37(7): 641-644. Gao C X, Yan Y X. Advance in bacteriophages as therapeutic agents[J]. Veterinary Science in China. 2007, 37(7): 641-644.
[3] Tiwari R, Chakraborty S, Dhama K, et al. Wonder world of phages: potential biocontrol agents safeguarding biosphere and health of animals and humans- current scenario and perspectives[J]. Pakistan Journal of Biological Sciences, 2014,17(3): 316-328.
[4] Daniells S. FDA approves viruses as food additive for meat[Z]. http://www.foodnavigator-usa.com/Suppliers2/FDA-approvesviruses-as-food-additive-for-meats
[5] Miller R W, Skinner J, Sulakvelidze A, et al. Bacteriophage therapy for control of necrotic enteritis of broiler chickens experimentally infected with clostridium perfringens[J]. Avian Diseases, 2010, 54(1): 33-40.
[6] Huff W E, Huff G R, Rath N C, et al. Method of administration affects the ability of bacteriophage to prevent colibacillosis in 1-day-old broiler chickens[J]. Poultry Science, 2013, 92(4): 930-934.
[7] von Seidlein L, Kim D R, Ali M, et al. A multicentre study of Shigella diarrheain in six Asian countries: Disease burden, clinical manifestations, and microbiology[J]. PLoS Medicine, 2006,3(e3539): 1556-1569.
[8] Adams M H. Bacteriophages[M]. New York: Interscience, 1959.
[9] 李陇平, 张智英. 金黄色葡萄球菌烈性噬菌体的分离鉴定和最佳保存方法研究[J]. 中国畜牧兽医, 2011, 38(6): 141-146. Li L P, Zhang Z Y. Isolate virulent phage of staphylococcus aureus and the study of the approach to optimal condition for preservation[J]. Chinese Animal Husbandry and Veterinary Medicine, 2011, 38(6): 141-146.
[10] Gill J J, Hyman P. Phage choice, isolation, and preparation for phage therapy[J]. Current Pharmaceutical Biotechnology, 2010,11(1): 2-14.
[11] Khan Mirzaei M, Nilsson A S. Isolation of phages for phage therapy: A comparison of spot tests and efficiency of plating analyses for determination of host range and efficacy[J]. PLoS One, 2015, 10(3): e0118557. DOI:10.1371/journal.pone.0118557
[12] Lau G L, Sieo C C, Tan W S, et al. Characteristics of a phage effective for colibacillosis control in poultry[J]. Journal of the Science of Food and Agriculture, 2012, 92(13): 2657-2663.
[13] Trevisan R B, Nakagi V S, Bravo P T, et al. Feeding programs and their effects on broiler performance and economic indexes[J]. Journal of Applied Poultry Research, 2014, 23(4): 593-604.
[14] 赵庆友, 朱瑞良. 噬菌体制剂的研究现状及发展前景[J]. 中国兽药杂志, 2010, 44(7): 40-43. Zhao Q Y, Zhu R L. Recent advances and prospects in bacteriophage therapy[J]. China Journal of Veterinary Medicine,2010, 44(7): 40-43.
[15] El-Gohary F A, Huff W E, Huff G R, et al. Environmental augmentation with bacteriophage prevents colibacillosis in broiler chickens[J]. Poultry Science, 2014, 93(11): 2788-2792.
[16] Kim J H, Kim J W, Lee B B, et al. Effect of dietary supplementation of bacteriophage on growth performance and cecal bacterial populations in broiler chickens raised in different housing systems[J]. Livestock Science, 2014, 170: 137-141.
[17] Kim K H, Lee G Y, Jang J C, et al. Evaluation of anti-se bacteriophage as feed additives to prevent Salmonella enteritidis (se) in broiler[J]. Asian-Australasian Journal of Animal Sciences,2013, 26(3): 386-393.
[18] 张辉, 王冉, 包红朵. 裂解性福氏志贺氏菌噬菌体SF-A2的生物学特性及其在巴氏杀菌牛奶中的灭菌效果[J]. 食品科学,2010, 31(23): 214-218. Zhang H, Wang R, Bao H D. Biological characteristics of lytic SF-A2 phage and its sterilization effect in milk[J]. Food Science,2010, 31(23): 214-218.
[19] Turner D, Hezwani M, Nelson S, et al. Characterization of the salmonella bacteriophage vB_SenS-Ent1[J]. Journal of General Virology, 2012, 93(9): 2046-2056.
(责任编辑:童成立)
The therapeutic effect of bacteriophage SYJ4 on diarrhea in broiler chickens
SUN Yu-jie, LIU Jia-zhi, WANG Zhi-rou, LEI Jin, LIN Lian-bing
(Faculty of Life Science and Technology, Kunming University of Science and Technology,Kunming, Yunnan 650500, China)
To isolate bacteriophages with the capacity of infecting Shigella dysenteriae CMCC (B) 51105, bacteriophage named SYJ4 was separated and purifed from sewage sample using double-plate method, then its preliminary biological characteristics and therapeutic effect on diarrhea in chickens were further analyzed. Results showed that SYJ4 had an optimal MOI (multiplicity of infection) as 0.1, the optimal infection temperature was 37 ℃, and its optimal infection pH ranged from 6 to 8. One-step growth curve also showed that SYJ4 was a variety of virulent phage, its burst size was 50, and the incubation period and the burst time were about 20 min and 120 min, respectively. Compared with the therapeutic effect of streptomycin, the chickens fed phage SYJ4 by gavage suffered from diarrhea caused by S. dysenteriae CMCC (B) 51105, which indicated that to some degree, bacteriophage SYJ4 had the same therapeutic effect on diarrhea caused by S. dysenteriae, however, its function on controlling the number of S. dysenteriae in intestine of chickens was better than the streptomycin. Therefore, the study will provide a certain valuable method for treating the meat and poultry bacterial intestinal disease with the phage therapy.
bacteriophage; Shigella dysenteriae; phage therapy; meat animals; dysentery
随着对抗生素滥用所产生后果的深入认识,如何减少化学药物和制剂的应用已成为养殖业生存和发展的严峻问题[1]。噬菌体的侵染具有高度的专一性,当噬菌体感染细菌时,可在细菌中繁殖并杀死细菌,但其对动植物或人体本身没有毒性[1]。在自然界中凡是有细菌分布的地方,均可发现特异噬菌体的存在[2]。因此,噬菌体以其特有的自然特征有望成为理想的抗菌药和新型生物杀菌制剂[3]。美国FDA已批准噬菌体作为食品添加剂用于杀灭食品中的李斯特菌(Listeria monocytogenes)[4],Miller等[5]证明了将噬菌体应用于控制肉禽坏死性肠炎的有效性,Huff等[6]证明了使用噬菌体饲喂1日龄肉禽可以预防气管内大肠杆菌导致的疾病。
志贺氏菌(Shigella)是胃肠疾病感染的主要病原菌,严重影响禽畜及人类卫生健康。而痢疾志贺氏菌(S. dysenteriae)造成的细菌性痢疾已发展为世界性流行趋势,志贺氏菌株血清型分布的多样性表明在亚洲需要有多效或有交叉保护性的志贺氏菌疫苗[7]。禽畜养殖场为防治家禽的疾病发生一般将在饲料和水体中常规投入抗生素或消毒剂。
National Natural Science Foundation of China (31160035); National Undergraduate Training Programs for Innovation and Entrepreneurship (201310674005).
LIN Lian-bing, E-mail: linlb@kmust.edu.cn.
11 February, 2015; Accepted 23 September, 2015
TS201.3;Q939.48
A
1000-0275(2016)03-0601-05
10.13872/j.1000-0275.2015.0141
国家自然科学基金项目(31160035);大学生创新创业计划项目(201310674005)。
孙宇杰(1992-),男,山西阳泉人,本科在读,E-mail: id201211805154@hotmail.com;通讯作者:林连兵(1969-),男,湖南通道人,教授,硕士生导师,现主要从事微生物在农业和环保领域的应用研究,E-mail: linlb@kmust.edu.cn。
2015-02-11,接受日期:2015-09-23

