环介导等温扩增技术快速检测肉及肉制品中的牛源性成分
冼钰茵,易敏英,张 璜,高东微,凌 莉,*
(1.广东检验检疫技术中心,广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623;3.广州迪澳生物科技有限公司,广东广州 510663)
环介导等温扩增技术快速检测肉及肉制品中的牛源性成分
冼钰茵1,2,易敏英1,2,张璜3,高东微1,2,凌莉1,2,*
(1.广东检验检疫技术中心,广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623;3.广州迪澳生物科技有限公司,广东广州 510663)
本文以牛源性线粒体细胞色素B(cytB)基因为模板,采用软件Primer Explorer Version 4设计并筛选出LAMP特异性扩增引物,通过反应体系优化建立了肉及肉制品中牛源性成分的环介导等温扩增技术检测方法,对该方法的灵敏度、特异性以及稳定性进行了验证,同时采用国标方法和商品化检测试剂盒对市售的12种牛肉及牛肉制品进行对比检测。结果表明该检测方法具有高灵敏度、高特异性和高稳定性,适用于实际的生鲜肉制品及加工肉制品中牛源性成分的鉴定。
环介导等温扩增,检测,肉及肉制品,牛源性成分
1986年始发于英国的疯牛病及其随后在欧洲地区的传播使动物源性成分的使用与控制受到人们越来越多的关注与重视。为了有效地管理与控制动物源性成分,尤其是敏感性反刍动物源性成分在饲料、化妆品及食品中的使用,我国先后出台了各级标准[1-4],其中牛源性成分的监控更是重中之重。
基于宗教信仰、饮食风俗及价格等因素的影响,多个国家与地区均要求肉及肉制品的食品标签必须真实明确地标明肉类来源。目前市场上肉类掺假的现象层出不穷,2013年席卷欧洲的马肉风波仅是冰山一角,以次充好、在高价肉中掺杂低价肉甚至病死肉、变质肉等违法行为屡禁不止,甚至在某些市场销售的散装肉制品中根本不含动物源性成分,只通过淀粉与食品添加剂仿制出肉的味道来欺骗消费者,这些掺假行为均严重侵害了消费者的合法权益,也对肉及肉制品的质量安全构成了严重威胁[5]。研发高效、快速、准确地鉴别肉及肉制品中动物源性成分的检测方法,刻不容缓。

表2 牛源性成分的引物序列
环介导等温扩增技术(Loop-mediated Isothermal Amplification,LAMP)是Notomi等人发明的一种新型核酸检测技术,该技术成本低,操作简单,特异性强[6],目前已在生物、医学、公共卫生及食品安全等技术领域中得到了广泛应用[7-10]。本文根据基层实验室日常检验和进出口现场检验的条件与需求,选取人类主要的食用牛种-黄牛、水牛和牦牛为目标牛源性成分,以具有高度保守性的线粒体细胞色素B基因为靶基因,建立了牛源性成分快速检测的LAMP检测方法,该技术检测效果良好,且与国家标准方法相比,具有较高的符合率。
1 材料与方法
1.1材料与仪器
实验样品相关信息见表1,实际样品的检测,三种方法对比,其中10~12为肉制品。
Promega Wizard®核酸裂解液北京盈田卓越科技有限公司;Precision System Science MagDEA DNA提取试剂盒艾拓思科技有限公司;Ex Taq和dNTPs宝生物工程(大连)有限公司;甜菜碱、Bst DNA聚合酶和10×Thermo Pol缓冲液Sigma 公司;1000×SYBR GreenⅠ厦门百维信生物科技公司。
实时荧光定量PCR仪美国,ABI 7900;核酸提取仪Magtration System 12GC日本,Precision System Science;核酸蛋白分析仪Nanodrop 1000美国,Thermo Scientific。
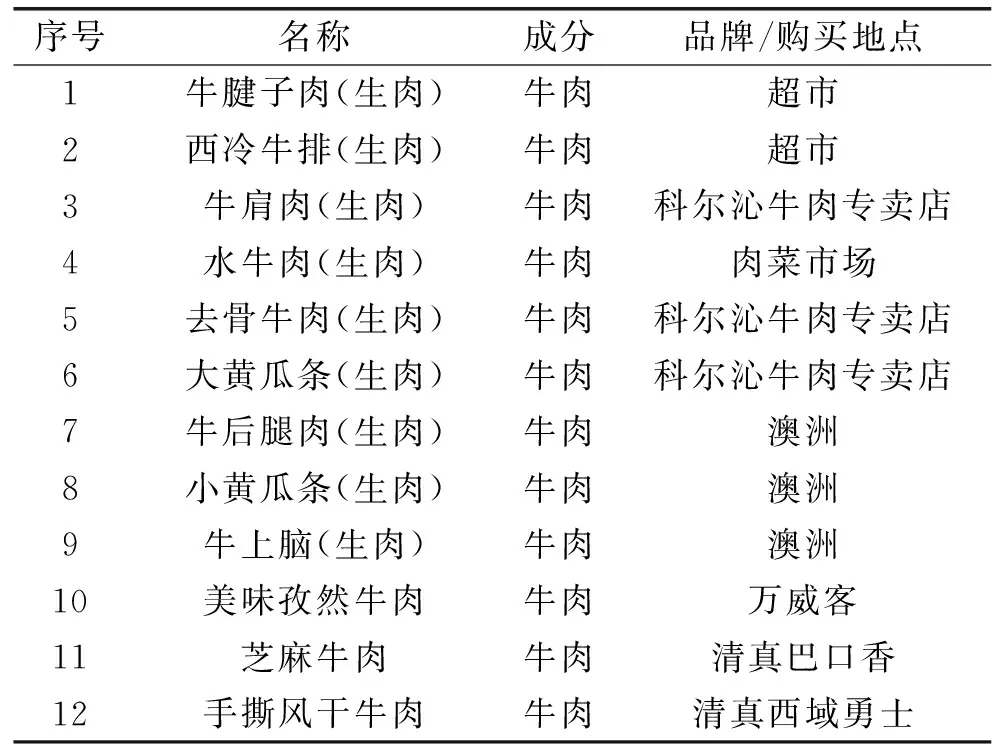
表1 实验样品相关信息
1.2实验方法
1.2.1DNA模板的制备实验样品均采用试剂盒提取DNA,并用核酸蛋白分析仪测定DNA的纯度和浓度后,将DNA溶液到稀释100 ng/μL,4℃保存备用。
1.2.2引物的设计与合成根据NCBI上公布的牛源性cytB基因序列(登录号:KJ193457.1),采用LAMP专用引物设计软件Primer Explorer Version 4设计并筛选出牛的特异性LAMP引物,由上海生工生物工程有限公司合成。引物序列见表2。
1.2.3LAMP方法的建立以黄牛、水牛和牦牛的DNA模板作为模板,以TAKARA牛源性成分检测试剂盒中的Reagent Control作为阳性对照,初步确定25 μL的LAMP反应体系,其成分包括:1×Thermol Pol缓冲液、外引物F3和B3各0.2 μmol/L、内引物FIP和BIP各1.6 μmol/L、环状引物FLP和BLP各0.8 μmol/L、1.6 mmol/L dNTPs、1 mol/L甜菜碱、6 mmol/L MgSO4、8 U Bst大片断DNA聚合酶、10×SYBR GREEN I荧光染料0.5 μL、DNA模板200 ng。
将混合物置于荧光PCR仪中实时监控扩增反应,荧光PCR仪反应程序为:Holding Stage为 63℃ 30 s,1个循环;Cycling Stage 为63℃ 15 s,63℃ 45 s,45个循环,于63℃ 45 s处收集荧光信号,荧光通道为SYBR。
1.2.4LAMP反应体系和反应条件的优化根据上述LAMP反应的实验结果,通过改变dNTPs、甜菜碱及Mg2+的浓度以及反应时间对LAMP反应条件进行优化,以确定最佳的反应体系和反应条件。
1.2.5特异性实验分别提取猪肉、水牛肉、黄牛肉、牦牛肉、山羊肉、绵羊肉、马肉及驴肉等共计31种样品的总DNA,利用上述的反应体系和条件配制相应的反应液,利用荧光PCR仪检测,确定该检测方法的特异性。
1.2.6灵敏度实验把牛源性DNA模板稀释到100 ng/μL,按体积比分别混合成10%,5%,1%,0.5%,0.1%五份阳性模拟样品,进行LAMP扩增,通过峰图评价本文所建立的LAMP的方法灵敏度。
1.2.7稳定性实验对牛源性DNA含量为10%、1%、0.5%及0.1%的阳性模拟样品,每个样品重复20次LAMP扩增,通过实时荧光检测法评价本文所建立的LAMP的方法稳定性。
1.2.8适用性实验为了验证本文所建立的LAMP方法的实际检测能力,对市售的12种牛肉及牛肉制品中的牛源性成分进行鉴定,通过实时荧光检测法评价本文所建立的LAMP的方法适用性。同时采用国标[4]中的荧光PCR方法和商品化的TAKARA牛源性成分检测试剂盒进行鉴定,与本文所建立的LAMP方法进行结果比对。
2 结果与分析
2.1牛源性成分LAMP检测方法的确立与优化
实时荧光监测结果显示,在25 μL的反应体系中,当dNTPs浓度为1.6 mmol/L,Mg2+浓度为6 mmol/L,甜菜碱浓度为1 mol/L,反应温度为63℃,反应时间为45 min时,LAMP反应的扩增效果最好,黄牛、水牛和牦牛的DNA模板均能得到明显扩增。
2.2特异性实验
利用建立的LAMP方法对31种动物的总DNA进行特异性扩增。实时荧光法的结果见图1,可知只有澳洲黄牛、科尔沁黄牛、水牛和牦牛出现特异性扩增,在其他动物的模板中均未得到任何扩增产物,表明本文所建立的检测牛源性成分的LAMP方法具有高度的方法特异性。
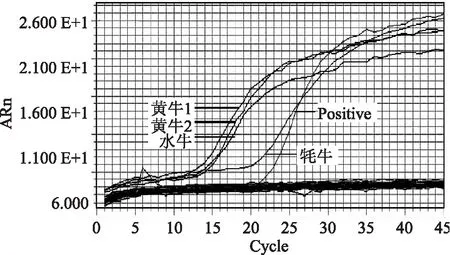
图1 牛源性成分LAMP检测方法特异性实验结果Fig.1 Specificity evaluations on LAMP reaction system for bovine ingredient detection注:黄牛1为澳洲黄牛,黄牛2为科尔沁黄牛,其余27种动物DNA模板分别为狗肉、虾肉、貉肉、猪肉、山羊肉、绵羊肉、番鸭肉、水鸭肉、鹌鹑肉、鹧鸪肉、乳鸽肉、鸡肉、罗非鱼、蟹肉、牡蛎、鹅、鳄鱼肉、田鸡肉、石蛙、昆明小鼠、SD大鼠、家兔、新西兰白化兔、驴肉、单峰骆驼、马肉、绵羊(检科院)。
2.3灵敏度实验
本文所建立的LAMP方法对黄牛、水牛和牦牛DNA模板的检测灵敏度结果见图2。实时荧光的检测结果表明本文所建立的LAMP方法对黄牛、水牛和牦牛的最低检测限均可达0.1%,具有极高的方法灵敏度。
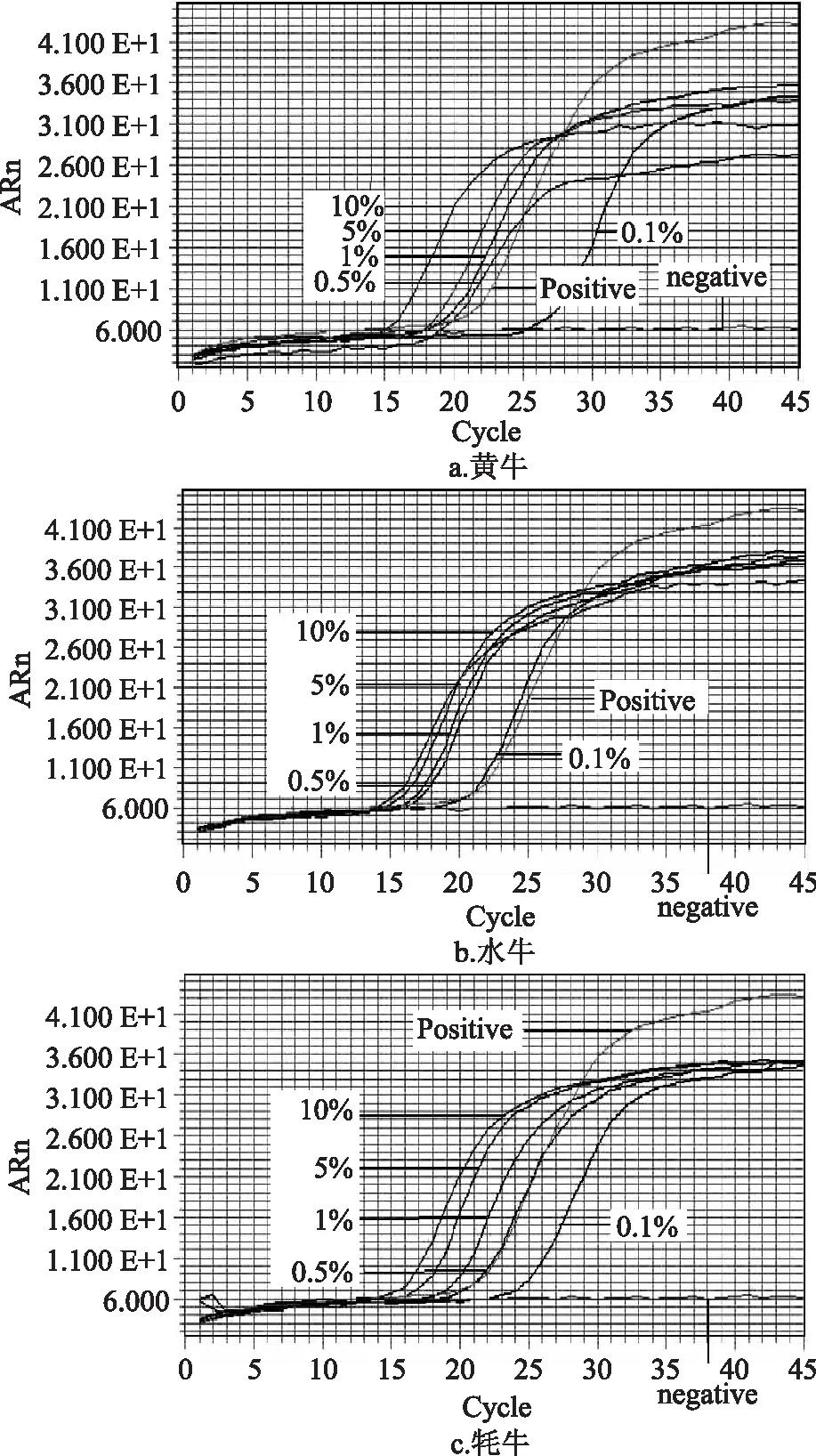
图2 牛源性成分LAMP检测方法灵敏度实验结果Fig.2 Sensitivity evaluations on LAMP reaction system for bovine ingredient detection
2.4稳定性实验
稳定性实验结果显示梯度浓度的黄牛、水牛和牦牛DNA模板在20次重复实验中均能得到准确而又稳定的有效扩增,假阴性率和假阳性率均为0,表明本文所建立的检测牛源性成分的LAMP方法具有良好的稳定性和重复性。图3是以黄牛为例的牛源性成分LAMP检测方法的稳定性实验结果。
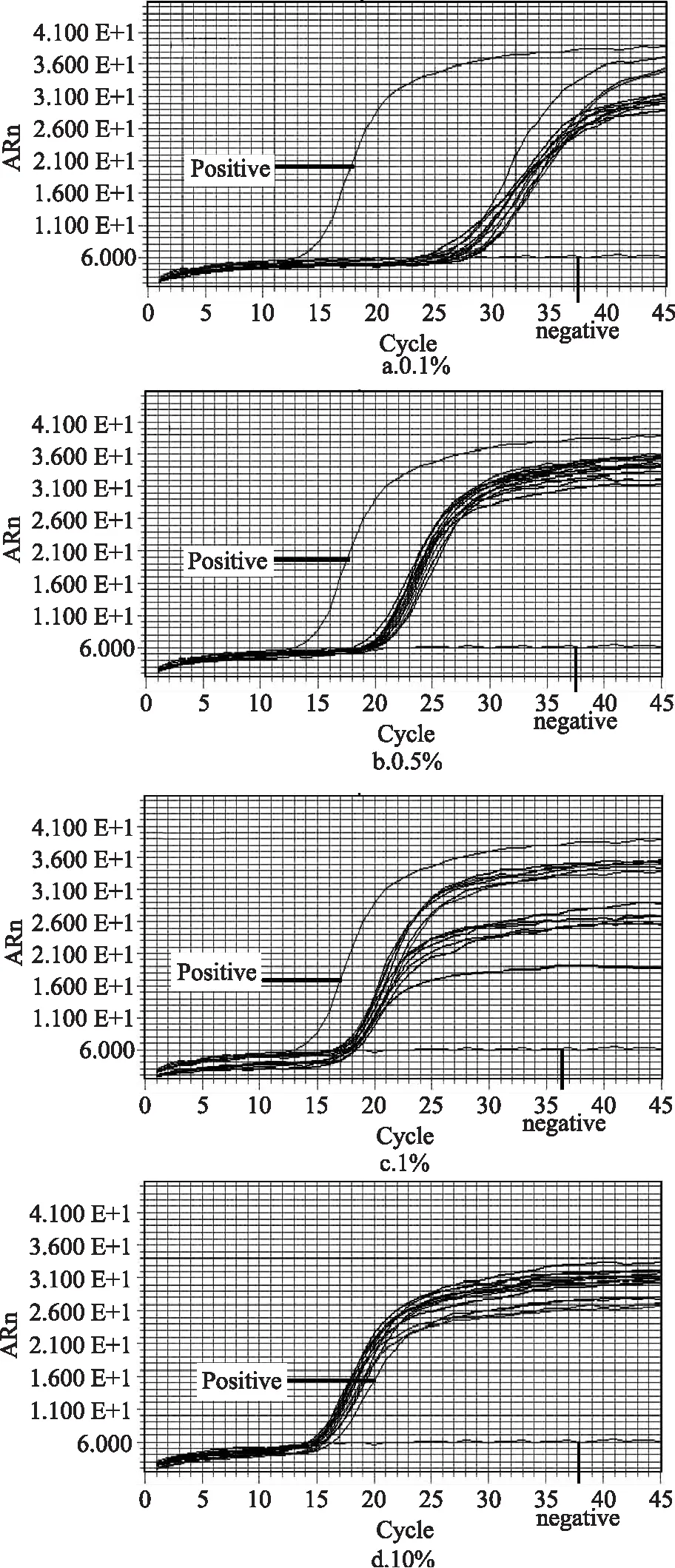
图3 以黄牛牛肉为例的牛源性成分LAMP检测方法的稳定性实验结果。Fig.3 Stability evaluations on LAMP reaction system for bovine ingredient detection(cattle)
2.5适用性实验
本文所建立的检测牛源性成分的LAMP方法适用性实验结果见图4。实时荧光的检测结果表明该检测方法对市售的牛肉及其牛肉制品中牛源性成分的鉴定与国标方法(图5)及商品化检测试剂盒(图6)完全一致,假阳性率和假阴性率均为0,表明本文建立的牛源性成分LAMP检测方法适用于生鲜牛肉及经过调味、风干制作的牛肉制品中牛源性成分的检测。
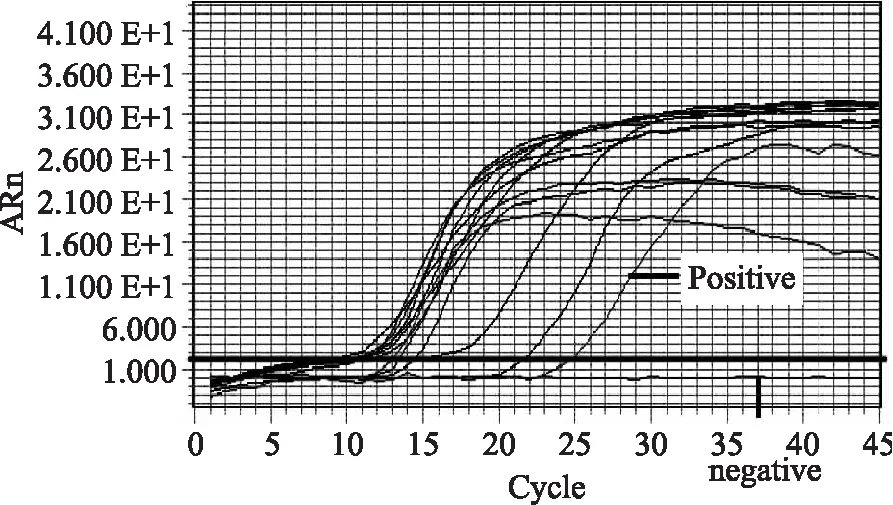
图4 牛源性成分LAMP检测方法适用性实验结果Fig.4 Applicability evaluations on LAMP reaction system for bovine ingredient detection
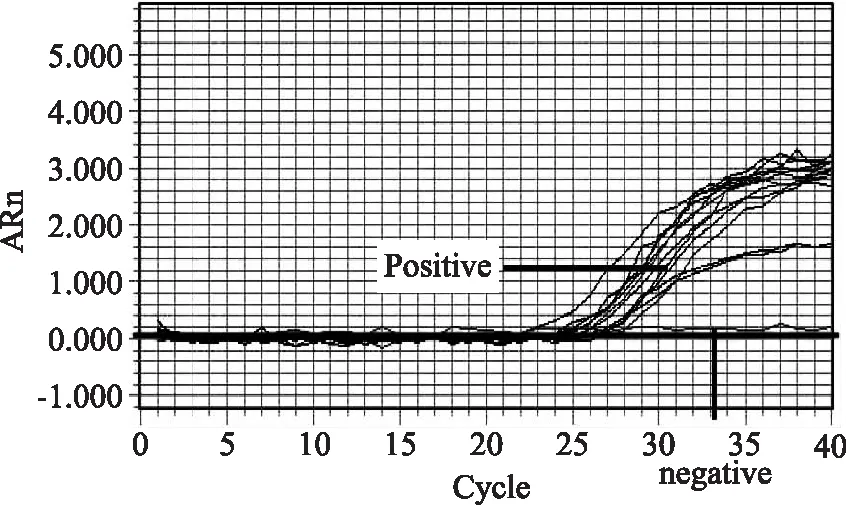
图5 牛源性成分国标检测方法适用性实验结果Fig.5 Applicability evaluations on national standard method for bovine ingredient detection
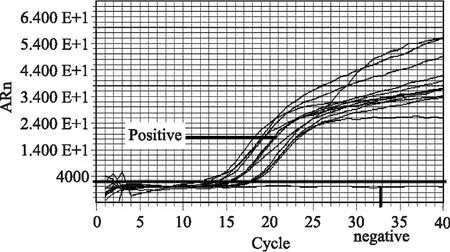
图6 牛源性成分商品化试剂盒适用性实验结果Fig.6 Applicability evaluations on commercial detection kits for bovine ingredient detection
3 结论
本文建立了肉及肉制品中牛源性成分的LAMP检测方法,该方法适用于生鲜牛肉及经过调味、风干制作的牛肉制品中牛源性成分的特异性检测,对我国南方主要食用牛肉-水牛、北方地区主要食用牛肉-黄牛及高原地区牛肉源牦牛均具有较高特异性,灵敏度均高达0.1%,以及良好的稳定性和重复性,是一种较为理想的快速定性检测方法,可满足基层实验室日常检验和进出口现场检验的条件与需求,具有极大的推广意义。
本文建立的LAMP检测方法选用线粒体细胞色素B基因为靶基因是在其具有高度保守性的基础上,综合考虑食品加工中的腌制、烹饪等过程对肉及肉制品中DNA的影响,选择拷贝数较多,在食品加工过程中降解程度相对较低的线粒体细胞色素B基因为目标基因[11]。
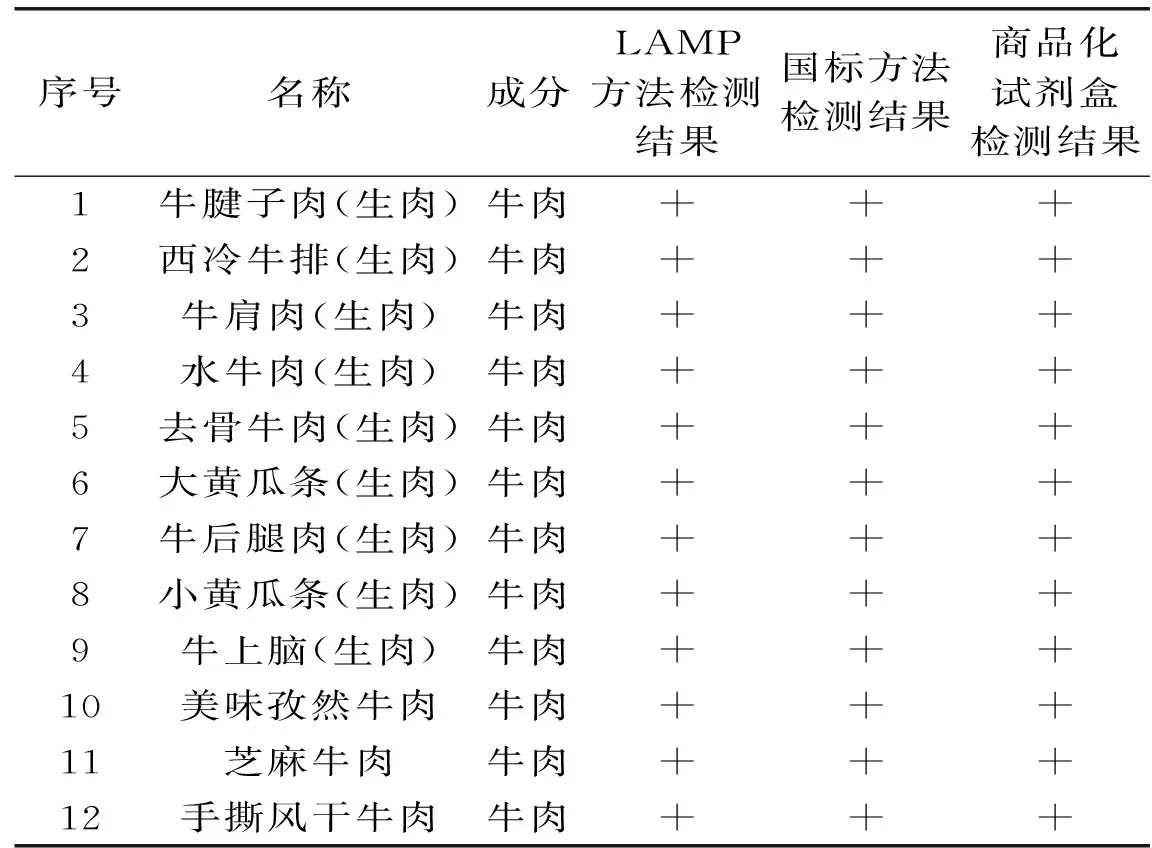
表3 实际样品检测结果
仅仅依靠视觉、嗅觉、触觉与味觉等感官评价及经验来鉴别肉及肉制品的掺假行为已远远不能满足现实检测要求。随着分子生物学的持续发展和现代仪器分析手段的不断完善,对肉及肉制品中动物源性成分的鉴别技术逐渐形成了基于蛋白质和基于核酸的两大检测技术体系,检测灵敏度与准确度均大幅提高[12]。蛋白质在肉及肉制品中分布差异较大,在腌制、烹饪等过程中易变性受损等因素限制了其在熟肉及肉制品中的应用,因此不适用于肉及肉制品中的牛源性成分检测[13-14];在热稳定性与酸碱稳定性方面略胜一筹的DNA作为遗传信息的载体具有特异性高,不受组织类别限制等优点,逐步成为肉及肉制品种属鉴别的技术主流,在此基础上衍生出PCR-RFLP[15]、RAPD-PCR[16]、实时荧光PCR[17]和LAMP[7]等技术。实时荧光定量PCR方法目前是肉类种属鉴别的主流,本文用来比对的国标方法和商品化检测试剂盒均是实时荧光PCR方法。LAMP则是肉及肉制品种属鉴别技术中极具潜力的发展方向,自2010年Ahmed等人[18]首开先河把LAMP与电化学传感器结合进行肉类种属来源的鉴别以后,LAMP在肉及肉制品种属鉴别领域得到越来越多的认可与重视;2012年侯东军[19]等人以细胞色素B基因组为模板,建立了LAMP检测方法运用于牛肉和羊肉中鸡肉、鲤鱼肉和猪肉成分的掺杂鉴定;2014年德国研究者还建立了以鸵鸟源性cytB基因的LAMP检测方法[20],韩国研究者甚至还针对猪、牛、鸡、鸭、马、山羊、绵羊和火鸡8种动物的线粒体DNA分别设计了种特异性引物以构建LAMP的肉源性鉴定[21]。本研究正是在这种发展趋势下深入研究LAMP技术在牛源性成分检测中的应用,并进一步细化肉源。从适用性实验结果看,3种方法均能定性检测出肉及肉制品中的牛源性成分,但从实时荧光监测图可知,本文建立的LAMP检测方法扩增效率最高,检测也更为灵敏。此外,本文建立的LAMP检测方法对仪器设备的要求相对较低,只需恒温加热,即可采用终点显色法进行结果判读,在基层及现场检验中具有很大应用前景,这是本文建立此检测方法的初衷,在此基础上建立肉及肉制品中牛源性成分的LAMP定量检测方法则是本文下一步研究计划。
[1]中华人民共和国国家质量监督检验检疫总局.SN/T 1119-2002进口动物源性饲料中牛羊源性成分检测方法PCR方法[S].北京:中国标准出版社,2002.
[2]中华人民共和国国家质量监督检验检疫总局.GB/T 21104-2007动物源性饲料中反刍动物源性成分(牛、羊、鹿)定性检测方法PCR方法[S].北京:中国标准出版社,2007.
[3]中华人民共和国国家质量监督检验检疫总局.SN/T 2051-2008食品、化妆品和饲料中牛羊猪源性成分检测方法实时PCR方法[S].北京:中国标准出版社,2008.
[4]中华人民共和国国家质量监督检验检疫总局.GB/T 25165-2010明胶中牛、羊、猪源性成分的定性检测方法实时荧光PCR法[S].北京:中国标准出版社,2010.
[5]李宗梦,赵良娟,赵宏,等.肉及肉制品动物源性成分鉴别技术研究进展[J].食品研究与开发,2014,35(18):122-127.
[6]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,
2000,28(12):63-68.
[7]Bühlmann A,Pothier J F,Rezzonico F,et al.loop-mediated isothermal amplification(LAMP)assay for rapid pathogen detection and on-site diagnosis of fire blight[J].Journal of Microbiology Methods,2013,92(3):332-339.
[8]江再茂,马雪萍,殷竹君,等.单管可视化环介导等温扩增技术快速检测恶性疟原虫[J].现代生物医学进展,2014,14(26):5014-5018.
[9]Scheel C M,Zhou Y,Theodoro R C,et al.Development of a loop-mediated isothermal amplification method for detection of Histoplasma capsulatum DNA in clinical samples[J].Journal of Clinical Microbiology,2014,52(2):483-488.
[10]初亚男,封利颖,张婕妤,等.环介导等温扩增技术改进的研究进展[J].微生物学通报,2015,42(4):729-735.
[11]Ballin N Z,Vogensen F K,Karlsson A H.Species determination:can we detect and quantify meat adulteration[J].Meat Science,2009,83(2):165-174.
[12]何玮玲,黄明,张驰.食品中肉类成分种属鉴别技术研究进展[J].食品科学,2012,33(3):304-307.
[13]Rao Q C,Hsieh Y H P.Evaluation of a commercial lateral flow feed test for rapid detection of beef and sheep content in raw and cooked meats[J].Meat Science,2007,76(3):489-494.
[14]Myers M J,Yancy H F,Farrell D E,et al.Assessment of two enzyme-linked immunosorbent assay tests marketed for detection of ruminant proteins in finished feed[J].Journal of Food Protection,2007,70(3):692-699.
[15]Murugaiah C,Noor Z M,Mastakim M,et al.Meat species identification and halal authentication analysis using mitochondrial DNA[J].Meat Science,2009,83(1):57-61.
[16]Saez R,Sanz Y,Toldra F.PCR-based fingerprinting techniques for rapid detection of animal species in meat products[J].Meat Science,2004,66(1):659-665.
[17]Kesmen Z,Gulluce A,Sahin F,et al.Identification of meat species by TaqMan-based real-time PCR assay[J].Meat Science,2009,82(4):444-449.
[18]Ahmed M U,Hasan Q,Mosharraf H M,et al.Meat species identification based on the loop-mediated isothermal amplification and electrochemical DNA sensor[J].Food Control,2010,5(21):599-605.
[19]侯东军,杨红菊,于雷,等.环介导恒温扩增法鉴定牛羊肉中的掺杂肉[J].食品工业科技,2012,33(22):60-62.
[20]Abdulmawjood A,Grabowski N,Fohler S,et al.Development of loop-Mediated Isothermal amplification(LAMP)assay for rapid and sensitive identification of ostrich meat[J].PLOS ONE 9(6):e100717.
[21]Cho A R,Dong H J,Cho S.Meat species identification using loop-mediated isothermal amplification assay targeting species-specific mitochondrial DNA[J].Korean Journal for Food Science of Animal Resources,2014,34(6):799-807.
Development of loop-mediated isothermal amplification (LAMP)method for rapid detection of bovine in meat and meat products
XIAN Yu-yin1,2,YI Min-ying1,2,ZHANG Huang3,GAO Dong-wei1,2,LING Li1,2,*
(1.Guangdong Inspection and Quarantine Technology Center,Guangzhou 510623,China; 2.Guangdong Key Laboratory of Import and Export Technical Measures of Animal,Plant and Food,Guangzhou 510623,China; 3.Guangzhou Diao Bio-Technonly Co.Ltd.,Guangzhou 510663,China)
According to the sequence of bovine mitochondrial cytochrome B(cytB)gene,sets of bovine-specific loop-mediated isothermal amplification(LAMP)primers were designed and screened with the Primer Explorer Version 4 software.Optimization of the parameters and the reaction system was made to establish the rapid detection LAMP method for bovine ingredient in meat and meat products.The specificity,sensitivity and stability of this method was evaluated and compared to national standard method and commercial detection kit.The bovine ingredient detection in 12 meat and meat products were 100% consistent to the sample information,indicated that this method with high specificity,sensitivity and stability could be used to detect bovine ingredient in fresh or processed meat products.
loop-mediated isothermal amplification;detection;meat and meat products;bovine ingredient
2015-10-14
冼钰茵(1990-),女,硕士,食品科学,从事微生物检测,E-mail:1037206309@qq.com。
凌莉(1978-),女,硕士,从事微生物检测,E-mail:joiceling@163.com。
广东局科技项目(2014GDK08);广州市科技计划项目(2014Y2-00081)。
TS251.5
A
1002-0306(2016)07-0278-05
10.13386/j.issn1002-0306.2016.07.045

