不同干燥方法对酸枣叶中核苷类、氨基酸类及黄酮类成分的影响
张 颖,郭 盛,朱邵晴,徐 璐,严 辉,钱大玮,段金廒
(南京中医药大学,江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏南京 210023)
不同干燥方法对酸枣叶中核苷类、氨基酸类及黄酮类成分的影响
张颖,郭盛*,朱邵晴,徐璐,严辉,钱大玮,段金廒*
(南京中医药大学,江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏南京 210023)
为研究不同干燥方法对酸枣叶干燥过程中内在质量的影响,采用UPLC-TQ MS法和HPLC法分别建立酸枣叶中20种核苷类和23种氨基酸类,以及黄酮类成分芦丁的分析方法,并探索不同干燥方法对酸枣叶中上述组分组成及含量的影响。研究结果表明本研究所建立的分析方法简便、准确可靠;所有样品均富含核苷类、游离氨基酸类及黄酮类成分芦丁,其中核苷类成分以磷酸化产物如胞苷-5′-单磷酸、腺苷-5′-单磷酸、鸟苷-5′-单磷酸含量相对较高,游离氨基酸类成分以脯氨酸、酪氨酸、γ-氨基丁酸含量相对较高;且所有干燥加工后样品其上述成分含量均总体高于新鲜样品。依据各样品中所测定成分的含量,采用TOPSIS分析法,对不同干燥方法干燥样品的内在质量进行了综合评价,结果显示以自然晒干样品和40 ℃热风干燥样品品质较优,而新鲜样品及70 ℃热风干燥样品品质较差。以上研究结果为酸枣叶产地干燥加工过程适宜干燥工艺的确定提供了数据支撑,也为叶类药材的干燥加工提供了借鉴。
酸枣叶,干燥加工,核苷类,氨基酸类,黄酮类
酸枣[Ziziphusjujubavar.spinosa(Bunge)Hu ex H.F.Chow]系鼠李科枣属植物,广泛分布于我国北方广大地区,其中尤以河北、山西、陕西、河南、山东等地的低山丘陵区为多。其干燥成熟种子酸枣仁为中医临床常用宁心安神药物,具养心补肝、宁心安神、敛汗、生津之功效。此外,本草尚记载酸枣果肉、花、叶、棘刺、树皮及根均可药用。其中,酸枣叶又名棘叶,具敛疮解毒之功,可用于臁疮的治疗[1]。除作药用外,近年来酸枣叶已被开发为功能性茶饮,具调节神经衰弱之心神不安、失眠多梦,改善心肌缺血,降血压,降血脂等保健作用。此外,酸枣叶在伊朗等地还常用于甜味抑制剂[2-3]。近年来,国内外围绕酸枣叶已开展了广泛的基础研究,结果表明酸枣叶中含有三萜酸及其皂苷类[2,4]、黄酮类[5]、酚酸类[6]、核苷类[7]、氨基酸类等多种类型活性成分,为其保健功效物质基础的阐明提供了支撑。但迄今,尚未见关于酸枣叶在采摘后干燥加工过程中其化学成分的变化趋势及不同干燥方法对其多类型活性成分影响的报道。据此,本研究以酸枣叶中含有的与其营养保健功效密切相关的核苷类、氨基酸类、黄酮类化学成分为指标,考察其干燥过程中多元化学成分的变化趋势,以及不同干燥方法对其变化程度的影响,以期为酸枣叶产地适宜干燥加工方法的建立提供参考。
1 材料与方法
1.1材料与仪器
氨基酸类化学对照品亮氨酸、苯丙氨酸、异亮氨酸、色氨酸、γ-氨基丁酸、甲硫氨酸、脯氨酸、缬氨酸、牛磺酸、酪氨酸、丙氨酸、4-羟基脯氨酸、苏氨酸、谷氨酸、赖氨酸、谷氨酰胺、丝氨酸、天冬酰胺、瓜氨酸、精氨酸、组氨酸、鸟氨酸、天冬氨酸,核苷类化学对照品胸腺嘧啶、胸苷、2′-脱氧腺苷、腺嘌呤、尿苷、腺苷、2′-脱氧肌苷、肌苷、胞嘧啶、胞苷、鸟苷、2′-脱氧腺苷-5′-单磷酸、腺苷-5′-单磷酸、鸟苷-5′-单磷酸、胞苷-5′-单磷酸、2′-脱氧尿苷、肌苷-5′-单磷酸、环磷酸鸟苷(cGMP)、环磷酸腺苷(cAMP)、2′-脱氧鸟苷均购自Sigma公司;黄酮类化学对照品芦丁购自中国食品药品检定研究院;以上化学对照品纯度经HPLC检测均大于98%。
乙腈(色谱纯)购自德国默克公司;超纯水(18.2 MΩ·cm)经EPED超纯水系统自制;其它化学试剂(分析纯)购自上海国药化学试剂公司。
酸枣叶样品于2015年7月采自南京中医药大学药用植物园,经南京中医药大学段金廒教授鉴定为鼠李科植物酸枣Ziziphusjujubavar.spinosa(Bunge)Hu ex H.F.Chow的叶。药材标本存放于南京中医药大学标本馆。样品采集后,去离子水清洗表面,4 ℃贮存备用。
电热鼓风干燥机上海一恒科学仪器有限公司;中短波红外干燥机江苏泰州圣泰科红外科技有限公司;隧道式微波干燥机南京研正微波设备厂;LabconcoFreeZone 2.5L冷冻干燥机美国Labconco公司;Waters 2695 HPLC及Waters ACQUITY UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器)、Xevo TQ检测器、MassLynxTM质谱工作站软件美国Waters公司;BT125型电子天平赛多利斯科学仪器有限公司;EPED超纯水系统南京易普易达科技发展有限公司;KQ-250E型超声波清洗器昆山禾创超声仪器有限公司;Anke GL-16GII型离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1样品处理及干燥方法取新鲜酸枣叶,去除杂质,混合均匀,随机分为质量相近的10组,按表1所示干燥方法进行干燥,至含水率达10%时停止干燥。

表1 酸枣叶干燥加工信息表Table 1 Information of drying methods carried out on the leaves of Ziziphus jujuba var.spionsa
1.2.2氨基酸及核苷类成分测定本课题组此前采用UPLC-TQ/MS法已建立了分别用于测定枣属植物中核苷类[7]、氨基酸类[8]化学成分的定性定量分析方法。为缩短分析时间、减少样品溶液制备次数,本研究在前期研究的基础上,参考文献[9]建立了同时测定20种核苷类成分、23种氨基酸类成分的UPLC-MS/MS分析方法。
1.2.2.1供试品溶液的制备取样品粉末1.0 g,精密称定,置100 mL具塞锥形瓶中,精密加入超纯水50 mL,称重,静置30 min后,超声(100 Hz,50 ℃)60 min,冷却后加超纯水补足减失重量,摇匀,13000 r/min离心10 min,取上清液过0.22 μm滤膜,取续滤液,即得。
1.2.2.2对照品溶液的制备取干燥至恒重的各核苷与氨基酸对照品适量,精密称定,以少量10%甲醇溶解,置10 mL容量瓶中,定容至刻度,摇匀,配成混合核苷与氨基酸对照品溶液。
1.2.2.3色谱及质谱条件色谱条件同文献[9]。
质谱检测方式:多反应检测(MRM);毛细管电压:3.0 kV;离子源温度:150 ℃;脱溶剂气温度:550 ℃;脱溶剂气流量:1000 L/h;锥孔气流量:50 L/h;碰撞气流量:0.15 mL/min;取样锥孔电压:4 V;碰撞能量:18 eV。
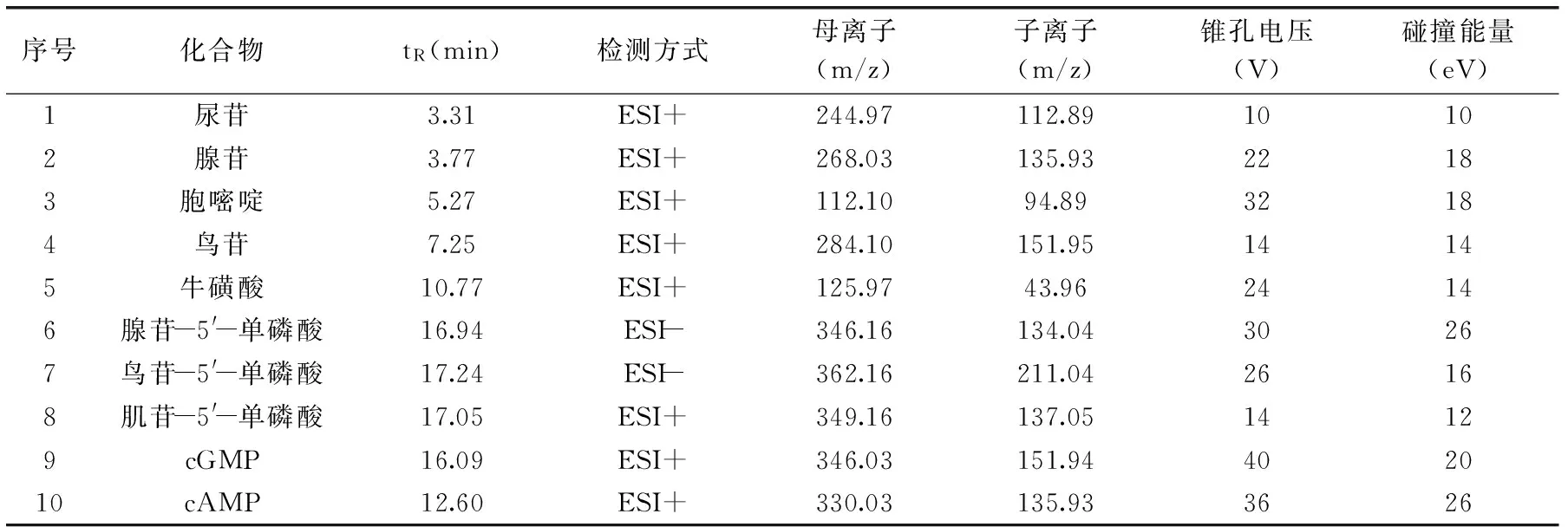
表2 各化合物的主要质谱检测参数Table 2 Precursor/product ion pairs and parameters for MRM of compounds used in this study
本研究基于文献[9]报道的化合物质谱检测条件外,新增加了尿苷等10个化合物的MS/MS检测,具体质谱检测参数见表2。
1.2.2.4方法学考察为考察所建立方法的适用性及可靠性,分别对其线性关系、精密度、重复性、稳定性、加样回收率进行了考察。
线性关系考察:按1.2.2.2步骤配制混合对照品系列标准溶液,按1.2.2.3色谱及质谱条件进样分析,评价方法的线性关系。
精密度、重复性及稳定性实验:取混合对照品溶液按“1.2.2.3”项下方法重复测定6次,记录峰面积并计算RSD值,得精密度实验结果;取样品S9,按“1.2.2.1”项下方法分别制备供试品溶液,按“1.2.2.3”项下方法测定各待测成分质量分数,计算RSD值,得重复性实验结果;取重复性实验中的任一供试品溶液,室温贮存,并分别于0、2、4、6、8、12 h分别进样测定,记录峰面积并计算RSD值,得稳定性实验结果。
加样回收率实验:取样品S9,采用标准加入法进行加样回收率实验。准确称取6份样品各0.5 g,分别加入适量已知质量浓度的对照品溶液。按“1.2.2.1”项下方法分别制备供试品溶液,按“1.2.2.3”项下方法测定各待测成分质量分数,计算其加样回收率。
1.2.3黄酮类成分的测定
1.2.3.1供试品溶液的制备取酸枣叶干燥品,粉碎,过筛(40目),取粉末约1 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇20 mL,称重,超声30 min,取出放冷,称重后补足失重,取上清液,离心(13000 r/min)10 min,经0.22 μm滤膜滤过,取续滤液,即得。
1.2.3.2对照品溶液的制备精密称取芦丁对照品1.27 mg,至5 mL量瓶中,加70%甲醇适量,超声溶解,放冷,加70%甲醇至刻度,涡旋混匀,即得芦丁对照品储备液。精密吸取适量储备液,稀释成系列不同浓度的对照品溶液,用于考察线性关系。
1.2.3.3色谱条件AlltimaTMC18(4.6 mm×250 mm,5 μm)色谱柱;柱温30 ℃;流动相为0.2%甲酸水(A)和乙腈(B);流速1.0 mL/min;梯度洗脱(0~15 min,15% B;15~20 min,15%~17% B;20~25 min,17% B;25~35 min,17%~22% B;35~40 min,22%~90% B;40~45 min,90%~15% B;45~50 min,15% B)。检测波长354 nm,进样体积10 μL。代表性色谱图见图2。
图1 酸枣叶中核苷及氨基酸类成分UPLC-TQ MS图Fig.1 UPLC-TQ MS of nucleosides and amino acids in the leaves of Ziziphus jujuba var.spinosa

图2 酸枣叶中芦丁HPLC图Fig.2 HPLC of rutin in the leaves of Ziziphus jujuba var.spinosa注:A:对照品溶液,B:样品溶液。
1.2.3.4方法学考察按1.2.3.2步骤配制芦丁对照品系列标准溶液,按1.2.3.3色谱条件进样分析,评价方法的线性关系。取混合对照品溶液按“1.2.3.3”项下方法重复测定6次,记录峰面积并计算RSD值,得精密度实验结果;以样品S9为供试品,称定6份,分别按“1.2.3.1”项下方法分别制备供试品溶液,按“1.2.3.3”项下方法测定芦丁成分质量分数,计算得其RSD值得重复性实验结果;取重复性实验中的任一供试品溶液,室温贮存,并分别于0、2、4、6、8、12 h分别进样测定,记录峰面积并计算RSD值,得稳定性实验结果。取样品S9,采用标准加入法进行加样回收率实验。准确称取6份样品各0.5 g,分别加入适量已知质量浓度的对照品溶液,按“1.2.3.1”项下方法分别制备供试品溶液,按“1.2.3.3”项下方法测定待测成分质量分数,计算其加样回收率。
1.3数据统计分析
测定结果采用平均值±标准差表示。所有数据采用SPSS18.0统计软件包进行单因素方差分析,显著性检验(p<0.05)以LSD检验方法进行。不同干燥方法酸枣叶样品营养及保健价值综合评价采用DPS数据处理系统逼近理想值的排序方法(Technique for Order Preference by Similarity to Ideal Solution,TOPSIS)进行分析。
2 结果与分析
2.1氨基酸及核苷类成分的测定
2.1.1方法学考察结果方法学考察测定结果见表3,结果显示43种待测成分在其相应的线性范围内线性相关系数为0.9952~1.0000,表明该方法线性关系均良好。精密度实验RSD值在1.36%~3.49%,重复性实验RSD值在1.94%~3.83%,稳定性实验RSD值在1.39%~3.33%。表明该方法精密度及重复性均良好,供试品溶液在24 h内稳定,可满足测定要求。加样回收率实验结果显示43种待测成分加样回收率为95.18%~103.43%,RSD<4%,表明该方法准确可靠。
2.1.2样品中核苷及氨基酸类成分的测定结果在上述方法学考察的基础上,按照选定的最佳仪器测试参数,采用外标一点法测定各样品溶液中待测成分的含量,结果见表4。比较酸枣叶新鲜样品及不同干燥方法干燥后样品中待测成分含量,结果显示:酸枣叶样品中均富含核苷类及氨基酸类成分,其中氨基酸类成分含量较为丰富,其总量最高可达2.0%。在核苷类成分中,以磷酸化的核苷类成分如胞苷-5′-单磷酸、腺苷-5′-单磷酸、鸟苷-5′-单磷酸,以及尿苷含量相对较高。在游离氨基酸中以脯氨酸含量最高,平均含量达1.90 mg/g,其次为酪氨酸(1.03 mg/g)、γ-氨基丁酸(0.97 mg/g)、丙氨酸(0.96 mg/g)。其中,γ-氨基丁酸是一种天然存在的非蛋白组成氨基酸,是目前研究较为深入的一种重要的抑制性神经递质,可参与多种代谢活动,具有健脑益智、促进睡眠、延缓脑衰老机能、降血压等作用。酪氨酸是酪氨酸酶单酚酶功能的催化底物,是最终形成优黑素和褐黑素的主要原料,应用于美白化妆品中,可有效地抑制黑素的生成,此外尚具有抗抑郁作用。8种必需氨基酸中,除未检测到甲硫氨酸外,其余均存在于多数样品中,表明酸枣叶具有较高的营养保健价值。
经不同干燥方法干燥后样品中核苷类及氨基酸类成分总量均高于新鲜样品。40 ℃热风干燥(S2)、红外干燥(S6)、晒干(S9)、微波干燥(S7)所得样品总核苷类成分含量相对较高。总游离氨基酸含量以晒干(S9)、35 ℃热风干燥(S1)含量相对较高。其中,脯氨酸、天冬酰胺在上述二样品中含量远高于其他干燥样品。有研究显示,植物在干旱胁迫下,脯氨酸、天冬酰胺可大量积累,植物体内脯氨酸及天冬酰胺的含量在一定程度上反映了植物的抗逆性。本研究中,新鲜酸枣叶采用35 ℃条件下热风干燥或晒干的处理方法,其过程与干旱胁迫类似,推测在此过程中脯氨酸及天冬酰胺相关合成酶活性增强,从而表现为所得样品中脯氨酸和天冬酰胺含量显著高于新鲜样品及其他干燥方法所得样品。而冷冻干燥是指物料经完全冻结,中心温度降至-18 ℃以下,并通过低温真空使冰晶升华,从而达到低温脱水干燥的目的,其可最大限度地保留新鲜样品中的活性成分,本研究显示冻干样品中脯氨酸及天冬酰胺含量与新鲜样品未见显著性差异,证实了干燥加工过程中脯氨酸及天冬酰胺含量的升高与单纯脱水无关。此外,本研究也显示与脯氨酸及天冬酰胺合成相关的酶系热稳定性差,故而在温度高于40 ℃条件下干燥时,随干燥温度升高其含量整体呈现下降趋势。以上研究结果进一步验证了脯氨酸及天冬酰胺含量的升高与模拟干旱胁迫相关。
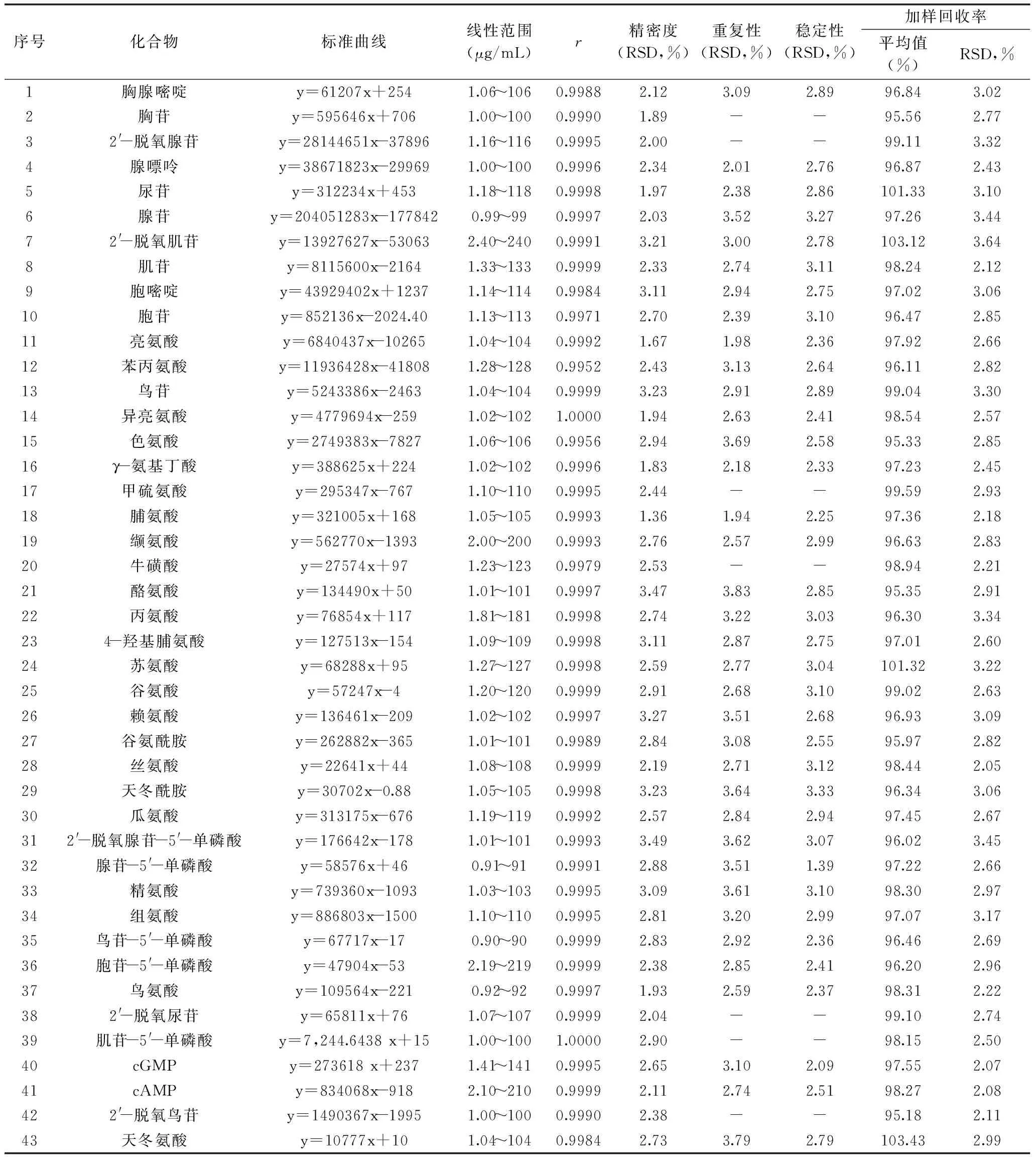
表3 核苷及氨基酸类成分测定方法学考察实验结果Table 3 Validation of the method for determination of nucleosides and amino acids
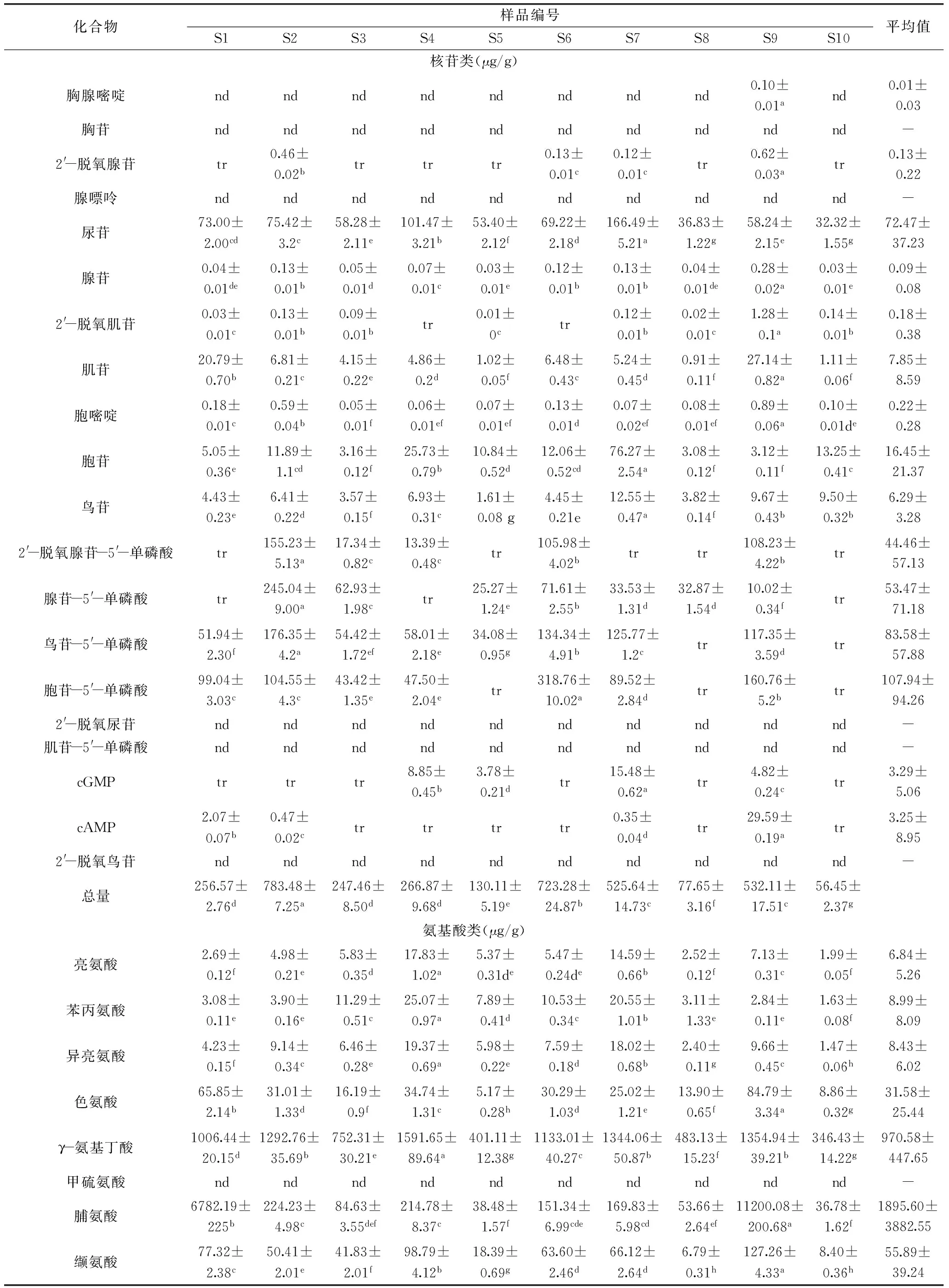
表4 不同样品中核苷类、氨基酸类及黄酮类成分分析结果(n=3)Table 4 The analysis results of the investigated nucleosides,amino acids and flavonoids in samples(n=3)
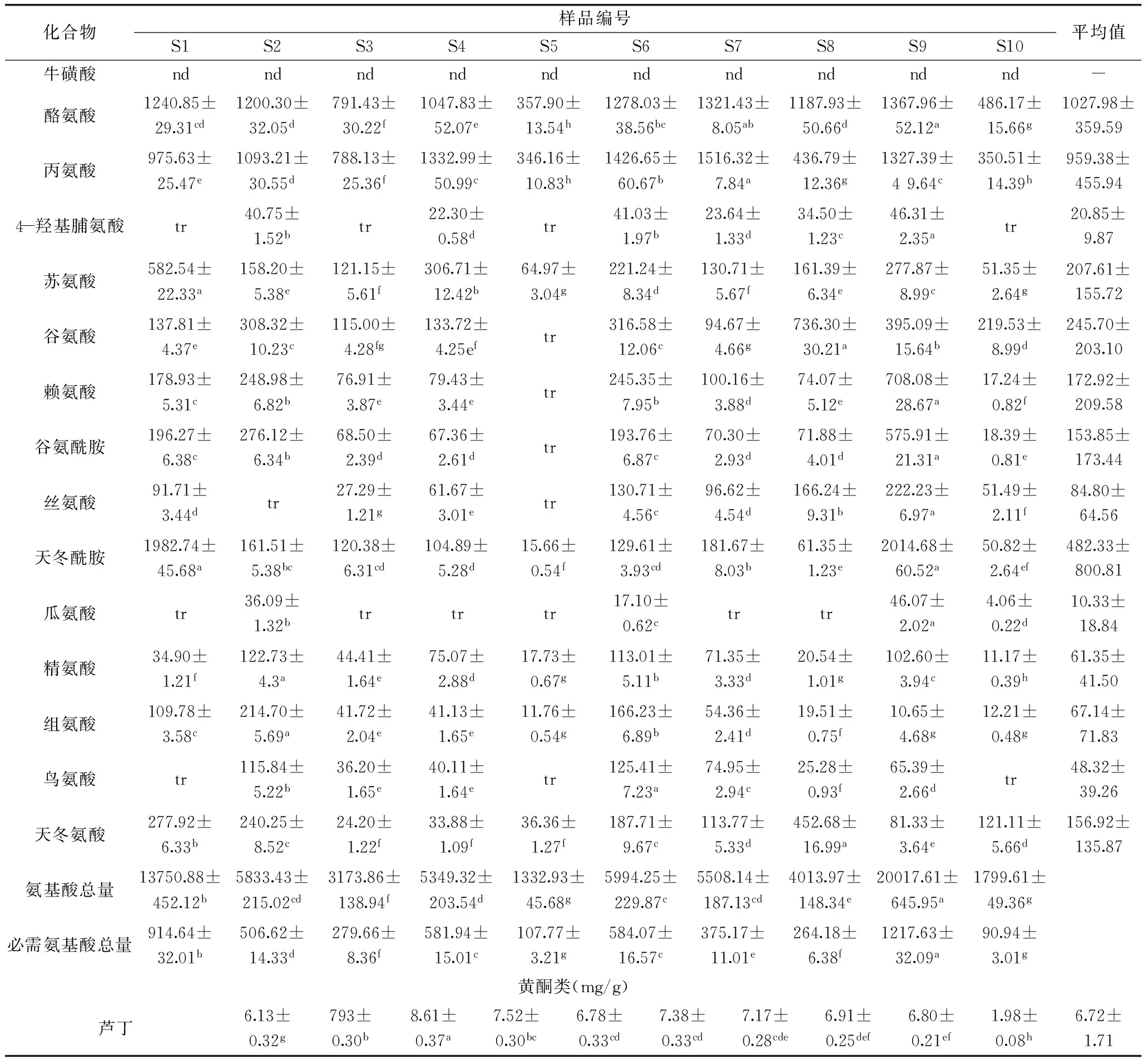
续表
注:样品序号同表1;nd:未检测到;tr:低于定量限;同一行中两组数据标识字母不同表明其具有显著性差异(p<0.05)。
2.2黄酮类成分芦丁的测定
2.2.1方法学考察结果线性关系考察结果显示芦丁对照品工作曲线回归方程为y=1695521 x+36757,在浓度2.54~254 μg/mL范围内相关系数(r)为0.9999,表明该方法线性关系良好。精密度、重复性、稳定性实验结果显示其RSD值分别为0.77%、1.44%、1.41%。以上实验结果表明该方法精密度及重复性均良好,供试品溶液在24 h内稳定,可满足测定要求。加样回收率实验结果显示其平均回收率为98.5%,RSD值0.84%,表明该方法准确可靠。
2.2.2样品中黄酮类成分芦丁的测定结果供试样品中芦丁含量测定结果见表4。结果显示,所有干燥样品中芦丁含量均显著高于新鲜样品。不同温度热风干燥样品中,芦丁含量随着干燥温度的升高呈现上升趋势,50 ℃干燥样品中芦丁含量最高(8.61 mg/g),之后随着干燥温度的升高芦丁含量渐趋下降。相同干燥温度(50 ℃)经不同干燥方法干燥样品,以热风干燥法芦丁含量最高,微波干燥法与红外干燥法所干燥样品其芦丁含量无显著差异。研究显示,芦丁具有抗氧化、抗衰老、保护心脑血管等多重生物活性。本研究结果显示酸枣叶中芦丁含量丰富,表明酸枣叶具有重要的营养保健价值。
2.3不同干燥方法酸枣叶样品营养及保健价值综合评价
本研究所测定酸枣叶中各指标成分含量在不同干燥方法中变化趋势不同,且在数量级上也存在较大差异,因此采用简单加和法显然不能客观全面反映各样品的内在质量。TOPSIS分析方法是目前一种较为理想的基于多指标变量进行综合排序的常用统计方法,其中心思想是首先确定各项指标的正理想值A+和负理想值A-,然后求出各干燥方法与正、负理想值之间的加权欧式距离D+和D-,从而求出各干燥方法与理想方案的接近程度Ci,作为评价方案优劣的标准[10]。据此,本研究为揭示不同干燥方法干燥酸枣叶样品的保健功效及营养价值差异,以10批次酸枣叶样品中含有的23种氨基酸、20种核苷以及芦丁的含量组成10×44矩阵,采用DPS数据处理系统,对酸枣叶样品测定结果进行TOPSIS分析,结果见表5。
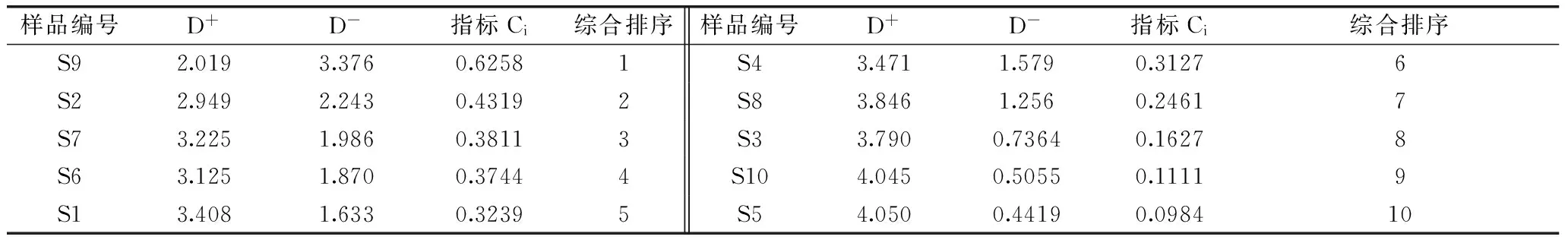
表5 TOPSIS综合评价结果Table 5 Results of the TOPSIS evaluation
TOPSIS评价结果显示,自然晒干样品(S9)、40 ℃热风干燥样品(S2)综合排序分列1、2位,而新鲜样品(S10)及70 ℃热风干燥样品(S5)综合排序分列9、10位,表明就以上所测定核苷类、氨基酸类及黄酮类成分芦丁而言,以自然晒干样品和40 ℃热风干燥样品品质较优,而新鲜样品及70 ℃热风干燥样品品质较差。以上研究结果提示酸枣叶在产地干燥加工过程中应以传统晒干法或40 ℃热风干燥为其最佳干燥方法。
3 结论
本文分别采用UPLC-TQ MS、HPLC法建立了酸枣叶中20种核苷类、23种游离氨基酸类,以及黄酮类成分芦丁的分析方法,并通过10批次样品验证表明本研究所建立的方法简便、准确可靠。所有样品均富含氨基酸类、核苷类及黄酮类成分芦丁,其中氨基酸类成分中以脯氨酸、酪氨酸、γ-氨基丁酸含量相对较高,核苷类成分以磷酸化产物如胞苷-5′-单磷酸、腺苷-5′-单磷酸、鸟苷-5′-单磷酸含量相对较高,表明酸枣叶具有较高的营养保健价值。基于TOPSIS分析法,建立了基于酸枣叶中含有的多类型营养成分角度的客观评价酸枣叶保健营养价值的综合评价方法。评价结果显示酸枣叶在产地干燥加工过程中应以传统晒干法或40 ℃热风干燥法为其适宜干燥方法,为酸枣叶产地干燥加工方法的选择提供了数据支撑。
[1]国家中医药管理局《中华本草》编委会.中华本草(第五册)[M].上海:上海科学技术出版社,1999,260,267.
[2]郭盛,段金廒,钱大玮,等.枣属植物化学成分研究进展[J].国际药学研究杂志,2013,40(6):702-710.
[3]Yoshikawa K,Shimono N,Arihara S.Antisweet substances,jujubasaponins I-III fromZizyphusjujubarevised structure of ziziphin[J]. Tetrahedron Lett,1991,32(48):7059-7062.
[4]Guo S,Duan JA,Tang YP,et al.Simultaneous qualitative and quantitative analysis of triterpenic acids,saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDA-MS/ELSD[J].Journal of Pharmaceutical and Biomedical Analysis, 2011,56(2):264-270.
[5]李喜悦,高哲,崔璨,等.枣叶黄酮类成分的分离鉴定及其抗氧化活性研究[J].食品工业科技,2015,36(10):135-138.
[6]徐变娜,王敏,曹静,等.不同时期梨枣叶茶抗氧化成分组成及活性差异的分析[J].食品科学,2013,34(13):34-38.
[7]Guo S,Duan JA,Qian DW,et al.Hydrophilic interaction ultra-high performance liquid chromatography coupled with triple quadrupole mass spectrometry for determination of nucleotides,nucleosides and nucleobases in Ziziphus plants[J].Journal of Chromatography A,2013,1301:147-155.
[8]Guo S,Duan JA,Qian DW,et al.Rapid determination of amino acids in fruits ofZiziphusjujubaby hydrophilic interaction ultra-high performance liquid chromatography coupled with triple quadrupole mass spectrometry[J].Jouranl of Agricultural and Food Chemistry,2013,61(16):2709-2719.
[9]Zhang LL,Bai YL,Su SL,et al.Simultaneous quantitation of nucleosides,nucleobases,amino acids,and alkaloids in mulberry leaf by ultra high performance liquid chromatography with triple quadrupole tandem mass spectrometry[J].Journal of Separation Science,2014,37:1265-1275.
[10]Sun YF,Liang ZS,Shan CJ,et al.Comprehensive evaluation of natural antioxidants and antioxidant potentials inZiziphusjujubaMill.var.spinosa(Bunge)Hu ex HF Chou fruits based on geographical origin by TOPSIS method[J].Food Chemistry,2011,124(4):1612-1619.
Effect of different drying methods on nucleoside,amino acids and flavonoids in the leaves ofZiziphusjujubavar.spinosa
ZHANG Ying,GUO Sheng*,ZHU Shao-qing,XU Lu,YAN Hui,QIAN Da-wei,DUAN Jin-ao*
(Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization,and National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine,Nanjing University of Chinese Medicine,Nanjing 210023,China)
To explore the effects of different drying methods on the quality ofZiziphusjujubavar.spinosa leaf(ZSL),the methods for determination of 20 nucleoside and 23 amino acids as well as rutin in ZSL were established by UPLC-TQ MS and HPLC method.Based on the results,the effects of different drying methods on the above constituents in the samples were evaluated.The results showed that the analysis method established in this study was simple,accurate and reliable.All samples were rich in nucleosides,free amino acids and rutin.The contents of phosphorylating products,such as cytidine 5′-monophosphate,adenosine 5′-monophosphate monophosphate and guanosine 5′-monophosphate were relative high in the nucleosides.For the free amino acids,high contents were found for proline,tyrosine andγ-aminobutyric acid in the samples.Also,the contents of these compounds determined in the samples after drying process were generally higher than those of fresh sample.Based on the contents of the compounds analyzed in the samples,TOPSIS analysis method was performed for evaluating the intrinsic quality of the samples dried by different methods.The results showed that the samples dried by the sun or hot air at 40 ℃ displayed better quality,while poor qualities were found for the fresh samples and the product dried at 70 ℃ with hot air.The above results provided the data for selecting the suitable drying process method of ZSL,and also could provide a reference for the drying process of leafy herbs.
Ziziphusjujubavar spinosa leaf;drying process;nucleosides;amino acids;flavonoids
2015-09-20
张颖(1995-),女,本科,研究方向:中药资源学,E-mail:nzyzyb@163.com。
郭盛(1977-),男,博士,研究方向:中药资源化学,E-mail:guosheng@njucm.edu.cn。
段金廒(1956-),男,教授,博导,研究方向:中药资源学及资源化学,E-mail:dja@njucm.edu.cn。
国家自然科学基金面上项目(81473538);教育部霍英东教育基金会高等院校青年教师基金项目(141040);国家中医药行业科研专项(201407005);江苏高校优势学科建设工程资助项目(ysxk-2014)。
TS207.3
A
1002-0306(2016)09-0296-08
10.13386/j.issn1002-0306.2016.09.049

