地塞米松治疗前后免疫性血小板减少症患者树突状细胞亚群及细胞因子变化的研究
谢研研,杨明珍
地塞米松治疗前后免疫性血小板减少症患者树突状细胞亚群及细胞因子变化的研究
谢研研,杨明珍
目的 探讨免疫性血小板减少症(ITP)患者外周血树突状细胞(DC)亚群的变化及CD80、CD86表达量的改变,进一步检测白细胞介素(IL)-2、IL-4、IL-10及干扰素-γ(IFN-γ)细胞因子含量的变化,并回顾性分析其与地塞米松治疗疗效间的关系。方法 留取肝素抗凝的60例ITP患者及10例正常对照者外周血标本,采用流式细胞术检测外周血DC亚群的分布情况,采用ELISA法检测相关细胞因子的含量。结果 ITP患者治疗前较正常对照组DC亚群DC2比例升高(P<0.05),治疗后与正常对照组比较差异无统计学意义;治疗前DC1、DC2上CD80的表达水平较正常对照组升高(P <0.05),DC2细胞上CD86的表达水平较正常对照组升高(P<0.05),地塞米松治疗后表达水平均下降;ITP患者治疗前较正常对照组IL-2、IFN-γ水平升高(P<0.05),地塞米松治疗后表达水平下降;IL-4、IL-10治疗前水平下降(P<0.05),地塞米松治疗后表达水平上升。结论 DC数量与功能的紊乱及IL-2、IL-4、IL-10、IFN-γ的水平变化均参与了ITP的发病,其与地塞米松的疗效可能有重要的联系。
免疫性血小板减少症;树突状细胞亚群;细胞因子;地塞米松
网络出版时间:2016-6-6 13:52:32 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.034.html
免疫性血小板减少症(immune thrombocytopenia,ITP)是由体液免疫和细胞免疫共同异常导致血小板破坏的一类自身免疫性疾病[1],其发病率(5 ~10)/105人口[2]。树突状细胞(dendritic cells,DC)是体内专职的最强的抗原提呈细胞(antigen presenting cell,APC),在活化的T、B淋巴细胞中起重要作用。根据DC的功能及其分子学标志,可以分为髓样树突细胞(DC1,分子学标志为HLA-DR+Lin-CD11c+)和浆细胞样树突细胞(DC2,分子学标志为HLA-DR+Lin-CD123+)。DC1促进辅助性T细胞(helper T cell,Th)中Th0向Th1分化,DC2促进Th0向Th2分化;Th1主要分泌白介素-2(interleukin-2,IL-2)、干扰素-γ(interferon-γ,IFN-γ)等相关细胞因子,参与细胞免疫迟发型超敏性炎症的发生[3],Th2主要分泌IL-4、IL-10等相关细胞因子,主要刺激B细胞增殖产生免疫球蛋白(IgG),与体液免疫有关[4]。该实验收集60例ITP患者外周血标本,采用流式细胞术检测DC1、DC2的分布情况及其表面CD80、CD86水平,采用ELISA法检测细胞因子的表达水平,与正常对照组比较;并回顾性分析其表达量的变化与地塞米松疗效间有无相关性。
1 材料与方法
1.1病例资料 选取2014年12月~2015年10月于安徽医科大学第一附属医院血液科住院的ITP患者60例,其中男18例,女42例;年龄18~63岁,中位年龄36岁;其中新诊断ITP 18例、持续性ITP 19例、慢性ITP 23例,均符合ITP的诊断标准[1]。后续对其中40例患者检测IL-2、IL-4、IL-10、IFN-γ细胞因子表达水平。正常对照组均为同期健康体检人群,其中男6例,女4例;年龄22~61岁,中位年龄36岁。
1.2疗效判定 予以大剂量地塞米松冲击治疗(40 mg/d,连续4 d静脉输注)。病情严重者予以地塞米松非胃肠道给药。患者地塞米松疗效评估参考文献[1],有效:地塞米松治疗4周后患者血小板(PLT)≥30×109/L,并且至少比基础血小板计数增加2倍,无出血症状;无效:标准治疗4周后PLT<30×109/L,或血小板计数增加少于基础值2倍,或有出血症状。
1.3实验器材和试剂 Lin混合抗体(CD2、CD3、CD14、CD16、CD19、CD56、CD235a)-FITC、HLA-DRPerCP-Cyanine5.5、CD11c-PE、CD123-PE、CD80-ECD、CD86-PC7、同型对照抗体鼠抗体IgG1和IgG2a(PE标记)购自美国BD公司;IL-2、IL-4、IL-10及INF-γ的ELISA试剂盒购自上海晶美生物公司;流式细胞仪购自美国COULTER公司;RT-2100c酶标自动分析仪购自贝克曼公司;红细胞裂解剂、磷酸盐缓冲液(PBS)、淋巴细胞分离液、1%甲醛购自合肥欣宜生物公司。
1.4标本采集 分别采集ITP患者及健康对照者的晨起空腹新鲜外周静脉血3 ml,置于肝素抗凝真空采血管,轻轻混匀,于2 h内送至实验室。留取患者和正常对照者血清,置于-80℃冰箱保存,待行细胞因子检测。
1.5实验步骤
1.5.1检测DC1、DC2及其表面共刺激分子CD80、CD86表达水平 参照文献[5]方法。①取400 μl肝素抗凝的ITP患者外周血分装4管,每管中加入FITC标记的Lin混合抗体和PerCP-Cyanine5.5标记的HLA-DR单抗各10 μl标记细胞,同时各管内分别加入PE标记CD11c、CD123、IgG1、IgG2a单抗各5 μl,其中3、4管作为阴性对照,震荡混匀,避光孵育20 min;加入红细胞裂解液1 ml,震荡混匀,避光15 min,1 500 r/min离心5 min,弃上清液;加入3 ml PBS洗涤液,震荡混匀,1 500 r/min离心5 min,弃上清液;再加入300 μl PBS悬浮细胞,另加入1%甲醛200 μl固定液,样本24 h内上流式细胞仪检测;②ITP患者外周血采用两倍体积PBS稀释,采用淋巴细胞分离液分离出外周血单个核细胞,调整细胞数量级为1×107/ml,各取100 μl悬浮液至于6只管中,每管中加入FITC标记的Lin混合抗体和Per-CP-Cyanine5.5标记的HLA-DR单抗各10μl标记细胞,同时管中加入PE-IgG1+CD80-ECD、PE-IgG1 +CD86-PC7、CD11c-PE+CD80-ECD、CD11c-PE+ CD86-PC7、CD123-PE+CD80-ECD、CD123+CD86-PC7单抗各5 μl,冰上孵育30 min,加入冷PBS洗涤1次,上流式细胞仪检测。
1.5.2检测细胞因子IL-2、IL-4、IL-10及IFN-γ表达水平 ITP患者冻存待检血清,冻解后,应用ELISA法定量测定,严格按照说明书步骤进行检测,以吸光度(absorbance,A)值为纵坐标(Y),相应的标准品浓度为横坐标(X),做的相应的曲线,计算A值,由标准曲线换算出相应的浓度。
1.6统计学处理 采用SPSS 19.0软件进行分析,数据予以正态性检验,以±s表示,统计资料多组间均值进行单因素方差分析,各组间数据比较采用t检验。
2 结果
2.1DC亚群的比例水平 ITP患者治疗前、治疗后DC2比较,差异有统计学意义(F=8.698,P<0.05)。ITP治疗前DC2表达比例与正常对照组、治疗后比较差异均有统计学意义(P<0.05)。见表1。
表1 外周血DC亚群比例的比较(%,±s)
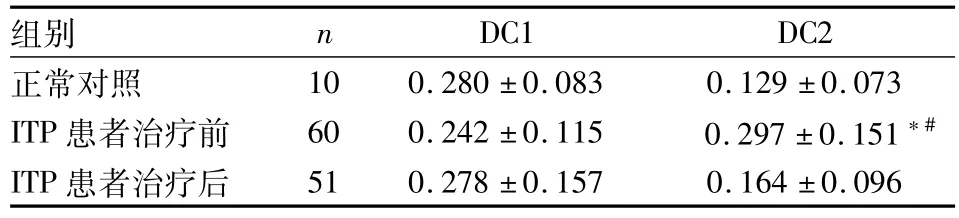
表1 外周血DC亚群比例的比较(%,±s)
与正常对照组比较:*P<0.05;与ITP患者治疗后比较:#P<0.05
组别 n DC1 DC2正常对照10 0.280±0.083 0.129±0.073 ITP患者治疗前 60 0.242±0.115 0.297±0.151*#ITP患者治疗后51 0.278±0.157 0.164±0.096
2.2DC1和DC2上CD80、CD86表达量的检测ITP患者DC1表面CD80的表达量组间比较,差异有统计学意义(F=12.624,P<0.05),DC2表面CD80、CD86的表达量组间比较,差异均有统计学意义(F=16.214、9.067,P<0.05)。治疗前DC2表面共刺激分子CD80、CD86和DC1表面CD80升高,与正常对照组比较差异均有统计学意义(P<0.05);治疗后表达量下降(P<0.05)。见表2。
2.3IL-2、IL-4、IL-10及INF-γ表达水平的检测ITP患者IL-2、IL-4、IL-10、IFN-γ治疗前后比较,差异有统计学意义(F=10.321、14.256、11.658、9.899,P<0.05)。与正常对照组比较,治疗前IL-2、IL-4升高,IL-10、IFN-γ下降(P<0.05)。与治疗前比较,治疗后IL-2、IL-4下降,IL-10、IFN-γ上升(P <0.05)。地塞米松治疗有效组IL-2、IL-4、IL-10、IFN-γ与治疗前比较差异有统计学意义(P<0.05)。地塞米松治疗无效组IL-2、IL-4、IL-10、IFN-γ与治疗前比较差异无统计学意义。见表3。
表2 两组外周血DC亚群DC1与DC2上CD80、CD86比例的比较(%,±s)
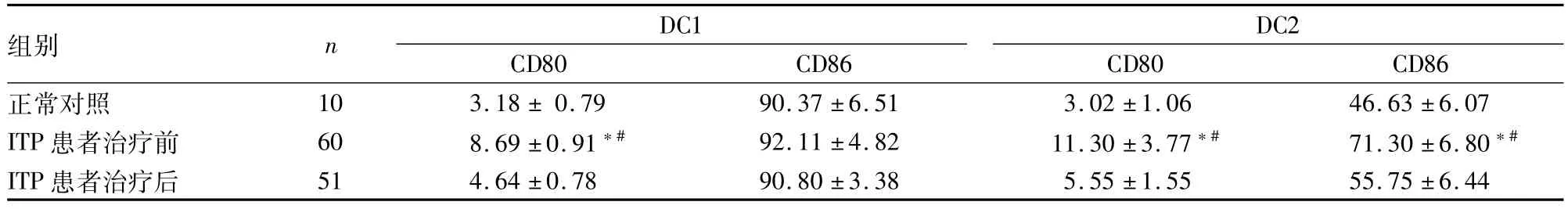
表2 两组外周血DC亚群DC1与DC2上CD80、CD86比例的比较(%,±s)
与正常对照组比较:*P<0.05;与 ITP患者治疗后比较:#P<0.05
组别 n DC1 CD80 CD86 DC2 CD80 CD86正常对照 10 3.18±0.79 90.37±6.51 3.02±1.06 46.63±6.07 ITP患者治疗前 60 8.69±0.91*# 92.11±4.82 11.30±3.77*# 71.30±6.80*#ITP患者治疗后 51 4.64±0.78 90.80±3.38 5.55±1.55 55.75±6.44
表3 IL-2、IL-4、IL-10、INF-γ表达水平比较(±s)
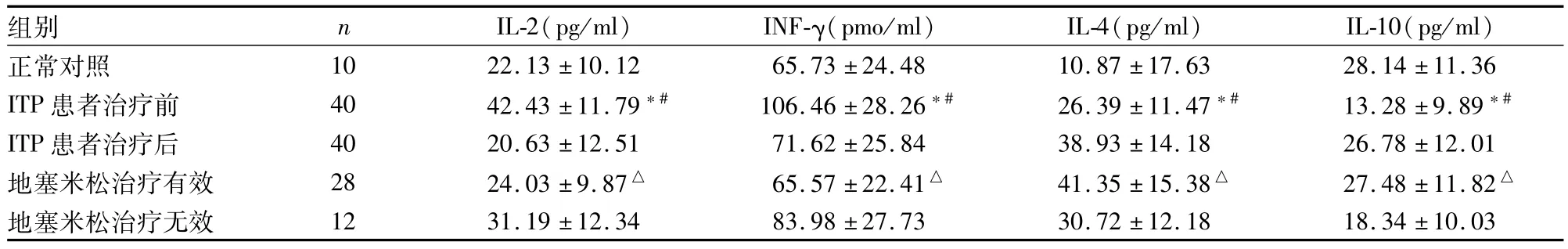
表3 IL-2、IL-4、IL-10、INF-γ表达水平比较(±s)
与正常对照组比较:*P<0.05;与 ITP患者治疗后比较:#P<0.05;与ITP患者治疗前比较:△P<0.05
组别 n IL-2(pg/ml) INF-γ(pmo/ml) IL-4(pg/ml) IL-10(pg/ml)正常对照 10 22.13±10.12 65.73±24.48 10.87±17.63 28.14±11.36 ITP患者治疗前 40 42.43±11.79*# 106.46±28.26*# 26.39±11.47*# 13.28±9.89*#ITP患者治疗后 40 20.63±12.51 71.62±25.84 38.93±14.18 26.78±12.01地塞米松治疗有效 28 24.03±9.87△ 65.57±22.41△ 41.35±15.38△ 27.48±11.82△地塞米松治疗无效 12 31.19±12.34 83.98±27.73 30.72±12.18 18.34±10.03
3 讨论
ITP是一种自身免疫性疾病,发病机制一直是研究的热点,急性ITP是由于患者体内产生了抗血小板的特异性抗体,形成抗原-抗体复合物,被单核-巨噬系统过度吞噬,从而引起疾病发病,但此并非ITP的唯一发病机制。研究[6]表明,ITP存在多种细胞因子异常。急性ITP多为体液免疫介导,而慢性ITP细胞免疫异常占主导作用,多种致病因素所引导的ITP患者体内体液及细胞免疫紊乱,其中活化的Th起重要的作用。
DC是体内专职的APC,可以诱发T细胞免疫,也可以通过对T细胞的杀伤或者对调节性T细胞(Treg)的诱导作用,介导发生免疫耐受的现象[7]。血小板特异性抗体的产生需要T淋巴细胞的参与[8],而 T淋巴细胞的活化、分化及增殖又与DC有着密切的关联,APC与T细胞活化存在两个主要的信号通路,第一信号为T细胞表面受体与APC表面的抗原肽-MHC复合物相结合;第二信号为T细胞与APC之间的协同刺激,途径为APC的表面B7家族成员CD80、CD86与T细胞表面CD28、CTLA-4相结合[9],DC、T淋巴细胞及B细胞产生抗体之间存在着复杂的关系,凌云等[5]发现成人ITP患者的外周血DC亚群数量和功能均存在异常,DC在ITP发病中占了重要的作用。
本实验显示ITP患者外周血DC亚群比例失衡,DC1在患者治疗前后与正常对照者比较差异无统计学意义,但DC2比例较正常对照者明显升高,大剂量地塞米松治疗后DC2比例下降,差异均有统计学意义。慢性ITP患者DC趋于成熟,CD80、CD86表达量升高,T淋巴细胞活化的第二信号加强,激活免疫应答[10]。本实验进一步研究显示,不同DC亚群CD80、CD86的表达量不同,DC2表面协同刺激分子CD80、CD86与DC1表面协同刺激分子CD80表达量升高,地塞米松治疗后下降,差异有统计学意义,但DC1表面CD86治疗前后与正常对照组比较差异无统计学意义。DC在机体免疫过程中,分泌大量的IL-12,促进 T淋巴细胞产生分化[10],在ITP患者中,Th1生成增多,Th2生产减少,Th1细胞主要分泌IL-2、TFN-γ等,可以介导细胞免疫应答,Th2主要分泌IL4、IL-10等,刺激B细胞分化成抗体产生细胞。本实验显示ITP患者治疗前IL-2、IFN-γ表达水平升高,治疗后表达水平下降,与正常对照者比较差异有统计学意义;而IL-4、IL-10表达水平下降,治疗后上升,差异有统计学意义。
大剂量地塞米松冲击疗法作为ITP患者治疗的一线方案,但并非100%的ITP患者有效,Zeng et al[11]发现当ITP患者的血小板特异性抗体为GPIba时,激素治疗效果差,提示患者为GPIba抗体介导的ITP时,可能存在着不同于GPIIb/IIIa介导的途径。同时大剂量地塞米松可以抑制DC的数量,减少DC分泌的IL-12,进而抑制了Th0向Th1分化,减轻了Th1介导的免疫应答,Th1/Th2维持平衡[12]。但是否所有的细胞免疫介导的ITP对地塞米松治疗都是有效的仍需进一步扩大样本量,比较地塞米松治疗有效组与无效组间的差异性。本实验显示在地塞米松治疗有效组和无效组间,DC1、DC2治疗前后的变化不一致,IL-2、IL-4、IL-10及IFN-γ变化也是不一致的,提示地塞米松的疗效与多种因素有关。
ITP患者的发病机制错综复杂,DC亚群失调,共刺激信号增强,细胞因子同时分泌紊乱,进一步研究其与地塞米松治疗疗效间的关系,可能为ITP的个体化治疗带来福音,避免地塞米松治疗无效给患者带来的副作用。
[1]张之南,郝玉书,赵永强,等.血液病学[M].2版.北京:人民卫生出版社,2012:1273-6.
[2]Frederiksen H,Schmidt K.The incidence of idiopathic thrombocytopenic purpura in adults increases with age[J].Blood,1999,94(3):909-13.
[3]Liu Y J.Dendritic cell subsets and lineages,and their functions in innate and adaptive immunity[J].Cell,2001,106(3):259-62.
[4]Palucka A K,Blanck J P,Bennett L,et al.Cross-regulation of TNF and IFN-alpha in autoimmune diseases[J].Proc Natl Acad Sci USA,2005,102(9):3372-7.
[5]凌 云,曹祥山,余自强,等.慢性特发性血小板减少性紫癜患者外周血树突细胞的变化及意义[J].中华血液学杂志,2008,29(3):187-91.
[6]Guo C,Chu X,Shi Y,et al.Correction of Th1-dominant cytokine profiles by high-dose dexamethasone in patients with chronic idiopathic thrombocytopenic purpura[J].J Clin Immunol,2007,27 (6):557-62.
[7]Ouabed A,Hubert F X,Chabannes D,et al.Differential control of T regulatory cell proliferation and suppressive activity by mature plasmacytoid versus conventional spleen dendritic cells[J].J Immunol,2008,180(9):5862-70.
[8]Kuwana M,Kawakami Y,Ikeda Y.Suppression of autoreactive T-cell response to glycoprotein IIb/IIIa by blockade of CD40/CD154 interaction:implications for treatment of immune thrombocytopenic purpura[J].Blood,2003,101(2):621-3.
[9]Curti A,Trabanelli S,Salvestrini V,et al.The role of indoleamine 2,3-dioxygenase in the induction of immune tolerance:focus on hematology[J].Blood,2009,113(11):2394-401.
[10]李 然,瞿 文,付 蓉,等.免疫性血小板减少症患者树突细胞亚群与淋巴转录因子Gata-3、T-bet的相关性[J].中华医学杂志,2013,93(22):1696-9.
[11]Zeng Q,Zhu L,Tao L,et al.Relative efficacy of steroid therapy in inmmune thrombocytopenia mediated by anti-platelet GPIIb/IIIa versus GPIbα antibodies[J].Am J Hematol,2012,87(2):206-8.
[12]Hsu N C,Chung C Y,Horng H C,et al.Cortico-steriod administration depresses circulating dendritic cells in ITP patients[J]. Platelets,2004,15(7):451-4.
Changes of dendritic cell subsets and cytokine before and after dexamethasone treatment in ITP patients
Xie Yanyan,Yang Mingzhen
(Dept of Hemopathology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the changes of dendritic cell subsets and CD80,CD86 expression in peripheral blood in patients with immune thrombocytopenia(ITP),and to evaluate the changes of serum interleukin-2(IL-2),serum interleukin-4(IL-4),serum interleukin-10(IL-10)and interferon-γ(IFN-γ)before and after dexamethasone treatment,overall,further analyzing the relationship between them and dexamethasone.Methods Collecting blood samples of 60 ITP patients and 10 normal controls with heparin anticoagulation,and distribution of dendritic cell subsets of ITP and normal controls was detected by flow cytometry,and the changes of serum IL-2,IL-4,IL-10 and IFN-γ were detected by enzyme linked immunosorbent assay(ELISA).Results The percentage of DC2 was increased in ITP patients compared with the control group(P<0.05)and there was no statistically significont difference after dexamethasone treatment;the expressions of CD80 on DC1 and DC2 were increased compared with the control group(P<0.05),as well as the expression of CD86 on DC2 and the percentage of them decreased after treatment.The serum IL-2,IFN-γ levels before the dexamethasone treatment were higher than the normal control group(P<0.05),then decreased after treatment.However,the serum IL-4,IL-10 levels were lower than the normal control group before the treatment(P<0.05),increased after treatment.Conclusion The disorder of the number and function of DCs and the changes of the serum IL-2,IL-4,IL-10 and IFN-γ levels may play important roles in the pathogenesis of ITP.Moreover,there is a probable key relationship between them and the effects of dexamethasone treatment.
immune thrombocytopenic;dendritic cell subsets;cytokines;dexamethasone
R 558.2
A
1000-1492(2016)07-0998-04
2016-03-23接收
安徽省自然科学基金(编号:1208085MH154)
安徽医科大学第一附属医院血液内科,合肥 230022
谢研研,女,硕士研究生;杨明珍,男,博士,主任医师,硕士生导师,责任作者,E-mail:yangmz89@163.com

