细菌纤维素/肝素复合物的制备与力学性能*
陈丹丹,陈袁曦,张雅琴,周晓东(华东理工大学化学工程联合国家重点实验室,上海 200237)
细菌纤维素/肝素复合物的制备与力学性能*
陈丹丹,陈袁曦,张雅琴,周晓东
(华东理工大学化学工程联合国家重点实验室,上海 200237)
采用浸泡和交联法将肝素(Hep)固定在细菌纤维素(BC)上,研究了BC/Hep复合物的结构与力学性能。傅立叶变换红外光谱结果表明,BC结构中出现了Hep的特征吸收峰;扫描电子显微镜和X射线衍射显示,浸泡或交联后,在Hep的作用下,BC的结构变得紧密,结晶度下降,晶粒尺寸增大,其中交联法制备的复合物的结构与结晶性能变化更为明显。拉伸性能实验表明,与纯BC相比,浸泡和交联制备的BC/Hep复合物力学性能增强,交联法制备的复合物力学性能优于浸泡法,Hep溶液浓度为1.5 g/100 mL时其拉伸强度最大,可达到177.82 MPa,与纯BC相比提高了76.3%。
细菌纤维素;肝素;复合物;微观结构;力学性能
细菌纤维素(BC)是由微生物发酵产生的天然高聚物,和植物纤维具有相同的化学结构[1]。BC具有许多独特的性质,如高强度、高结晶度、高持水性、超细纳米纤维网络等,已被广泛应用于许多领域。另外,良好的生物相容性和生物可降解性,使得BC在相关生物医学和生物技术方面的应用得到人们的广泛关注[2]。BC在生物医用材料中可作为人工皮肤、人工血管、组织工程支架[3-7]等,并且有着良好的应用前景。BC虽有很多的生物学特性,但将其具体应用于医用材料时,与血液直接接触,仍需要对其进行一些表面改性,以使其具有更好的血液相容性和组织相容性。
肝素(Hep)是一种酸性粘多糖,在临床上作为抗凝血药物广泛使用。肝素结构中含有大量的磺酸基与羧基[8],因而带有很强的负电荷,可增加血细胞表面和血管壁的负电荷,增强其相互间的排斥性,具有抗聚集作用[9],以减少血栓的发生。将生物材料进行Hep固定是提高其凝血性能最有效的方法[10]。
笔者采用浸泡和交联两种方法,制备BC/Hep复合物。BC和Hep复合,不仅保持纤维素材料的理化特性及纳米纤维网络结构,又能将Hep引入到材料结构中,使复合材料同时拥有了两者的优点,因此BC/Hep复合物对于BC生物医用材料的研究和应用具有重大意义。生物医用材料除了具有良好的生物相容性外,还需具备良好的力学性能,因此除了利用傅立叶变换红外光谱(FTIR)、扫描电子显微镜(SEM)以及X射线衍射(XRD)对两种方法制备的复合物进行微观结构分析外,还对复合物的力学性能进行研究。通过力学性能测试,分析BC/Hep复合物较优的制备方法。
1 实验部分
1.1主要原料
木醋杆菌:A.xylinum 1.1812,中科院微生物研究所;
酵母浸膏:生物纯,上海天莲化工科技有限公司;
葡萄糖、无水乙醇、氢氧化钠:分析纯,上海凌峰化学试剂有限公司;
2-吗琳乙烷磺酸(MES,纯度≥99%),N-羟基丁二酰亚胺(NHS,纯度>98%)和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC,分析纯):合肥博美生物科技有限公司;
Hep:北京亿泰科华生物技术有限公司。
1.2主要仪器与设备
FTIR仪:Thermo Nicolet 5700型,美国Nicolet公司;
SEM:S-4800型,日本Hitachi公司;
XRD仪:D/max 2550V型,日本理学公司;
动态机械热分析仪:DMAQ800型,美国TA公司。
1.3BC膜的制备
将酵母浸膏、葡萄糖、无水乙醇加入去离子水中,三者的浓度分别为1.5 g/100 mL,7 g/ 100 mL,1 mL/100 mL,利用1 mol/L氢氧化钠溶液调节pH值为6.8,高温灭菌,然后接种木醋杆菌,之后于30℃恒温培养10 d后取出BC膜,经0.1 mol/L氢氧化钠溶液提纯处理后,用去离子水冲洗至其表面呈中性。将BC膜置入去离子水中,于冰箱4℃下保存备用。
1.4BC/Hep复合物的制备
(1)浸泡法制备BC/Hep复合物。
在100 mL去离子水中分别加入0.1 g,0.5 g,1.0 g和1.5 g Hep,溶解后得到Hep溶液,将BC湿膜放入不同浓度的Hep溶液中,室温下搅拌1 h,去离子水冲洗24 h,烘干。以Hep溶液的浓度表示Hep的用量,分别为0.1 g/100 mL,0.5 g/ 100 mL,1.0 g/100 mL,1.5 g/100 mL。
(2)交联法制备BC/Hep复合物。
在MES缓冲液中加入交联剂EDC和NHS,再加入Hep溶液(Hep溶液浓度同上)和BC湿膜,室温下搅拌1 h。Na2HPO4溶液清洗2次终止反应,1 mol/L的NaCl溶液和去离子水分别冲洗24 h,烘干。
1.5测试与表征
(1) FTIR测试。
采用KBr压片制样,对复合干膜进行FTIR分析。
(2) SEM观察。
将BC和BC/Hep复合物冷冻干燥24 h,真空喷金,在SEM下观察断面形貌并拍照。
(3) XRD测试。
Cu靶,管流100 mA,40 kV高压,扫描范围为2θ=3º~50º,由式(1)计算结晶度。

式中:I200——2θ=22º的最大衍射强度;
Iam——2θ=18º的最大衍射强度。
晶粒尺寸可通过Scherrer公式(式2)计算得出。
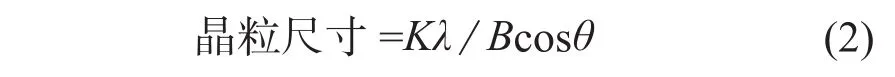
式中:K——Scherrer常数,取值0.89;
λ——X射线的波长;
B——实测样品衍射峰的半高宽度;
θ——衍射角。
在计算过程中,B和θ需转化为弧度制。
(4)力学性能测试。
拉伸试样为80℃下烘干的干膜,所有试样均在30℃,60%相对湿度的条件下放置24 h,消除环境因素的影响。试样的长度为30 mm,宽度为3 mm,用测厚仪测出每个试样的厚度,按照式(3)计算拉伸强度。测量时的夹持长度为15 mm,负荷提升的速度为1 N/min,每组实验至少测量10个试样,求其平均值以及标准偏差。
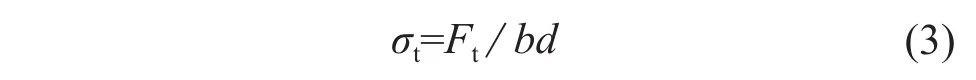
式中:σt——拉伸强度;
Ft——拉伸最大载荷;
b——试样原始宽度;
d——试样原始厚度。
2 结果与讨论
2.1FTIR分析
图1为纯BC和不同方法制备的BC/Hep复合物的FTIR谱图。由图1可知,3 430 cm-1处出现—OH的伸缩振动,2 900 cm-1处为—CH2—的伸缩振动吸收峰,1 160~1 060 cm-1和898 cm-1是糖苷键C—O—C的特征吸收峰,与BC的结构基本吻合,证明浸泡交联不改变复合物的基本骨架。BC/Hep复合物在1 230 cm-1处出现了Hep的特征吸收峰[11],为S=O的不对称伸缩振动峰。同时,3 430 cm-1处—OH的特征吸收峰高明显增加,而Hep中含有大量的—OH,说明Hep成功复合在纯BC上。
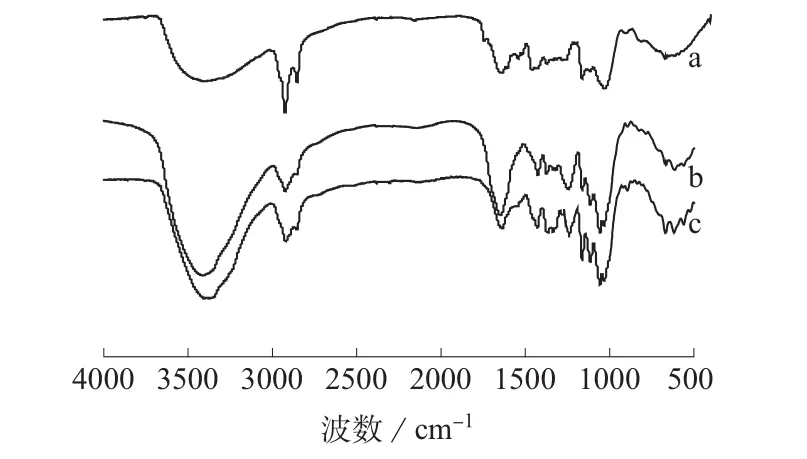
图1 纯BC和不同方法制备的BC/Hep复合物的FTIR谱图
2.2SEM分析
图2为纯BC和不同方法制备的BC/Hep复合物的SEM照片。从图2a中可观察到纯BC中的纳米纤维和层状结构,网络结构由纤维交错而成,单根纤维表面光滑无附着物,纤维间的空隙较大。图2b显示,BC/Hep复合物微纤间团聚大量Hep,纤维结构紧密,层状结构消失。交联后,过量Hep填充到BC网络结构的网孔中,填补缺陷,形成更致密的结构。

图2 纯BC和不同方法制备的BC/Hep复合物的SEM照片
2.3结晶性能分析
图3为纯BC和不同方法制备的BC/Hep复合物的XRD图。由图3可以看出,复合物和纯BC谱图基本一致,依然呈现典型的纤维素I型的晶体特征。计算3种材料的结晶指数和晶粒尺寸,结果见表1。
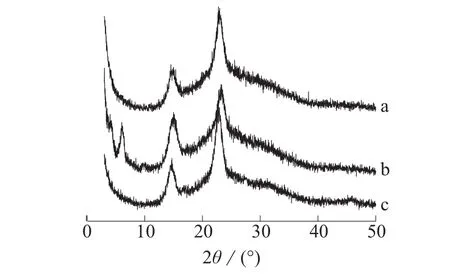
图3 纯BC和不同方法制备的BC/Hep复合物的XRD图

表1 不同材料的面间距、晶粒大小以及结晶度
和纯BC相比,BC/Hep复合物(110)面的布拉格角较小,面间距较大,β晶型含量低[12],结晶尺寸增大,结晶指数明显降低,表明Hep干扰了BC膜在干燥过程中的结晶。一方面,Hep包覆于BC微纤表面,阻碍了BC分子的相互接近,影响干燥过程中的结晶;另一方面,Hep的极性含氧基团可与BC上的羟基形成氢键,降低纤维素分子内和分子间的氢键作用,从而降低复合物的结晶度。交联后,纤维素微纤表面包覆的Hep量增多,干扰作用增强,交联复合物的结晶尺寸增大,结晶度进一步降低。
2.4力学性能分析
图4为不同方法制备的BC/Hep复合膜的拉伸强度。
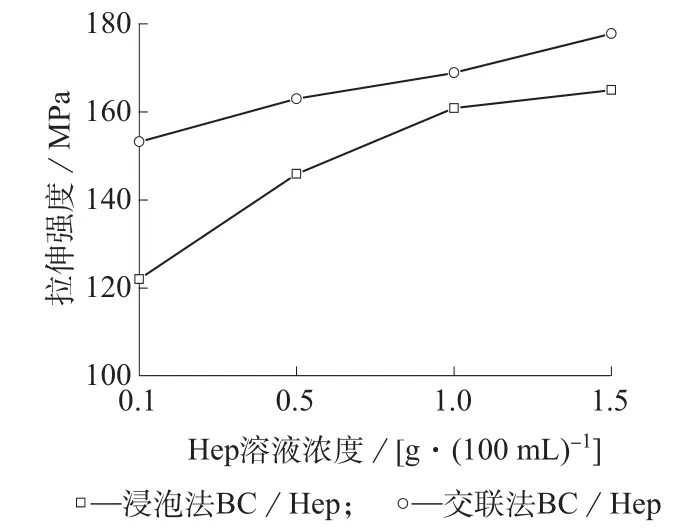
图4 不同方法制备的BC/Hep复合物的拉伸强度
纯BC膜的拉伸强度为100.87 MPa,由图4可知,浸泡与交联制备的复合物力学性能均优于纯BC,且拉伸强度随着溶液Hep浓度的增加而增大。浸泡和交联制备的BC/Hep复合物拉伸强度最高可达到165.02 MPa和177.82 MPa,与纯BC膜相比,分别增加了63.6%和76.3%。Hep进入BC网络结构中,纤维素结构更加紧密,力学性能提高。交联剂的加入使Hep与BC间的作用力由氢键转变为更加牢固的化学键,复合物结构更加紧密,力学性能进一步提高,SEM照片亦证实了这一点。
3 结论
(1)采用浸泡法和EDC/NHS化学交联法可制备BC/Hep复合物。FTIR结果表明,复合物中出现了Hep的特征吸收峰。SEM和XRD结果显示,加入Hep后BC的微观结构发生变化,结构更加紧密,结晶度下降,晶粒尺寸增大,其中交联法制备的复合物的结构和结晶性能变化更为明显。
(2)浸泡和交联法制备的复合物拉伸强度均有较大提高。交联法制备的BC/Hep复合物力学性能优于浸泡法,相比于纯BC,拉伸强度最大提高了76.3%。
[1] Shi Z,Zang S,Jiang F,et al. In situ nano-assembly of bacterial cellulose polyaniline-composites[J]. Rsc Advances,2012,2(3):1 040-1 046.
[2] Shah N,Ul-Islam M,Khattak W A,et al. Overview of bacterial cellulose composites:A multipurpose advanced material[J]. Carbohydrate Polymers,2013,98(2):1 585-1 598.
[3] Petersen N,Gatenholm P. Bacterial cellulose-based materials and medical devices:Current state and perspectives[J]. Applied Microbiology and Biotechnology,2011,91(5):1 277-1 286.
[4] Yadav V,Sun L,Panilaitis B,et al. In vitro chondrogenesis with lysozyme susceptible bacterial cellulose as a scaffold[J]. Journal of Tissue Engineering and Regenerative Medicine,2015,9(12):E276-E288.
[5] Malm C J,Risberg B,Bodin A,et al. Small calibre biosynthetic bacterial cellulose blood vessels:13-months patency in a sheep model[J]. Scandinavian Cardiovascular Journal,2012,46(1):57-62.
[6] Shi Q,Li Y,Sun J,et al. The osteogenesis of bacterial cellulose scaffold loaded with bone morphogenetic protein-2[J]. Biomaterials,2012,33(28):6 644-6 649.
[7] Liu X,Ma Y,Zhou Y,et al. A promising hybrid scaffold material:Bacterial cellulose in-situ assembling biomimetic lamellar CaCO3[J]. Materials Letters,2013,102:91-93.
[8] 王小梅.肝素化壳聚糖,大豆蛋白质复合材料的制备及其抗凝血功能研究[D].武汉:武汉大学,2011. Wang Xiaomei. Preparation and evaluation of heparinized chitosan/soy protein composites as anticoagulant materials[D]. Wuhan:Wuhan University,2011.
[9] 王鸿利.肝素临床应用[M].郑州:河南医科大学出版社,1999. Wang Hongli. Clinical application of heparin[M]. Zhengzhou:Henan Medical University Press,1999.
[10] Fernández-Muiños T,Recha-Sancho L,López-Chicón P,et al. Bimolecular based heparin and self-assembling hydrogel for tissue engineering applications[J]. Acta biomaterialia,2015,16:35-48.
[11] 李园园.细菌纤维素血管支架的制备及改性[D].天津:天津大学,2009. Li Yuanyuan. Preparation and modification of bacterial cellulose vascular stents[D]. Tianjing:Tianjing University,2009.
[12] 周伶俐,孙东平,吴清杭,等.不同培养方式对细菌纤维素产量和结构性质的影响[J].微生物学报,2007,47(5):914-917. Zhou Lingli,Sun Dongping,Wu Qinghang,et al. Influence on yield and structure properties of bacterial cellulose produced by different methods[J]. Journal of Microbiology,2007,47(5):914-917.
Preparation and Mechanical Properties of Bacterial Cellulose/Heparin Composites
Chen Dandan, Chen Yuanxi, Zhang Yaqin, Zhou Xiaodong
(State Key Laboratory of Chemical Engineering, East China Universtiy of Science and Technology, Shanghai 200237, China)
Heparin was immobilized within bacterial cellulose by immersing and crosslinking to produce bacterial cellulose/ heparin composites. The structure and mechanical properties of the composites were also studied. FTIR results show that the characteristic peaks of heparin present in the structure of bacterial cellulose,SEM and XRD reveal that after immersing or crosslinking,under the effect of heparin,the microstructure of bacterial cellulose becomes more dense and has lower crystallinity and bigger crystalline sizes,the structure and crystallinity of the composite prepared by crosslinking method have more obvious changes. Tensile property test shows that immersing and crosslinking all can improve the mechanical properties of bacterial cellulose/heparin composites,and the improving effect of crosslinking method is better than that of immersing method. When the concentration of heparin solution is 1.5 g/100 mL,the tensile strength of crosslinked composite comes up to the maximum value 177.82 MPa,increases by 76.3% than that of the pure bacterial cellulose.
bacterial cellulose;heparin;composite;microstructure;mechanical property
TQ321.2
A
1001-3539(2016)08-0018-04
10.3969/j.issn.1001-3539.2016.08.004
*中央高校基本科研业务费专项基金项目
联系人:周晓东,教授,主要从事聚合物基复合材料制备及成型技术、聚合物材料的界面和嵌段共聚物的组装行为及相关功能材料的研究
2016-05-10

