响应面法优化防腐剂在腌制大头菜中抑制腐败微生物的效果
王征征,陈泽平,刘艳全,李明元,李玉锋
(西华大学食品与生物工程学院,四川成都 610039)
响应面法优化防腐剂在腌制大头菜中抑制腐败微生物的效果
王征征,陈泽平,刘艳全,李明元,李玉锋*
(西华大学食品与生物工程学院,四川成都 610039)
微生物的繁殖是导致袋装腌制蔬菜腐败变质的根本原因,为了延长食品的保存期和货架期,对防腐剂进行筛选和优化,研究了防腐剂对腌制大头菜中腐败微生物的抑制效果。以腌制大头菜中筛选得到的芽孢杆菌(Bacillussp.)、枯草芽孢杆菌(Bacillusstubtilitus)、巨大芽孢杆菌(Bacillusmegaterium)、产硫芽孢杆菌(Bacillusboroniphilus)、球形赖氨酸芽孢杆菌(Lysinibacillussphaericus)、近邹褶念珠菌(Candidapararugos)、酵母类念珠菌(Candidazemplinina)为研究对象,考察了苯甲酸钠、脱氢乙酸钠、山梨酸钾、亚硫酸钠、乙二胺四乙酸(EDTA)对以上腐败菌的抑制作用。在此基础上,探讨了防腐剂复配对大头菜中腐败菌的抑制效果。结果表明,苯甲酸钠、脱氢乙酸钠、EDTA对腌制大头菜中腐败菌有明显的抑制作用。响应面优化得到复合防腐剂最佳配方为苯甲酸钠0.5 g/L,脱氢乙酸钠0.2 g/L,EDTA0.2 g/L。在该复配条件下对于实验中抗性较强的菌株Bacillussp.、Lysinibacillussphaericus有良好的抑制效果,抑制率都在99%以上。
腌制大头菜,防腐剂,腐败微生物,抑制效果,响应面优化
我国腌制菜距今有3000多年历史,起源于周朝[1]。在我国居民餐桌上,腌制蔬菜是常见的佐餐食品,市场销售的主要形式是袋装产品[2]。腌制蔬菜中腐败微生物的快速增长使产品质量下降、变劣、腐败。目前蔬菜腌制品向着低盐、增酸、适甜方向发展,但是正是由于用盐量的下降,腌制对腐败微生物的抑制作用降低,而带来保质期限缩短的问题[3]。酱腌菜在加工过程中发生的各种变化以及成品的败坏,主要是微生物的生长繁殖的结果,这些微生物主要是霉菌、酵母菌和其它细菌[4]。
防腐剂主要作用是抑制微生物的生长繁殖,延长食品的保存时间,抑制物质的腐败[5]。谈到防腐剂,人们往往认为它是有害的,但研究表明防腐剂在安全使用范围内,对人体是无毒副作用的[6]。随着食品工业的快速发展,传统食品防腐方法已不能满足其防腐需求[7],人们对食品的防腐提出了更高的要求:要求操作更简便、保质期更长、达到防腐效果的成本更低[8]。于是,渐渐将化学产品作为防腐剂,用于食品防腐中[9]。防腐剂之所以在食品行业中得到广泛应用,是因为它能有效抑制食品中微生物的生长繁殖所引起的腐败变质现象,从而延长食品的保存期和货架期[10]。可以这样说,当今的食品工业是站在食品防腐剂的肩膀上发展起来的,食品防腐剂为当今的食品工业发展作出了巨大贡献[11]。为了保持低盐腌制大头菜的固有品质,又能达到一定的保存期限,针对工厂化生产中经高温水浴杀菌后的袋装低盐腌制大头菜添加一定的防腐剂,实属必要[12]。
本实验参照食品防腐剂在腌制蔬菜中的添加法规和标准,通过对各种防腐剂成分和质量浓度的复合研究,利用响应面进一步优化,得到安全高效的复合防腐剂,应用于腌制大头菜中,以延长腌制大头菜的保质期和货架期。
1 材料与方法
1.1材料与仪器
腌制大头菜宜宾戎陈坊食品有限公司;实验菌种从胀袋的腌制大头菜中筛选的7株腐败微生物,其中5株细菌X1(Bacillussp.)、X2(Bacillusstubtilitus)、X3(Bacillusmegaterium)、X4(Bacillusboroniphilus)、X5(Lysinibacillussphaericus),2株酵母菌Y1(Candidapararugos)、Y2(Candidazemplinina);培养基营养琼脂培养基(液体)、YPD培养基(液体);苯甲酸钠、亚硫酸钠、乙二胺四乙酸(EDTA)天津博迪化工股份有限公司;山梨酸钾上海源叶生物科技有限公司;脱氢乙酸钠Ding Chemistry(Shanghai)Co.,Ltd。
DR5000型紫外可见分光光度计哈希HACH仪器有限公司;HH-S6型数显恒温水浴锅郑州科创仪器公司;ZWY-1102C恒温培养振荡器上海智诚分析仪器制造有限公司;YXQ-LS-50A立式高压蒸汽灭菌器上海博讯仪器有限公司;隔水式电热恒温生长箱-BG-270杭州汇尔仪器有限公司;IS09001电子天平北京赛多利斯仪器系统有限公司;FE20-Five EasyTMpH计梅特勒-托利多仪器科技有限公司;SW-CJ-2F双人双面净化工作台苏州净化设备有限公司;BCD-192TGN海尔冰箱海尔集团有限公司。
1.2实验方法
1.2.1制备菌悬液制备细菌菌悬液[13]:从营养琼脂平板上挑取少量菌接入牛肉膏蛋白胨普通营养琼脂液体培养基中,置于37 ℃空气恒温摇床中振荡培养12~14 h,保存于冰箱中备用。
制备酵母菌菌悬液[14]:从平板上挑取少量菌接入YPD液体培养基中,置于30 ℃空气恒温摇床中振荡培养16~18 h,保存于冰箱中备用。
1.2.2评价抑菌效果的方法
1.2.2.1绘制标准曲线按照下述制备菌株标准曲线的方法,测定大头菜中7株腐败菌Bacillussp.、B.stubtilitus、B.megaterium、B.boroniphilus、L.sphaericus、C.pararugos、C.zemplinina的标准曲线。
取9 mL液体培养基,接种1 mL各菌株的菌悬液,对比其标准曲线,使其初始菌量与测得的最大菌落总数一致,然后置于恒温振荡培养箱中,37 ℃下培养12 h(酵母菌于30 ℃下培养14 h),将没有接种的培养基作为空白对照组,相同条件下培养后于分光光度计中600 nm下测得其OD值。
在无菌操作台中,将培养了12 h的菌悬液用空白培养基稀释,使其浓度分别变为稀释前浓度的5%、10%、20%、40%、60%、80%不等梯度。以相同培养条件下但没有接种的培养液作为对照,测定稀释后的不同浓度的菌悬液在600 nm下的吸光度值[15]。同时将各稀释度的菌悬液,接种于营养琼脂固体培养基中,在37 ℃恒温培养箱中培养12 h后,取出计数。以菌悬液在600 nm下的吸光度值为纵坐标,菌悬液的不同稀释浓度为横坐标,绘制成标准曲线。
1.2.2.2计算抑菌率的方法将实验的各个菌株对比其标准曲线进行稀释,使接种到培养基中的菌株初始菌量为500 CFU/mL。再添加不同浓度的防腐剂到此培养基中,放在恒温振荡培养箱中,设置37 ℃培养12 h(两株酵母菌C.pararugos、C.zemplinina置于恒温培养箱中30 ℃下培养14 h),然后于600 nm下测定其OD值。将接种菌株但不加防腐剂的培养基作为空白对照组,相同条件下培养,然后在600 nm下测定其OD值。每个处理重复三次,最后结果取其平均值。
抑菌率(%)=对照组的吸光度-添加防腐剂组的吸光度/对照组的吸光度×100
1.2.3单一防腐剂对大头菜中腐败菌抑制效果研究根据GB2760-2011《食品添加剂使用安全卫生标准》和文献的记录结果[16],选择苯甲酸钠、脱氢乙酸钠、EDTA、山梨酸钾、亚硫酸钠作为防腐剂,对选取的实验菌株进行抑菌实验。苯甲酸钠实验浓度分别取:0、0.15、0.03、0.45 g/L、0.06、0.09、0.12 g/L;脱氢乙酸钠实验浓度分别取:0、0.05、0.1、0.15、0.2、0.3、0.4 g/L;EDTA实验浓度分别取:0、0.05、0.1、0.2、0.25 g/L;山梨酸钾实验浓度分别取:0、0.1、0.2、0.3、0.4、0.5、0.6、0.7g/L;亚硫酸钠实验浓度分别取:0、0.05、0.1、0.2、0.25 g/L,用实验中得出的抑菌率来表示防腐剂的抑制效果。
1.2.4响应面实验设计复合防腐剂对大头菜中腐败菌抑制作用研究用Design-Expert.V 8.0.5b软件中Box-Behnken法则进行响应面实验设计[17-19]。
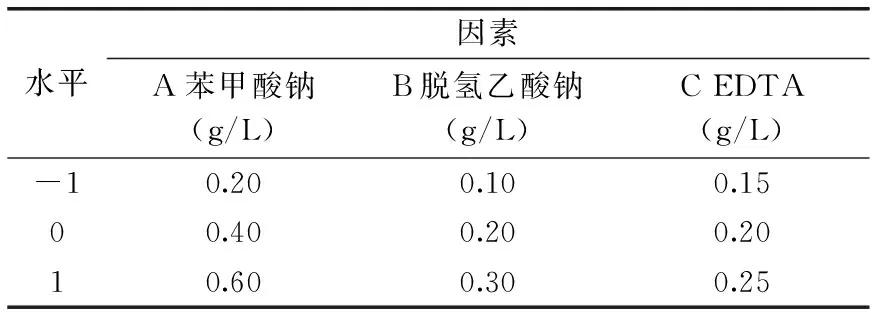
表1 复合防腐剂响应面实验因素和水平Table 1 Response surface test factors and levels of composite preservatives
根据单因素实验结果,选择苯甲酸钠、脱氢乙酸钠、EDTA三个因素为实验因子,实验菌的抑菌率为响应值,采取响应面设计,优化出最佳的对实验菌的抑菌效果。复合防腐剂响应面实验因素和水平取值见表1。菌种培养基以普通营养琼脂液体培养基为标准,装液在试管中,装液量为10 mL。置于37 ℃恒温空气摇床中恒温培养12 h后,再于600 nm分光光度计下测定其吸光度[20],通过其菌种数量并计算7株腐败菌Bacillussp.、B.stubtilitus、B.megaterium、B.boroniphilus、L.sphaericus、C.pararugos、C.zemplinina的抑制率。
1.2.5验证实验将实验所得出的复合防腐剂配备方案,按照具体的防腐剂添加量,添加到袋装腌制大头菜中,以不添加防腐剂的袋装腌制大头菜作为空白对照组,常温下放置30 d,对其进行感官评价[21]。
2 结果与讨论
2.1腐败菌吸光度-菌落数标准曲线
对刚生产的未添加任何防腐剂的真空包装低盐腌制大头菜菌落总数进行测定。10-1稀释度的计数结果如表2所示。

表2 真空包装低盐腌制大头菜初始菌落总数测定结果Table 2 The determination results of vacuum packaging of low salt pickled turnip initial colony total
取7株腐败菌菌悬液接种量1 mL,测定其菌落总数。Bacillussp.未稀释菌悬液在10-3梯度上菌落数为67 CFU/mL;B.stubtilitus未稀释菌悬液在10-4梯度上菌落数为228 CFU/mL;B.megaterium未稀释菌悬液在10-4梯度上菌落数为30 CFU/mL;B.boroniphilus未稀释菌悬液在10-3梯度上菌落数为81 CFU/mL;L.sphaericus未稀释菌悬液在10-6梯度上菌落数为114 CFU/mL;C.pararugos未稀释菌悬液在10-8梯度上菌落数为240 CFU/mL;C.zemplinina未稀释菌悬液在10-8梯度上菌落数为180 CFU/mL。
由实验结果得出7株腐败菌的标准曲线。以7株腐败菌在600 nm下的吸光度为纵坐标,菌悬液的稀释浓度为横坐标绘制标准曲线,见表3。
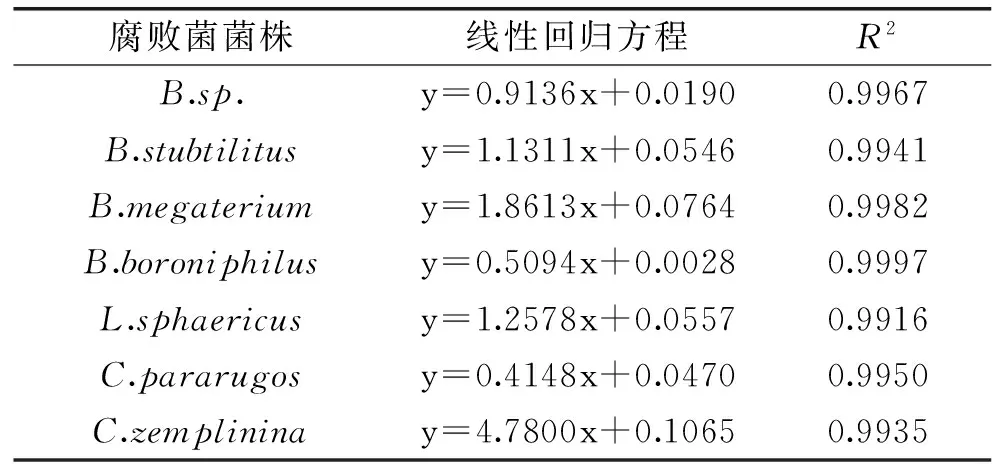
表3 7株腐败菌标准曲线的线性回归方程Table 3 The linear regression equation of the standard curve of seven strains of spoilage bacteria
2.2单一防腐剂对腐败菌抑制实验
2.2.1苯甲酸钠浓度对实验腐败菌抑制效果的影响苯甲酸钠对所示的7种腐败菌均有较好的抑制效果。如图1所示,苯甲酸钠浓度为0.3 g/L时,其对B.sp.、B.stubtilitus、B.megaterium、B.boroniphilus的抑制率均在40%以上。当苯甲酸钠的浓度达到0.3 g/L时,B.sp.、B.stubtilitus、B.megaterium、B.boroniphilus、C.zemplinina的抑制率分别为98.86%、96.12%、91.98%、61.93%、45.03%。但是苯甲酸钠对L.sphaericus、C.pararugos的抑制效果相对较弱。苯甲酸钠浓度为0.3 g/L时,L.sphaericus、C.pararugos的抑制率分别为18.70%、16.02%。当苯甲酸钠浓度达到最大1.2 g/L时,其对L.sphaericus、C.pararugos两种腐败菌的抑制率能达到59.26%、58.46%。由此可知,苯甲酸钠对本实验的多数菌株均有很好的抑制效果,所以本实验可考虑选择苯甲酸钠作为复合防腐剂的成分。综合考虑以上因素最终确定苯甲酸钠添加量为0.35~0.45 g/L。

图1 不同浓度苯甲酸钠对腐败菌的抑制效果Fig.1 Inhibition effect of sodium benzoate on spoilage bacteria
2.2.2脱氢乙酸钠浓度对实验腐败菌抑制效果的影响脱氢乙酸钠对所示7种腐败菌均有较好的抑制效果。如图2所示,随着脱氢乙酸钠浓度的增加,其对腐败菌的抑制效果也越来越明显。其中当脱氢乙酸钠浓度为0.15 g/L时,C.pararugos、B.boroniphilus、C.zemplinina、B.megaterium、B.stubtilitus的抑制率都达到80%以上,抑制率分别为:90.63%、88.64%、87.37%、87%、83.09%。当脱氢乙酸钠浓度再增加到0.2 g/L时,除L.sphaericus外,其余6株菌的抑制率都达到了90%以上,对抗性相对较强的B.sp.的抑制率也能达到99.90%,此时只有L.sphaericus相对抑制率较低。可见,脱氢乙酸钠对L.sphaericus的抑制效果相对较低,但当脱氢乙酸钠浓度增加到0.4 g/L时,L.sphaericus的抑制率也能达到99.05%。所以,脱氢乙酸钠对L.sphaericus的抑制效果相对较差,而对其他菌株有较好的抑制效果。这可能是由于脱氢乙酸钠作用于腐败菌的细胞膜上,让细菌胞内蛋白质变性,从而实现抑制或直接杀死腐败菌,所以增大它的用量,抑制效果越来越强。因此,综合考虑最终确定脱氢乙酸钠的添加量为0.15~0.25 g/L。

图2 不同浓度脱氢乙酸钠对腐败菌的抑制效果Fig.2 The inhibitory effect of different concentration of sodium dehydroacetate on spoilage bacteria
2.2.3EDTA浓度对实验腐败菌抑制效果的影响EDTA对实验腐败菌的抑制效果如图3所示。当EDTA浓度达到0.1 g/L时,对B.sp.的抑制率达到了66.08%,所以EDTA对B.sp.有较好的抑制效果。随着防腐剂浓度的增加,对B.sp.抑制效果也逐渐增强,当EDTA达到最大浓度0.25 g/L时,其抑制率达到85.37%。对于其他几株菌来说,随着EDTA浓度的增加,对其的抑制率也有明显提高的效果。当EDTA的浓度达到最大浓度0.25 g/L时,其对菌株L.sphaericus的抑制率也能达到51.68%。所以,EDTA可被选作为复合防腐剂的成分,综合考虑最终确定EDTA的添加量为0.15~0.25 g/L。
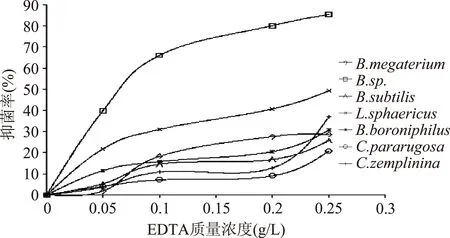
图3 不同浓度EDTA对腐败菌的抑制效果Fig.3 Inhibitory effect of different concentrations of EDTA on spoilage bacteria
2.2.4山梨酸钾浓度对实验腐败菌抑制效果的影响山梨酸钾对所示7种腐败菌的抑制效果差别较大。由图4可知,随着山梨酸钾浓度的逐渐增大,对各腐败菌的抑制效果也逐渐增强。其中对B.boroniphilus、C.zemplinina的抑制效果最佳,当山梨酸钾的浓度达到0.4 g/L及以上时,基本可以完全抑制这两种菌株,但是对于B.sp.、L.sphaericus的抑制效果还是较差。当所示山梨酸钾浓度达到最大0.7 g/L时,对B.sp.、L.sphaericus的抑制率分别才46.60%、29.39%。因此可以得出,山梨酸钾对这几株腐败菌的抑制作用不强,必须要在其最大实验浓度下才能基本抑制本实验中的腐败菌,且对于腐败菌B.Sp、L.Sphaericus的抑制效果尤为不佳,所以此响应面优化实验将不考虑把山梨酸钾作为复配成分。
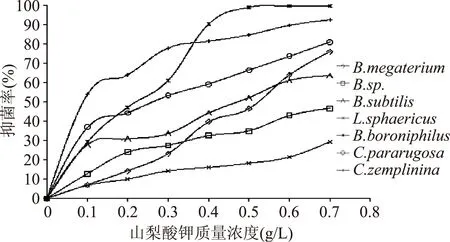
图4 不同浓度山梨酸钾对腐败菌的抑制效果Fig.4 Inhibitory effect of different concentrations of potassium on the inhibition of spoilage bacteria
2.2.5亚硫酸钠浓度对实验腐败菌抑制效果的影响由图5可知,亚硫酸钠对本实验的几株防腐剂的抑制效果均不明显。当亚硫酸钠达到最大浓度0.2 g/L时,对B.sp.最好的抑制率也才28.8%,不超过30%,几乎可认为亚硫酸钠对其没有起到抑制作用,达不到预期的抑制效果。同样,亚硫酸钠对其他菌株的也不能达到较好的抑制效果,抑制率都超不过30%。即使当亚硫酸钠达到最大浓度0.2 g/L时,C.zemplinina的抑制率才6.73%。由此可得出,本实验可完全不用考虑亚硫酸钠作为复合防腐剂的成分。
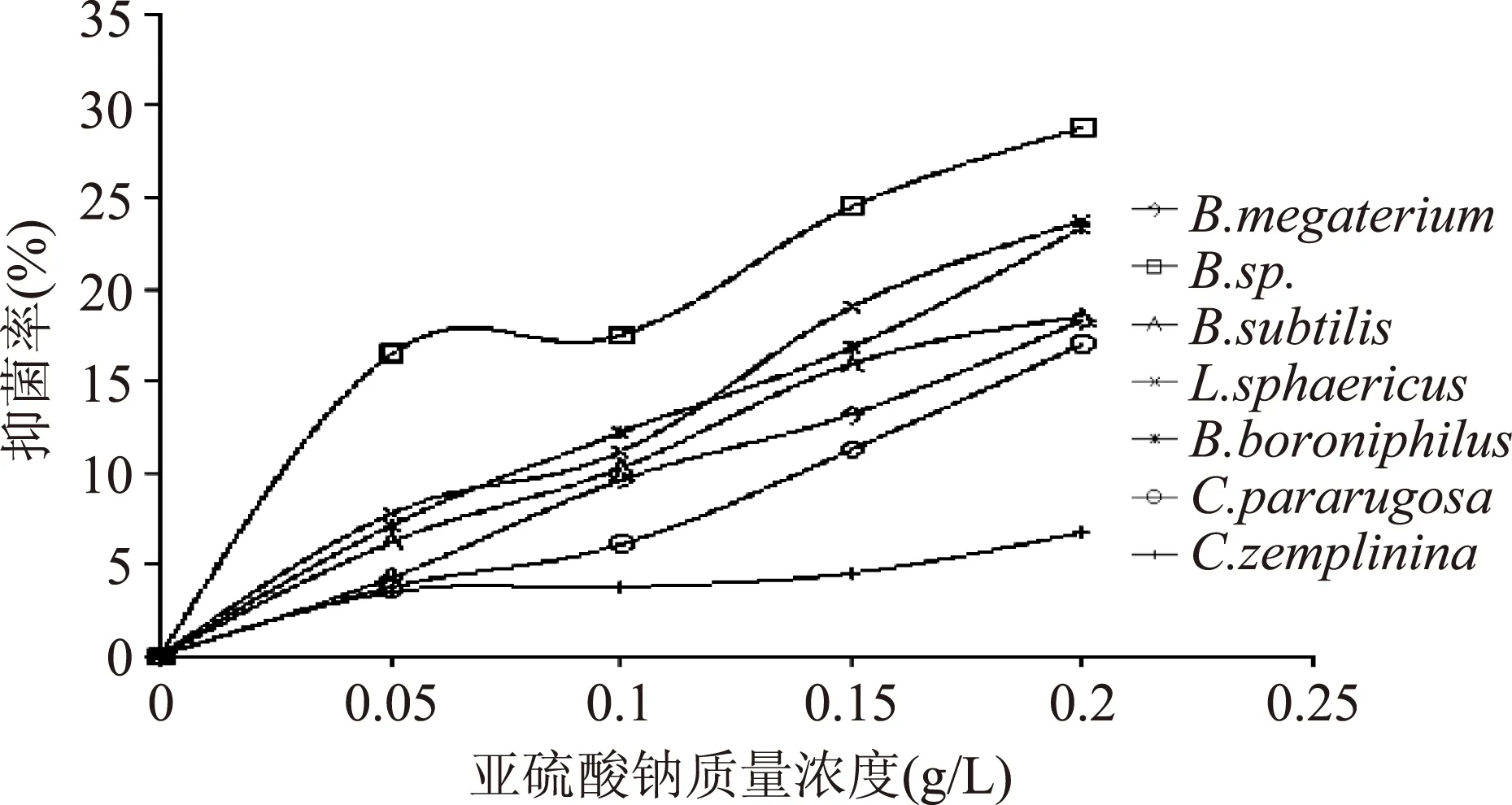
图5 不同浓度亚硫酸钠对腐败菌的抑制效果Fig.5 The inhibitory effect of different concentration of sodium sulfite on spoilage bacteria
2.3针对抗性较强菌株优化复合防腐剂最佳配方的响应面实验结果分析
2.3.1回归模型的建立及方差分析由单因素实验结果可看出,L.sphaericus、B.sp.对防腐剂的抗性较强,上述实验结果又确定了复合防腐剂的成分,即苯甲酸钠、脱氢乙酸钠和EDTA。所以在此基础上依据Box-Behnken实验设计原理,选用对此两株菌的抑制率作为响应面优化的评价标准。然后对此响应面优化实验的结果进行分析,结果见表4。
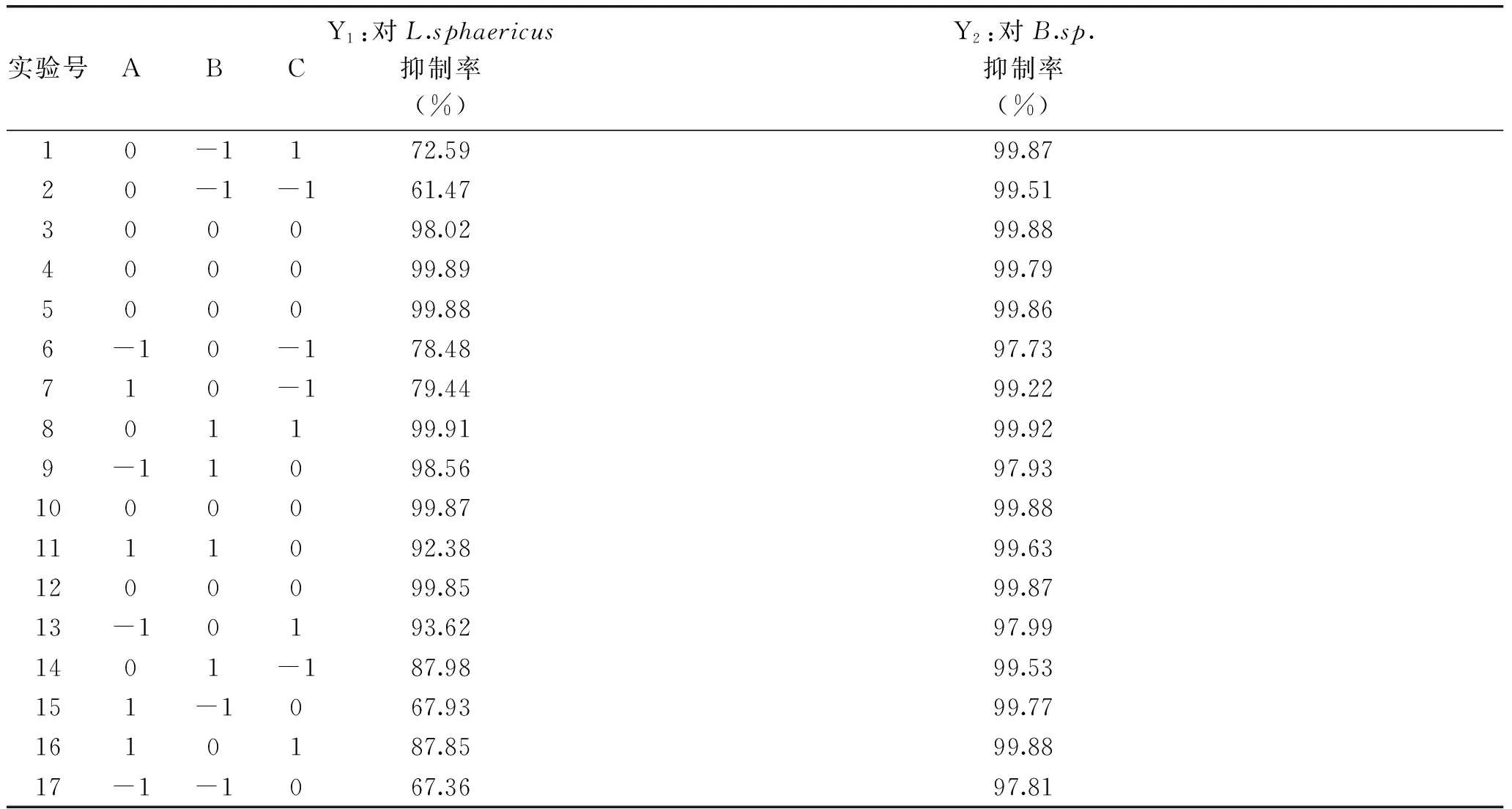
表4 响应面分析实验结果Table 4 Response surface analysis test results
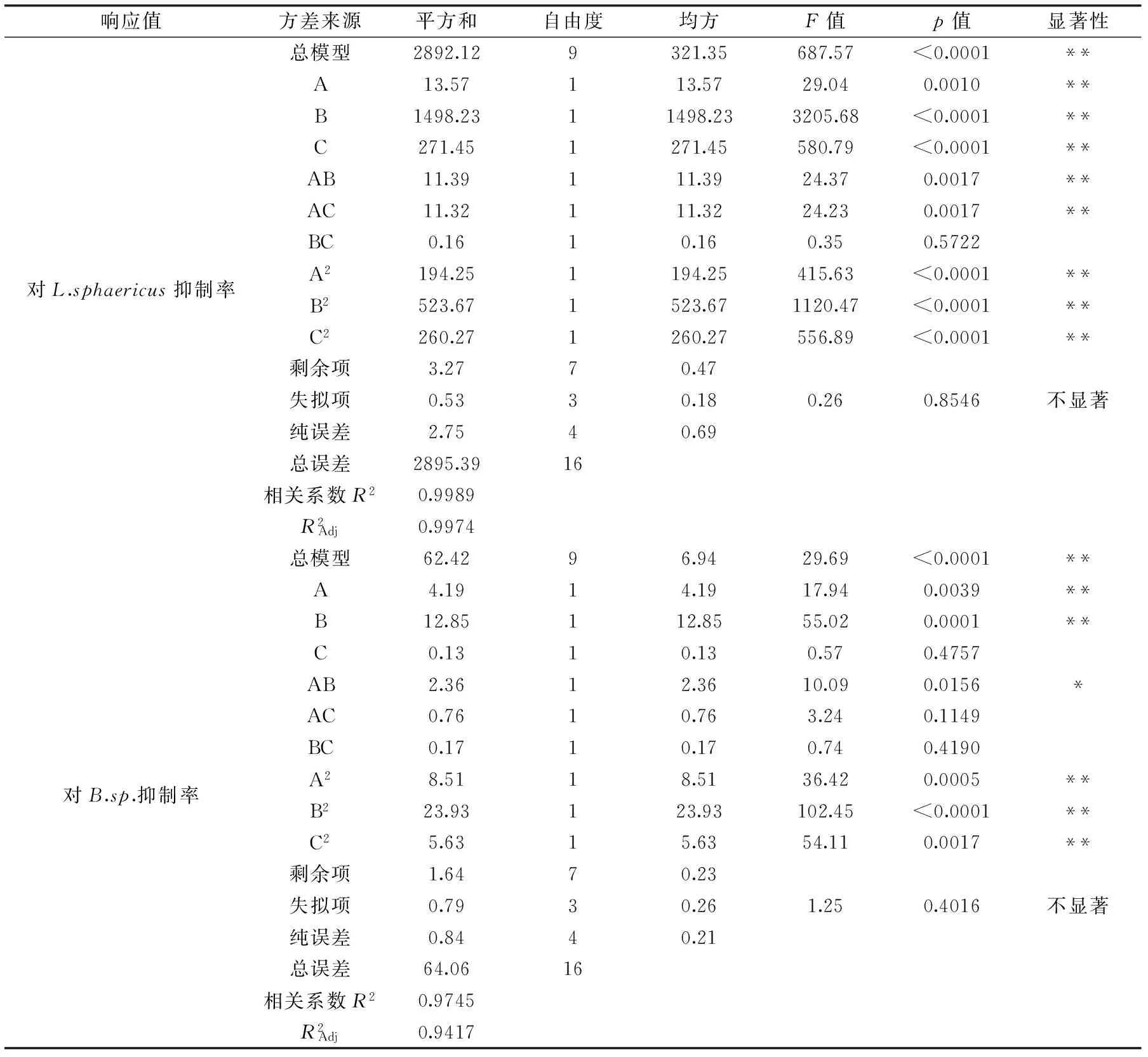
表5 响应面实验回归模型方差分析Table 5 Response surface regression model analysis of variance
注:**表示影响极显著(p<0.01);*表示影响显著(p<0.05)。利用Design-Expert.V 8.0.5b软件对实验数据进行多元回归拟合,三个因素经过回归拟合分别得到以对L.sphaericus抑制率(Y1)及对B.sp.抑制率(Y2)为目标函数的二次回归方程:
Y1=99.50-1.30A+13.68B+5.83C-1.69AB-1.68AC+0.20BC-6.79A2-11.15B2-7.86C2
Y2=99.65+0.72A+1.27B-0.13C+0.77AB+0.44AC-0.21BC-1.42A2-2.38B2-0.16C2
由表5回归模型方差分析可知,回归模型p值均小于0.0001,达到了极显著水平,说明该模型显著回归,方程能够正确反映L.sphaericus和B.sp.的抑制率与各因素之间的关系。模型的失拟项p值分别为0.8546和0.4016,均大于0.05,差异不显著,说明回归模型与实际实验拟合较好,实验误差小,可用于模型分析。相关系数R2分别为0.9989及0.9745,表明采用响应面法设计所得的回归模型有效,适用于此复合防腐剂对腌制大头菜中腐败微生物的抑制作用研究实验的理论预测。以对L.sphaericus抑制率(Y1)为响应值的模型中,A、B、C、AB、AC、A2、B2及C2的p值小于0.01,表明影响极显著;以对B. sp.抑制率(Y2)为响应值的模型中,A、B、A2、B2及C2的p值小于0.01,表明影响极显著。
2.3.2响应面分析响应面图能够直观地反映出各个因素及其交互作用,利用Design Expert软件即可以作出两因素交互作用的响应面图,交互作用显著和极显著的交互性的响应面图结果见图6~图8。
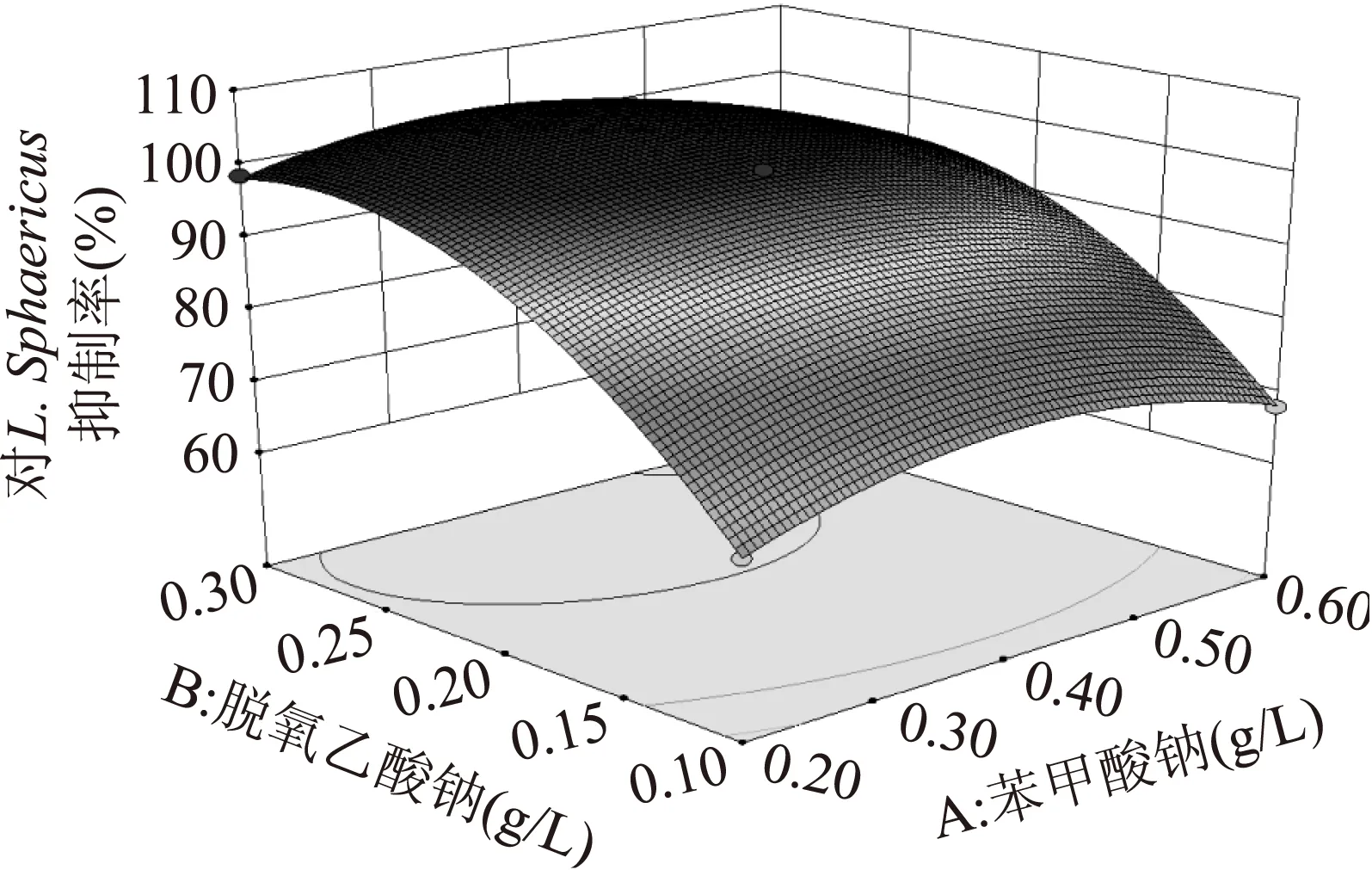
图6 苯甲酸钠和脱氢乙酸钠交互作用 对L. sphaericus抑制率的响应面图Fig.6 The response surface of L. sphaericus inhibition by the interaction of sodium benzoate and sodium dehydroacetate
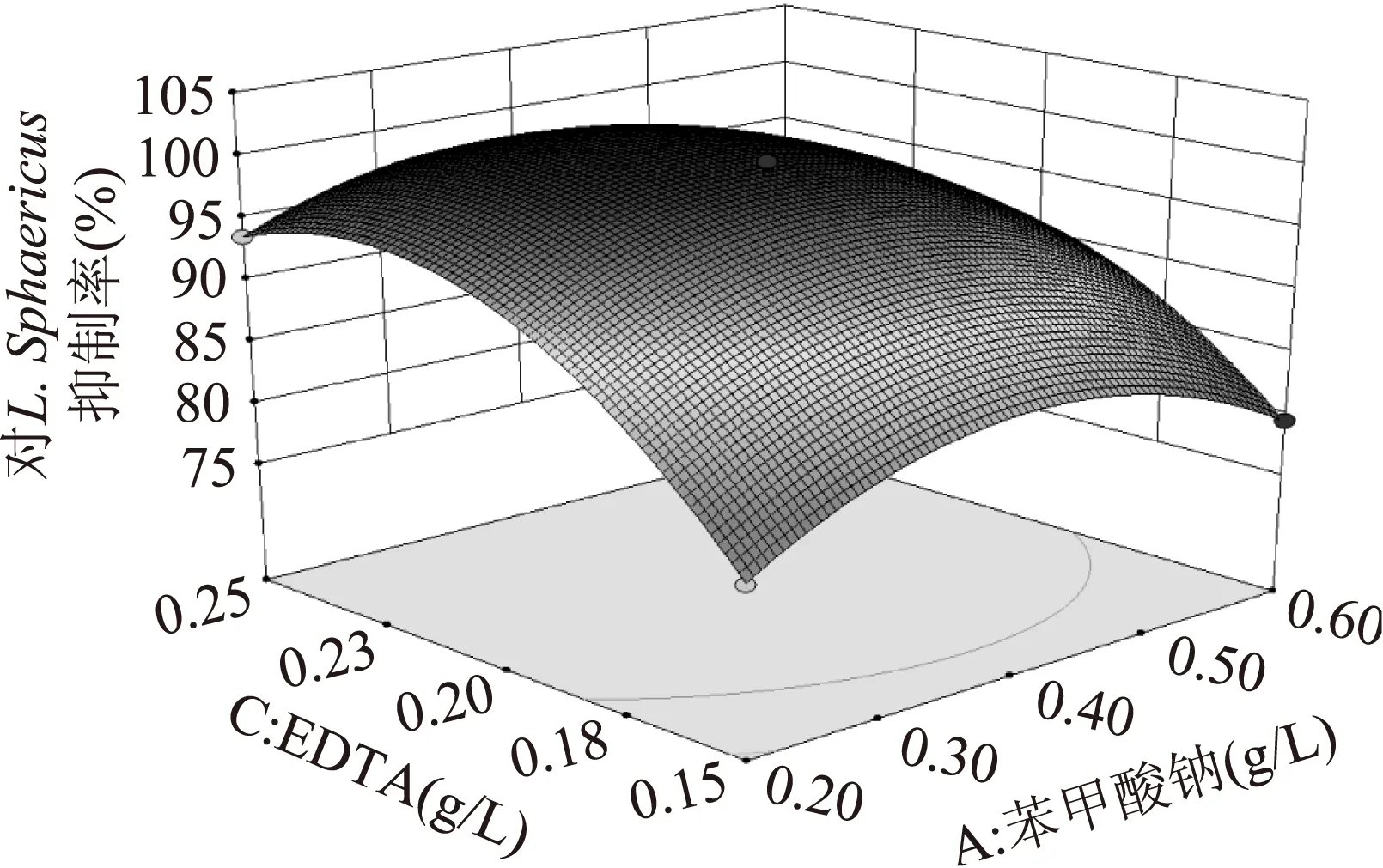
图7 苯甲酸钠和EDTA交互作用 对L. Sphaericus抑制率的响应面图Fig. 7 The response surface of L. Sphaericus inhibition by the interaction of sodium benzoate and EDTA
由表5可知,苯甲酸钠、脱氢乙酸钠、EDTA均为影响L.Sphaericus抑制率的主要因素,其中交互项显著如图6、图7。从结果来看,响应值随着苯甲酸钠变化的幅度较小,而脱氢乙酸钠和EDTA对响应值的影响较大。图6可以看出,对L.Sphaericus抑制率随着脱氢乙酸钠添加量和苯甲酸钠添加量的增加呈先上升后下降的趋势;图7可以看出,对L.Sphaericus抑制率随着苯甲酸钠添加量和EDTA添加量的增加呈先上升后下降的趋势。
由表5可知,苯甲酸钠、脱氢乙酸钠为影响B.Sp.抑制率的主要因素,交互项显著的响应面分析如图8。从结果来看,响应值随着苯甲酸钠变化的幅度较小,而脱氢乙酸钠对响应值的影响较大。图8可以看出,对B.Sp.抑制率随着脱氢乙酸钠添加量和苯甲酸钠添加量的增加呈先上升后下降的趋势。
2.3.3响应面法分析结果利用Design-Expert软件,通过对两个二次回归方程进行联合求解,分析可得最优化的对抗性较强的两株菌L.sphaericus和B.sp.的抑制率条件为苯甲酸钠添加量0.47 g/L,脱氢乙酸钠添加量0.23 g/L,EDTA添加量0.20 g/L。该条件下对L.Sphaericus抑制率的理论预测值为101.23%,对B.Sp抑制率的理论预测值为99.98%。
对最佳提取工艺进行验证实验,根据实际生产,综合考虑复合防腐剂对腌制大头菜中腐败微生物抑制作用的研究,将预测条件校正为苯甲酸钠添加量0.50 g/L,脱氢乙酸钠添加量0.20 g/L,EDTA添加量0.20 g/L。结果得出在此优化工艺条件下,对实验中大头菜的抑菌率达到了99%以上,与模型理论预测值的偏差均约为1.0%,说明该响应面回归模型具有可行性。
2.4验证实验结果
综合响应面结果分析,根据各因素相对实验菌株的显著性不同。将上述复合防腐剂组合添加到腌制大头菜中,常温下放置30 d,对菌落总数进行计数,空白组菌落总数为9×104CFU/mL,添加复合防腐剂组合的菌落总数为60 CFU/mL。对比空白组,有很高的抑菌作用,添加该复合防腐剂对产品有很好的保质和贮存效果。另外对两组腌制大头菜进行感官评价,结果见表6。
3 结论
本实验单一防腐剂的筛选实验表明,脱氢乙酸钠、苯甲酸钠对实验中7种腐败菌的抑制效果比较明显。对于L.sphaericus和B.sp.两株抗性较强的菌株,EDTA对其抑制率尤为明显。响应面实验表明,在防腐剂苯甲酸钠浓度为0.5 g/L,脱氢乙酸钠浓度为0.2 g/L,EDTA浓度为0.20 g/L的复配下,实验中大头菜的抑菌率达到了99%以上,有相当好的抑制效果,且复配防腐剂各自的用量之和占其最大使用量的比例之和小于90%,符合GB26687-2011的要求,达到了复配协同增效的作用。
将所筛选和响应面优化得到的复合防腐剂添加到腌制大头菜中,常温放置30 d,进行菌落测定和感官评价,表明其仍然具有很好的保鲜效果,可以达到对腌制大头菜防腐和延长食品货架期的目的。
[1]宦银根.蔬菜的腌制[J].中国调味品,2000(2):45-49.
[2]林科.食品防腐剂的种类及其研究进展[J].广西轻工业,2009,25(10):9-11.
[3]李场.“不含防腐剂”≠放心食品[J].食品与健康,2006(11):32-32.
[4]王心礼.天然食品防腐剂-R-多糖(克霉王)的抑菌效果评价[J].中国调味品,2008(7):74-76.
[5]王盼盼.肉制品加工中使用的辅料——防腐剂[J].肉类研究,2011(4):33-40.
[6]王心礼.生物食品防腐剂-R-多糖(克霉王)的抑菌效果评价[J].中国乳品工业,2008,36(9):65-66.
[7]李学贵.酱腌菜存在质量问题的解决措施[J].中国酿造,2006,154(1):55-55.
[8]慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001(22):91-94.
[9]张爽.酱腌菜防腐保鲜技术研究进展[J].安徽农业科学,2011,39(11):6538-6539.
[10]Verónica Romero-Gil,Pedro García-García,Antonio Garrido-Fernández.Susceptibility and resistance of lactic acid bacteria and yeasts against preservatives with potential application in table olives[J]. Food Microbiology,2016,54(4):72-79.
[11]陈满全.酱腌菜防腐措施的研究[J].食品研究与开发,2004,25(3):141-142.
[12]Dominic Dussault,Khanh Dang Vu,Monique Lacroix. Development of a model describing the inhibitory effect of selected preservatives on the growth of Listeria monocytogenes in a meat model system[J]. Food Microbiology,2016,53(2):115-121.
[13]骆洁.测定灰尘中细菌总数的可行性研究[J].硅谷,2008(2):43-44.
[14]Rui Cai,Yahong Yuan,Zhouli Wang,el at. Effects of preservatives on Alicyclobacillus acidoterrestris growth and guaiacol production[J]. International Journal of Food Microbiology,2015,214(12):145-150.
[15]马丽辉.葡萄酒中菌落总数测量不确定度的评估研究[J].酿酒,2007,34(5):83-84.
[16]Müjgan Ercan,EmiDeniz Akbulut,Sedat Abulu,et al. Stability of urine specimens stored with and without preservatives at room temperature and on ice prior to urinalysis[J]. Clinical Biochemistry,2015,48(13):919-922.
[17]董彩文,段蒙蒙,耿培栋,等.响应面法优化黄秋葵汁酶解工艺条件研究[J].食品工业,2015,36(8):137-140.
[18]杜彬,李凤英,范长军,等.响应面法优化葡萄皮渣中可溶性膳食纤维的酸法提取工艺[J].食品科学,2011,32(22):128-134.
[19]张根生,范爱月,韩冰,等.响应曲面法优化碱性蛋白酶提取林蛙残体胶原蛋白[J].食品科学,2011,32(2):93-97.
[20]Maria Alves,Eduardo Esteves,Célia Quintas. Effect of preservatives and acidifying agents on the shelf life of packed cracked green table olives from Maçanilha cultivar[J]. Food Packaging and Shelf Life,2015,9(5):32-40.
[21]Anuj H Chheda,Madhavi R,Vernekar. Improved production of natural food preservative ε-poly-l-lysine using a novel producer Bacillus cereus[J]. Food Bioscience,2014,9(7):56-63.
Study on the inhibitory effects of preservatives on spoilage microorganisms in salted turnip using response surface methodology
WANG Zheng-zheng,CHEN Ze-ping,LIU Yan-quan,LI Ming-yuan,LI Yu-feng*
(College of Food and Biological Engineering,Xihua University,Chengdu 610039,China)
The reproduction of microorganisms is the main cause of spoilage of bagged pickled vegetables. In order to preserve and extend the shelf life of food,screening and optimization of preservatives,studied on the inhibitory effect of preservatives on spoilage microorganisms in salted turnip. Seven spoilage microbes,Bacillussp.,Bacillusstubtilitus,Bacillusmegaterium,Bacillusboroniphilus,Lysinibacillussphaericus,Candidapararugos,andCandidazemplinina,separated from pickled rutabaga were used as objective strains.The antibacterial effects of sodium benzoate,sodium dehydroacetate,potassium sorbate,sodium sulfite,and EDTA on the strains were investigated.Then,the synergistic effects of the preservatives were studied.The results showed that sodium benzoate,sodium dehydroacetate,and EDTA exhibit significant inhibitory actions on the main spoilage microbes in rutabaga. Moreover,a compound preservative was optimized to be 0.5 g/L sodium benzoate,0.2 g/L sodium dehydroacetate,and EDTA 0.2 g/L through response surface optimization. This compound preservative exhibited an excellent suppression effect on two strains of bacteria separated from pickled rutabaga. The suppression rate could reach up to 99%.
pickled rutabaga;preservative;spoilage microbe;antibacterial effect;response surface optimization
2015-12-25
王征征(1992-),女,硕士研究生,研究方向:食品生物技术,E-mail:4163383@qq.com。
李玉锋(1965-),男,博士,教授,研究方向:食品生物技术,E-mail:907493056@qq.com。
TS255.36
A
1002-0306(2016)14-0291-07
10.13386/j.issn1002-0306.2016.14.050

