响应面法优化玉米苞叶多糖的提取工艺
张 扬,张 艳,杨秀东,刘 洋,周鸿立
(吉林化工学院化学与制药工程学院,吉林吉林 132022)
响应面法优化玉米苞叶多糖的提取工艺
张扬,张艳,杨秀东,刘洋,周鸿立*
(吉林化工学院化学与制药工程学院,吉林吉林 132022)
应用响应面法优化玉米苞叶多糖提取工艺。单因素实验基础上,选择提取时间、提取温度、液料比、乙醇浓度为影响因子,多糖提取率为响应值,利用Box-Behnken中心组合设计建立数学模型,进行响应面分析。研究结果显示:玉米苞叶多糖的最佳提取工艺为:提取时间2.0 h、温度83 ℃、液料比17∶1(mL/g)、乙醇浓度63%,此条件下的多糖提取率为0.552%。
玉米苞叶,多糖,响应面法,提取
玉米(ZeamaysL.)为一年生禾本科(Gramineae)植物,是我国总产量最高的粮食作物之一,种植面积约有3亿亩。玉米苞叶(Corn bract)为玉米的外苞叶,每公顷玉米可采集600 kg苞叶,资源非常丰富,是常见的农业副产物。研究表明,玉米苞叶中富含黄酮、木糖醇、花色苷、花青素、微量元素等多种生理活性物质[1]。具有调节血脂、预防动脉粥样硬化、抑制α-糖苷酶等药理作用[2-4]。目前,玉米苞叶主要作为牲畜饲料使用,少数质地优良的苞叶用于编织工艺品,综合利用率不高。因此,对玉米苞叶中的生物活性成分进行深度发掘具有较大现实意义。
多糖是一类由单糖通过糖苷键链接而成的大分子有机化合物,广泛存在于植物、微生物及动物体内,在生命体生长、发育过程中扮演着重要角色。很多植物来源的天然多糖具有广泛的药理作用,如免疫调节、抗氧化、抗肿瘤、抗病毒、抗炎等生物学活性[5]。研究表明,玉米须中富含多糖,且具有较高活性[6]。近年来,伴随研究深入,开发了多种高效、快捷的植物多糖提取方法,如超声波辅助提取法、微波辅助提取、超临界流体萃取法、酶法等[7-8]。然而,超声波和微波可能会破坏多糖结构,进而降低活性[9];酶法和超临界流体萃取法则成本较高,难以工业化。比较而言,经典水提法具有成本低、操作简单、环境友好、对多糖结构影响小等优点,广泛应用于植物多糖的提取研究中[10]。针对玉米苞叶提取多糖的研究较少,本文采用经典水提醇沉法对玉米苞叶中的多糖类物质进行提取研究,为玉米苞叶资源的深入开发及相关功能性产品的研制提供实验数据。
1 材料与方法
1.1材料和仪器
玉米苞叶采至吉林省吉林市郊区;葡萄糖标准品购自北京普凯瑞生物科技有限公司(纯度:HPLC≥98%);乙醇、浓硫酸、苯酚购自安耐吉化学;其他试剂均为国产分析纯。
752N紫外可见分光光度计上海菁华科技仪器有限公司;HH-6数显恒温水浴锅国华电器有限公司;RE-52A旋转蒸发仪上海亚荣生化仪器厂;TGL-20M台式高速冷冻离心机湖南湘仪实验室仪器开发有限公司。
1.2实验方法
1.2.1玉米苞叶多糖的提取采用水提醇沉法[11],流程为:苞叶的预处理(清洗、40~45 ℃烘干至恒重、粉碎、过40目筛备用)→提取→真空抽滤→减压浓缩至原体积1/3~1/4→醇沉→4 ℃静置过夜→3000×g离心10 min→无水乙醇洗涤→真空干燥→粗多糖。
1.2.2粗多糖含量及提取率测定以葡萄糖为对照品,采用苯酚-硫酸法测定粗多糖含量[12]。回归方程为Y=7.3928X+0.0085,R2=0.9998。多糖提取率计算公式为:
式中,m为粗多糖质量(g);M为玉米苞叶质量(g);W为粗多糖含量(%)。
1.2.3提取工艺优化
1.2.3.1单因素实验设计设定提取时间、提取温度、液料比、乙醇浓度为因素,考察四个因素对多糖提取率的影响。固定提取温度80 ℃、液料比30∶1、乙醇浓度80%,提取时间为0.5、1.0、1.5、2.0、2.5 h;固定提取时间1.5 h、液料比30∶1、乙醇浓度80%,温度为50、60、70、80、90 ℃;固定提取时间1.5 h、提取温度80 ℃、乙醇浓度80%,液料比为10∶1、20∶1、30∶1、40∶1、50∶1(mL/g);固定提取时间1.5 h、提取温度80 ℃、液料比30∶1,乙醇浓度50%、60%、70%、80%、90%。
1.2.3.2响应面实验设计根据BOX-Behnken Design(BBD)实验设计原理,综合单因素结果,选取提取时间、提取温度、液料比、乙醇浓度作为考察因素。在单因素基础上采用四因素三水平的响应面分析进行实验设计(表1)。

表1 BBD方案设计的因素和水平编码值表Table 1 The coded factors and levels in the Box-Behnken design
1.3数据处理
应用Design-Expert V 8.0.6.1软件进行四因素三水平Box-Behnken实验设计。
2 结果与讨论
2.1单因素实验结果及分析
2.1.1提取时间对多糖提取率的影响如图1所示,一定范围内,随提取时间延长,多糖提取率先增大后减小,当提取时间为2.0 h时,多糖提取率最高。可能由于提取时间短,苞叶中多糖溶解不充分;提取时间过长则会使大分子多糖分子降解为低分子量的寡糖或单糖[13],影响提取率。因此,提取时间以2.0 h为宜。

图1 提取时间对多糖提取率的影响Fig.1 Effect of extraction time on PCB yield
2.1.2提取温度对多糖提取率的影响由图2可知,50~80 ℃范围内,随温度升高,多糖提取率增加。超过80 ℃,多糖提取率开始下降。可能因为一定范围内,随温度升高,多糖在提取液中溶解度增大,提取率升高;而当温度太高时,提取液中的多糖会有损失,也会使蛋白质等杂质析出,进而影响提取率。故提取温度以80 ℃为宜。
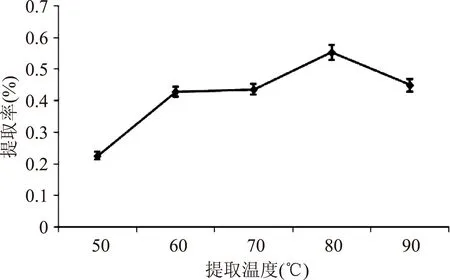
图2 提取温度对多糖提取率的影响Fig.2 Effect of extraction temperature on PCB yield
2.1.3液料比对多糖提取率的影响由图3可见,当液料比(mL/g)在20∶1时,提取率最高。此后,随溶剂量增加,多糖提取率下降。可能因为液料比小时,溶剂过少,苞叶中多糖溶出不充分;而液料比过大时,则溶剂过多,浓缩耗时长,进而导致多糖损失,降低提取率。故液料比以20∶1(mL/g)为宜。

图3 液料比对多糖提取率的影响Fig.3 Effect of liquid to solid ratio on PCB yield
2.1.4乙醇浓度对多糖提取率的影响由图4可知,乙醇浓度在60%时,多糖提取率最大。此后,随乙醇浓度增加,提取率增加幅度不大,基本趋于平稳。说明一定浓度乙醇能降低多糖溶解度,利于沉淀多糖;高浓度乙醇则会使某些杂质一起沉淀析出,降低多糖纯度[14],进而影响提取率。因此,选择60%为醇沉浓度为宜。

图4 乙醇浓度对多糖提取率的影响Fig.4 Effect of ethanol concentration on PCB yield
2.2响应面实验结果与分析
2.2.1Box-Behnken设计方案及结果如表2所示,共29个实验点,其中24个为析因点,5个为零点,析因点为自变量取值在X1、X2、X3、X4所构成的三维顶点;零点为区域的中心点,其中零点实验重复5次,用以估计实验误差。

表2 响应面实验设计的因素、水平与实验结果Table 2 Factors and levels in the response surface design and experimental results
2.2.2模型的建立与显著性检验对表2实验数据进行多元回归拟合,得玉米苞叶多糖提取率(Y)对提取时间(X1)、提取温度(X2)、液料比(X3)、乙醇浓度(X4)的二次多项回归模型为:
Y=0.56+0.0095X1+0.064X2-0.026X3+0.066X4+0.043X1X2+0.026X1X3-0.00275X1X4-0.055X2X3+0.00375X2X4-0.00875X3X4-0.13X12-0.13X22-0.08X32-0.13X42
对该模型进行显著性检验和回归模型系数显著性检验,结果见表3。
由表3中的二次回归模型的方差分析结果可知,该模型能较好解释数据变异性。X1X4、X2X4、X3X4的影响不显著,X1的影响显著,其余因子均为极显著。
2.2.3多糖提取工艺的响应面分析与优化响应面分析的图形是特定的响应值对应自变量构成的一个三维空间图,可以直观地反映出各自变量对响应值的影响。根据回归模型做出相应的响应曲面,见图5~图7。
当液料比(mL/g)20∶1、乙醇浓度60%时,提取时间和提取温度对多糖提取率的影响见图5。由图5可知,在1.5~2.5 h范围内多糖提取率先增大后减小。在温度为70~90 ℃的范围内,提取率不断增加,之后随提取时间延长,多糖提取率有下降趋势,表明提取时间和温度对提取率的交互作用极显著。

图5 提取时间和提取温度对多糖提取率的响应曲面图Fig.5 Response surface plot of extraction time and temperature on PCB yield

表3 回归模型的方差分析结果Table 3 ANOVA of the regression model
注:**,极显著;*,显著,p<0.05。
当提取温度80 ℃、乙醇浓度60%时,提取时间和液料比对多糖提取率的影响见图6。由图6可知,当液料比一定时,随提取时间延长,多糖提取率先增加后降低。时间1.5~2.5 h范围内,随液料比增加多糖提取率先上升后下降,对多糖提取率的影响极显著。

图6 提取时间和液料比对多糖提取率的响应曲面图Fig.6 Response surface plot of extraction time and liquid to solid ratio on PCB yield
提取时间2.0 h、乙醇浓度60%时,提取温度和液料比对多糖提取率的影响见图7。由图7可知,提取温度对多糖提取率的影响较大,且响应面显示坡度较陡,表明提取温度和液料比的交互作用极显著。

图7 提取温度和液料比对多糖提取率的响应曲面图Fig.7 Response surface plot of extraction temperature and liquid to solid ratio on PCB yield
软件分析得玉米苞叶多糖提取的最佳条件为:提取时间2.03 h、提取温度83.16 ℃、液料比17.22∶1、乙醇浓度62.79%。此条件下,多糖提取率理论值为0.579%。为检验响应曲面法所得结果的可靠性,采用上述优化提取条件进行玉米苞叶多糖提取,考虑到实际操作的便利,将提取工艺参数修正为:提取时间为2.0 h、提取温度83 ℃、液料比17∶1、乙醇浓度63%。实际测得的平均提取率为0.552%,与理论预测相比,其相对误差约为4.7%,因此,基于响应曲面法所得的优化提取工艺参数准确可靠,具有实用价值。
3 结论
本文采用经典水提醇沉法制备玉米苞叶多糖,在单因素实验基础上,结合实验设计软件Design-Expert.V8.0.6.1,通过二次回归得到玉米苞叶多糖提取率与提取时间、温度、液料比、乙醇浓度的回归模型,经检验证明该模型合理、可靠,能较好预测多糖提取率。在对影响多糖提取率的关键因素及相互作用进行探讨后,优化出玉米苞叶多糖提取工艺的最佳条件为:提取时间2.0 h、提取温度83 ℃、液料比17∶1、乙醇浓度63%,多糖实际提取率为0.552%,与理论预测相比,其相对误差约为4.7%,理论预测与实测结果相差较小,结果可靠,适合于玉米苞叶多糖的提取。
[1]张扬,刘洋,周鸿立. 玉米苞叶中的生物活性成分[J]. 吉林农业,2015(6):59.
[2]甄艳军,侯建明,姜秀娟,等. 玉米苞叶煎剂对高脂大鼠血清NO、ET水平及内皮凋亡的作用[J]. 辽宁中医杂志,2009,36(2):307-308.
[3]侯建明,甄颜君,王林,等. 玉米苞叶降低动脉硬化家兔白细胞凋亡及CD44表达[J]. 中国老年学杂志,2005,24(11):1036-1037.
[4]尹震花,顾雪竹,顾海鹏,等. 玉蜀黍苞叶和玉米棒提取物α-糖苷酶抑制活性[J]. 河南大学学报:医学版,2012,31(2):88-90.
[5]Chen S,Chen H,Tian J,et al. Enzymolysis-ultrasonic assisted extraction,chemical characteristics and bioactivities of polysaccharides from corn silk[J]. Carbohydrate Polymers,2014,101(1):332-341.
[6]Hongli Z,Yang Z,Min Z,et al. A Polysaccharide from Stigma Maydis[J]. Chemistry of Natural Compounds,2015,51(2):320-322.
[7]尹艳,高文宏,于淑娟. 多糖提取技术的研究进展[J]. 食品工业科技,2007(2):248-250.
[8]王如涛,吴绵斌,林建平,等. 植物多糖分离提取技术的研究进展[J]. 中国生物工程杂志,2013,33(7):118-123.
[9]Mahesar S A,Sherazi S T H,Kamran A,et al. Application of microwave heating for the fast extraction of fat content from the poultry feeds[J]. Talanta,2008,75(5):1240-1244.
[10]徐运飞,刘琴,宋珅,等. 响应面法优化黄参多糖的提取工艺及其体外抗氧化活性[J]. 天然产物研究与开发,2015,27(12):2116-2123.
[11]Chen S,Chen H,Tian J,et al. Chemical modification,antioxidant andα-amylase inhibitory activities of corn silk polysaccharides[J]. Carbohydrate Polymers,2013,98(1):428-437.
[12]Deng Q,Xin Z,Chen H. Optimization of enzyme assisted extraction of Fructus Mori polysaccharides and its activities on antioxidant and alcohol dehydrogenase[J]. Carbohydrate Polymers,2014,111(20):775-782.
[13]Zhao B,Zhang J,Guo X,et al. Microwave-assisted extraction,chemical characterization of polysaccharides from Lilium davidii var. unicolor Salisb and its antioxidant activities evaluation[J]. Food Hydrocolloids,2013,31(2):346-356.
[14]李颖畅,王亚丽,齐凤元,等. 响应面法优化蓝莓叶多糖提取工艺[J]. 食品工业科技,2015(3):227-231.
Optimization of extraction process of polysaccharides from corn bract by response surface methodology
ZHANG Yang,ZHANG Yan,YANG Xiu-dong,LIU Yang,ZHOU Hong-li*
(School of Chemistry and Pharmaceutical Engineering,Jilin Institute of Chemical Technology,Jilin 132022,China)
In this study,optimization of extraction process of polysaccharides from corn bract(PCB)by response surface methodology was investigated. Based on the results of single factor experiment,four factors,including extraction time,extraction temperature,the ratio of liquid to raw material,and ethanol concentration were selected as impacting factors,and PCB yield as the response value. Mathematical model was established to analyze response surface using Box-Behnken central composite design. The optimal extraction process was as follows:extraction time 2.0 h,extraction temperature 83 ℃,liquid to solid ratio 17∶1(mL/g),and alcohol precipitation concentration 63%. Under these conditions,the yield of PCB was 0.552%.
corn bract;polysaccharides;response surface methodology;extraction
2015-12-18
张扬(1982-),男,博士,副教授,主要从事天然产物化学方面的研究,E-mail:zhangyhappy@126.com。
周鸿立(1967-),女,博士,教授,主要从事活性天然产物研究与功能性食品方面的研究,E-mail:zhl67@126.com。
吉林省科技厅科研项目(20150311044YY);吉林化工学院博士启动资金(15001)。
TS254.4
B
1002-0306(2016)14-0267-05
10.13386/j.issn1002-0306.2016.14.045

