富油新绿藻对四种抗生素敏感性的研究
张 茜,李雁群,卢少霞,钟 敏,胡雪琼,杨青峰,杨慧敏
(广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东海洋大学食品科技学院,广东湛江 524088)
富油新绿藻对四种抗生素敏感性的研究
张茜,李雁群*,卢少霞,钟敏,胡雪琼,杨青峰,杨慧敏
(广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东海洋大学食品科技学院,广东湛江 524088)
为了探讨富油新绿藻(Neochlorisoleoabundans)对氯霉素、青霉素、链霉素和四环素4种常用抗生素的敏感性,以液体培养下藻细胞生物量和固体平板培养下藻落的形成和生长为指标,研究富油新绿藻在四种抗生素的浓度为10、25、100和500 μg/mL条件下的生长情况。结果表明:液体培养条件下,四种抗生素对富油新绿藻的生长均表现出了抑制作用。链霉素抑制作用最为明显,浓度10 μg/mL便可完全抑制藻细胞的生长;其次为氯霉素和四环素,100 μg/mL时能表现出明显抑制效果;但是青霉素要在浓度达到500 μg/mL时才表现出明显的抑制。通过对数据进行统计分析得出,链霉素、四环素、氯霉素、青霉素对富油新绿藻生长的半抑制浓度分别为:0.25、72、119和164 μg/mL。在固体培养中,链霉素浓度为10 μg/mL时完全抑制了藻细胞的生长,氯霉素和四环素的抑制浓度为100 μg/mL,而青霉素没有表现出明显的抑制作用。
富油新绿藻,抗生素,微藻,敏感性
微藻作为单细胞生物,相比于陆生高等植物,具有生长快、产量高、占地少、淡水消耗少、易于工业化培养等特点[1-2]。微藻与陆生植物一样,可以根据其不同的生物特性用以生产蛋白质、油脂、淀粉以及其他多种生物活性物质[3-6]。一些微藻甚至可以直接作为食品,如螺旋藻、小球藻等[7-8]。因此,微藻作为食品材料的研究越来越受到人们的重视。一些微藻具有在细胞内大量积累油脂的能力,高的可以达到其细胞干重的70%以上,一些微藻已经被用来生产功能性油脂,如利用裂殖壶菌生产DHA[9-10]。通过生物工程技术,微藻还具有生产其他保健作用的多种功能性食用油的潜在可能[11]。富油新绿藻(Neochlorisoleoabundans)是1962年从沙漠中分离得到的一株淡水藻,经鉴定为绿藻门,绿藻纲,绿球藻目,绿球藻科,新绿藻属(Neochloris)的一种单细胞真核绿藻[12]。这种藻脂质含量可达到干重的17.5%~54%,三脂肪酰甘油酯占总脂质含量的80%,且其脂肪酸组成中大多数是16~18碳的脂肪酸[13]。本实验室分析表明,富油新绿藻油脂中不饱和脂肪酸占66.28%,其中油酸和亚麻酸的含量达到总脂肪酸的48.98%,由此可见,富油新绿藻油脂具有可作为优质食用油的潜在可能[14]。
微藻培养极易受其他微生物侵染[15]。在微藻受到严重污染需要采取补救措施或者需要纯化藻种,以及微藻基础研究中,微藻的纯种培养和保存中,都需要用到抗生素的处理[16-17]。在微藻基因工程技术研发中更要用到抗生素抗性作为转基因藻的筛选特性[18]。因此,研究微藻对各种不同抗生素的敏感性,以指导和帮助微藻培养研究和实践中对抗生素的应用具有实际意义。
但是,目前有关富油新绿藻的抗生素敏感性的研究尚未见到文献报道,本文拟通过分别采用液体培养和固体培养两种不同的手段,观察富油新绿藻对于青霉素、链霉素、氯霉素、四环素等四种抗生素的敏感性,找出这些抗生素对这种藻的抑制浓度,为以后富油新绿藻培养和基因工程研究和实际应用打下基础。
1 材料与方法
1.1材料与仪器
富油新绿藻(Neochlorisoleoabundans)原购自美国德克萨斯州立大学藻种保藏中心(The Culture Collection of Algae at the University of Texas in Austin,Austin,TX,USA),编号UTEX LB #1185,由加拿大渥太华大学Christopher Lan 教授惠赠;改良SE培养基含NaNO351 g/L,CaCl·22H2O 5 g/L,NaCl 5 g/L,MgSO4·7H2O 15 g/L,FeCl·6H2O 1 g/L,KH2PO435 g/L,K2HPO4·3H2O 15 g/L,混合微量元素盐溶液1 mL,其中的试剂均为分析纯,购自湛江林达化学试剂公司;抗生素氨苄青霉素、氯霉素、硫酸链霉素、盐酸四环素纯度均为99%,均购自广州市齐云生物技术有限公司。
YXQ-LS-18SI手提式压力蒸汽灭菌器上海博迅实业有限公司医疗设备厂;CJT-12超净工作台广州瑞智科学仪器有限公司;98-2磁力搅拌器上海司乐仪器有限公司;WFJ7200分光光度计尤尼柯上海仪器有限公司;AK-1200电子天平(d=0.01 g)中韩合资科威电子仪器有限公司;CHZ-98B恒温光照培养箱金坛市万华实验仪器厂。
1.2实验方法1.2.1藻细胞培养培养温度为27~30 ℃,用500 mL血清瓶装培养基400 mL,2000 Lux连续光照,通入含5%二氧化碳的空气,通气量为400~600 mL/min,用磁力搅拌器搅拌[19]。
1.2.2藻细胞浓度的测定抽取2 mL培养液于分光光度计上测定在600 nm处的吸光度值OD600,以细胞干物质重计的细胞浓度计算为[19]
CDW(g/L)=OD600×0.4
式(1)
其中:CDW为细胞干重。
1.2.3液体培养抗生素的敏感性实验取300 mL无菌改良SE液体培养基分别加入不同浓度的抗生素,抗生素浓度见表1;另外以同样的培养基不加抗生素作为对照样。接种100 mL对数生长期藻液,按1.2.1条件培养,每天测定培养液的藻细胞浓度,做3个平行测定,在接种后观察5 d,进行数据分析。

表1 用于敏感性实验抗生素浓度(μg/mL)Table 1 Concentrations of antibiotics(μg/mL)
1.2.4固体培养抗生素敏感性实验在100 mL改良SE培养液中加入1.5%琼脂粉,高压灭菌,冷却到50 ℃左右,加入相应浓度抗生素(抗生素浓度同液体筛选浓度一致),倒固体平板。按照细胞计数法计算细胞浓度,将生长至对数期的微藻培养液稀释到适当浓度,定量吸取藻液200 μL均匀涂布于平板上,28 ℃恒温2000 Lux连续光照培养,观察20 d,以微藻藻落形成和生长情况评价微藻对抗生素的敏感性。
1.3数据处理
采用Origin 6.0软件处理数据。
2 结果与分析
2.1富油新绿藻对氯霉素的敏感性
2.1.1富油新绿藻液体培养下对氯霉素的敏感性氯霉素敏感性实验结果见图1。由图1可见,氯霉素对富油新绿藻生长情况有一定的抑制作用;随着氯霉素浓度的增加,抑制作用增强;当氯霉素浓度为100 μg/mL时对富油新绿藻的生长产生了较为明显的抑制;当氯霉素浓度为500 μg/mL时抑制作用显著,此时富油新绿藻几乎不能生长;然而,在氯霉素浓度≤25 μg/mL时对富油新绿藻的生长影响却不明显,说明富油新绿藻可以耐受25 μg/mL以下浓度的氯霉素。

图1 氯霉素对富油新绿藻生长的影响Fig.1 The effect of chloramphenicol on the growth of Neochloris oleoabundans
从图1可见,没有抗生素影响的对照组,富油新绿藻在第4 d已经到达生长阶段的稳定期,用第4 d的细胞生长数据分析抗生素抑制浓度,得到藻细胞浓度与抗生素浓度关系曲线。
拟合所得的富油新绿藻对氯霉素敏感性曲线表达式为:
Y=2.997-0.005 X,R2=0.9974
式(2)
取Y=1/2Y0=1.53求得半抑制浓度为,X1/2=119 μg/mL,即氯霉素对富油新绿藻的半抑制浓度为119 μg/mL。
2.1.2富油新绿藻固体培养下对氯霉素的敏感性固体培养条件下,富油新绿藻对氯霉素的敏感性见图2。结果表明,低浓度氯霉素对于富油新绿藻抑制效果不明显,当浓度达到100 μg/mL时,固体平板上没有藻落长出,富油新绿藻的生长完全被抑制。

图2 固体培养富油新绿藻对氯霉素敏感性Fig.2 The sensitivity of chloramphenicol on Neochloris oleoabundans grown on solid medium 注:从左至右浓度依次为 0、10、25、100、500 μg/mL。图4、图6、图8同。
2.2富油新绿藻对青霉素的敏感性
2.2.1富油新绿藻液体培养下对青霉素的敏感性青霉素敏感性实验结果见图3,从图3中可见,青霉素对富油新绿藻生长有一定的抑制作用,随着青霉素浓度的增加抑制作用更加明显。但是与氯霉素相比,青霉素的抑制作用比较温和,氯霉素浓度为100 μg/mL时对富油新绿藻的生长就表现为出较为明显的抑制,而青霉素只有在500 μg/mL的浓度下才表现出明显的抑制作用。

图3 青霉素对富油新绿藻量生长的影响Fig.3 The effect of penicillin on the growth of Neochloris oleoabundans
取富油新绿藻第4 d的生长数据,得到式(3):
式(3)
由式(3)得青霉素对富油新绿藻细胞生长的半抑制浓度为164 μg/mL。
2.2.2富油新绿藻固体培养下对青霉素的敏感性固体培养条件下,富油新绿藻对青霉素的敏感性见图4。由图4可知,各个浓度平板上均有藻细胞长出,浓度500 μg/mL藻细胞相对于其他浓度偏少,500 μg/mL青霉素对于富油新绿藻生长具有轻微抑制,所以500 μg/mL以下的青霉素浓度对于富油新绿藻的生长没有明显的抑制效果。
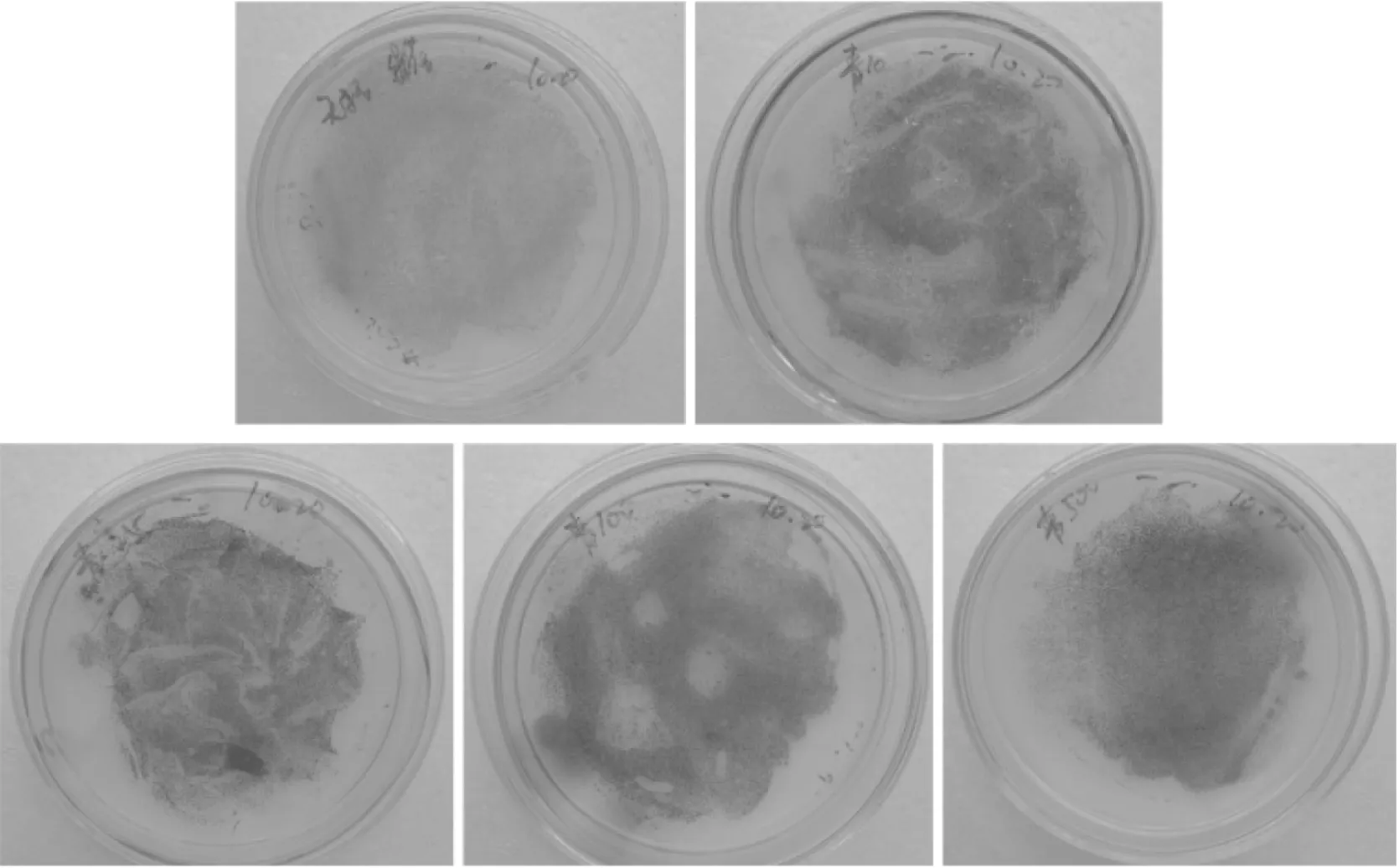
图4 固体培养富油新绿藻对青霉素敏感性Fig.4 The sensitivity of penicillin on Neochloris oleoabundans grown on solid medium
2.3富油新绿藻对链霉素的敏感性
2.3.1富油新绿藻液体培养下对链霉素的敏感性富油新绿藻对链霉素敏感性实验结果见图5,结果表明链霉素在实验浓度范围内对富油新绿藻生长均有明显的抑制作用。随着链霉素浓度的增加,抑制作用越明显。链霉素浓度在实验的最低浓度10 μg/mL时就对富油新绿藻的生长产生了明显的抑制,链霉素浓度越高,抑制作用就越强烈,当浓度≥25 μg/mL时,富油新绿藻几乎不能生长。这说明富油新绿藻对链霉素很敏感。

图5 链霉素对富油新绿藻生长的影响Fig.5 The effect of streptomycin on the growth of Neochloris oleoabundans
取图5中富油新绿藻第4 d的生长数据,得到式(4):
R2=0.99955
式(4)
式(4),可得链霉素对富油新绿藻生长量的半抑制浓度为0.25 μg/mL。
2.3.2富油新绿藻固体培养下对链霉素的敏感性固体培养条件下,富油新绿藻对链霉素的敏感性见图6。由图6可明显观察到,所选四种浓度的固体培养基中均无藻细胞长出,可见,链霉素对于富油新绿藻的生长抑制作用明显,浓度10 μg/mL时可完全抑制富油新绿藻的生长。

图6 固体培养富油新绿藻对链霉素敏感性Fig.6 The sensitivity of streptomycin on Neochloris oleoabundans grown on solid medium
2.4富油新绿藻对四环素的敏感性
2.4.1富油新绿藻液体培养下对四环素的敏感性富油新绿藻对四环素敏感性实验结果如图7所示,由图7中可见,四环素对富油新绿藻生长有一定的抑制作用,随着四环素浓度的增加抑制作用更加明显。但是与链霉素相比,四环素的抑制作用比较温和,四环素浓度为100 μg/mL时对富油新绿藻的生长表现为出较为明显的抑制,而四环素只有在500 μg/mL的浓度下才表现出明显的抑制作用,说明富油新绿藻可以耐受100 μg/mL以下浓度的四环素。

图7 四环素对绿藻量生长的影响Fig.7 The effect of tetracycline on the growth of Neochloris oleoabundans
取图7中富油新绿藻第4 d的生长数据,用Origin 6.0软件分析拟合,得到式(5)。
R2=1
式(5)
可取对照组生长量的一半Y1/2=1.84对应的浓度作为半抑制浓度X1/2,代入式(5),可得X1/2=72 μg/mL,故四环素对富油新绿藻生长量的半抑制浓度为72 μg/mL。
2.4.2富油新绿藻固体培养下对四环素的敏感性固体培养条件下,富油新绿藻对四环素的敏感性见图8。由图8可知,当浓度为0和10 μg/mL时,固体平板上有藻细胞长出,浓度25和100 μg/mL时平板上有少量藻落长出,藻细胞生长明显受到抑制,当浓度达到500 μg/mL时,没有藻落长出,生长完全被抑制。

图8 固体培养富油新绿藻对四环素敏感性Fig.8 The sensitivity of tetracycline on Neochloris oleoabundans grown on solid medium
3 讨论
青霉素的主要作用是抑制细菌的细胞壁的合成,会使细胞壁缺损,抗渗透压能力降低,引起细菌细胞变形、破裂而死亡。然而,由于真菌和微藻的细胞壁化学成分和结构都有不同,青霉素对其他微生物的作用也不相同,不同微藻对青霉素的敏感性也有差异[20]。氯霉素、链霉素、四环素也是抗生素筛选常用的抗生素,通过抑制细菌的蛋白质合成来抑制细菌的生长。但是,同样的抗生素对不同种类的微藻的作用也表现出多样性。王逸云[18]等的研究表明,小球藻对链霉素不敏感,对氯霉素较敏感,当氯霉素浓度达到100 μg/mL时,已经抑制其生长。周文礼等[21]发现,低浓度的氯霉素和青霉素均可促进金藻的生长,随着浓度增高,才表现出抑制作用。黄健等[22]对6种微藻进行了链霉素的敏感性分析发现,当链霉素浓度低到一定程度时,对6种微藻均表现出一定的生长刺激作用。杨芳芳等[23]选取了3种真眼点藻和3种绿藻,分别进行氯霉素和硫酸新霉素的敏感性研究,发现氯霉素可以作为抗性筛选剂。在微藻对抗生素敏感性实验方法上,固体培养法简便易行,但不能像液体培养法一样定量描述藻细胞的生长情况。李杰等[24]研究发现,在不同的培养条件下,微藻对抗生素的敏感性有差异,因此固体培养条件下分析出的抗性浓度不一定适合液体培养。所以本实验分别观察了液体培养和固体培养两种条件下,富油新绿藻对四种抗生素的敏感性。本研究中,液体培养条件下氯霉素浓度为100 μg/mL时,富油新绿藻生长未完全被抑制,但是固体培养条件下相同浓度的氯霉素完全抑制了细胞在培养平板中长出。
从研究结果可以看出,在液体培养条件下,四种抗生素对富油新绿藻的生长均有抑制作用,但是该藻种对各种抗生素的敏感性存在差异,敏感程度为:链霉素>四环素>氯霉素>青霉素。其中链霉素作用最为明显,其次为氯霉素和四环素,在液体培养条件下,适当的控制氯霉素和四环素的浓度,可以在杀灭细菌的同时保持富油新绿藻的正常生长。在固体培养的条件下,链霉素浓度为10 μg/mL抑制作用明显,氯霉素和四环素没有表现出明显的抑制效果,故
固体培养条件下,氯霉素和四环素也可作为抑制剂使用。链霉素对富油新绿藻抑制作用明显,在富油新绿藻基因工程领域中,可以作为转基因操作时用于抗性筛选的抗生素。
4 结论
在液体培养条件下,氯霉素、青霉素、链霉素和四环素对富油新绿藻生长都有抑制作用,4种抗生素对富油新绿藻的半抑制浓度分别为:119、164、0.25、72 μg/mL。链霉素抑制力最强,当浓度为10 μg/mL时富油新绿藻生长完全被抑制。在固体培养条件下,链霉素的完全抑制浓度为10 μg/mL,氯霉素和四环素的完全抑制浓度为100 μg/mL,但是青霉素却没有表现出明显的抑制作用。
[1]Minowa T,Yokoyama S,Kishimoto M,et al. Oil production from algal cells of Dunaliella tertiolecta by direct thermochemical liquefaction[J]. Fuel,1995,74(12):1735-1738.
[2]Dote Y,Sawayama S,Inoue S,et al. Recovery of liquid fuel from hydrocarbon-rich microalgae by thermochemical liquefaction[J]. Fuel,1994,73(12):1855-1857.
[3]Hu Q. 12 Industrial production of microalgal cell-mass and secondary products-major industrial species[J]. Handbook of microalgal culture:Biotechnology and Applied Phycology,2004:264-272.
[4]Wen Z Y,Chen F. Heterotrophic production of eicosapentaenoic acid by microalgae[J]. Biotechnology advances,2003,21(4):273-294.
[5]Jin E,Polle Jew,Hong Kumlee,et al. Xanthophylls in microalgae:From biosynthesis to biotechnological mass production and application[J]. Journal of Microbiology and Biotechnology,2003,13(2):165-174.
[6]王冬琴,谭瑜,卢虹玉,等. 微藻生物活性物质在食品工业中的应用进展[J].现代食品科技,2013,29(5):1185-1191.
[7]Milledge J J. Commercial application of microalgae other than as biofuels:a brief review[J]. Reviews in Environmental Science and Bio/Technology,2011,10(1):31-41.
[8]Milledge J J. The challenge of algal fuel:economic processing of the entire algal biomass[J]. Condensed Matter-Materials Engineering Newsletter,2010,1:4-6.
[9]Chisti Y. Biodiesel from microalgae beats bioethanol[J]. Trends in Biotechnology,2008,26(3):126-131.
[10]Jiang Y,Fan K W,Tsz-Yeung Wong R,et al. Fatty acid composition and squalene content of the marine microalga Schizochytrium mangrovei[J]. Journal of Agricultural and Food Chemistry,2004,52(5):1196-1200.
[11]Iwamoto H. 11 Industrial Production of Microalgal Cell-mass and Secondary Products-Major Industrial Species[J]. Handbook of Microalgal Culture:Biotechnology and Applied Phycology,2004:255.
[12]Chantanachat S,Bold H C. Some algae from arid soils[M]. Texas:University of Texas,1962.
[13]Tornabene T G,Holzer G,Lien S,et al. Lipid composition of the nitrogen starved green alga Neochloris oleoabundans[J]. Enzyme and Microbial Technology,1983,5(6):435-440.
[14]王冬琴. 微藻油脂湿法提取技术研究[D].湛江:广东海洋大学,2013:6.
[15]Wang H,Zhang W,Chen L,et al. The contamination and control of biological pollutants in mass cultivation of microalgae[J]. Bioresource Technology,2013,128:745-750.
[16]王海英,裴国凤,杨柳. 2株污染小球藻的除菌技术[J]. 水生态学杂志,2010,3(4):146-149.
[17]唐颖,王长海,李克锦,等. 杜氏盐藻无菌纯化研究[J]. 大连理工大学学报,2010(6):871-876.
[18]王逸云,王长海. 小球藻基因工程选择标记研究[J]. 大连理工大学学报,2007,47(4):509-514.
[19]Li Y,Horsman M,Wang B,et al. Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans[J]. Applied Microbiology and Biotechnology,2008,81(4):629-636.
[20]Eguchi K,Nagase H,Ozawa M,et al. Evaluation of antimicrobial agents for veterinary use in the ecotoxicity test using microalgae[J]. Chemosphere,2004,57(11):1733-1738.
[21]周文礼,王悠,肖慧,等. 不同海洋饵料微藻对抗生素的敏感性差异分析[J]. 武汉大学学报:理学版,2007,53(2):249-254.
[22]黄健,宫相忠. 链霉素对海洋微藻的毒物刺激效应[J]. 青岛海洋大学学报:自然科学版,2000,30(4):642-644.
[23]杨芳芳,李爱芬,万凌琳,等. 6 种微藻对氯霉素和硫酸新霉素敏感性研究[J]. 生物技术,2012,22(2):58-63.
[24]李杰,黄洁虹,俞梅敏,等. G418 和氯霉素作为转基因盐藻的抗生素筛选标记[J]. 生物技术,2003,13(3):22-23.
Research on the sensitivity ofNeochlorisoleoabundansto four antibiotics
ZHANG Xi,LI Yan-qun*,LU Shao-xia,ZHONG Min,HU Xue-qiong,YANG Qing-feng,YANG Hui-min
(Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Key Laboratory of Advanced Processing of quatic Products of Guangdong Higher Education Institution,College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China)
In order to study the sensitivity of theNeochlorisoleoabundansto cloramphenicol,penicillin,streptomycin and tetracycline,the growth of algal cells was observed in the media with the antibiotics at the concentrations of 10,25,100 and 500 μg/mL under liqid culture and agar medium plates. The results revealed that all these four kinds of antibiotics could inhibit the growth of alga cells. Among the four antibiotics,streptomycin had a severe inhibition to the alga growth as the completely inhibiting concentration was 10 μg/mL,while the inhibition concentrations of chloramphenicol and tetracycline were 100 μg/mL. However,penicillin behaved inhibition only when the concentration of it reached to 500 μg/mL. The data analysis showed that the half inhibitory concentrations of streptomycin,tetracycline,cloramphenicol and penicillin were 0.25,72,119 and 164 μg/mL respectively. Under solid culture,the inhibition concentrations of streptomycin,chloramphenicol and tetracycline were 10,100 and 100 μg/mL respectively,while penicillin behaved no significant inhibition effection on the alga growth.
Neochlorisoleoabundans;antibiotic;microalgae;sensitivity
2016-01-06
张茜(1989-),女,硕士研究生,研究方向:海洋生物活性物质研究,E-mail:493605980@qq.com。
李雁群(1963-),男,博士,教授,研究方向:发酵工程,E-mail:liyq2004@126.com。
广东省国际合作项目(2011B050400027);广东海洋大学引进人才启动项目(1112096)。
TS201.1
A
1002-0306(2016)14-0154-05
10.13386/j.issn1002-0306.2016.14.022

