大粒车前子苯乙醇苷提取物的精制及降血尿酸作用
皮璟渔,苏 昱,李 娅,罗 成,邹 彬,万 茵,*,谢明勇
(1.南昌大学,食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330031;3.江西省药物研究所,江西南昌 330029)
大粒车前子苯乙醇苷提取物的精制及降血尿酸作用
皮璟渔1,2,3,苏昱1,2,李娅1,2,罗成1,2,邹彬1,2,万茵1,2,*,谢明勇1,*
(1.南昌大学,食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330031;3.江西省药物研究所,江西南昌 330029)
研究了大孔吸附树脂对大粒车前子苯乙醇苷粗提物的富集纯化效果,并探讨了苯乙醇苷精制物调节高尿酸血症大鼠的血尿酸水平的作用。经过比较HPD400、HPD400A等9种树脂苯乙醇苷的吸附解吸效果,最终选择HPD400A树脂来精制苯乙醇苷提取物。当层析树脂柱径高为1.00 cm×33.50 cm时,优化后的富集纯化条件为:粗提物上样液质量浓度为10.3 mg/mL,吸附流速为2.7 mL/min,解吸流速为3.5 mL/min,解吸剂为30%乙醇水溶液,解吸剂体积为400 mL。从500 g车前子原料中可得到总苯乙醇苷含量达80%的精制物3.07 g,得率为0.61%。经大鼠经口给药实验表明,苯乙醇苷粗提物和精制物均能显著降低血尿酸水平和黄嘌呤氧化酶活性,且与模型组相比差异显著(p<0.01)。
大粒车前子,苯乙醇苷类,大孔吸附树脂,纯化,血尿酸水平
长期嘌呤代谢紊乱或尿酸排泄减少会导致血中尿酸增高并在体内关节等处形成尿酸盐沉积,当血清尿酸值≥416 μmol/L,则称为高尿酸血症(Hyperuricemia),严重者即引起痛风。治疗高尿酸血症一般采用促进尿酸排泄和抑制尿酸合成这两条途径,但是目前临床用药多数毒副作用强,对人体机能损伤较大。因此从安全的保健植物资源中分离获得天然功效成分,对于开发预防高尿酸血症和痛风的保健食品、筛选高尿酸血症和痛风患者的辅助治疗膳食具有重大意义。
大粒车前子为车前科(Plantaginaceae)车前属(generaPlantago)植物大粒车前(PlantagoasiaticaL.)的干燥成熟种子,《神农本草经》将其记载为药用上品,且是国家卫生部认可的可用于保健食品物品。相关文献表明,车前草醇提物可明显降低急性高尿酸血症小鼠的血尿酸水平[1],车前子水煎液可明显降低高尿酸大鼠的血尿酸水平[2],并探讨了车前子醇提物对高尿酸血症小鼠血清尿酸水平的影响及降尿酸的作用机制[3],但均未明确指出其中降血尿酸的有效成分为何种物质。
苯乙醇苷类化合物(Phenylethanoid glycosides)是车前子中活性化合物,是由苯乙醇基与酰基基团或单糖结合到糖苷上所形成,具有免疫调节、抗氧化、抗炎、抗病毒、抗诱变、抗菌、抗肿瘤、增强记忆、抗血小板、保肝强心等生物特性[4-7]。据报道车前的种子中含有大车前苷、异大车前苷、类叶升麻苷、异类叶升麻苷、去鼠李糖类叶升麻苷、地黄苷、毛蕊花苷及其异构体等苯乙醇苷类[8]。本实验室利用制备液相色谱从大粒车前子中分离得到类叶升麻苷和异类叶升麻苷,并建立了RP-HPLC法同时检测车前子中这两种物质的方法[9]。
大孔树脂对有机质有较好的选择性,在浓缩、分离过程中不受无机盐、强离子小分子化合物的干扰,且理化性质稳定,在酸、碱及有机溶剂中不溶解。所以大孔树脂常用于分离皂苷类、黄酮类、苯乙醇苷类物质,而且分离效果较好。在顾家珲等[10]的研究中,DA-201树脂对肉苁蓉中苯乙醇苷纯化后,其纯度为51.2%;相似的结果也出现在邱建国等[11]的研究中,用XDA-1树脂纯化独一味水提物后,得到苯乙醇苷的含量为56.56%。
本实验以富集车前子苯乙醇苷为目的,从多种树脂中筛选出最合适的大孔吸附树脂,优化纯化工艺条件,得到苯乙醇苷精制物,通过评价血清尿酸(SUA)、血清肌酐(SCr)、血尿素氮(BUN)和肝脏黄嘌呤氧化酶活性(XOD)等生理指标,探讨大粒车前子来源的苯乙醇苷类物质对高尿酸血症型大鼠的作用效果和机制。
1 材料与方法
1.1材料与仪器
大粒车前子购自江西省吉安地区,经南昌大学付桂明教授鉴定为大粒车前子(Seeds ofPlantagoasiaticaL.);雄性SD大鼠35只,体重200~220 g,湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2009-0004;毛蕊花苷标准品中国药品生物制品检定所;大孔吸附树脂HPD100、HPD100A、HPD400、HPD400A、HPD720、BEHP-2沧州宝恩化工有限公司;大孔吸附树脂AB-8南开大学树脂厂;大孔吸附树脂NKA-2、NKA-9天津市海光化工有限公司;氧嗪酸钾盐Sigma-Aldrich公司;98%别嘌呤醇上海晶纯试剂有限公司;尿酸(SUA)、尿素氮(BUN)、肌酐(SCr)和黄嘌呤氧化酶(XOD)试剂盒南京建成生物工程研究所;肝素钠上海晶纯试剂有限公司;甲醇色谱纯,国药集团化学试剂有限公司;其他试剂均为国产分析纯,天津市永大化学试剂有限公司。
Agilent 1290液相色谱仪美国Agilent公司;UV-7504单光束紫外-可见分光光度计上海精科实业有限公司;TU-1900双光束紫外分光光度计北京普析通用仪器有限责任公司;RE-52旋转蒸发仪上海亚荣生化仪器厂;PY-150S-11数控摇床汇城科技生物公司;FD-1D-50型真空冷冻干燥机北京博医康医疗器械有限公司;DFY-500摇摆式高速万能粉碎机温岭市林大机械有限公司;HL-2D恒流泵上海青浦沪西仪器厂。
1.2实验方法
1.2.1苯乙醇苷粗提液的制备精密称取5 g粉碎后的车前子粉末置于圆底烧瓶内,加入70%乙醇溶液进行超声提取(温度58 ℃,液料比26 mL/g,超声时间34 min,功率200 W),过滤,滤液减压浓缩至100 mL。
1.2.2苯乙醇苷含量的检测采用毛蕊花苷为标准品绘制标准曲线。精密称取10 mg毛蕊花苷标准品于10 mL容量瓶内,用色谱级甲醇稀释至刻度,摇匀,得到浓度为1.0 mg/mL的标准液。然后依次吸取1.0、2.0、2.5、3.0 mL于4个10 mL容量瓶,定容,得到浓度分别为0.10、0.20、0.25、0.30 mg/mL的标准液。分别吸取此系列标准液各400 μL,依次加入0.5 mol/L盐酸溶液2 mL、10%亚硝酸钠溶液0.4 mL、10%钼酸钠溶液1.6 mL和2 mol/L氢氧化钠溶液2 mL,蒸馏水定容至10 mL,摇匀,静置,显色10 min后在525 nm下读取吸光度值并以吸光度值为纵坐标、毛蕊花苷浓度为横坐标绘制标准曲线[12]。得到线性方程为A=1.0918 C-0.0582(R2=0.9991),当毛蕊花苷质量浓度在0.1~1.0 mg/mL范围内质量浓度与吸光度呈现良好的线性关系。
将标准溶液替换为粗提液,按上述步骤可测得粗提液吸光度,利用回归方程计算粗提液中苯乙醇苷的含量。
1.2.3树脂的选择
1.2.3.1吸附量的测定称取经预处理的树脂各1 g于250 mL具塞三角瓶中,加入稀释后的苯乙醇苷粗提液50 mL(总苯乙醇苷含量C0为23.50 μg/mL),置于恒温摇床中,在25 ℃、120 r/min的条件下均匀吸附24 h,过滤,定容至50 mL,测定苯乙醇苷的浓度C1,计算吸附量Q1和吸附率:
Q1=(C0-C1)×50
式(1)
吸附率(%)=(C0-C1)/C0×100
式(2)
1.2.3.2解吸率的测定上述吸附饱和的各种树脂,分别投入50 mL 80%乙醇溶液中,在25 ℃、120 r/min的条件下振摇24 h,过滤,测定解吸液中苯乙醇苷的浓度C2和体积V2计算解吸率:
解吸率(%)=(C2×V2)/Q1×100
式(3)
1.2.3.3静态动力学吸附曲线的绘制选取吸附解吸效果最佳的树脂,上样后测定树脂在1、2、3、4、5、6、24 h时的吸附率,以时间为横坐标、吸附率为纵坐标作图,得到静态动力吸附曲线。
1.2.4树脂富集纯化条件优化
1.2.4.1上样液浓度的选择大孔吸附树脂装柱(层析柱径高为1.0 cm×33.5 cm),以2.7 mL/min的吸附流速分别上质量浓度为5.0、7.7、10.3、13.3 mg/mL的苯乙醇苷粗提液50 mL,采用1.2.2方法测定流出液中剩余的苯乙醇苷的含量,比较吸附率。
1.2.4.2吸附流速的选择分别以2.0、2.7、3.5、4.2 mL/min的吸附流速上样,上样体积为50 mL,质量浓度为10.3 mg/mL,测定流出液中剩余的苯乙醇苷的含量,比较吸附率。
1.2.4.3解吸剂的选择苯乙醇苷粗提液质量浓度10.3 mg/mL,上样体积50 mL,上样流速2.7 mL/min,上样后静置1 h以吸附完全,用蒸馏水洗脱杂质后,分别用10%、30%、50%、100%的乙醇水溶液进行洗脱,测定各洗脱液中的苯乙醇苷含量,比较解吸率。
1.2.4.4解吸流速的选择上质量浓度为10.3 mL/g苯乙醇苷粗提液50 mL,上样流速2.7 mL/min,上样后静置1 h待树脂吸附完全后,用蒸馏水洗脱杂质,选用30%乙醇水溶液分别以2.0、2.7、3.5、4.2 mL/min的流速洗脱,测定各洗脱液中苯乙醇苷的含量,比较解吸率。
1.2.4.5苯乙醇苷洗脱曲线的绘制以2.7 mL/min的流速上10.3 mg/mL苯乙醇苷粗提液50 mL的样品,静置吸附1 h后,蒸馏水洗脱杂质,然后用30%乙醇溶液进行洗脱,按10 mL/管收集洗脱液,采用超高效液相色谱法测定每管洗脱液中苯乙醇苷的含量,绘制洗脱曲线。
例2 取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是( )。
1.2.4.6苯乙醇苷纯化后的检测收集苯乙醇苷洗脱液,55 ℃旋蒸除醇,冻干,得到粉末状苯乙醇苷精制物。取适量用水溶解,用超高效液相色谱仪检测纯度,色谱条件:Agilent 1290+DAD,Agilent C18(10 mm×1.8 mm)色谱柱,柱温25 ℃,流动相:A(甲醇),B(超纯水),梯度洗脱条件:0 min,A∶B为20%∶80%;3 min,A∶B为30%∶70%;4 min,A∶B为40%∶60%;流速0.20 mL/min,进样量1 μL,压力260 bar,检测波长330 nm。
1.2.5动物实验
1.2.5.1实验分组及给药方法SD大鼠购入后,经7 d适应期,再按体重随机分为7组,每组5只,分别为正常对照组、模型组、别嘌呤醇组、苯乙醇苷精制物低剂量组、苯乙醇苷精制物高剂量组、苯乙醇苷粗提物低剂量组、苯乙醇苷粗提物高剂量组。实验期内,正常对照组和模型组用蒸馏水灌胃,别嘌呤醇组按照10 mg/kg体重进行灌胃,精制物低剂量组和粗提物低剂量组按照每千克大鼠体重用18 mg提取物,即按照18 mg/kg体重进行灌胃,精制物高剂量组和粗提物高剂量组按照每千克大鼠体重用54 mg提取物,即按照54 mg/kg体重进行灌胃,每日一次,连续10 d。
1.2.5.2诱导模型各组大鼠喂养10 d,于第10 d,除正常对照组外,其余各组在灌胃前1 h用浓度1.50 g/100 mL的氧嗪酸钾按300 mg/kg体重一次性腹腔注射,诱导建立高尿酸血症模型。
1.2.5.3指标测定建模1 h后,各大鼠按1.2.5.1灌胃给药,再过1 h后,摘取眼球取血,离心分离分别获取血清和血浆。取完血后,脱颈处死大鼠,取肝脏,按试剂盒说明测定血清尿酸(SUA)、血清尿素氮(BUN)、血清肌酐(SCr)和肝脏黄嘌呤氧化酶(XOD)活性指标。
1.3数据处理
实验所得数据均采用SPSS 19.0统计软件进行单因素方差分析,Origin Pro 8对数据进行处理分析及图表绘制。
2 结果与讨论
2.1静态吸附实验筛选树脂
2.2HPD400A静态吸附曲线
从图1可知,HPD400A对苯乙醇苷的吸附在2 h内即达近80%的吸附率,而后随时间延长,吸附率上升缓慢,属于快吸附型。
2.3树脂精制条件优化
2.3.1上样液质量浓度的选择由图2可知,上样液质量浓度在10.3 mg/mL及以下时,吸附率均接近100%,其中以7.7 mg/mL的吸附率最大达到99.90%,表明此浓度范围是在HPD400A的承载吸附量内。另一方面,随着上样液质量浓度的升高,样品的吸附量也随之增加。当上样液质量浓度在13.3 mg/mL时,吸附率出现很明显的下滑,这是因为上样液的苯乙醇苷含量大于树脂的吸附饱和度,这样不仅会造成大量上样液的浪费,还会造成树脂的再生困难的问题。为了让树脂能更加充分的吸收更多的提取液,综合考虑吸附量与吸附率两个因素,故选择上样液的质量浓度为10.3 mg/mL。
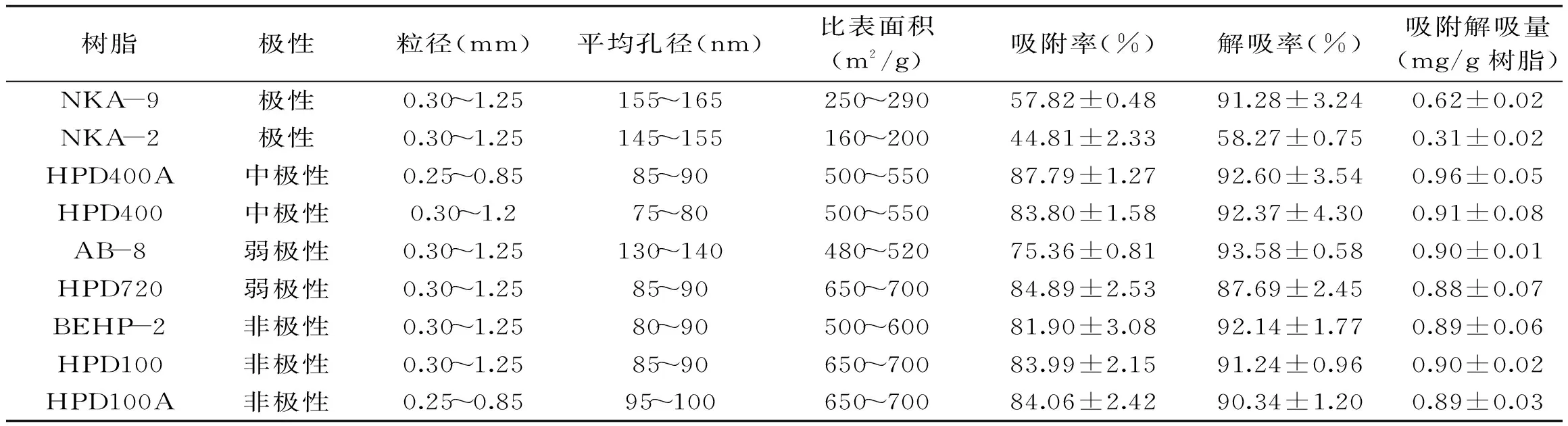
表1 各种树脂的性质及其对苯乙醇苷的吸附解吸性能
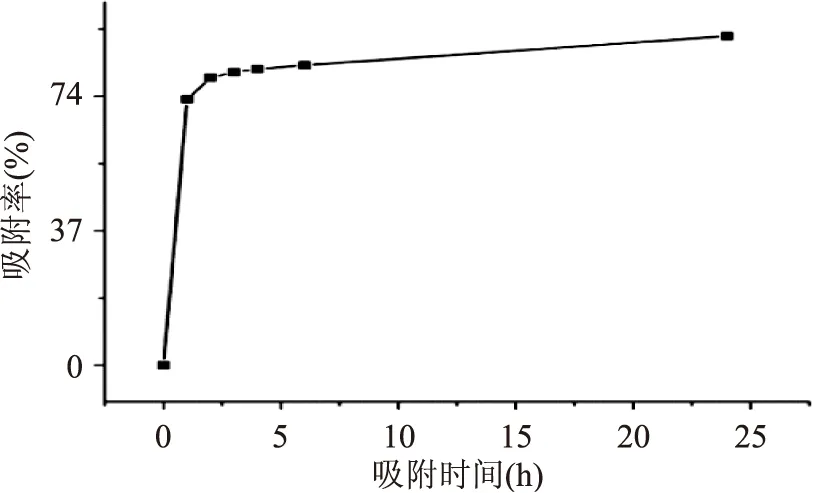
图1 HPD400A树脂对苯乙醇苷静态动力学吸附曲线Fig.1 Dynamic adsorption curve of HPD400A on phenylethanoid glycosides
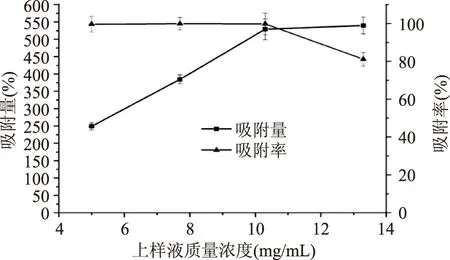
图2 上样液的质量浓度对吸附率的影响 Fig.2 Effect of the concentration of the extract fluid on the adsorption rate
2.3.2吸附流速的选择从图3可知,吸附流速对苯乙醇苷的吸附率影响颇大。当流速控制在2.7 mL/min以内时,HPD400A能充分吸附苯乙醇苷,而当流速增加到2.7 mL/min及以上时,由于流速过快,上样液中的苯乙醇苷物质来不及被树脂吸附就流出柱子,导致吸附率显著下降。2.0 mL/min与2.7 mL/min相比,两者的吸附率相差不大,但是时间却延长很多,从时间效率综合因素考虑,为有利于工厂化生产,选择2.7 mL/min为最佳吸附流速。
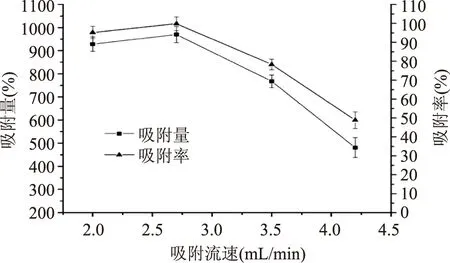
图3 吸附流速对吸附率的影响Fig.3 Effect of adsorption flow rate on the adsorption ratio
2.3.3解吸剂的选择结果见表2。10%乙醇能洗下半数以上被吸附的苯乙醇苷,30%乙醇水溶液能洗脱下约90%的苯乙醇苷,继续提高乙醇浓度对苯乙醇苷洗脱率的提高帮助不大,且增加成本,还会洗脱下被树脂吸附的黄酮类等其他酚类物质,影响苯乙醇苷在精制物中的纯度。为达到较高的苯乙醇苷得率又节约成本的目的,故选用30%乙醇水溶液为解吸剂。

表2 解吸剂对解吸率的影响
2.3.4解吸流速的选择从图4可知,解吸流速从2.0 mL/min升高到3.5 mL/min时,解吸率逐渐增加,表明适当增加流速可以加大解吸率,同时还可防止因解吸时间过长而洗脱出更多的杂质,既节约时间又提高效率。而当流速为4.2 mL/min时,又因流速过快导致解吸不够完全,解吸率略下降。综合比较,选择3.5 mL/min为最佳解吸流速。
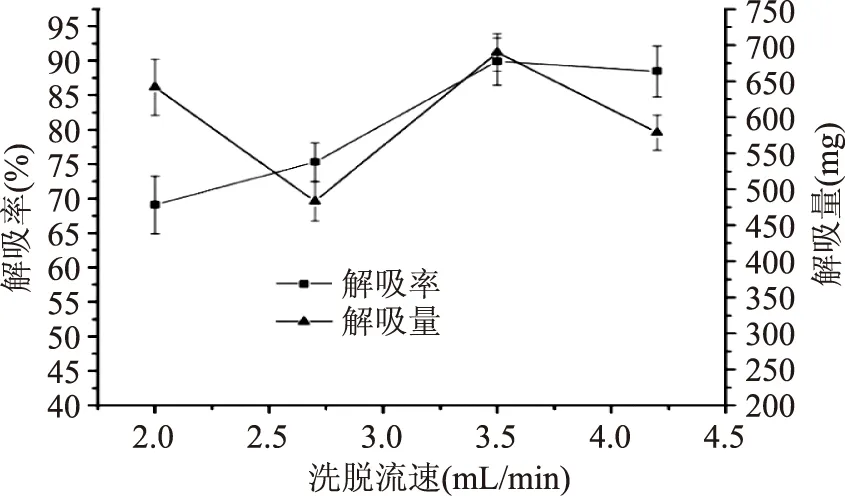
图4 解吸流速对解吸率的影响Fig.4 Effect of desorption flow rate on the desorption rate
2.3.5苯乙醇苷洗脱曲线由图5可知,苯乙醇苷出峰迅速,峰型尖窄,洗脱液体积在200 mL时就已经解吸出绝大部分苯乙醇苷,400 mL以后,洗脱液中苯乙醇苷的含量趋向平稳且接近零。为尽可能得到更多的苯乙醇苷又不浪费试剂,30%乙醇水溶液的适宜用量为400 mL。
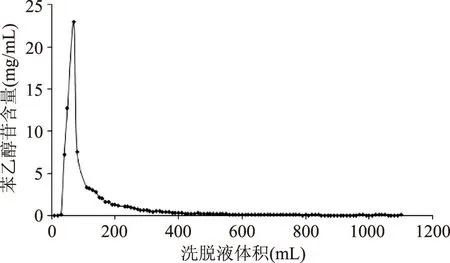
图5 苯乙醇苷洗脱曲线Fig.5 The elution curve of phenylethanoid glycosides

表3 样品对高尿酸血症大鼠各个生理指标的影响(n=5)
注:Δ表示与正常组相比差异显著,p<0.05;ΔΔ表示与正常组相比差异极显著,p<0.01;*表示与模型组相比差异显著,p<0.05;**表示与模型组相比差异极显著,p<0.01。
2.3.6苯乙醇苷精制物及毛蕊花苷的液相谱图大粒车前子原料500 g,超声提取得到车前子提取液100 mL,提取液经HPD400A在上述优化条件下处理,得到苯乙醇苷精制物3.07 g,得率为0.61%。比较精制物和毛蕊花苷标准品的UPLC谱图(图6),精制物组分最高峰的保留时间和紫外吸收光谱与毛蕊花苷标准品基本一致,330 nm下峰面积比为80%;可以推断苯乙醇苷精制物的主要成分为毛蕊花苷。
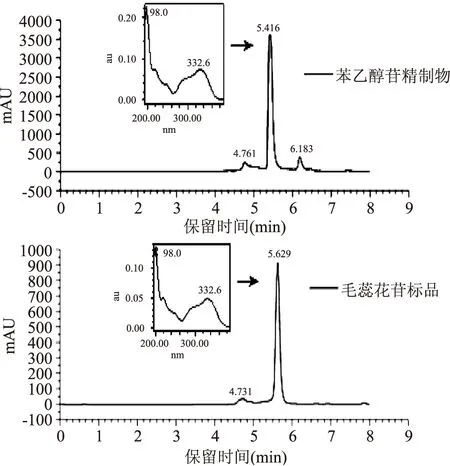
图6 苯乙醇苷精制物和毛蕊花苷标准品的超高效液相色谱图Fig.6 UPLC spectra of phenylethanoid glycosides and acteoside reference substance
2.4动物实验结果
各实验动物组的指标检测结果如表3所示,模型组动物的血清SUA浓度、血清SCr浓度、血清BUN浓度、肝脏XOD活性一直维持在较高水平,与正常对照组相比,差异有统计学意义(p<0.01),表明用氧嗪酸钾诱导建立模型成功。
表3数据表明,苯乙醇苷粗提物和精制物均可有效降低血SUA、BUN和肝XOD活性(p<0.01),且能有效降低血SCr水平,说明苯乙醇苷类物质能在降低血尿酸的同时又起到对肾脏的保护作用,作用途径可能是促进尿酸排泄和抑制尿酸生成,是车前子中降血尿酸水平的主要有效成分。精制物组降血尿酸的效果好于粗提物组,但粗提物组BUN水平低于精制物组,推测或许有车前子其他成分参与了降低BUN水平的作用。
别嘌呤醇组血SCr水平与模型组基本一致,说明给予别嘌呤醇不能明显恢复损伤的肾脏;而尿酸水平显著低于正常组,尿酸具有一定的抗氧化能力[17],特别是抑制DNA损伤的能力,过低的血尿酸水平可能会导致反效果。
3 结论
对大孔吸附树脂纯化苯乙醇苷的树脂类型、上样液质量浓度、吸附流速、解吸液乙醇浓度、解吸流速等影响因素进行了研究,确定了苯乙醇苷粗提物的最佳精制工艺条件:最佳大孔吸附树脂类型是HPD400A,层析树脂柱径高为1.00 cm×33.50 cm时,上样液质量浓度为10.3 mg/mL(上样体积为50 mL),吸附流速为2.7 mL/min,解吸剂为30%乙醇水溶液,解吸流速为3.5 mL/min,解吸剂体积为400 mL。大粒车前子500 g经超声提取、HPD400A大孔吸附树脂吸附纯化、真空冷冻干燥,最后得到苯乙醇苷精制物3.07 g,得率为0.61%,经超高效液相检测330 nm下毛蕊花苷的峰面积比约为80%。苯乙醇苷粗提物和精制物均可有效降低SUA水平和XOD活性水平,显示了苯乙醇苷类物质在预防治疗高尿酸血症上的潜在前景。
车前子具有利尿消炎、改善肾功能的作用,利尿能促进尿酸排泄,抗炎消肿可以抑制尿酸结晶的炎症反应过程,因此,从车前子中提取苯乙醇苷对提供有效的高尿酸血症治疗方案和膳食辅助治疗手段具有重要意义。
[1]钱莺,傅旭春,王建平. 车前草降血尿酸有效成分提取工艺的研究[J]. 浙江大学学报:理科版,2010,37(5):560-563.
[2]郑璇,孙红. 车前子对Wistar高尿酸大鼠降尿酸的机制研究[J]. 福建中医药,2010,41(6):52-53.
[3]曾金祥,魏娟,毕莹,等. 车前子醇提物降低急性高尿酸血症小鼠血尿酸水平及机制研究[J]. 中国实验方剂学杂志,2013,19(9):146-150.
[4]Korkina L G. Phenylpropanoids as naturally occurring antioxidants:from plant defense to human health[J]. Cellular and Molecular Biology,2007,53(1):15-25.
[5]Miyazawa M,Hisama M. Antimutagenic activity of phenylpropanoids from clove(Syzygiumaromaticum)[J]. J Agric Food Chem,2003,51(22):6413-6422.
[6]Arthur H,Joubert E,De Beer D,et al. Phenylethanoid glycosides as major antioxidants inLippiamultifloraherbal infusion and their stability during steam pasteurisation of plant material[J]. Food Chemistry,2011,127(2):581-588.
[7]Amakura Y,Yoshiaki A,Yoshimura M,et al. Isolation and characterization of phenolic antioxidants fromPlantagoherb[J]. Molecules,2012,17(5):5459-5466.
[8]万茵. 车前子多糖、黄酮和苯乙醇苷类的纯化、结构解析及其活性功能研究[D]. 南昌:南昌大学,2007.
[9]万茵,谢明勇,何彦林. 反相高效液相色谱法同时测定车前子中的毛蕊花苷和异毛蕊花苷[J]. 天然产物研究与开发,2008,20(3):474-476.
[10]顾家珲,余晓晖,吴蓉,等. 大孔吸附树脂分离纯化肉苁蓉中苯乙醇苷工艺研究[J]. 中国现代应用药学,2011,28(11):1006-1009.
[11]邱建国,张泉龙,尉丽力,等. 独一味不同提取物工业化提取分离纯化工艺研究[J]. 中草药,2013,44(15):2067-2074.
[12]Arnow L E. Colorimetric determination of the components of 3,4-dihydroxy phenylalanine tyrosine mixtures[J]. J Biol Chem,1937,118:531-537.
[13]张雷红,堵年生,王青. 紫外分光光度法测定肉苁蓉总苷胶囊中苯乙醇苷类的含量[J]. 新疆医科大学学报,2002,25(4):407-408.
[14]胡季强,王如伟,吕桑. 大孔树脂分离纯化延胡索总生物碱的工艺研究[J]. 中国现代应用药学,2009,26(4):271-273.
[15]靖会,佐建锋,李教社. 苯乙醇苷类化合物的药理研究进展[J]. 时珍国医国药,2006,17(3):440-441.
[16]Jimenez C,Riguera R. Phenylethanoid glycosides in plants:structure and biological activity[J]. Natural Product Reports,1995,11(4):591-606.
[17]Stinefelt B,Leonard S S,Blemings K P,et al. Free radical scavenging,DNA protection,and inhibition of lipid peroxidation mediated by uric acid[J]. Ann Clin Lab Sci,2005,35(1):37-45.
Purification and serum uric acid level reducing effect of phenylethanoid glycosides extract from seeds ofPlantagoasiaticaL.
PI Jing-yu1,2,3,SU Yu1,2,LI Ya1,2,LUO Cheng1,2,ZOU Bin1,2,WAN Yin1,2,*,XIE Ming-yong1,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Food College of Nanchang University,Nanchang 330031,China;3.Jiangxi Institute of Pharmaceutical Research,Nanchang 330029,China)
Crude extract of phenylethanoid glycosides from seeds ofPlantagoasiaticaL. was enriched and purified by macroporous adsorption resins and the effect of refined phenylethanoid glycosides on serum uric acid level in hyperuricemic rats was explored. Resin HPD400A was selected as the refining resin by comparing the adsorption and desorption effect of 9 kinds of macroporous resin on phenylethanoid glycosides. When the column diameter and height of chromatography resin was 1.00 cm×33.50 cm,the enrichment and purification conditions were optimized as follows. The sample concentration was 10.3 mg/mL,the absorptive flow rate was 2.7 mL/min,the desorption flow rate was 3.5 mL/min,the desorption agent was 30% ethanol water solution,and the volume of the desorption agent was 400 mL. With optimized conditions,3.07 g of the purified extract contained 80% phenylethanoid glycosides was obtained from 500 g of seeds ofPlantagoasiaticaL. and its yield was 0.61%. The results of hyperuricemic model rat experiment showed that given different doses of crude phenylethanoid glycosides extract or refined extract intragastrically could obviously reduce the rat serum uric acid level and inhibit the rat liver xanthine oxidase activity. The treatment groups had a significant difference(p<0.01)with model group.
seeds ofPlantagoasiaticaL.;macroporous adsorption resins;purification;phenylethanoid glycosides;serum uric acid level
2015-10-26
皮璟渔(1988-),女,硕士,助理研究员,研究方向:食品成分的功能作用,E-mail:197115084@qq.com。
万茵(1976-),女,博士,副教授,研究方向:食品功能成分的开发利用,E-mail:yinwan@ncu.edu.cn。
谢明勇(1957-),男,教授,研究方向:食品功能成分的开发利用,E-mail:myxie@ncu.edu.cn。
国家自然科学基金资助项目(31160316)。
TS201.1
A
1002-0306(2016)12-0339-06
10.13386/j.issn1002-0306.2016.12.056

