蜂胶黄酮的超声波提取工艺优化及其抗氧化活性研究
曾林晖,邓泽元,余修亮,李红艳
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
蜂胶黄酮的超声波提取工艺优化及其抗氧化活性研究
曾林晖,邓泽元,余修亮,李红艳*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
在选择超声波频率的基础上,分别研究了提取时间、超声波功率、超声波占空比和液面高度对蜂胶总黄酮提取得率的影响。再采用响应面法,对超声波辅助提取蜂胶黄酮的工艺进行进一步优化。并对超声波提取的蜂胶黄酮进行抗氧化活性的研究。结果表明,20 kHz聚能超声波对蜂胶黄酮的提取效果最好。其它因素对蜂胶总黄酮得率的影响大小顺序为:超声波占空比>液面高度>提取时间>超声波功率;得到最佳的超声波提取工艺参数为:提取时间18 min,超声功率100 W,占空比75%,液面高度4 cm,蜂胶黄酮得率达到(39.06±0.48) mg/g。此方法提取出的蜂胶黄酮有较强的DPPH自由基清除能力和FRAP抗氧化能力。
超声波,蜂胶,黄酮,响应面法,抗氧化
蜂胶是由蜜蜂(Apismellifera)采集胶源植物的幼芽、树皮等部位分泌的树脂,再混合蜜蜂上颚腺和蜡腺等腺体分泌物及少量花粉混合而成的,是一种具有芳香性气味的胶状物质[1]。蜂胶的主要成分为树脂(55%),蜂蜡(30%),芳香挥发油(10%),花粉(5%)等。目前蜂胶中被鉴定的物质已达300余种,主要有酚酸及其酯类、黄酮类、萜烯类、芳香类、脂肪酸等[2]。蜂胶具有广谱的抗菌活性,对大多数病原菌和病毒都有抵抗作用,并能提高人体免疫力,有“紫色黄金”和“黄酮类化合物的宝库”的美誉[3]。同时,蜂胶还具有抗氧化、抗增殖、抗炎和降脂降糖等作用[4-5],因此被广泛地应用于食品、药品以及化妆品等领域[6]。蜂胶近年来成为保健食品领域研究的热点,对蜂胶中黄酮类化合物的提取研究也具有巨大的经济价值。
目前,常采用乙醇冷浸泡或加热回流提取蜂胶中功能性成分,但这些方法存在耗时长、溶剂使用量大等缺点。同时,过高的提取温度可能破坏蜂胶中功能性物质。超声波在液体介质中能产生空化效应,有效破坏包埋结构的外层,加速内容物的溶出,从而提高提取效率。以往对超声波提取工艺的优化,往往会忽略超声波频率、周期、液面高度的研究,而这些参数的变化会直接影响超声的提取效果。本文以蜂胶为原料,采用超声波提取蜂胶中的黄酮类物质,先对超声波的频率进行选择,然后采用响应面分析法对蜂胶黄酮的提取工艺进行优化,以期获得蜂胶黄酮的最佳提取工艺参数,并对提取的蜂胶黄酮进行抗氧化活性的研究。
1 材料与方法
1.1材料与仪器
蜂胶(Apismellifera)南昌同心紫巢生物工程有限公司提供;芦丁(生化试剂,含量≥95.0%)、DPPH阿拉丁化学试剂有限公司生产;FRAP试剂盒购自碧云天生物技术有限公司;Al(NO3)3、KAc、无水乙醇均为市售分析纯。
SHZ-Ⅲ型循环水式真空泵上海亚荣生化仪器厂;FA2204B电子天平上海精科天美科学仪器有限公司;超声波细胞粉碎机(20 kHz,GA92-ⅡDA)、超声波清洗机(28、40、68 kHz,GA-5200D)无锡上佳生物科技有限公司;722 G型可见分光光度计上海仪电科学仪器股份有限公司;ELx800 光吸收酶标仪美国伯腾仪器有限公司。
1.2实验方法
1.2.1蜂胶预处理 蜂胶经筛选去杂后置于-18 ℃下冷冻12 h,在低温干燥状态下取样,快速粉碎,过200目筛,收集粉末,密封,于-18 ℃保存备用。
1.2.2蜂胶总黄酮提取精密称取2.5 g蜂胶粉末,加入80%乙醇溶液75 mL,按照设定的条件进行超声波辅助提取,提取液经过抽滤后,滤液用乙醇定容于100 mL棕色容量瓶中,待测。
1.2.3总黄酮含量的测定按照GBT 24283-2006标准方法进行测定。
1.2.3.1芦丁标准曲线的绘制精密称取干燥至恒重的芦丁标准品10 mg,用无水乙醇溶解并定容于50 mL容量瓶中。此溶液中芦丁标准品浓度为0.2 mg/mL。精密吸取上述芦丁标准品溶液0.5、1、1.5、2、2.5、3 mL,分别置于25 mL容量瓶中,加95%的乙醇至体积7.5 mL,依次加10% Al(NO3)3溶液0.5 mL、9.8% KAc溶液0.5 mL,摇匀,加蒸馏水定容至刻度。静置1 h后,以30%乙醇溶液为空白对照,用1 cm比色皿于415 nm处测定吸光度。以25 mL容量瓶中芦丁含量为横坐标,吸光度为纵坐标,绘制标准曲线:y=1.182x-0.0202,R2=0.9997。
1.2.3.2黄酮得率的计算精密吸取蜂胶提取液0.5 mL于25 mL容量瓶中,按上述方法测定样品中总黄酮含量。按照以下公式计算得率:

式中:X-由回归方程计算出蜂胶黄酮的浓度(mg/mL);N-稀释倍数;V-提取液体积(mL);M-称取的蜂胶质量(g)。
1.2.4蜂胶总黄酮提取单因素实验分别考察超声波频率、提取时间、功率、超声波周期(占空比)、液面高度对提取率的影响,每次实验重复三次。
1.2.4.1超声波频率和提取时间在乙醇浓度80%、料液比1∶30、功率300 W的条件下,分别考察频率为20、28、40、68 kHz的超声波提取率随时间的变化,并进行无超声波提取实验做为对照组。其中28、40、68 kHz为发散型超声波;20 kHz为聚能型超声波,实验时其占空比设定为50%(超声2 s/间隔2 s)、液面高度为3 cm。
1.2.4.2超声波功率在频率20 kHz、占空比50%(聚能时间2 s)、乙醇浓度80%、料液比1∶30、提取时间20 min、液面高度3 cm的条件下,分别考察功率50、100、200、300、400 W对蜂胶黄酮提取率的影响。
1.2.4.3超声波占空比在频率20 kHz、聚能时间2 s、乙醇浓度80%、料液比1∶30、提取时间20 min、功率300 W、液面高度3 cm的条件下,分别考察占空比20%、33.3%、50%、66.7%、80%对蜂胶黄酮提取率的影响。
1.2.4.4液面高度液面高度是超声探头末端到容器底部的距离。在频率20 kHz、占空比50%(聚能时间2 s)、乙醇浓度80%、料液比1∶30、提取时间20 min、超声功率300 W的条件下,分别考察液面高度1、3、5、7、9 cm对蜂胶黄酮提取率的影响。
1.2.5响应面法优化工艺条件根据Box-Benhnken的中心组合实验设计原理,基于单因素实验结果,以提取时间(A)、超声功率(B)、占空比(C)、液面高度(D)为响应因素,编码水平为-1、0、1,蜂胶黄酮提取率(Y)为响应值,采用四因素三水平的响应面分析法进行实验设计,因素水平设计见表1。
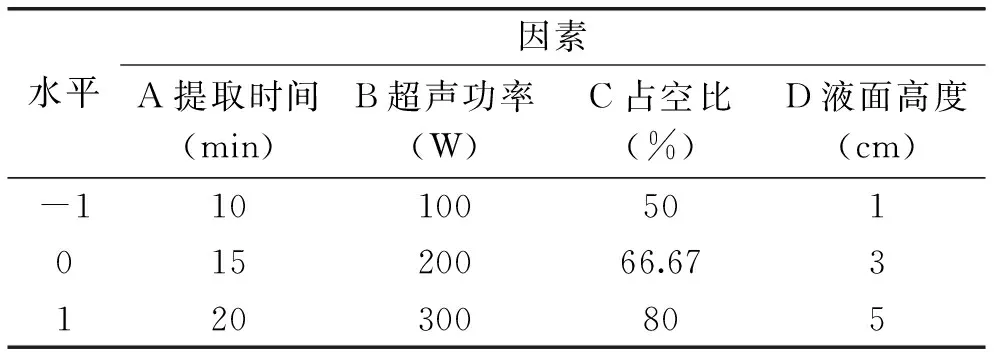
表1 响应曲面实验因素水平设计
1.2.6抗氧化活性的研究
1.2.6.1DPPH自由基清除率的测定[7]分别检测5、10、15、20、25、30 μg/mL总黄酮浓度的蜂胶黄酮提取液对0.2 mmol/L DPPH溶液的自由基清除率。以Trolox(5、10、15、20、25、30 μg/mL)作为阳性对照。分别确定达到同一自由基清除率时Trolox和蜂胶黄酮的浓度,浓度越低表明其清除自由基的能力越强,即其抗氧化能力越强。
准确吸取100 μL的蜂胶黄酮提取液,加入100 μL 0.2 mmol/L的DPPH溶液,37 ℃避光静置30 min,以甲醇为空白,用酶标仪测定吸光值A517。按下列公式计算自由基清除率,以清除率为纵坐标,蜂胶黄酮浓度为横坐标,Trolox作为阳性对照:

式中:A样品为样品吸光值;A空白为空白液吸光值。
1.2.6.2FRAP抗氧化能力的测定[8]分别检测50、75、125、250、400、500 μg/mL的Trolox以及50、75、125、250、400、500 μg/mL的蜂胶黄酮提取液在593 nm处的吸光值,并绘制对照品Trolox和蜂胶黄酮的还原力曲线。当达到同一吸光值时所需的样品浓度越小,表示还原力越强,即抗氧化能力越强。
准确吸取180 μL的FRAP工作液,加入5 μL的蜂胶黄酮提取液,37 ℃孵育3 min后,用酶标仪测定吸光值A593。以A593为纵坐标,蜂胶黄酮浓度为横坐标作图。Trolox为阳性对照。
1.3数据处理
所有数据均为3次重复实验的平均值,通过运用Excel、OriginPro 9.0 数据处理软件和Design-Expert 8.05统计软件进行数据分析。
2 结果与分析
2.1单因素实验结果与分析
2.1.1超声波频率和超声时间由图1可知,随提取时间的增加,四种不同频率超声波的蜂胶黄酮提取率在短时间内都快速提高,而后趋于稳定,提取速率显著高于浸泡组。发散超声波呈现出提取率随频率降低而升高的趋势,这可能是由于超声波的频率越低,空化作用越强,溶剂分子和物料表面的相互作用越剧烈,加快了溶剂分子扩散到物料内部的速率,从而加速黄酮类物质的溶出[9-10]。聚能超声波比发散超声波具有更快的提取速率和更高的提取率。发散超声波在30 min时达到最高提取率,而聚能超声波在15 min时就具有较好提取效果。Zhongli Pan[11]等比较了频率为20 kHz的聚能超声波和发散超声波对石榴皮中抗氧化物质的影响,结果表明两种超声波都具有较好的提取效果,但是聚能超声波消耗更低的能量。因此,从提取率和节约能源方面考虑,选定20 kHz的聚能超声波进行提取,选择15 min超声时间为最佳提取时间。
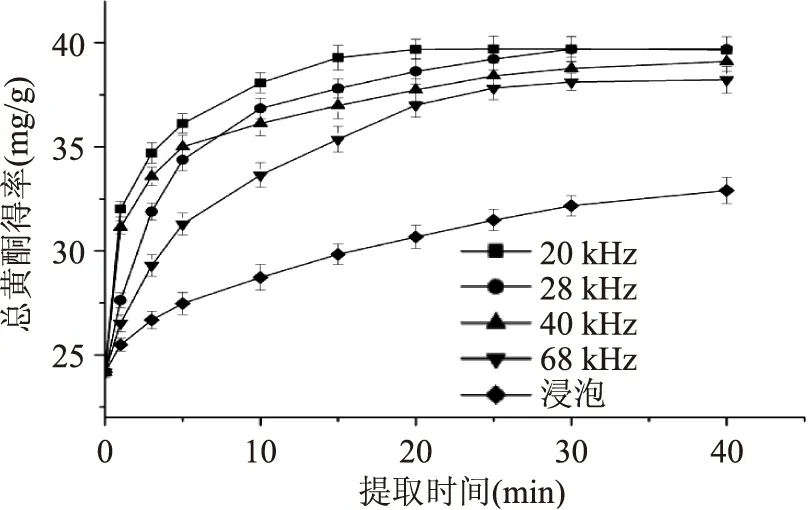
图1 超声波频率和提取时间对黄酮提取率的影响Fig.1 Effect of ultrasound frequency and extraction time on flavonoid extraction yield
2.1.2超声波功率由图2可知,随超声波功率的增加,黄酮提取率呈现先升高后降低的趋势,在200 W时达到最大值。这可能是由于当超声功率在0~200 W范围内时,空化泡的形成随功率的升高而变得更容易,并且空化泡的崩解也随功率的升高而变得更加剧烈;当功率超过200 W后,空化泡增长的过大,以至于不能崩解或者很脆弱的崩解,大大降低了空化作用的效果,并且过多的空化泡也会阻碍超声波的传播[12]。此外,当超声波的功率处于较高的水平时,其热效应也非常显著,使得反应体系的温度急剧升高,将加速溶剂乙醇的挥发,降低了提取效果[13]。因此,选定超声波功率为200 W。
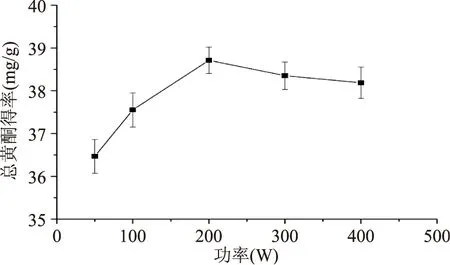
图2 超声波功率对黄酮提取率的影响Fig.2 Effect of ultrasound power on flavonoid extraction yield
2.1.3超声波占空比由图3可知,随占空比不断提高,蜂胶黄酮提取率呈现先增高后降低的趋势,在占空比为66.67%时达到最大值。当占空比在20%~66.67%范围内增加时,累积超声时间不断增加,提取率不断升高。当占空比高于66.67%时,由于超声波的持续作用,热效应开始凸显,导致溶液温度不断升高,乙醇迅速挥发,因而降低了提取效果。Herrera[14]等用超声波来提取树莓中的酚类化合物时也发现占空比对结果具有显著的影响。所以,选择66.67%为最优占空比。

图3 超声波占空比对黄酮提取率的影响Fig.3 Effect of ultrasound duty cycle on flavonoid extraction yield
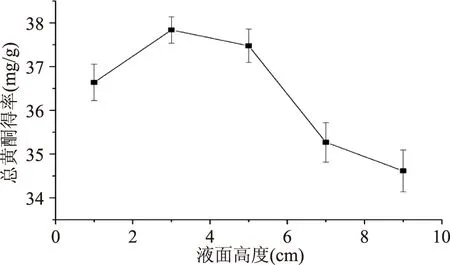
图4 液面高度对黄酮提取率的影响Fig.4 Effect of liquid height on flavonoid extraction yield
2.1.4液面高度由图4可见,提取率随液面高度的增加呈现先升高后降低的趋势,在液面高度为3 cm时达到最大值。当液面高度在1~3 cm范围内增加时,超声波变幅杆在溶液中的辐射面积不断增加,空化作用不断增强,使得提取率不断升高;当液面高度超过3 cm时,提取率随液面高度的升高而显著降低,可能的原因是随着液面高度的增加,辐射面不断增大,超声波慢慢的被吸收和消散,这将导致空化作用的强度降低[15]。因此,选定超声波的最佳液面高度为3 cm。
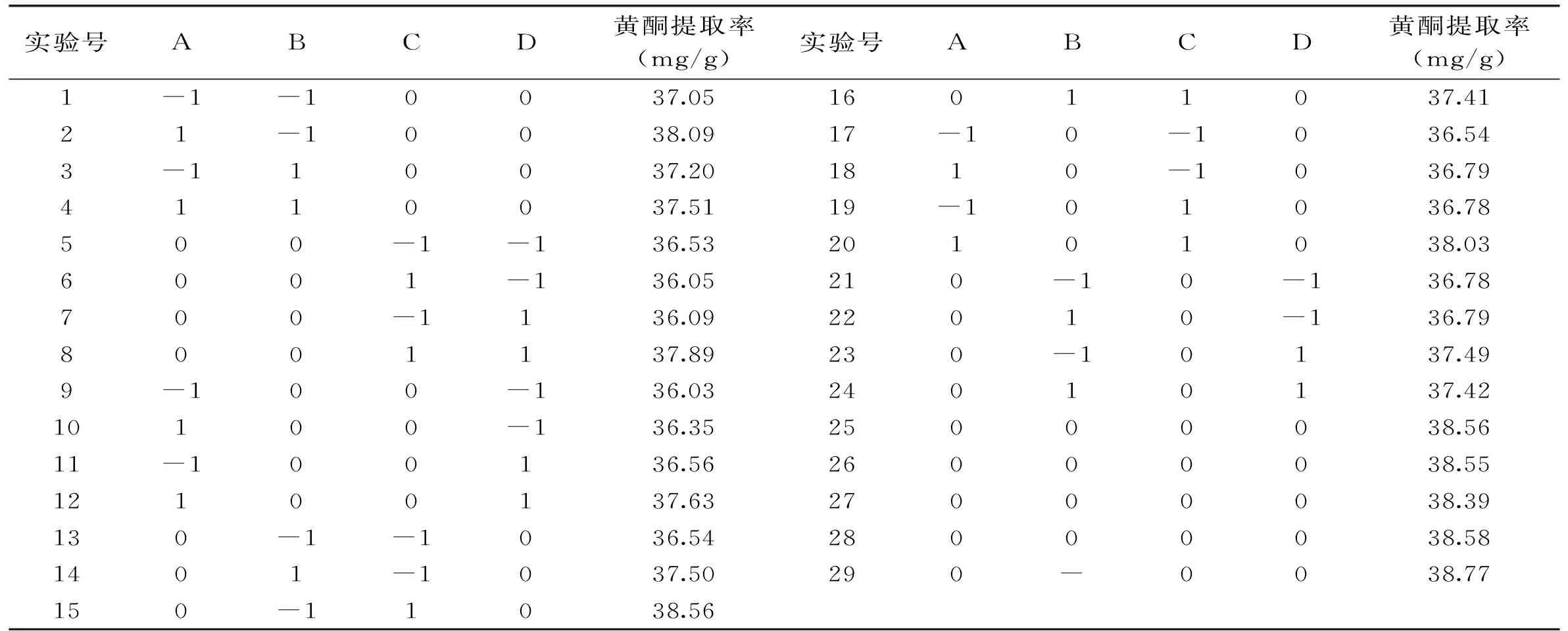
表2 Box-Benhnken实验设计和结果
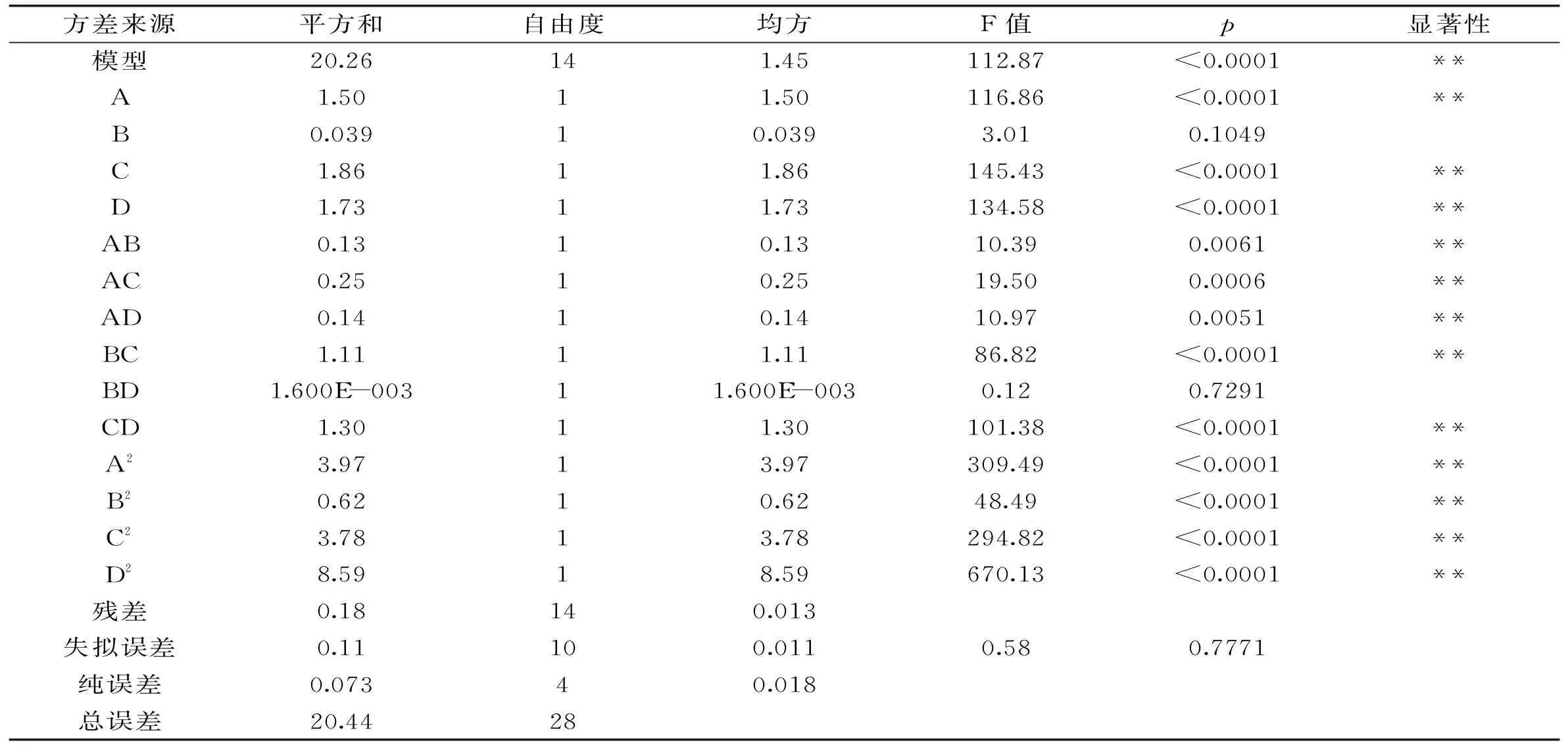
表3 回归模型的方差分析
2.2响应面分析
2.2.1响应面设计方案选取超声时间(A),超声功率(B),占空比(C),液面高度(D)四个因素作为自变量,以蜂胶黄酮提取率作为响应值。Box-Benhnken实验设计与结果如表2所示。
2.2.2方差分析及显著性检验用软件Design-Expert.8.05对所得数据进行回归分析,分析结果如表3所示。对各因素进行回归拟合,得到回归方程:
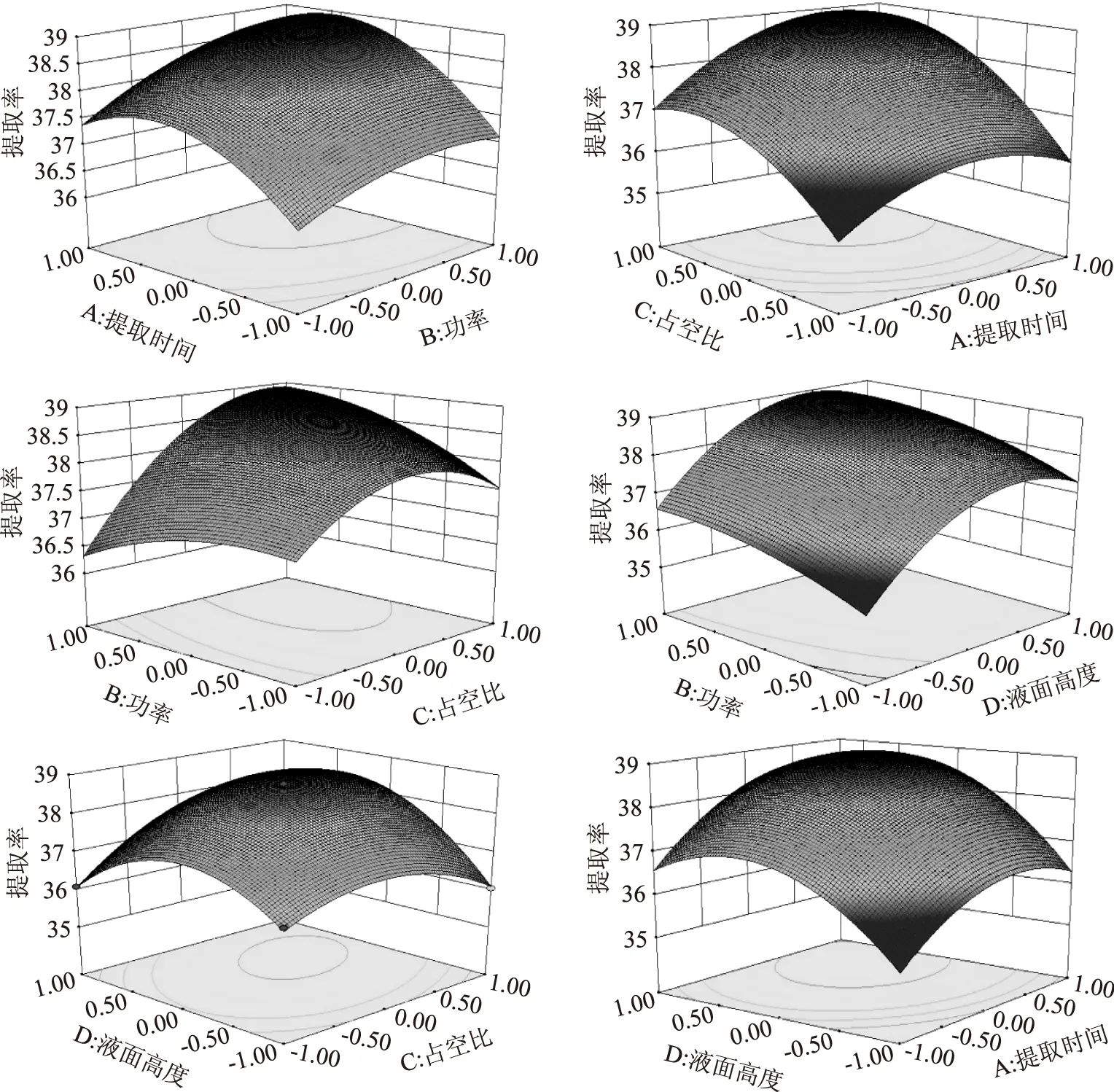
图5 超声提取时间(A),超声功率(B),占空比(C),液面高度(D)对蜂胶黄酮提取率的影响Fig.5 Effect of ultrasound extraction time(A),ultrasound power(B),duty cycle(C),liquid height(D)on extraction yield of flavonoids
蜂胶黄酮提取率(mg/g)=+38.57+0.35A-0.057B+0.39C+0.38D-0.18AB+0.25AC+0.19AD-0.53BC-0.02BD+0.57CD-0.78A2-0.31B2-0.76C2-1.15D2
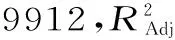
图5是各因素间交互作用的响应曲面3D分析图,等高线的形状可反映出交互作用的强弱,等高线呈椭圆形表示两因素交互作用显著,而圆形则表示不显著,同时有闭合的圆或椭圆表示有最大值。
2.2.3最优工艺条件的确定与模型验证通过Design-Expert.8.05软件对回归方程进行计算,得到超声波辅助提取蜂胶黄酮最佳工艺条件,即采用频率20 kHz的聚能超声波,在提取时间为17.60 min,超声功率103 W,占空比76.84%,液面高度3.84 cm的条件下,得到最高的黄酮得率为38.94 mg/g。考虑到实际条件的可操作性,将最佳工艺条件调整为:超声提取时间18 min,超声功率100 W,占空比75%,液面高度4 cm。为验证结果的可靠性,采用上述优化出的工艺参数进行3次重复实验,得到蜂胶黄酮的实际得率为(39.06±0.48)mg/g。说明所得回归方程对蜂胶黄酮提取率进行分析和预测非常可靠,具有一定的实践指导意义。
2.2.4蜂胶黄酮抗氧化活性测定
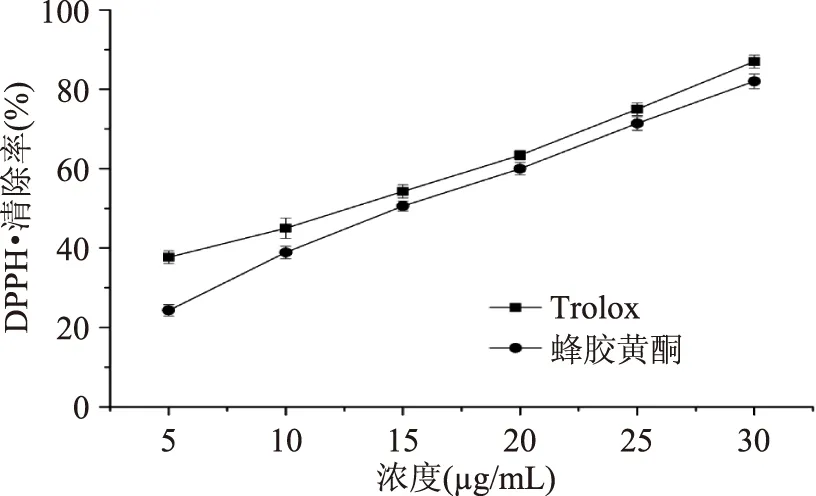
图6 Trolox和蜂胶黄酮对DPPH·的清除能力Fig.6 DPPH· radical scavenging activity of Trolox and propolis flavonoids
2.2.4.1DPPH·清除能力测定由图6可知,一定浓度范围内,DPPH·的清除率随蜂胶黄酮和Trolox浓度的增加而增大,呈现一定的量效依赖关系。在相同浓度下,Trolox比蜂胶黄酮的清除率要强。当清除率达到60%时,所需的Trolox和蜂胶黄酮的浓度分别为18和21 μg/mL。由此可知,蜂胶黄酮具备一定的DPPH·清除能力,但稍弱于Trolox。
2.2.4.2FRAP抗氧化能力测定由图7可知,一定浓度范围内,Trolox和蜂胶黄酮的总抗氧化能力随浓度的增加而增大,呈现一定的量效依赖关系。在相同浓度下,Trolox比蜂胶黄酮的清除率要强。当吸光值达到0.6时,所需的Trolox和蜂胶黄酮的浓度分别为250和330 μg/mL,可见蜂胶黄酮具有较强的FRAP抗氧化能力,但弱于Trolox。
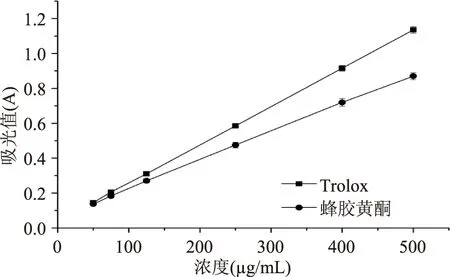
图7 Trolox和蜂胶黄酮总抗氧化能力测定Fig.7 Total antioxidant activity of Trolox and propolis flavonoids
3 结论
本实验对超声波辅助提取蜂胶黄酮过程中的不同工艺参数进行了优化。选定了合适的超声波频率,通过响应曲面法建立了超声波辅助提取蜂胶黄酮的二次多项式数学模型,得到了超声波提取蜂胶黄酮的最佳工艺,并进行蜂胶黄酮抗氧化活性的研究。实验结果表明,超声提取时间、超声波功率、超声波占空比和液面高度对蜂胶黄酮提取率影响的大小关系是:占空比>液面高度>超声提取时间>超声功率。优化出的超声波辅助提取蜂胶黄酮的最佳工艺条件为:超声波频率为20 kHz,超声提取时间18 min,超声功率100 W,占空比75%,液面高度4 cm,此条件下蜂胶黄酮的实际得率为(39.06±0.48)mg/g。超声波提取得到的蜂胶黄酮具有较强的DPPH自由基清除能力和FRAP抗氧化能力,是一种天然的抗氧化资源。
[1]Bankova V,Popova M,Bogdanov S,et al. Chemical composition of European propolis:expected and unexpected results[J]. Z Naturforsh C,2002,579(5-6):530-533.
[2]Gomez-Caravaca A M,Gomez-Romero M,Arraez-Roman D,et al. Advances in the analysis of phenolic compounds in products derived from bees[J]. Journal of Pharmaceutical and Biomedical Analysis,2006,41(4):1220-1234.
[3]罗宇倩,郭辉,钱俊青. 蜂胶黄酮提取纯化的工艺研究[J].中国蜂业,2011,6(1):6-10.
LUO Yu-qian,GUO Hui,QIAN Jun-qing. Study on extraction and
purification of flavonoids in propolis[J]. Apiculture of China,2011,6(1):6-10.
[4]蔡君,宋欢.蜂胶提取物的抗氧化活性研究[J]. 现代食品科技,2012,28(8):940-944.
CAI Jun,SONG Huan. Antioxidant activity research of propolis extract[J]. Modern Food Science and Technology,2012,28(8):940-944.
[5]Rajibul A L,Ismail S,Nayan R. Antioxidant activity of Indian propolis and its chemical constituents[J]. Food Chemistry,2010,122(4):233-332.
[6]Shi H,Yang H,Zhang X,et al. Identification and quantification of phytochemical composition and anti-inflammatory and radical scavenging properties of methanol extract of Chinese propolis[J]. Journal of Agriculture and Food Chemistry,2012,60(50):12403-12410.
[7]Wu S B,Dastmalchi K,Long C,et al. Metabolite profiling of jaboticaba(Myrciariacauliflora)and other dark-colored fruit juice[J]. Journal of Agriculture and Food Chemistry,2012,60:7513-7525.
[8]Li H,Deng Z,Liu R,et al. Characterization of phytochemicals and antioxidant activities of a purple tomato(SolanumlycopersiumL.)[J]. Journal of Agriculture and Food Chemistry,2011,59:11803-11811.
[9]María Reyes González-Centeno,Kai Knoerzer,Henry Sabarez,et al. Effect of acoustic frequency and power density on the aqueous ultrasonic-assisted extraction of grape pomace(VitisviniferaL.)- A response surface approach[J]. Ultrasonics Sonochemistry,2014,21:2176-2184.
[10]Jiang Feng Song,Da Jing Li,Hui Li Pang,et al. Effect of ultrasonic waves on the stability of all-trans lutein and its degradation kinetics[J]. Ultrasonics Sonochemistry,2015,27:602-608.
[11]Zhongli Pan,Wenjuan Qu,Haile Ma,et al. Continuous and pulsed ultrasound-assisted extraction of antioxidants from pomegranate peel[J]. Ultrasonics Sonochemistry,2011,18:1249-1257.
[12]Yujing Sun,Donghong Liu,Jianchu Chen,et al. Effect of different factors of ultrasound treatment on the extraction yield of the all -trans-β-carotene from citrus peels[J]. Ultrasonics Sonochemistry,2011,18(1):243-249.
[13]Shirsath S R,Sonawane S H,Gogate P R. Intensification of extraction of natural products using ultrasonic irradiation-A review of current statues[J]. Chemical Engineering and Processing,2012,53:10-23.
[14]M C Herrera,M D Luque de Castro. Ultrasound for the analysis of phenolic compounds in strawberries[J]. Analytical and Bioanalytical Chemistry,2004,379(7-8):1106-1112.
[15]Y Q Ma,X Q Ye,Y B Hao,et al. Ultrasound-assisted extraction of hesperidin from Penggan(Citrusreticulata)peel[J]. Ultrasonics Sonochemistry,2008,15:227-232.
权威·核心·领先·实用·全面
Optimization of the ultrasound-assisted extraction of flavonoids from propolis and its antioxidant activity
ZENG Lin-hui,DENG Ze-yuan,YU Xiu-liang,LI Hong-yan*
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
The flavonoids of propolis were extracted by ultrasound assisted method,the extracted conditions were optimized by response surface methodology,and the antioxidant activities of flavonoids extracted by pulsed ultrasound were analyzed by DPPH and FRAP assay. First,the optimal frequency of ultrasound was selected. On the basis of single variable experiment,the extracted conditions of flavonoids in propolis were optimized by 4-variable,3-level Box-Behnken experimental design. The optimized ultrasound frequency was 20 kHz,the order of other factors affecting the total flavonoid content was the duty cycle>liquid height>extraction time>the power of ultrasound. The optimized parameters were as follows:extraction time 18 min,the power of ultrasound 100 W,duty cycle 75% and liquid height 4 cm. The extraction yield of flavonoids were(39.06±0.48)mg/g. At these conditions,the flavonoids extracted by pulsed ultrasound assisted method showed great DPPH and FRAP antioxidant activities.
ultrasound;propolis;flavonoids;response surface methodology;antioxidant activity
2015-11-24
曾林晖(1990-),男,硕士研究生,研究方向:食品科学与工程,E-mail:linhuizeng1990@aliyun.com。
李红艳(1986-),女,博士,副教授,研究方向:抗氧化、食品营养、食品化学,E-mail:lihongyan@ncu.edu.cn。
南昌大学食品科学与技术国家重点实验室青年研究基金项目资助(SKLF-QN-201506)。
TS201.1
B
1002-0306(2016)12-0295-06
10.13386/j.issn1002-0306.2016.12.047

