南极假丝酵母Pseudozyma sp. JCC207的培养及其海藻糖提取工艺优化
王 帅,尹 花,任红霞,侯旭光,缪锦来,郑 洲,*
(1.啤酒生物发酵工程国家重点实验室,山东青岛 266061;2.山东大学威海分校,山东威海 264209;3.国家海洋局生物活性物质重点实验室,山东青岛 266061;4.青岛农业大学,山东青岛 266109)
南极假丝酵母Pseudozymasp. JCC207的培养及其海藻糖提取工艺优化
王帅1,2,3,尹花1,+,任红霞4,侯旭光2,缪锦来3,郑洲3,*
(1.啤酒生物发酵工程国家重点实验室,山东青岛 266061;2.山东大学威海分校,山东威海 264209;3.国家海洋局生物活性物质重点实验室,山东青岛 266061;4.青岛农业大学,山东青岛 266109)
本文研究了南极假丝酵母Pseudozymasp. JCC207的培养条件,对其海藻糖的提取工艺进行优化。利用单因素实验研究了培养温度和初始pH对南极假丝酵母生长的影响,采用RSM分析法确定了三氯乙酸(TCA)法提取南极假丝酵母海藻糖的最优工艺。结果表明其最适培养温度为25 ℃,起始pH为5~9范围内酵母生长情况差别不大;最优提取条件为:三氯乙酸浓度0.6 mol/L、体积15.20 mL、提取时间29 min;每克南极假丝酵母湿菌体中海藻糖的提取量为17.72 mg;功能实验表明,与甘油(20%)和二甲基亚砜(10%)等传统保种试剂相比,0.5%海藻糖溶液在短期内(5 d)对酵母具有更好的保种能力。
南极假丝酵母,培养条件,海藻糖,提取工艺,优化
极地微生物是极地生态系统的重要组成部分。由于极地独特的地理、气候及环境特点,极地微生物所具有的新颖性与多样性,在科学研究、应用开发等方面都具有重要价值,并逐渐受到人们的广泛关注。有关极地微生物的资源勘探与代谢活性产物研究,已成为国际微生物学研究的热点之一,但关于极地酵母海藻糖的研究还鲜有报道。
海藻糖是由两个葡萄糖分子组成的一个非还原性双糖[1],广泛存在于细菌[2]、真菌[3]、酵母、藻类、低等植物、昆虫及无脊椎动物中[4-5],尤其是在酵母细胞中含量高达15%。海藻糖在水中溶解性好且很稳定,对环境变化形成的应激状态具有高抗性,可防御如高温、冷冻、脱水和高渗透压等不利环境因素,外源性的海藻糖同样对生物体和生物大分子有良好的非特异性保护作用[6-8]。添加海藻糖被认为是保护细胞抵抗冷冻的一种有前途的方法,研究发现添加外源海藻糖明显地提高了极端环境酵母细胞的存活率[6]。目前,海藻糖已被广泛运用于食品、化妆品、医药品等行业[9-12]。
目前生产海藻糖的方法主要有酶转化法和酵母提取法,因酵母极易富集和培养,使得酵母提取法成为国内外生产海藻糖的首选方法[13-14]。用酵母生产海藻糖是利用优化过的培养基及培养条件来达到海藻糖在菌体内大量积累,然后再进行提取的过程。海藻糖提取用到的方法主要有水提取法、乙醇提取法、三氯乙酸(TCA)提取法及微波预处理提取法。刘洋等[15]分别用三氯乙酸、冷乙醇、热乙醇和热蒸馏水浸提海藻糖,结果显示三氯乙酸溶液浸提产率最高,且酵母菌用三氯乙酸提取,所得溶液仅有海藻糖存在。因此,本实验研究了南极假丝酵母Pseudozymasp. JCC207的培养条件,并对其海藻糖的三氯乙酸法提取工艺进行优化,初步探索了海藻糖在酵母保种过程中的作用,以期为极地酵母海藻糖资源的开发利用奠定基础。
1 材料与方法
1.1材料与仪器
南极假丝酵母Pseudozymasp. JCC207国家海洋局海洋活性物质重点实验室保存;种子培养基1000 mL蒸馏水中加入葡萄糖8 g,酵母膏2 g,MgSO41 g,K2HPO41 g,溶解调pH7,115 ℃蒸汽灭菌30 min,该培养基作为种子培养基和实验优化设计的初始培养基;固体培养基1000 mL蒸馏水中加入胰蛋白胨4 g,酪蛋白胨2 g,酵母膏2 g,牛肉膏1.5 g,葡萄糖1 g,溶解调pH7,加入琼脂20 g,115 ℃蒸汽灭菌30 min;海藻糖标准品南宁中诺生物工程有限责任公司;二甲基亚砜(DMSO)天津市广成化学试剂有限公司;三氯乙酯(TCA)国药集团化学试剂有限公司;酵母浸膏国药集团化学试剂有限公司;蒽酮上海科丰实业有限公司;硫酸镁天津市博迪化工有限公司。
Eppendorf 5804离心机Eppendorf中国有限公司;FD50A高压灭菌器致微仪器有限公司;HZQ-F160振荡培养箱哈尔滨东联电子技术开发有限公公司;SW-CJ-2D净化工作台苏州净化设备有限公司;UV-2550紫外分光光度计岛津有限公司。
1.2实验方法
1.2.1南极酵母培养及菌体制备将活化的南极酵母种子液接入250 mL种子培养基中,接种量为2%放入振荡培养箱中,在20 ℃、160 r/min条件下,振荡培养48 h,得到所需酵母菌液。将发酵液在8000 r/min离心10 min除去上清液,加蒸馏水洗涤2次,湿酵母放冰箱-20 ℃。贮存待用。
1.2.2培养温度对南极假丝酵母生长的影响将活化的实验菌种按照2%的接种量加入到100 mL种子培养基中进行摇瓶培养,初始培养条件为160 r/min,pH7,设置15、20、25和30 ℃四个温度进行培养,每隔12 h取样测定OD600,绘制不同培养温度下酵母菌的生长曲线。
1.2.3培养基初始pH对南极假丝酵母生长的影响用6 mol/L的盐酸、氢氧化钠溶液将培养基初始pH分别调整为5、6、7、8和9,南极酵母接种量为2%,然后在20 ℃、160 r/min进行摇瓶发酵培养,每隔12 h取样测定OD600,绘制不同初始pH下酵母菌的生长曲线。
1.2.4海藻糖标准曲线的绘制分别量取1 mg/1000 μL海藻糖标准品溶液0、25、50、100、150、200 μL,然后各自加蒸馏水至2 mL,再向各管中加入0.2%的蒽酮-硫酸试剂8 mL,立即摇匀,并置于沸水浴中加热2 min后取出,并用自来水冲洗快速冷却。以未加海藻糖标准品的样液作为空白对照,在590 nm下测定溶液的吸光度值[16]。以制得的海藻糖质量为横坐标,测出的吸光度值为纵坐标,绘制海藻糖标准曲线。
1.2.5TCA法提取海藻糖在1 g湿酵母中加15 mL TCA溶液(0.5 mol/L)于冰水浴中提取30 min,将提取液以8000 r/min的速度离心5 min,取上清液待测。重复上述步骤,共提取6次。
1.2.6提取时间、TCA浓度和体积对海藻糖提取量的影响按照1.2.5中的方法,加入15 mL 0.5 mol/L TCA溶液,分别提取10、20、30、40、60 min后,依次测定各上清液中海藻糖含量;加入15 mL浓度分别为0.4、0.5、0.6、0.7、0.8 mol/L的TCA溶液,提取30 min后,依次测定各上清液中海藻糖含量;分别加入10、15、20、25 mL浓度为0.6 mol/L的TCA溶液,提取30 min后,依次测定各上清液中海藻糖含量。
1.2.7Box-Behnken响应面优化海藻糖提取的最佳工艺条件设计在1.2.6单因素实验的基础上,依据中心组合(Box-Behnken)设计原理[17-19],选取TCA溶液的浓度、体积和提取时间三个因素为自变量因子,依次记作A、B、C,海藻糖提取量为响应值,记作Y,设计3因素3水平的响应曲面实验(RSM),根据单因素实验结果设计因素水平编码表,见表1。
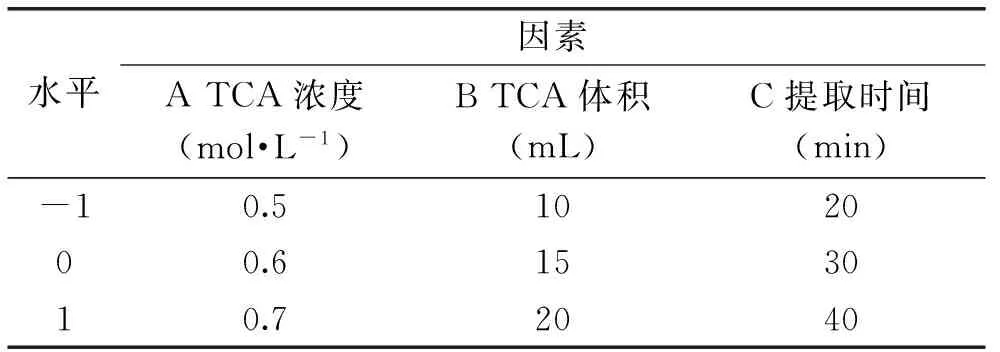
表1 RSM因素水平编码表
利用Minitab15分析软件进行Box-Behnken设计,分析实验结果,再通过Design-Expert 8.0.6对该结果进行响应面分析,找出海藻糖提取时的最优条件。
1.2.8海藻糖对于酵母保种的功能验证将菌液按2%接种量接种到100 mL、pH7种子培养基中,放入振荡培养箱中,在20 ℃、160 r/min条件下,振荡培养12 h,得到所需保种酵母菌液。保种试剂选用20%甘油、10% DMSO、0.5%、1%、2%海藻糖溶液以及空白作为对照,-80 ℃分别保种5、10、20和40 d。取保种样品,每个样品取样1 μL用种子培养基稀释至10倍,涂布于固体培养基平板中,室温培养48 h,计数。
1.2.9数据分析每组实验重复三次,实验数据采用SPSS19.0软件进行分析。
2 结果与讨论
2.1培养温度对南极假丝酵母生长的影响
南极酵母在不同温度下的生长曲线见图1。可以看出,温度对南极假丝酵母的生长存在一定影响,对数生长期,培养温度越高,酵母生长的越快;稳定期,酵母在25 ℃测得的生长曲线最高,20 ℃测得生长曲线与25 ℃非常接近,其次是30 ℃时生长曲线,15 ℃酵母的生长曲线最低。
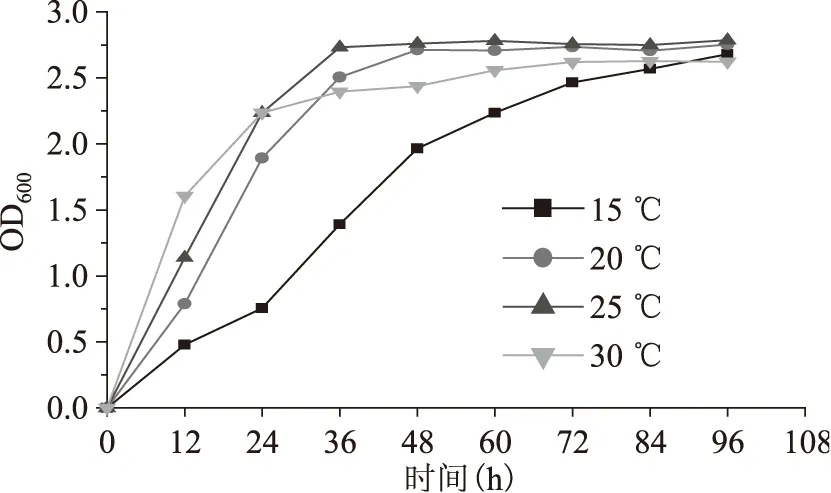
图1 南极假丝酵母在不同培养温度下的生长曲线Fig.1 The growth curve of Candida antarctica with different culture temperatures
2.2培养基初始pH对南极假丝酵母生长的影响
不同pH下酵母生长曲线见图2。可以看出,实验培养的南极假丝酵母在不同初始pH下的生长情况变化不大,从酸性pH5到碱性pH9,该酵母生长呈现较好的一致性,说明该菌种可适应的pH范围较大,为广谱性,也得知pH对该酵母生长影响较小。
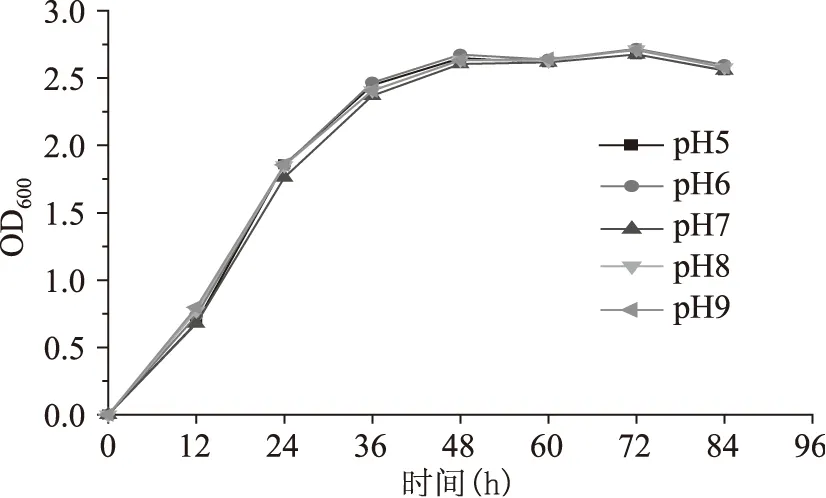
图2 南极假丝酵母在不同初始pH下的生长曲线Fig.2 The growth curve of Candida antarctica under different initial pH value
2.3海藻糖标准曲线
实验中分别测定了5个不同浓度下海藻糖标准溶液在590 nm下的吸光度值,以海藻糖的质量为横坐标,测得的吸光度值为纵坐标,绘制出海藻糖标准曲线见图3,其回归方程为Y=3.90189X+0.00308,相关系数R2=0.9991,线性关系良好。
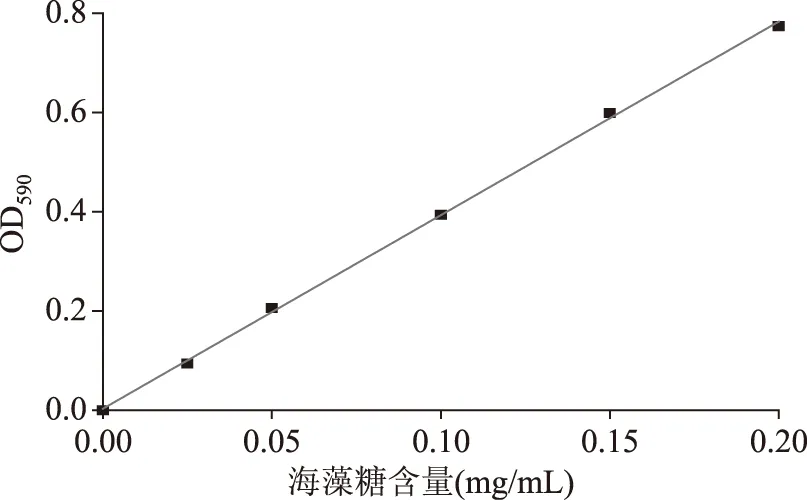
图3 海藻糖的标准曲线Fig.3 The standard curve of trehalose
2.4海藻糖提取的单因素实验
2.4.1不同提取时间对海藻糖提取量的影响提取时间对海藻糖提取量的影响见图4,随着TCA提取时间的增加,酵母提取液中海藻糖的含量呈现先升后降的趋势,提取30 min时达到最大。原因可能是在一定的TCA提取时间内,海藻糖由胞内渗出基本达到平衡,过度延长TCA提取时间后,由于时间过长,导致酵母细胞中其它非目标物质的分解和溶出,从而阻碍海藻糖的继续提取,影响了提取海藻糖量。因而选取TCA提取时间为30 min。

图4 不同提取时间下海藻糖含量Fig.4 Trehalose content under different extraction time
2.4.2不同TCA浓度对海藻糖提取量的影响在提取过程中,TCA作为一种强变形剂,能将多种蛋白质、海藻糖酶和多糖等变性沉淀,海藻糖便从胞内浸提出来。TCA浓度对海藻糖提取量的影响见图5,用浓度为0.6 mol/L的TCA溶液提取得到的海藻糖量最多,其他3个浓度提取的海藻糖较少。浓度为0.5 mol/L和0.7 mol/L的海藻糖含量与0.6 mol/L的相差较大,说明在提取过程中TCA溶液的浓度对提取量的影响很大。在一定浓度范围内,TCA浓度越大,变性作用越强,使海藻糖酶失活率越高,海藻糖提取量便越多;但当TCA浓度过高时,形成的较高渗透压环境会使菌体细胞壁皱缩,进而海藻糖不易溶出,使提取量降低[20]。

图5 不同TCA浓度下得到的海藻糖含量Fig.5 Trehalose content under different concentration of chloroacetic acid
2.4.3不同TCA体积对海藻糖提取量的影响三氯乙酸体积对海藻糖提取量的影响见图6,TCA体积对酵母海藻糖得量的影响呈先升而后降的趋势,在TCA体积为15 mL时海藻糖量达到最大。当TCA溶液的体积较少时,对酵母中海藻糖的浸提作用不充分,不能达到充分提取;随着TCA溶液体积的增加,提取过程越来越充分,得到的海藻糖量也越来越多;但是当其体积过高时,提取溶液极性变小,反而抑制水溶性海藻糖的提取[20]。
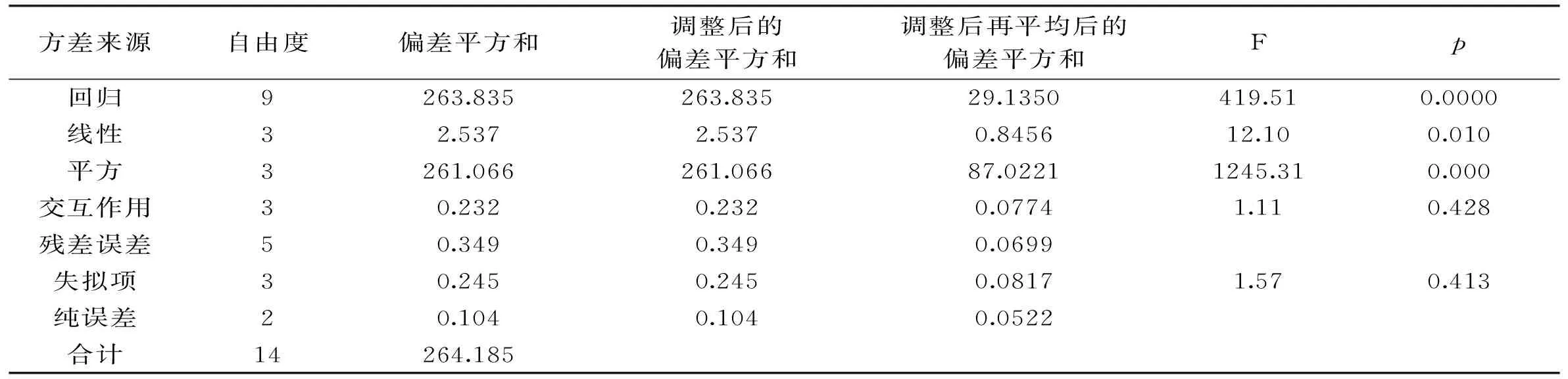
表3 回归方程的方差分析
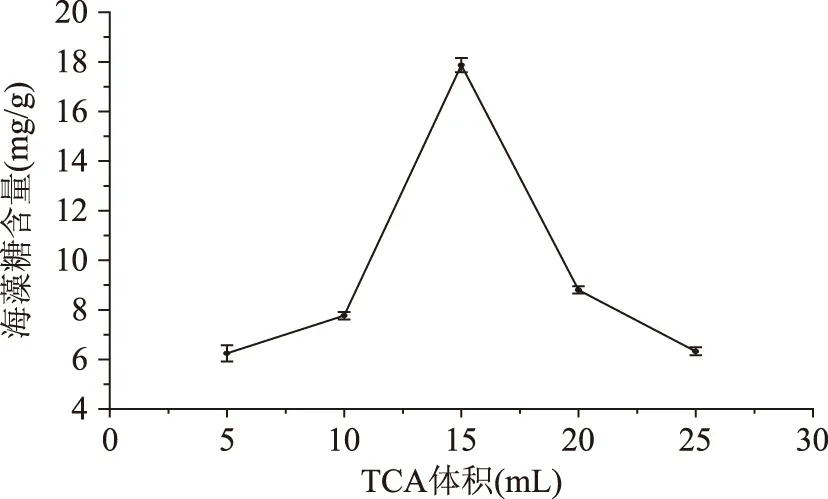
图6 不同提取体积下海藻糖含量Fig.6 Trehalose content under differentextraction volume of chloroacetic acid
注:当p<10-6时,p值显示为0.0000。
2.5RSM优化海藻糖提取工艺
2.5.1回归方程的建立和方差分析利用响应曲面法优化海藻糖提取的实验设计和结果如表2所示,借助Design-Expert统计分析软件对表2中的结果进行回归拟合,得到海藻糖提取量(Y)对TCA浓度A、TCA体积B和提取时间C的回归方程为:
Y=17.8343+0.4123A+0.2733B-0.2692C+0.0190AB+0.1955AC+0.1395BC-5.8369A2-4.2789B2-5.3744C2
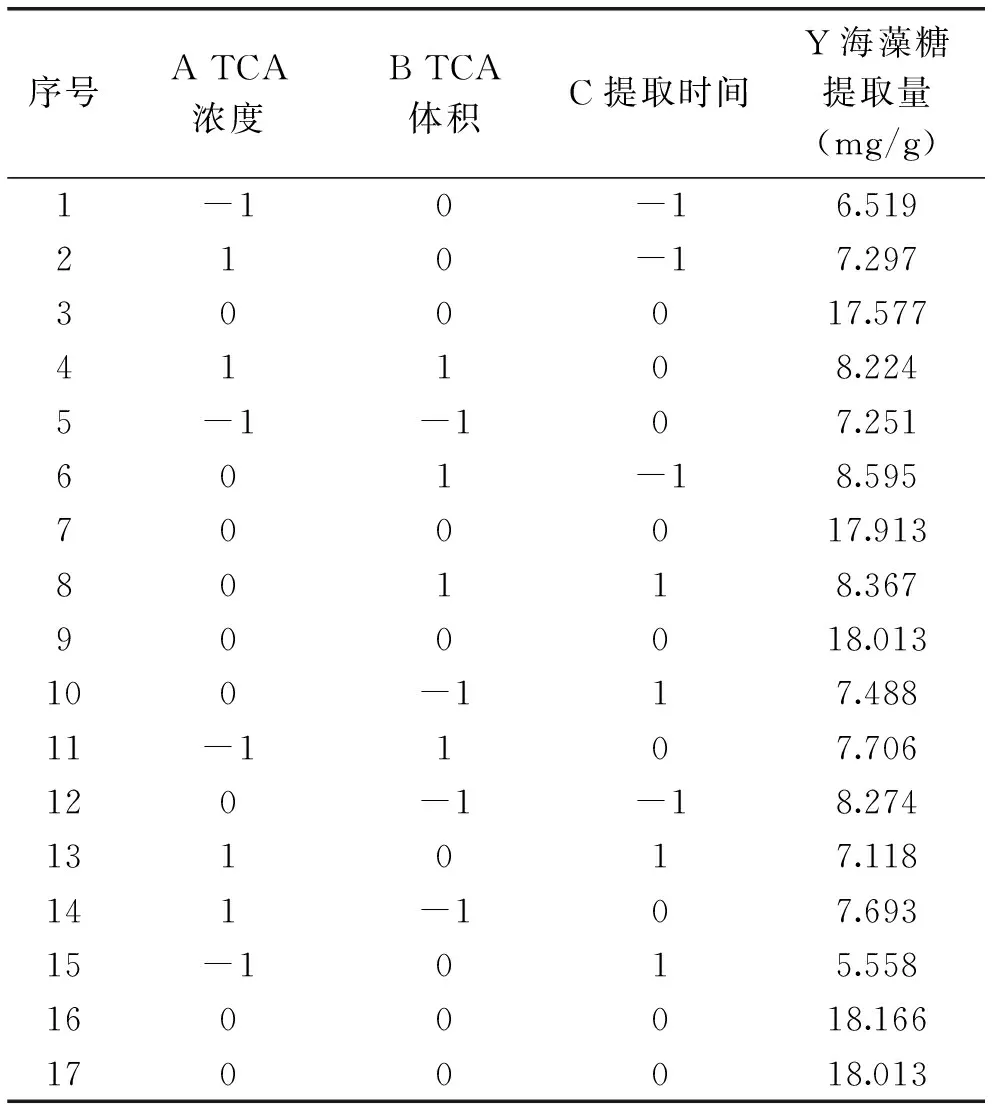
表2 响应曲面分析法实验设计和结果
对该回归方程进行方差分析和回归系数的显著性分析,结果分别见表3和表4。从表3回归方程的方差分析可知失拟项F=1.57,p=0.413>0.05,不显著,说明模型不存在失拟因素。表4回归系数的显著性分析显示拟合回归模型的复相关系数R2=0.9987,和软件预测值R2=0.9843相差较小,表明该模型与实验拟合性良好。综上可知,该模型的拟合程度较高,具有较好的预测作用。
由表4中各项系数的p值可知,在所选因素水平范围内,对海藻糖提取量影响作用由大到小的顺序为TCA溶液浓度>TCA法体积>提取时间。其中,一次项A和平方项A2、B2、C2是模型的极显著因素(p<0.01),一次项B和C为显著因素(p<0.05),交互项AB、AC、BC影响不显著(p>0.05)。

表4 回归系数的显著性分析
2.5.2响应曲面分析借助Design-Expert 8.0.6对2.5.1中的设计结果进行相应曲面分析,TCA浓度、体积和提取时间三种因素对海藻糖提取量的响应面影响分别见图7、图8和图9。由图7可知,在一定的TCA浓度条件下,提取过程中当TCA溶液的体积在10~15 mL范围内和提取时间在20~30 min范围内时,这两种变化因素分别表现出显著的增效作用,即随着TCA体积的增加和提取时间的延长海藻糖的提取量也随之增加;但是当超过15 mL和30 min后,海藻糖的提取量反而随着TCA体积和提取时间的增加出现降低的趋势。
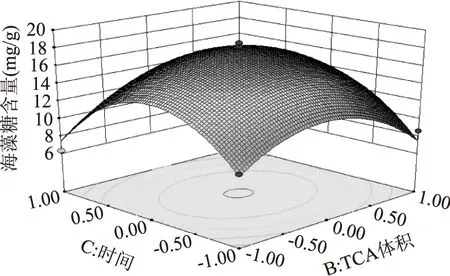
图7 TCA体积和提取时间对海藻糖提取量的响应曲面图Fig.7 Response surface of TCA volume and extraction time vs trehaloseextraction content with constant value of TCA concentration
在TCA溶液体积为一定值的条件下,考察TCA浓度和提取时间两因素对海藻糖提取量的影响。如图8所示,在TCA溶液的浓度由0.5 mol/L增加到0.6 mol/L的范围内和提取时间由20 min变化到30 min的范围内,海藻糖的提取量也随之增加;当超过0.6 mol/L和30 min后,海藻糖的提取量随TCA浓度和提取时间的增加呈现出减小的现象。
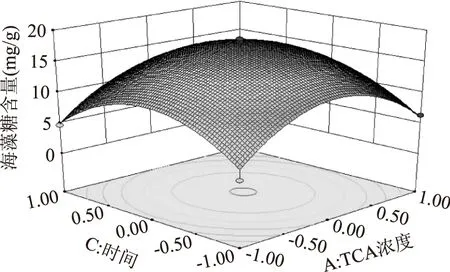
图8 TCA浓度和提取时间对海藻糖提取量影响的响应曲面图Fig.8 Response surface of TCA concentration and extraction time vs trehalose extraction content with constant value of TCA volume
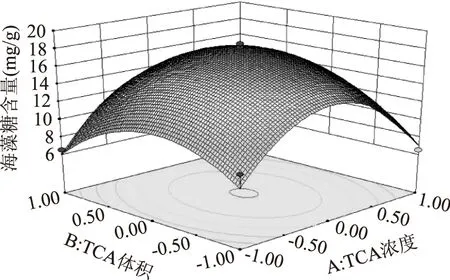
图9 提取时间一定时TCA浓度和体积对海藻糖提取量的响应曲面图Fig.9 Response surface of TCA concentration and its volume vs trehalose extraction content with constant value of extraction time
在提取时间为一定值的条件下,研究TCA浓度和体积时间2个变量对海藻糖提取量的影响。如图9所示,当TCA溶液浓度由0.5 mol/L变化到0.6 mol/L和体积由10 mL变化到15 mL时,得到的海藻糖提取量也呈现出相应的增加;TCA溶液超过0.6 mol/L和15 mL后,所得海藻糖提取量随两因素的增加而减小。
2.5.3验证实验利用响应面分析法得到提取最优条件为:TCA浓度0.60 mol/L、体积15.16 mL、提取时间29.76 min,在此条件下,海藻糖的理论提取量为17.90 mg/g。为验证由响应曲面法得到的最优条件是否可靠、准确,本实验实际选取TCA浓度0.6 mol/L、体积15.20 mL和提取时间29 min的提取条进行验证,得到的海藻糖提取量为17.72 mg,接近海藻糖的理论提取量;这说明利用响应曲面法得到的优化提取条件可靠,具有较好的实际应用价值。
2.6海藻糖对酵母保种作用结果
通过平板计数得出结果见表5,0.5%海藻糖在-80 ℃处理5 d的保种效果最好,20%甘油在-80 ℃处理10、20和40 d的保种功能最好。不同海藻糖浓度取得的保种效果不同,其中0.5%的效果最为显著;-80 ℃保种5 d,0.5%的海藻糖溶液对酵母的保种作用最好,随着保种时间延长,保种功能迅速下降。该结果表明外源海藻糖可在短期内明显地提高冷冻条件下酵母细胞的存活率,证实了海藻糖对于酵母保种中的作用,表明海藻糖有助于酵母应对极端低温环境。

表5 各保种试剂中菌落数
注:与空白组比较**表示差异极显著(p<0.01),*表示差异显著(0.01 研究表明南极假丝酵母最适温度为25 ℃,培养基初始pH在5~9范围内对酵母生长影响不大。利用响应面法优化了南极假丝酵母海藻糖的提取条件,确定海藻糖提取的最佳工艺参数为:TCA浓度0.6 mol/L、体积15.20 mL、提取时间为29 min,在此最优工艺下每克南极假丝酵母湿菌体中海藻糖的提取量为17.72 mg。与甘油(20%)和二甲基亚砜(10%)等传统保种试剂相比,0.5%海藻糖溶液在短期内(5 d)对酵母具有更好的保种能力。 [1]El-Bashiti T,Hamamci H,Öktem HA,et al. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J]. Plant Science,2005,169(1):47-54. [2]Shimakata T,Minatogawa Y. Essential role of trehalose in the synthesis and subsequent metabolism of corynomycolic acid inCorynebacteriummatruchotii[J]. Arch Biochem Biophys,2000,380(2):331-338. [3]Nwaka S,Holzer H. Molecular biology of trehalose and the trehalases in the yeast Saccharomyces cerevisiae[J]. Prog Nucleic Acid Res Mol Biol,1998,58:197-237. [4]Müller J,Aeschbacher RA,Wingler A,et al. Trehalose and trehalase in Arabidopsis[J]. Plant Physiol,2001,125(2):1086-1093. [5]Zentella R,Mascorro-Gallardo JO,Van Dijck P,et al. A Selaginella lepidophylla trehalose-6-phosphate synthase complements growth and stress-tolerance defects in a yeast tps1 mutant[J]. Plant Physiol,1999,119(4):1473-1482. [6]O’Shea TM,Webber MJ,Aimetti AA,et al. Covalent Incorporation of Trehalose within Hydrogels for Enhanced Long-Term Functional Stability and Controlled Release of Biomacromolecules[J]. Adv Healthc Mater,2015,4(12):1802-1812. [7]Ma LK,Zhang B,Deng SG,et al. Comparison of the cryoprotective effects of trehalose,alginate,and its oligosaccharides on peeled shrimp(Litopenaeusvannamei)during frozen storage[J]. Food Sci,2015,80(3):540-546. [8]Lü X,Han SC,Li LY,et al. The potential of trehalose to replace insect hemolymph in artificial media for Trichogramma dendrolimi(Hymenoptera:Trichogrammatidae)[J].Insect Sci,2013,20(5):629-636. [9]Diniz-Mendes L,Bernardes E,de Araujo PS,et al. Preservation of frozen yeast cells by trehalose[J]. Biotechnol Bioeng,1999,65(5):572-578. [10]Cesaro A,Giacomo OD,Sussich F,et al. Water interplay in trehalose polymorphism[J]. Food Chemistry,2008,106(4):1318-1328. [11]Cho YJ,Park OJ,Shin HJ. Immobilization of thermostable trehalose synthase for the production of trehalose[J]. Enzyme and Microbial Lechnology,2006,39(1):108-113. [12]赵玉巧,杜云建,王微,等. 海洋酵母内海藻糖的提取方法研究[J]. 食品研究与开发,2013,34(12):34-37. [13]张玉华,凌沛学,籍保平. 海藻糖的研究现状及应用前景[J]. 食品与药品,2005,7(3):8-13. [14]张丽洁,王昌科,韩雪,等. 酵母中海藻糖提取的响应曲面优化及纯化工艺[J]. 生物技术,2014,24(3):82-87. [15]刘洋,张红缨,高俊芳,等. 酵母菌中海藻糖的几种提取方法的比较[J]. 中国生化药物杂志,1999,20(1):15-17. [16]谭海刚,梅英杰,关凤梅,等. 蒽酮-硫酸法测定酵母中海藻糖的含量[J]. 现代食品科技,2006,22(1):125-128. [17]宋晓丽,李历,李军庆,等. Box-Behnken响应面设计优化微波辅助提取酵母胞内海藻糖的工艺[J]. 中国酿造,2013,32(2):114-118. [18]杨晓红,王元秀,郑明洋. 响应面法优化啤酒酵母海藻糖提取工艺[J]. 济南大学学报,2013,27(3):270-274. [19]李静,谭海刚,宫春波,等. 从面包酵母中提取海藻糖的研究[J].食品与药品,2008,10(3):24-26. [20]Murakami Y,Hahn Y,Yokogiawa K,et al. Induction of freeze-sensitive mutants from a feeze-tolerant yeast,Torulaspora delbrueckii[J]. Biosci Biotechnol Biochem,1994,58:206-207. Optimization of culture conditions and trehalose extractive technology ofPseudozymasp. JCC207 WANG Shuai1,2,3,YIN Hua1,+,REN Hong-xia4,HOU Xu-guang2,MIAO Jin-lai3,ZHENG Zhou3,* (1.State Key Laboratory of Biological Fermentation Engineering of Beer,Qingdao 266061,China;2.Shandong University,Weihai,Weihai 264209,China;3.Key Laboratory of Marine Bioactive Substance,State Oceanic Administration,Qingdao 266061,China;4.Qingdao Agricultural University,Qingdao 266109,China) The culture conditions ofPseudozymasp.JCC207 from Antarctic and the optimization of the extractive technology for its trehalose were studied in this paper. Effects of culture temperature and initial pH of culture medium onPseudozymasp.JCC207 growth were explored by single factor tests,and the optimization of extraction condition of yeast trehalose by rchloroacetic acid(TCA)was determined using response surface method(RSM).The results showed that the optimum culture temperature was 25 ℃,and initial pH value of 5 to 9 impacted little on yeast growth,and the optimal extraction conditions were obtained as follows:TCA concentration 0.6 mol/L,TCA volume 15.20 mL,and extraction time 29 min. The extraction amount was 17.72 mg from one gram wet cells ofPseudozymasp. JCC207. Function test indicated that 0.5% trehalose solution had a better conservation capacity for yeast in 5 days compared with 20% glycerol and 10% dimethyl sulphoxide(DMSO). Pseudozymasp.JCC207;culture conditions;trehalose;extraction;optimization 2015-12-18+并列第一作者。 王帅(1989-),男,硕士研究生,研究方向:应用微生物,E-mail:524207035@qq.com。 尹花(1972-),女,硕士,应用研究员,研究方向:发酵工程,E-mail:yinhua@tsingtao.com.cn。 郑洲(1978-),男,博士,副研究员,研究方向:应用微生物,E-mail:zhengzhou@fio.org.cn。 啤酒生物发酵工程国家重点实验室开放基金(K2014003);全球变化与海气相互作用专项(GASI-03-02-02-05);国家自然科学基金(31200272)。 TS202.1 A 1002-0306(2016)12-0206-06 10.13386/j.issn1002-0306.2016.12.0313 结论

