酶解鹅血制备高氨基酸血红素
秦春青,黄 可,李本姣,程亚娇,冷安钟,刘 雄,*
(1.西南大学食品科学学院,重庆 400715;2.重庆清水湾食品有限公司,重庆 408307)
酶解鹅血制备高氨基酸血红素
秦春青1,黄可1,李本姣1,程亚娇1,冷安钟2,刘雄1,*
(1.西南大学食品科学学院,重庆 400715;2.重庆清水湾食品有限公司,重庆 408307)
利用Box-Behnken中心组合实验设计对碱性蛋白酶水解鹅血提取高氨基酸鹅血血红素的工艺条件进行了优化。结果表明:对水解度的影响次序为酶浓度>水解温度>水解时间>溶液pH。鹅血提取高氨基酸血红素的最佳酶解工艺参数:酶浓度5%,温度50 ℃,pH8.80,水解时间5.15 h,水解度为14.36%±0.18%。水解后,水解液中血红素含量为1.210 mg/mL,铁离子的含量为90.42 μg/mL。
鹅血,酶解,水解度,高氨基酸血红素
血红素是由卟啉和一分子的亚铁离子结合,构成的铁卟啉类化合物[1]。血红素存在于各种动物的肌肉和血液组织中,具有非常重要的生理功能和很高的使用价值,在医药、食品、化工、保健品、建筑及化妆品行业中有广泛应用[2]。
鹅血是一种高蛋白质资源,蛋白质含量高达19%,其中血红蛋白含量约为11.6~12.99 g/100 mL,占全血蛋白的2/3[3-4]。鹅血中含有丰富的微量元素,以铁的含量最高,是瘦肉含铁量的20倍,可作为良好的补血剂[5]。血液的利用以血豆腐、血粉、血浆粉等初级加工形式为主[6],而在补铁方面很少涉及。在我国,缺铁性贫血的患病率较高。常见补铁剂为硫酸亚铁等无机铁,虽有补铁的效果,但在体内利用率较低,毒副作用较大,且有特殊金属铁锈味。血红素铁是一种生物态铁,可直接被肠粘膜细胞吸收,不产生任何消化道刺激症状,生物利用率高,是理想补铁剂[7]。
目前血红素的提取方法主要为:有机溶剂法(冰醋酸和丙酮法)、羧甲基纤维素法、表面活性剂法和酶法[8]等。这些方法,虽然可以提取到较高纯度的血红素,但有些对人体有害,有些生产成本高,通常认为不适宜于工厂化生产[9]。酶解法是获得高功能性和高营养价值产品最有效的方法[10],与其他提取血红素的方法相比,酶解提高血红蛋白利用率,并且避免酸、碱水解血红蛋白时生产周期长、腐蚀设备、污染环境等缺陷,扩大了水解产物的应用范围。许多研究人员证明,碱性蛋白酶是各种蛋白质水解物的制备中效果最好的酶[11]。
本研究以鹅血为原料,用碱性蛋白酶酶解鹅血,运用响应面法优化碱性蛋白酶酶解鹅血提取富含氨基酸鹅血血红素工艺参数,旨在为高氨基酸鹅血血红素的提取提供理论指导。
1 材料与方法
1.1材料和仪器
鹅血由重庆市北碚区农贸市场提供;98%血红素标准品国药集团化学试剂有限公司;碱性蛋白酶200000 U/g,北京奥博星生物技术有限责任公司;柠檬酸三钠、氯化钠、氢氧化钠、甲醛、硫酸铜、硫酸钾、亚甲基红、亚甲基蓝、浓硫酸均为分析纯。
日立L-8800型全自动氨基酸分析仪天美科技有限公司;KQ 3200DB型数控超声波清洗器昆山市超声仪器有限公司;pHS-3型精密酸度计上海三信仪器有限公司;722S紫外分光光度计上海菁华仪器有限公司;HWS-26数显水浴锅上海齐欣科学仪器有限公司;JA2003电子天平上海精天仪器有限公司;TGL16G型台式离心机上海安亭科学仪器厂;B5-2A恒温磁力搅拌器常州博远实验分析仪器有限公司;ZDDN-II全自动凯氏定氮仪浙江托普仪器有限公司。
1.2实验方法
1.2.1鹅血酶解制备血红素的工艺鹅血的洗涤→冻藏→解冻→加水搅拌15 min→超声→静置过夜→酶解→灭酶→离心取上清
将鹅血解冻,然后加蒸馏水,配成10%的溶液,充分搅拌,100 W超声处理15 min,震荡30 min,静止12 h,使红细胞充分溶胀。加酶进行酶解,在酶解过程中,4 mol/L的NaOH调节水解液pH,使水解液pH稳定,酶解完成后90 ℃灭酶15 min,冷却,4000 r/min离心10 min,取上清液,即可得到富含氨基酸血红素的鹅血水解液。
其中鹅血的洗涤工艺为:鹅血→加柠檬酸钠抗凝剂→4000 r/min离心10 min→沉淀物→加生理盐水→4000 r/min离心10 min→沉淀物→加生理盐水→4000 r/min离心10 min→沉淀物
1.2.2鹅血提取血红素水解度的测定氨基态氮的含量(AN,Amino Nitrogen):采用甲醛电位滴定法测定[12]。操作步骤:取水解蛋白液5.0 mL于小烧杯中加入60 mL去离子水并磁力搅拌,用精密pH计指示其pH,并用0.1 mol/L氢氧化钠滴定至pH为8.2,然后加入pH为8.2甲醛溶液20 mL,滴定至pH为9.2,记录所耗氢氧化钠的毫升数;做空白实验(以5.0 mL水做空白);则水解蛋白液的氨基氮含量为:
式中,X为样品中氨基氮含量(mmol/L);M为所用氢氧化钠溶液的摩尔浓度(mol/L);V1为样品滴定所耗氢氧化钠的体积数(mL);V2为空白实验所耗氢氧化钠的体积数(mL)。
其中,DH:水解度;TN(Total Nitrogen):总氮量按照国际GB 5009.5-2010测定;AN(Amino Nitrogen):氨基态氮的含量。
1.2.3制备工艺的单因素实验分别考察加酶浓度、水解温度、水解时间、pH 4个实验因素对鹅血提取血红素的影响,进行单因素实验。
1.2.3.1酶浓度对水解度的影响将10%的鹅血红细胞溶液,在温度55 ℃,pH9.5的条件下分别按红细胞的量添加1%、2%、3%、4%、5%的碱性蛋白酶,酶解5 h,然后测定酶解溶液的水解度。
1.2.3.2温度对水解度的影响将10%的鹅血红细胞溶液,在酶浓度3%,pH9.5的条件下分别在40、45、50、55、60 ℃的温度下,酶解5 h,然后测定酶解溶液的水解度。
1.2.3.3水解时间对水解度的影响将10%的鹅血红细胞溶液,在酶浓度3%,pH9.5,温度55 ℃的条件下酶解,分别酶解2、3、4、5、6 h,然后测定酶解液的水解度。
1.2.3.4溶液的pH对水解度的影响将10%的鹅血红细胞溶液,在酶浓度3%,温度55 ℃,分别在溶液pH为8、9、10、11、12的条件下酶解5 h,然后测定酶解溶液的水解度。
1.2.4响应面优化实验设计根据单因素实验结果,选择对水解度影响较大的因素,采用Box-Behnken进行实验设计,采用Design-Expert(Version 8.0)实验设计原理,建立数学回归模型,进行数据分析,其因素水平设计见表1。

表1 Box-Behnken因素水平表
1.2.5水解液中其他物质的测定
1.2.5.1水解液中血红素含量的测定血红素标准曲线的绘制,精密称取经105 ℃干燥至恒重的血红素标准品(16.0±0.1)mg,置于100 mL容量瓶中,加0.1 mol/L NaOH溶液适量使完全溶解后,再用0.1 mol/L NaOH溶液稀释至刻度,摇匀,得标准液待用。精密量取血红素标准液0、1.0、2.0、3.0、4.0、5.0 mL,用0.1 mol/L的NaOH溶液定容于100 mL容量瓶,摇匀,以0.1 mol/L的NaOH溶液为空白,在383 nm波长处测定其吸光度值,绘制标准曲线[13]。
水解液中血红素的测定在优化工艺的基础上,用最优工艺酶解鹅血,然后取1 mL水解液,用0.1 mol/L NaOH定容至100 mL,以0.1 mol/L NaOH为空白,在383 nm波长处测定其吸光度值,根据标准曲线计算血红素的含量。
1.2.5.2水解液中铁离子的测定在优化工艺的基础上,用最优工艺酶解鹅血,然后取5 mL水解液,加入10 mL HNO3∶HClO4=4∶1的混酸,消化,测定铁离子的含量[14]。
1.2.5.3水解液中游离氨基酸的测定在优化工艺的基础上,用最优工艺酶解鹅血,然后用全自动氨基酸分析仪测定游离氨基酸的含量。样品的前处理:水解液用6%磺基水杨酸稀释6倍,水解前的鹅血(空白样)1.1694 g加入6%磺基水杨酸1.2 mL,150 W超声30 min置4 ℃冰箱2 h,16500 r/min离心2 min用0.22 μm滤膜过滤上机分析。分析条件:一个样品分析周期53 min;分离柱:(4.6 mm×60 mm),洗脱液流速0.4 mL/min,柱温70 ℃,柱压9.627 MPa;反应柱:茚三酮及茚三酮缓冲液流速0.35 mL/min,柱温135 ℃,柱压1.078 MPa。
1.2.5.4数据处理单因素实验采用Origin进行数据分析,响应面实验设计采用软件Design Expert进行二次回归模型分析以及响应面分析图象处理。
2 结果与分析
2.1单因素实验
2.1.1酶浓度对水解度的影响从图1可以看出,随着加酶量的增加,酶解液的水解度呈上升趋势。在加酶量4%时水解度达到最大,此后呈现平稳的趋势。这可能是酶添加量对酶促反应有一定的影响,酶添加量越大,与底物作用的酶分子就越多,反应就越充分;但是酶添加到一定量的时候,酶分子将底物饱和,再增加酶量对反应起不到促进作用。因此选择酶浓度为4%。
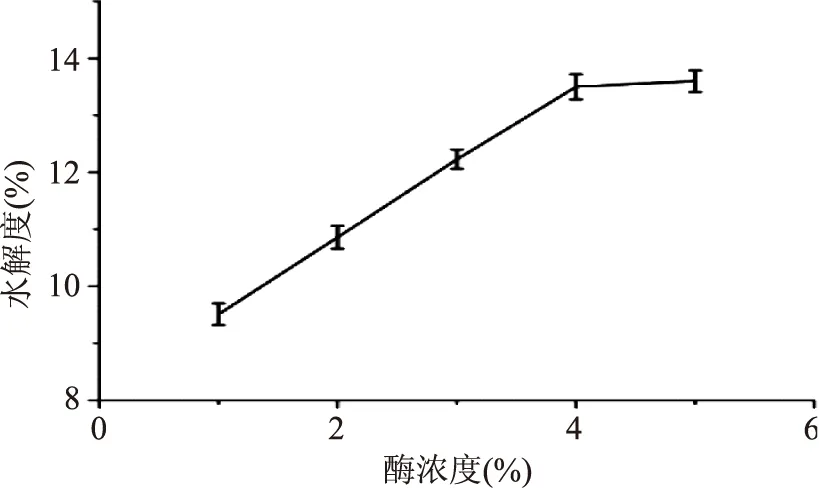
图1 酶浓度对水解度的影响Fig.1 Effect of enzyme concentration on the degree of hydrolysis
2.1.2水解温度对水解度的影响从图2可看出随着水解温度的升高,水解度的变化很显著。在40~50 ℃之间水解度急剧上升,50 ℃时达到最大,之后呈下降趋势。酶的催化作用受温度的影响很大。温度对酶催化的反应有双重效应,一方面,温度上升可以使反应加快;另一方面,温度升高可使酶因变性而失活。各种酶的反应有其最适的温度,此时,酶的反应速度最快。可能是50 ℃时,酶的作用力最强,能较好的酶解血红蛋白;血红蛋白在50 ℃时能较好的伸展开,使作用位点充分的暴露,有利于酶的作用。因此选择水解温度50 ℃。
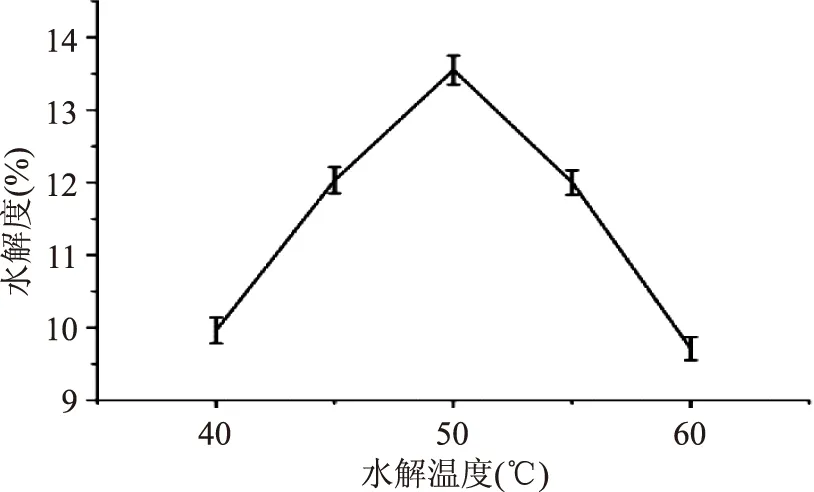
图2 水解温度对水解度的影响Fig.2 Effect of temperature on degree of hydrolysis
2.1.3pH对水解度的影响图3可以看出,pH对水解度的影响很大,pH在8~9时,随着pH升高,水解度增大,在9时达到最大,之后呈下降趋势。酶是一种特殊的蛋白质,其催化反应的能力很大程度上受所处环境pH的影响。环境pH影响酶分子的构象及酶分子与底物的结合,所以pH过高或过低均不利于酶的活性从而影响酶促反应的速度。各种酶对底物的作用均有一个最佳的pH,碱性蛋白酶对鹅血血红蛋白作用的最适pH为9。
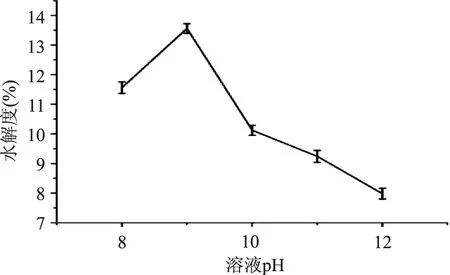
图3 溶液pH对水解度的影响Fig.3 Effect of pH on the degree of hydrolysis
2.1.4水解时间对水解度的影响从图4可以看出,酶促反应在开始时反应比较剧烈,5 h后反应趋于平缓,说明反应已经基本达到平衡。延长水解时间有利于提高水解度,但是超过5 h后对于反应的意义不大。综合生产过程中的电能消耗、生产周期、溶剂损失、经济效益和水解液的质量等因素,选取水解时间5 h适宜。

图4 水解时间对水解度的影响Fig.4 Effect of hydrolysis time on the degree of hydrolysis
2.2工艺优化实验
2.2.1响应面实验结果通过单因素实验确定实验的最佳水平,采用Box-Behnken进行实验设计,设计4因素3水平共29个实验,其中24个分析因素实验,5个零点实验,优化碱性蛋白酶酶解鹅血提取血红素的工艺条件。设计的实验方案和结果见表2。
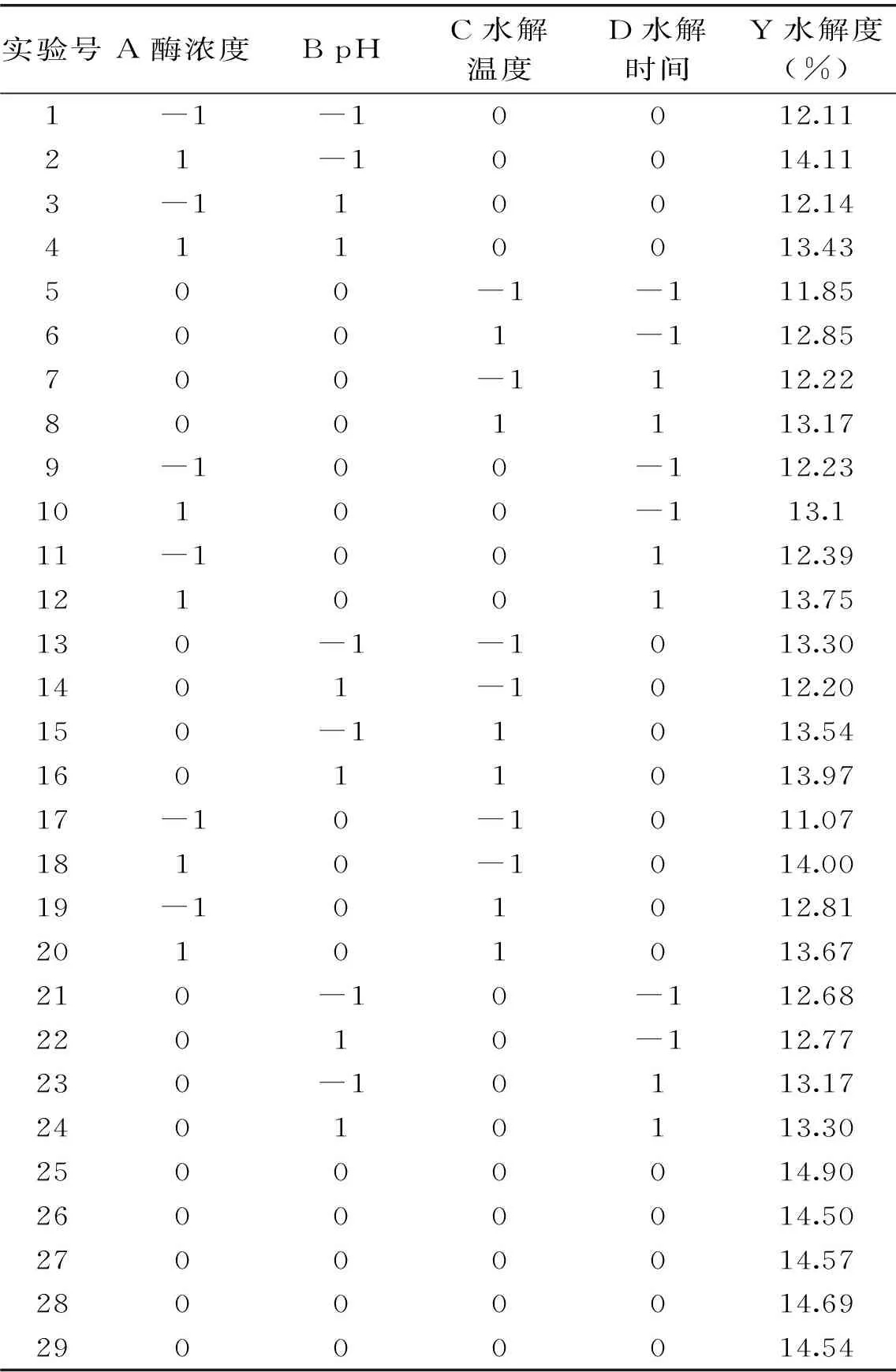
表2 Box-Behnken中心实验设计方案及结果
2.2.2回归模型的建立和方差分析使用响应面分析法对表2中的实验数据进行多元回归拟合,得到酶浓度、pH、水解温度、水解时间相关回归系数,其回归方程为:
Y=14.64+0.78A-0.092B+0.45C+0.21D-0.18AB-0.52AC+0.12AD+0.38BC+0.010BD-0.013CD-0.88A2-0.64B2-0.90C2-1.04D2
进一步对回归方程进行分析,所得的方差分析结果见表3。

2.2.3两因素交互作用分析酶浓度与水解温度、溶液pH和水解温度交互作用的响应面图,如图5所示。
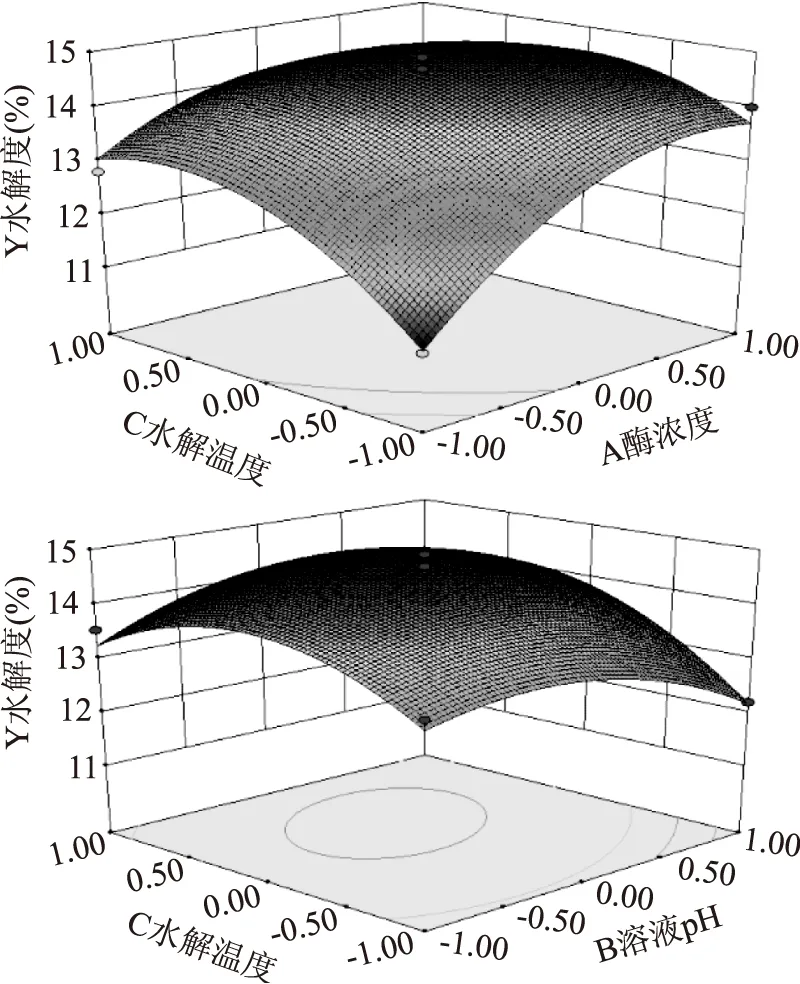
图5 交互作用对水解度的响应面图Fig.5 Response surface plot of effect of interaction on the degree of hydrolysis
依据响应面的等高线的形状越接近椭圆形和曲面倾斜度越陡,响应值对于处理条件改变的敏感程度越大,因素间交互作用越显著,反之则交互作用不显著[15]。由图5可以看出,在一定的范围内,水解度随着酶浓度和水解温度的增加而升高,两者交互作用为极显著。同样,可以看出,在一定的范围内,水解度随着溶液pH和水解温度的增加而升高,两者交互作用为显著;而酶浓度和pH、酶浓度和水解时间以及水解温度和水解时间交互作用不明显。
2.3最佳工艺的确定与验证
从上述回归模型中求得最佳工艺条件为:酶浓度5%、水解温度49.63 ℃、水解时间5.15 h、pH8.80,此条件下水解度预测值为14.60%。考虑到实际操作,将上述条件修正为:酶浓度5%、水解温度50 ℃、水解时间5.15 h、pH8.80。
验证实验结果表明:在修正的最佳工艺条件下,水解度为14.36%±0.18%,预测精度高达98.36%,再次证明回归模型的准确性。
2.4水解液中血红素及铁离子的含量
根据吸光度y对应标准血红素浓度x的关系,得到血红素的标准曲线方程为:y=0.04551x+0.00376,相关系数R2=0.9980,在0~10 μg/mL范围内呈现良好的线性关系。
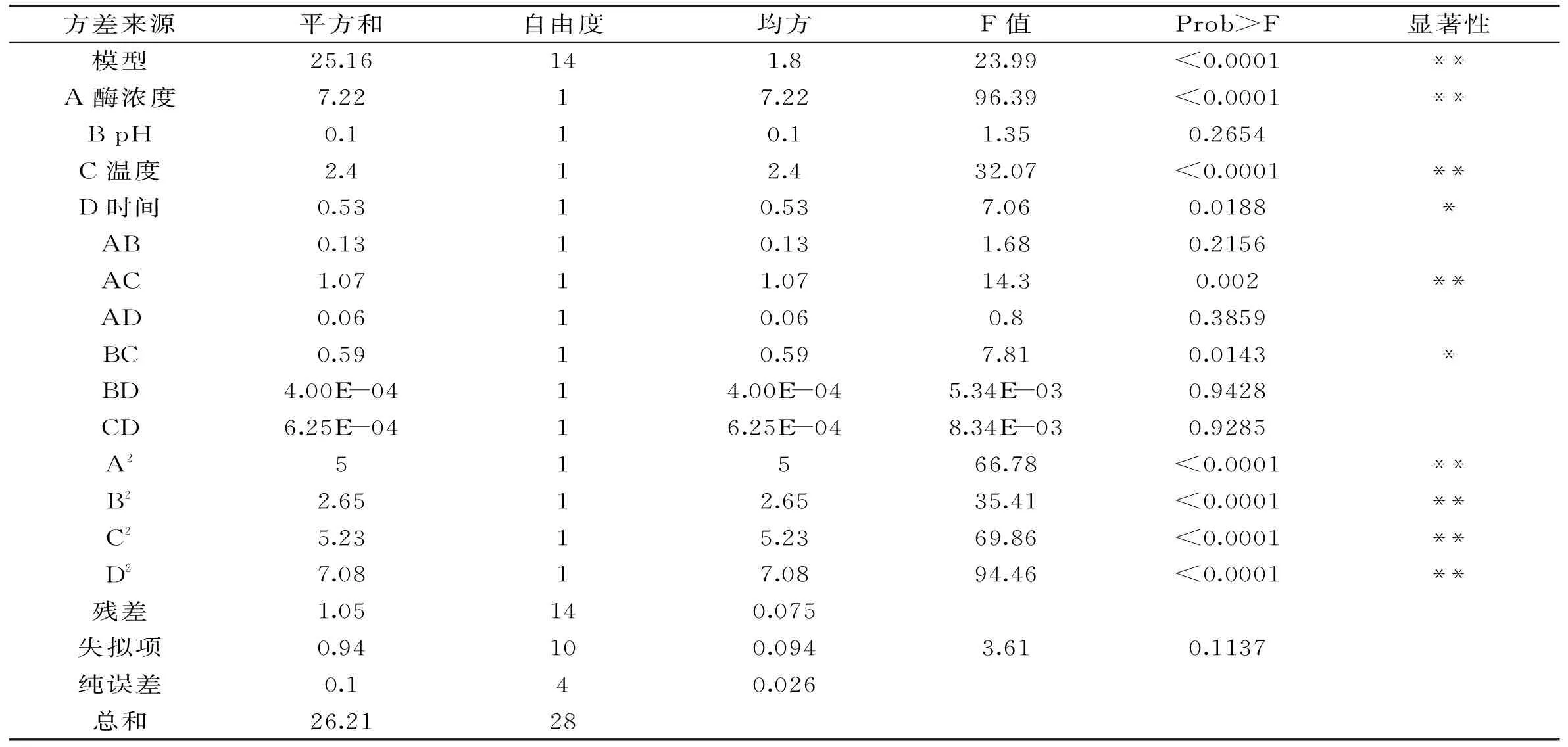
表3 水解度的回归方程各项的方差分析
注:p<0.01为极显著,用**表示;p<0.05为显著,用*表示。
优化工艺酶解鹅血,测水解液中血红素及铁离子的含量。得水解液中血红素的含量为1.210 mg/mL;铁离子的含量为90.42 μg/mL。
2.5水解液中游离氨基酸的测定
由鹅血酶解前后游离氨基酸含量(没有色氨酸标品未测色氨酸)分析结果见表4,可知,鹅血中含有18氨基酸,其中包括人体必需的8种氨基酸,且这些氨基酸不仅含量高,而且种类平衡。鹅血中游离必需氨基酸占总游离氨基酸的21.95%,游离必需氨基酸占游离非必需氨基酸的28.13%。鹅血酶解后,水解液中的游离必须氨基酸占总游离氨基酸的52.17%,游离必需氨基酸占游离非必需氨基酸的109.07%,人体必需氨基酸和婴儿体内不能合成的组氨酸共9种氨基酸,除苏氨酸减少外,其余的8种氨基酸百分含量均增加,总必需氨基酸所占百分比大大增加,酶解后水解液中必需氨基酸的百分比高达52.17%。本实验的必需氨基酸百分比,与高杨[16]酶解鹅血水解液中必需氨基酸的百分比为29.37%相比,远远高于其含量,并且种类更齐全。氨基酸能与铁离子络合,促进铁离子的吸收,酶解后水解液中氨基酸含量极高,水解液可大大促进人体对铁离子的吸收。陈洁等[17]研究表明氨基酸对硫酸亚铁有显著促进吸收的作用。所以,水解液可作为理想的补铁补血原料。此外,氨基酸提供几个健康益处,例如降低血液中的胆固醇,减少冠状动脉心脏疾病和提高抗肥胖症的潜力[18]。天冬氨酸、甘氨酸和谷氨酸也已知在伤口愈合的过程中发挥作用[19]。人们将酪氨酸、蛋氨酸、组氨酸、赖氨酸和色氨酸作为抗氧化剂[20],可生产优质的功能性食品。水解液中同时富含多肽,可作为富含小肽成分的蛋白质营养来源,提高蛋白的消化利用率,也可作为理想的配体,生产优质的饲料添加剂。

表4 鹅血酶解前后游离氨基酸含量
3 结论
本文通过单因素和响应曲面优化实验,得到了碱性蛋白酶酶解鹅血提取血红素的工艺条件为:酶浓度5%、水解温度50 ℃、水解时间5.15 h、pH8.80,该条件下水解度为14.36%±0.18%,预测精度高达98.36%,证明该模型具有准确性和可行性。
水解液中血红素的含量为1.210 mg/mL,铁离子的含量为90.42 μg/mL,游离必需氨基酸占总游离氨基酸的52.17%,游离必需氨基酸占游离非必需氨基酸的109.07%,可作为理想的补铁补血原料。
[1]葛静微,罗均,李小定,等. 响应面分析法优化血红素提取工艺[J]. 食品科学,2010,31(8):60-64.
[2]于长青,张丽娜,李夫庆. 肉牛血红素提取工艺的研究[J].中国农学通报,2005,21(11):74-77.
[3]于长青,任泊晓,修峰. 鹅血酶解液活性炭脱色效果的研究[J]. 中国食品添加剂,2007(1):66-69.
[4]赵立冬,高扬,于振新,等. 鹅血血红蛋白肽成分的分析[J]. 肉类工业,2010(7):26-28.
[5]范守城,张云茹,张昌莲,等. 鹅血的抗癌机理及其药物开发[J]. 水禽世界,2007(4):54-55.
[6]郑召君,张日俊. 畜禽血液的开发与研究进展[J]. 饲料工业,2014,17:019.
[7]汪学荣,王飞. 生物态补铁剂——血红素铁研究进展[J]. 粮食与油脂,2007(4):40-43.
[8]蔡君. 猪血生物法制备血红素及珠蛋白肽的工艺研究[D].武汉:湖北工业大学,2013.
[9]刘振斌. 牦牛血血红素提取工艺研究[D]. 兰州:甘肃农业大学,2012.
[10]Martins V G,Costa J A V,Hernandez C P. Hidrolisado protéico de pescado obtido por vias química e enzimática a partir de corvina(Micropogoniasfurnieri)[J]. Química Nova,2009,32(1):61-66.
[11]Kristinsson H G,Rasco B A. Fish protein hydrolysates: production,biochemical,and functional properties[J]. Critical Reviews in Food Science and Nutrition,2000,40(1):43-81.
[12]赵新淮,冯志彪. 大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
[13]张亚娟. 从猪血中酶法制取血红素的研究[D]. 无锡:江南大学,2007.
[14]冯绍平,李自静,黄兆龙,等. 云南不同地区橄榄中微量元素含量的测定与比较[J]. 北方园艺,2014(12):31-33.
[15]黎英,尤双圳,赖丹妮,等. 响应面法优化超声波辅助提取状元豆多糖工艺[J]. 食品与发酵工业,2015(4):223-229.
[16]李斌. 微胶囊血红素片生产技术研究[D]. 武汉:武汉工业学院,2010.
[17]陈洁,杨红芸. 氨基酸促进硫酸亚铁吸收的药效学研究[J]. 华西药学杂志,2001,16(6):419-420.
[18]González-Fandos E,Garca-Linares M C,Villarino-Rodrguez A,et al. Evaluation of the microbiological safety and sensory quality of rainbow trout(Oncorhynchusmykiss)processed by the sous vide method[J]. Food Microbiology,2004,21(2):193-201.
[19]Witte M B,Thornton F J,Tantry U,et al. L-Arginine supplementation enhances diabetic wound healing:involvement of the nitric oxide synthase and arginase pathways[J]. Metabolism,2002,51(10):1269-1273.
[20]Saito K,Jin D H,Ogawa T,et al. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J]. Journal of Agricultural and Food Chemistry,2003,51(12):3668-3674.
Enzymolysis goose blood preparation high amino acid goose blood heme
QIN Chun-qing1,HUANG Ke1,LI Ben-jiao1,CHENG Ya-jiao1,LENG An-zhong2,LIU Xiong1,*
(1.Coleege of Food Science,Southwest University,Chongqing 400715,China;2.Qing shui-wan Food Co.,Ltd.,of Chongqing,Chongqing 400715,China)
Box-Behnken experiment was designed to optimize the process conditions of alkaline protease enzyme goose blood to preparate high amino acid heme. The results showed that enzyme concentration had the greatest impact on the degree of hydrolysis,the next one was hydrolysis temperature,the third was the hydrolysis time and the last was the pH of solution. The optimal process conditions for goose blood preparation high amino acid goose blood heme were:enzyme concentration 5%,hydrolysis temperature 50 ℃,hydrolysis time 5.15 h and pH8.80,the degree of hydrolysis was 14.36%±0.18%. After hydrolysis,the content of heme in the hydrolysate was 1.210 mg/mL,and the content of iron ion was 90.42 μg/mL.
goose blood;enzymatic hydrolysis;degree of hydrolysis;high amino acids heme
2015-12-25
秦春青(1989-)女,硕士研究生,研究方向:食品化学与营养学,E-mail:158722614@qq.com。
刘雄(1970-)男,博士,教授,研究方向:碳水化合物资源开发与利用,E-mail:liuxiong848@hotmail.com。
TS201.1
B
1002-0306(2016)12-0172-06
10.13386/j.issn1002-0306.2016.12.025

