不补料酶膜耦合反应制备牛乳蛋白ACE抑制肽的研究
龚 洋,马海乐,王 洋,苟文来,熊 建,刘 芳
(江苏大学食品与生物工程学院,江苏省食品物理加工重点实验室,江苏镇江 212013)
不补料酶膜耦合反应制备牛乳蛋白ACE抑制肽的研究
龚洋,马海乐*,王洋,苟文来,熊建,刘芳
(江苏大学食品与生物工程学院,江苏省食品物理加工重点实验室,江苏镇江 212013)
为了克服传统酶解技术的不足,提高酶解反应效率,采用不补料酶膜耦合反应制备牛乳蛋白ACE抑制肽。考察超滤膜对牛乳蛋白及酶的截留、膜通量及滤出液的ACE抑制率和IC50的影响,确定出超滤膜最佳的截留分子量为5000 u;研究了反应时间、底物浓度、加酶量和循环泵转速对蛋白转化率的影响,确定最优酶解工艺条件:底物浓度7%(W/W)、加酶量2000 U/g、反应时间100 min、循环泵转速100 r/min,该条件下蛋白转化率、单位酶产肽量、ACE抑制率分别达到53.16%、39.59 g肽/g酶、76.81%,与对照组相比蛋白转化率、单位酶产肽量、ACE抑制率分别提高了16.99%、16.61%、18.55%;采用高效凝胶过滤色谱法测定超滤液中ACE抑制肽的分子量分布,发现样品中分子量≤2253 u组分质量分数为94.62%,超滤膜对截留分子量大小控制准确。因此不补料酶膜耦合反应可为酶法制备牛乳蛋白ACE抑制肽提供一种更为高效的方法。
牛乳蛋白,酶膜耦合,ACE抑制肽,蛋白转化率
牛乳蛋白是人类膳食蛋白质的重要来源,不仅为人类提供丰富的营养,还包含具有降血压活性的血管紧张素(Angiotensin I-converting enzyme,ACE)抑制肽等多种生物活性肽的序列,食用安全性高、无副作用[1-3]。传统酶法制备ACE抑制肽采用先酶解再膜分离的制取工艺,存在产品均一性差、酶消耗量大、多肽产率低、工序繁琐等缺点[4-5]。相比之下,酶膜耦合反应制备ACE抑制肽,在酶解反应的同时,实现生物小分子多肽在线分离,减少产物抑制效应,产物分布集中,酶和大分子多肽及蛋白等未反应的物质则返回反应体系继续反应,提高了酶的利用率,从而得到更高的底物转化率[6-7]。近年来,大量研究表明酶膜耦合技术可以改善传统间歇酶解制备ACE抑制肽的不足,显著提高反应效率及产物活性。丁青芝[8]等人以蛋白转化率为指标,研究了三种酶膜耦合制备活性多肽的模型,结果表明连续酶膜耦合模型可大大提高活性多肽的产能;姜瞻梅[9]等采用10000 u和3000 u的超滤膜分离酪蛋白酶解物中的ACE抑制肽,证明超滤技术是一种分离ACE抑制肽的有效手段;Cheison[10]等人利用响应面优化乳清蛋白在切变流酶膜反应器中的工艺参数,重点研究了底物浓度、加酶量和膜通量对酶膜反应器运行状况的影响。本文以牛乳蛋白为原料,在前期选酶及传统酶解最优工艺基础上,考察酶膜耦合反应过程中操作参数对蛋白转化率的影响,探索制备牛乳蛋白ACE抑制肽的有效方法,并采用高效凝胶过滤色谱法测定其相对分子量分布,为酶膜耦合技术在食品加工中的应用提供实验依据和参考。
1 材料与方法
1.1材料与仪器
光明脱脂奶粉蛋白含量34%,市售;血管紧张素转化酶(ACE)酶活力4.2 U/mL;马尿酰组氨酰亮氨酸(N-Hippuryl-L-histidyl-L-leucine,HHL)Sigma公司;Neutrase(中性蛋白酶)酶活力119987 U/mL,南京诚纳化工有限公司;乙腈德国默克MERCK公司;牛血清白蛋白(67000 u)、细胞色素C(12500 u)、杆菌酶(1450 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(451 u)、色氨酸(204 u)Sigma公司;盐酸、三氟乙酸、氢氧化钠国药集团化学试剂有限公司。
Pellicon小型超滤系统包含截留分子量为5000、3000、1000 u的再生纤维素复合膜,美国Millipore公司;BT600S型蠕动泵保定雷弗流体科技有限公司;WFJ7200型可见分光光度计尤尼柯(上海)仪器有限公司;PHS-3C酸度计上海鸿盖仪器有限公司;Agilent 1100高效液相色谱系统美国安捷伦公司;Waters 1525型高效液相色谱仪美国Waters公司。
1.2酶膜耦合反应实验方法
1.2.1超滤膜截留分子量的选择实验以超滤膜通量、透过液ACE抑制率为考核指标,通过传统的酶解实验,确定最佳的超滤膜截留分子量。在底物浓度9%、加酶量1500 U/g、水解温度50 ℃、pH7.0的条件下酶解60 min,沸水浴灭酶10 min,5000 r/min离心10 min后取上清液,采用不同截留分子量(5000、3000、1000 u)的膜进行超滤。超滤过程中循环泵转速设为100 r/min,料液温度维持50 ℃,操作压力0.09 MPa。测定膜通量、透过液ACE抑制率。
1.2.2超滤膜对蛋白质和酶截留情况的评价实验对于酶膜耦合反应,需要评价膜对蛋白和蛋白酶的截留情况[11-12]。
对蛋白的截留情况实验:取m1(81 g)牛奶粉配制成9%的溶液,在温度50 ℃、转速100 r/min、压力0.09 MPa的条件下过5000 u的膜循环1 h,收集渗透液并浓缩冻干,称重为m2(2 g),截留率即为97.53%。
对蛋白酶的截留情况实验:在底物浓度9%、加酶量1500 U/g、温度50 ℃,pH7、压力0.09 MPa的条件下,以5000 u的膜进行酶膜耦合反应100 min,每隔20 min测透过液和截留液的酶活。截留率为截留液中酶活力单位总数与原始反应液中酶活力单位总数的百分比,透过率为透过液中酶活力单位总数与原始反应液中酶活力单位总数的百分比。
1.2.3不补料酶膜耦合反应条件的优化以牛奶蛋白转化率为考核指标,通过实验优化不补料模式下最佳酶膜耦合反应的条件。选用中性蛋白酶、5000 u再生纤维素复合膜,对牛奶蛋白进行连续循环酶膜耦合反应。超滤装置如图1所示,在中性蛋白酶产品提供的最适温度50 ℃和pH7.0下,考察酶解反应时间、底物浓度、加酶量、循环泵转速对牛奶蛋白转化率的影响。各单因素的取值分别为:在底物浓度9%、加酶量1500 U/g、循环泵转速100 r/min下,酶解反应时间20、40、60、80、100、120、140、160 min;在酶解反应时间100 min、加酶量1500 U/g、循环泵转速100 r/min下,底物浓度3%、5%、7%、9%、11%、13%;在酶解反应时间100 min、底物浓度7%、循环泵转速100 r/min下,加酶量1000、1500、2000、2500、3000 U/g;在酶解反应时间100 min、底物浓度7%、加酶量2000 U/g下,循环泵转速60、80、100、120 r/min。
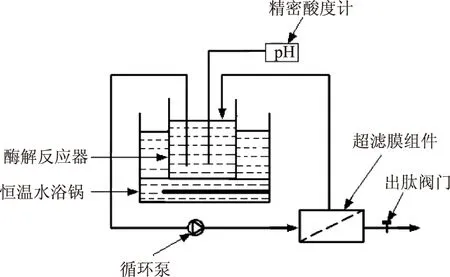
图1 不补料连续酶膜耦合反应装置示意图Fig.1 Demonstration of continuous membranereactor without new material feeding
1.2.4超滤透过液组分的相对分子量分布采用高效凝胶过滤色谱法测定超滤液的相对分子量分布[13]。Waters液相色谱系统:Waters 1525泵,Waters 2998 PDA检测。色谱条件:色谱柱为TSK-GEL G2000SW×L(7.8 mm×300 mm,5 μm);流动相A,水∶三氟乙酸=100∶0.1;流动相B,乙腈∶三氟乙酸=100∶0.1;检测波长:UV 220 nm;流速0.5 mL/min;柱温30 ℃;进样体积30 μL;洗脱条件:梯度洗脱,可使复杂样品中性质差异较大的组分能按各自适宜的容量因子k达到良好的分离目的,使峰型得以改善,增加灵敏度。依据样品的色谱数据计算超滤液中多肽的相对分子量及其分布范围所占质量分数。梯度洗脱条件如表1所示。
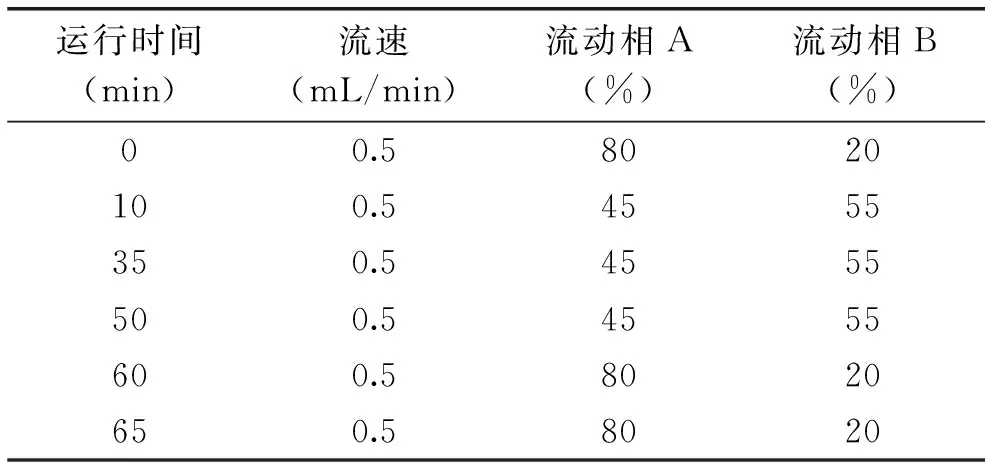
表1 梯度洗脱条件
蛋白质分子量标准曲线的绘制:准确称取牛血清白蛋白(67000 u)、细胞色素C(12500 u)、杆菌酶(1450 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(451 u)、色氨酸(204 u)各0.1 g,分别溶于流动相(乙腈∶水∶三氟乙酸=45∶55∶0.1)100 mL,再各取25 mL混合制成混标。在上述条件下进样,记录相应保留时间,以蛋白质标准样分子量对数值对标准样保留时间作图,得出标准曲线回归方程。
1.2.5对照酶解实验在传统酶解最优条件下进行酶解[14-16],即底物浓度9%、加酶量1500 U/g、水解温度50 ℃、pH7.0、酶解时间60 min,酶解结束后灭酶(沸水浴10 min)、离心(5000 r/min),取上清液过5000 u的超滤膜,测定透过液的ACE抑制率、蛋白转化率及单位酶产肽量。
1.3主要指标的测定方法
1.3.1膜通量的测定
式中:J-透过速率,mL·(m2·min)-1;V-透过组分的体积,mL;A-超滤膜有效面积,m2(本实验用的膜包面积为0.1 m2);t-超滤时间,min。
1.3.2蛋白酶的活力测定采用中华人民共和国专业标准SB/T 10317-1999测定蛋白酶活力。
1.3.3蛋白转化率的计算蛋白含量采用福林酚法[17]进行测定。蛋白转化率X(%)以透过液中蛋白质含量占原料液中蛋白含量的百分比计算。
式中:X-蛋白转化率(%);C0-原料液蛋白含量(mg·mL-1);V0-原料液总体积(mL);C1-透过液蛋白含量(mg·mL-1);V1-透过液总体积(mL)。
1.3.4单位酶产肽量单位酶产肽量Q(g肽/g酶)定义为单位质量酶产生目标肽制品的质量,以肽制品的质量与蛋白酶的质量比计算。超滤液真空冷冻干燥后得到的产品质量即为肽制品质量。
1.3.5ACE抑制率的测定参照吴琼英的测定方法并适当改进[18]。吸取10 μL样品溶液,加入25 μL ACE溶液(用加盐的硼酸缓冲液稀释10倍),在37 ℃的水浴锅中反应10 min后加入40 μL HHL,在37 ℃条件下继续反应30 min,尽快加入85 μL 1 mol/L HCl终止反应,得到反应液。将反应液用0.22 μm滤膜过滤后用于HPLC分析。同时用10 μL pH8.3的硼酸缓冲液替代样品溶液制备反应液,作为空白对照组。液相色谱条件:色谱柱:ZORBAX SB-C18分析用色谱柱(4.6 mm×150 mm,填料粒径为5 μm);流动相:乙腈-超纯水(体积比为25∶75,各含0.05%体积分数的三氟乙酸),等梯度洗脱;流速:1 mL/min;柱温:25 ℃;进样量:10 μL。
式中:ACEI-ACE抑制率,%;A-空白对照组Hip的峰面积;B-添加ACE抑制肽组Hip的峰面积。
称取一定质量样品配成不同浓度的溶液(0.5、1.0、1.5、2.0、2.5 mg/mL),以浓度为横坐标,抑制率为纵坐标绘成圆滑的曲线,从曲线中计算IC50值。
1.4数据处理
2 结果与讨论
2.1超滤膜的选择
2.1.1不同截留分子量膜对膜通量的影响图2为不同截留分子量膜对膜通量的影响。由图2可以看出,在压力0.09 MPa条件下5000 u的膜对酶解液具有较高的膜通量,其平均值分别是3000 u膜的1.2倍和1000 u膜的4倍左右,因此从膜通量的角度来看,5000 u的膜比较合适。

图2 超滤时间对膜通量的影响Fig.2 Influence of ultra-filtration time on flux of membrane
2.1.2不同截留分子量膜对透过液ACE活性的影响图3为不同截留分子量膜对透过液ACE抑制活性的影响。由图3可以看出,未经超滤的酶解液其ACE抑制率较低,而经过超滤膜处理的酶解液其ACE抑制率有了大幅度的提高,通过SPSS分析四者ACE抑制活性有显著性差异,这表明超滤可以实现ACE抑制肽活性成分的分离与浓缩,为制取高活性的ACE抑制肽提供一种更为有效的方法。但是3000 u和1000 u的膜通量与5000 u的膜比相对较小,因此为了提高原料的利用率和生产效率,综合考虑选用5000 u分子量的膜作为酶膜耦合的实验用膜。与未经超滤相比,5000 u膜过滤液ACE抑制率提高了45.22%,IC50下降了31.03%。

图3 不同超滤膜透过液ACE抑制率及其IC50Fig.3 Inhibitory rate of ACE and IC50by ultra-filtration of various membrane
2.1.3超滤膜对原料及酶的截留及透过情况评价实验发现,超滤100 min,5000 u的膜对牛奶蛋白原料的截留率高达97.53%,说明5000 u的再生纤维素复合膜对原料具有良好的截留性。
图4为截留液中酶的活力截留率和透过液中酶的活力透过率随时间的变化图。由图4可以看出,透过液中酶活力透过率始终维持较低水平(<5%),说明所用的5000 u的膜对中性蛋白酶几乎完全截留,而截留液中维持着较高的酶活力截留率(>90%),这表明在酶膜耦合的反应过程中,酶得到了充分地循环利用,因此5000 u的再生纤维素复合膜可以作为实验用膜。

图4 超滤膜对蛋白酶的截留及透过情况Fig.4 Proteases retension and permeation of 5000 u ultra-filtration membrane
2.2不补料酶膜耦合反应条件的优化
2.2.1酶膜耦合反应时间对蛋白转化率的影响蛋白转化率随酶膜耦合反应时间的变化趋势如图5所示。由图5可知,反应初期随着酶膜耦合时间的延长,蛋白转化率快速增长,而100 min以后其增长的趋势平缓,蛋白转化率不再显著增加。酶膜耦合反应可以显著提高蛋白转化率的主要原因在于小分子肽的及时排除,减小了产物抑制效应。酶解100 min以后,底物逐渐不足,受酶催化蛋白质的解聚过程趋于结束,且反应过程失去大量的水,反应体系中料液粘稠致使膜通量下降,影响了蛋白转化率的继续提升[19]。所以,最终确定100 min为酶膜耦合反应时间。
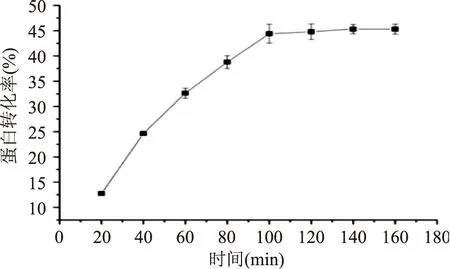
图5 酶膜耦合反应时间对蛋白转化率的影响Fig.5 Influence of time on conversion ratio of protein
2.2.2底物浓度对蛋白转化率的影响底物浓度对蛋白转化率的影响见图6。由图6可知,底物浓度越高,蛋白转化率反而越低。这主要是因为随着底物浓度的不断增大,物料粘度增加使膜通量相应降低,膜通量的减小影响了透过液的体积,从而使蛋白转化率降低。

图6 不同底物浓度对蛋白转化率的影响Fig.6 Influence of different substrate concentration on conversion ratio of protein
图7为不同底物浓度对蛋白转化率及ACE抑制活性的影响。由图7可知,就底物浓度对酶解产物的ACE抑制活性的影响而言,过低的底物浓度会造成产物ACE抑制活性降低,随着底物浓度的增加产物ACE抑制活性显著升高。酶解100 min时,底物浓度3%的蛋白转化率为62.39%,ACE抑制率仅为40.69%;底物浓度13%的蛋白转化率为28.41%,ACE抑制率高达80.31%。综合考虑蛋白转化率和产物ACE抑制率,选择底物浓度为7%,其蛋白转化率和ACE抑制率分别为47.92%和74.11%。

图7 不同底物浓度对蛋白转化率及ACE抑制率的影响Fig.7 Influence of different substrate concentration on conversion ratio of protein and inhibitory rate of ACE
2.2.3加酶量对蛋白转化率的影响加酶量对蛋白转化率的影响如图8所示。由图8可以看出,在相同时间内,加酶量低于2000 U/g时,蛋白转化率随着加酶量的增加有明显的提高;而加酶量高于2000 U/g时,蛋白转化率无明显增加,其直接原因在于底物蛋白已被蛋白酶所饱和,再增加酶浓度对体系的反应无明显影响[20],综上所述,选择加酶量为2000 U/g。

图8 加酶量对蛋白转化率的影响Fig.8 Influence of enzyme concentration on conversion ratio of protein
2.2.4蠕动泵转速对蛋白转化率的影响蠕动泵转速对蛋白转化率的影响如图9所示。随着蠕动泵转速增加,蛋白转化率相应提高。这是由于蠕动泵转速增加,有利于多肽在线分离和底物转化,促使蛋白转化率提升[21-22]。但是转速过快,会导致酶与底物接触时间减少,造成酶解不充分,如图9所示出现了转速为120 r/min时蛋白转化率低于80 r/min的蛋白转化率。经测定转速100 r/min以后膜通量增加不明显,维持在120.13 mL·(m2·min)-1左右,其蛋白转化率达最大值,因此选择100 r/min作为实验最优循环转速。

图9 不同蠕动泵转速对蛋白转化率的影响Fig.9 Influence of different cycle pump speed on conversion ratio of protein
通过单因素逐级优化实验,得到最佳的酶膜耦合反应条件为:酶膜耦合时间100 min、底物浓度7%(W/W)、加酶量2000 U/g、循环泵转速100 r/min。在此条件下,蛋白转化率为53.16%、ACE抑制率为76.81%,单位酶产肽量为39.59 g肽/g酶。利用传统的酶解方法,蛋白转化率为45.44%、ACE抑制率为64.79%、单位酶产肽量为33.95 g肽/g酶。因此,就牛奶蛋白的不补料酶膜耦合反应而言,蛋白转化率、ACE抑制率、单位酶产肽量分别提高了16.99%、18.55%、16.61%。
2.3超滤透过液组分的相对分子量分布
以标准品相对分子量对数值对保留时间作图,得出标准曲线回归方程:Y=-0.283X+7.981(R2=0.998),式中X为保留时间,Y为相对分子量对数值。
采用高效凝胶过滤色谱法测定最优条件下超滤透过液组分的相对分子量分布,由图10可以看出,大面积的峰其保留时间靠后,超滤液中绝大部分物质的分子量较小,这表明酶膜耦合能较为准确地控制超滤液的分子量大小[23-24],使透过液的分子量主要集中在5000 u以下。
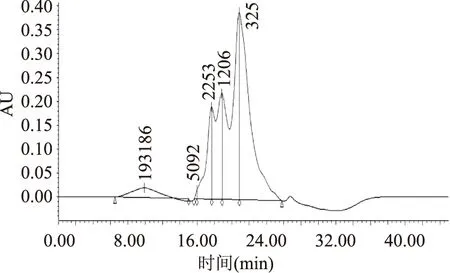
图10 超滤组分高效凝胶排阻色谱图Fig.10 The high performance size exclusionchromatography of the permeate fraction
使用GPC数据处理软件,将样品的色谱数据代入标准曲线回归方程中计算,即可得到超滤液中多肽的相对分子量及其分布范围所占质量分数,结果如表2所示。从表2中可知,超滤液中相对分子量分布在2253 u及其以下组分的质量分数为94.62%。本课题组多年研究发现,具有ACE抑制活性的多肽主要为3000 u以下的小分子片段[25],由此可见酶膜耦合可以富集这些高活性物质,从而提高产物的ACE抑制活性。

表2 超滤透过液的相对分子量分布
3 结论
实验确定了5000 u的再生纤维素复合膜为分离富集产物的适宜膜包,对牛奶蛋白和中性蛋白酶具有较好的截留功能。
通过单因素实验确定的酶膜耦合最佳反应工艺为:底物浓度7%(W/W)、加酶量2000 U/g、反应时间100 min、循环泵转速100 r/min,在最优条件下酶解,蛋白转化率为53.16%、ACE抑制率为76.81%,单位酶产肽量为39.59 g肽/g酶。与对照组相比,蛋白转化率、ACE抑制率、单位酶产肽量分别提高了16.99%、18.55%、16.61%。
采用高效凝胶过滤色谱法测定了超滤液中ACE抑制肽的分子量分布,其分子量≤2253 u的组分质量分数为94.62%,表明酶膜耦合可以较准确地控制截留分子量大小,可以富集高活性物质,提高产物的ACE抑制活性。
通过产物的在线分离和酶的循环利用,酶膜耦合反应技术克服了传统酶解技术的不足,提高了蛋白转化率和单位酶产肽量,从而节约了生产成本,提高了生产效率,可为工业化生产牛乳蛋白ACE抑制肽提供参考和依据。
[1]于晓庆,王雄,司佳. 酶法制备乳源ACE抑制肽[J]. 食品研究与开发,2011,32(9):134-136.
[2]Fitzgerald R J,Meisel H. Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme[J]. British Journal of Nutrition,2000,84:33-37.
[3]洪伟. 酪蛋白中血管紧张素转换酶(ACE)抑制肽的研究[D]. 芜湖:安徽工程大学,2010.
[4]魏春燕. 酪蛋白非磷肽酶膜耦合法制备ACE抑制肽[D]. 无锡:江南大学,2011.
[5]崔洁,孔祥珍,周惠明,等. 小麦面筋蛋白预处理及酶膜耦合连续反应研究[J]. 食品工业科技,2011,32(6):188-191.
[6]熊治清,徐志宏,魏振承,等. 酶膜反应器在蛋白酶解过程中的研究进展[J]. 食品科技,2010,35(1):88-92.
[7]QU Wenjuan,MA Haile,ZHAO Weirui,et al. ACE-inhibitory peptides production from defatted wheat germ protein by continuous coupling of enzymatic hydrolysis and membrane separation:Modeling and experimental studies[J]. Chemical Engineering Journal,2013,226:139-145.
[8]丁青芝,马海乐,骆琳,等. 酶解-膜分离耦合技术制备米糠蛋白活性多肽的研究[J]. 高校化学工程学报,2009,23(4):632-638.
[9]姜瞻梅,田波,吴刚,等. 酶解牛乳酪蛋白制备ACE抑制肽的研究[J]. 中国食品学报,2007,7(6):39-43.
[10]Seronei C C,ZHANG Wang,ZHANG Wang. Hydrolysis of whey protein isolate in a tangential flowfilter membrane reactor Ⅱ[J]. Journal of Membrane Science,2006,286:322-332.
[11]姚喜梅. 连续式酶膜耦合反应制备魔芋葡甘露寡糖[D]. 北京:中国农业科学院,2011.
[12]齐崴,何志敏,何明霞. 酶解反应与膜分离耦合连续制备酪蛋白磷酸肽[J]. 化学工程,2006,34(4):43-46.
[13]刘妍妍,张丽萍. 牛乳酪蛋白源降血压肽的分离及其分子量分布研究[J]. 中国乳品工业,2006,34(5):26-28.
[14]徐鑫,蔡丽丽,刘国艳,等. 响应曲面法优化酶解条件制备乳源ACE抑制肽[J]. 食品科学,2012,33(5):208-212.
[15]张艳,胡志和,闫星,等. 胃蛋白酶水解酪蛋白制备ACE抑制肽的条件[J]. 食品科学,2010,31(14):42-46.
[16]OTTE J,SHALABY S M,ZAKORA M,et al. Angiotensin converting enzyme inhibitory activity of milk protein hydrolysates:Effect of substrate,enzyme and time of hydrolysis[J]. International Dairy Journal,2007,17:488-503.
[17]陈钧辉,陶立,李俊,等. 生物化学实验[M]. 北京:科学出版社,2003:59-61.
[18]吴琼英,马海乐,骆琳,等. 高效液相色谱法测定血管紧张素转化酶抑制剂的活性[J]. 色谱,2005,23(1):79-81.
[19]陈耿华,王磊,王强,等. 用于连续制备乳清蛋白ACE抑制肽的酶膜反应器运行条件优化[J]. 农产品加工,2011(9):4-7.
[20]YANG Sen,DING Wenyong,CHEN Hongzhang. Enzymatic hydrolysis of corn stalk in a hollow fiber ultrafiltration membrane reactor[J]. Biomass and Bioenergy,2009,33:332-336.
[21]黄文浩. 连续化酶膜耦合法制备高活性ACE抑制玉米肽研究[D]. 武汉:华中农业大学,2011.
[22]WU Shufen,QI Wei,LI Tonghe,et al. Simultaneous production of multi-functional peptides by pancreatic hydrolysis of bovine casein in an enzymatic membrane reactor via combinational chromatography[J]. Food Chemistry,2013,141:2944-2951.
[23]蒋菁莉,任发政,蔡华伟. 牛乳酪蛋白降血压肽的超滤分离[J]. 食品科学,2006,27(7):124-128.
[24]夏镇波. 酪蛋白源血管紧张素转化酶抑制肽制备及分离纯化研究[D]. 南京:南京农业大学,2008.
[25]李文,马海乐,王金斌. 酶解反应与膜分离耦合连续制备紫菜降血压肽[J]. 食品开发与机械,2008(10):71-75.
ACE-inhibitory peptides derived from milk protein by continuous coupling of enzymatic hydrolysis and membrane separation without material feeding
GONG Yang,MA Hai-le*,WANG Yang,GOU Wen-lai,XIONG Jian,LIU Fang
(School of Food and Biological Engineering,Jiangsu University,Jiangsu Provincial Key Laboratory for Food Physical Processing,Zhenjiang 212013,China)
To overcome disadvantage of traditional enzymatic hydrolysis and improve reaction effect,ACE-inhibitory peptides from milk protein were prepared by coupling of enzymatic hydrolysis and membrane separation. According to the comparison of protein retention,protease retention,membrane flux,permeates’ ACE-inhibitory activity and IC50,the molecular weight of ultra-filtration membrane was determined as 5000 u. The effects of reaction time,substrate concentration,enzymatic dosage and cycle pump speed on conversion ratio of protein were investigated respectively. The optimal conditions obtained from the single factor tests were:substrate concentration 7%(W/W),enzymatic dosage 2000 U/g,reaction time 100 min and cycle pump speed 100 r/min. Under the optimal conditions,conversion ratio of protein reached 53.16% with productivity of 39.59 g peptide·(g protease)-1and the inhibitory rate of ACE was 76.81%. Compared with the control group,the three contents were increased by 16.99%,16.61% and 18.55% respectively. The relative molecular weight of permeates was measured by high performance size exclusion chromatography(HPSEC). The results showed that the molecular weight could be effectively controlled by ultra-filtration and 94.62% of sample was less than 2253 u. Therefore,it is suggested that the reaction of coupling of enzymatic hydrolysis and membrane separation can provide a more effective method for the preparation of ACE-inhibitory peptides from milk protein.
milk protein;coupling of enzymatic hydrolysis and membrane separation;ACE-inhibitory peptides;conversion ratio of protein
2015-12-25
龚洋(1990-),女,硕士研究生,研究方向:食品分离及食品生物技术,E-mail:gongyangln@163.com。
马海乐(1963-),男,教授,研究方向:食品分离及食品生物技术,E-mail:mhl@ujs.edu.cn。
国家863计划课题(2013AA102203)。
TS201.1
B
1002-0306(2016)12-0166-06
10.13386/j.issn1002-0306.2016.12.024

