分散固相萃取-超高效液相色谱-串质谱法测定豆芽中10 种植物生长剂和杀菌剂
程盛华,杨春亮,曾绍东,魏晓奕,王明月,李积华
(中国热带农业科学院农产品加工研究所,农业部农产品加工质量安全风险评估实验室,广东湛江 524001)
分散固相萃取-超高效液相色谱-串质谱法测定豆芽中10 种植物生长剂和杀菌剂
程盛华,杨春亮,曾绍东,魏晓奕,王明月,李积华*
(中国热带农业科学院农产品加工研究所,农业部农产品加工质量安全风险评估实验室,广东湛江 524001)
建立了一种同时分析豆芽中10种植物生长调节剂和杀菌剂的分散固相萃取-超高效液相色谱-串联质谱法(UPLC-MS/MS)的检测方法。样品经过1%酸化乙腈提取,PSA、C18、GCB吸附剂净化,UPLC-MS/MS多反应监测模式测定,外标法定量,检测结果显示:多菌灵、6-苄基氨基嘌呤、吲哚乙酸、赤霉素、恩诺沙星、2,4-二氯苯氧乙酸、多效唑、咪鲜胺、涕灭威和甲基托布津10种药物浓度在5.0~200.0 μg/L范围内呈良好线性关系,相关系数均大于0.99,加标回收率为80.4%~99.8%,相对标准偏差(RSD%)为2.0%~7.8%,方法检出限为0.2~2.6 μg/kg。该方法简单、快速、可靠。串联质谱法在很大程度上减少了基质干扰,减少了假阳性现象的产生。
植物生长调节剂,杀菌剂,超高效液相色谱-串联质谱法,分散固相萃取,豆芽
豆芽具有丰富的食用价值,深受人们的喜爱,但是不少黑心作坊为了缩短豆芽生长周期,增加品相,使豆芽看起来更肥嫩白净,在生产过程中违规添加多种植物生长剂和杀菌剂。一些植物生长调节剂有蓄积毒性,导致各种疾病的出现,如Erin等通过大鼠实验,发现赤霉素能引起形成肿瘤的肥大细胞增多[1],而2,4-二氯苯氧乙酸可能引起非霍奇金淋巴瘤[2],滥用植物生长调节剂会给健康带来风险,已成为目前食品安全领域的一个重大问题[3-5]。随着近年“毒豆芽”事件不断曝光,政府对食品安全也越来越重视,农业部成立了专门研究豆芽的风险评估中心,深入研究豆芽中的非法添加药物和对人体健康的危害。国家标准(GB2760-2014)《食品安全国家标准 食品添加剂使用标准》中明确规定人工合成激素,如2,4-二氯苯氧乙酸(2,4-D)和6-苄氨基腺嘌呤(6-BA)不再作为食品添加剂使用,其它植物生长调节剂包括天然植物激素如赤霉素、吲哚乙酸也不允许应用于豆芽生产中。
植物生长调节剂和杀菌剂种类多,包括人工合成农药、植物内生激素、抗生素和兽药,化学性质差别大且残留量低,净化和测定要求高,目前植物生长调节剂和杀菌剂的测定仪器有液相色谱法、气质联用法和液质联用法[6-10],检测标准有SN/T 3725-2013和GB/T23381-2009[11-12],豆芽中相关检测方法主要集中在单一组分或者是单一类型药物,如恩诺沙星、6-BA、赤霉素、2,4-D等药物[13]。多菌灵、恩诺沙星、多效唑和咪鲜胺等药物主要是具有保鲜和杀菌的作用,6-BA、吲哚乙酸、2,4-D和赤霉素等药物主要是促进细胞分裂和加快生根的作用[14-16]。QuEChERS(Quick Easy Cheap Effective Rugged Safe)技术,是近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术,具有以下优势:回收率、精确度、准确度高,可分析的农药范围广,分析速度快,溶剂使用量少,污染小,操作简便。针对豆芽前处理过程复杂,检测参数单一,采用QuEChERS技术减少了溶剂消耗,超高效液相色谱-串联质谱法同时测定10种植物生长调节剂和杀菌剂,缩短了分析时间,该法具有快速、灵敏和准确等优点,可以应用于豆芽的批量检测。
1 材料与方法
1.1材料与仪器
多菌灵(纯度≥96.7%)、6-苄基氨基嘌呤(纯度≥99.0%)、吲哚乙酸(纯度≥96.2%)、赤霉素(纯度≥93.6%)、恩诺沙星(纯度≥98.5%)标准品德国Dr. Ehrenstorfer公司;2,4-二氯苯氧乙酸、多效唑、咪鲜胺、涕灭威、甲基托布津(100.0 mg/L)标准品农业部环境质量监督检验测试中心;甲醇、乙腈、甲酸、乙酸美国Fisher 公司(均为色谱纯);水为Milli-Q系统纯化水;1%酸化乙腈(乙酸∶乙腈=1∶100 v/v)、N-丙基乙二胺(PSA)、十八烷基键合硅胶(C18)、石墨化炭黑(GCB)分散固相萃取吸附剂上海安谱实验科技股份有限公司;氯化钠(用前经120 ℃烘干6 h后)和无水硫酸镁(用前在马弗炉550 ℃灼烧4 h后)广州试剂厂,均为分析纯,于干燥器中贮存,备用。
ACQUITY TM超高效液相色谱仪和XevoTM TQD-MS质谱仪配有电喷雾电离(Electrospray ionization,ESI)接口及Masslynx数据处理系统美国Waters公司;Milli-Q超纯水器美国Millipore公司;CR22GⅢ型高速冷冻离心机日本HITACHI公司;AUY220型电子分析天平日本Shimadzu公司;N-Evap112氮吹仪美国Organomation Associates公司;涡旋混合器MS3、分散均浆机T25德国IKA公司;移液枪20~200 μL、1~5 mL德国Eppendorf公司。
1.2样品制备
黄豆芽、绿豆芽、黑豆芽、豌豆苗均在市场购买,基质豆芽选用成熟无蛀虫的优质黄豆、绿豆、黑豆、豌豆于实验室放在无油、底部有小孔的玻璃器皿中浸泡一段时间,上面放一块吸水的湿布,每天浇水数次,保持湿度,避光培养4~6 d。
1.3样品前处理
1.3.1提取准确称取10.00 g粉碎均匀试样于50 mL聚乙烯离心管中,加入15 mL 1%酸化乙腈提取液,在均质机上以10000 r/min均质1 min后,静置5 min,在4 ℃ 8000 r/min离心5 min,离心后取出上清液,再加入10 mL 1%酸化乙腈提取液,在旋涡混合器上以3000 r/min 涡旋1 min,重复上述操作,合并提取液,加入7 g 氯化钠,涡旋1 min,静置10 min,8000 r/min离心1 min,分离上层有机相于25 mL烧杯中,在45 ℃水浴中氮吹至近干,加2 mL乙腈溶解残渣,涡旋30 s,待净化。
1.3.2净化将待净化液倒入装有MgSO4150 mg、PSA 50 mg、C18150 mg、GCB 25 mg的5 mL聚乙烯离心管中,涡旋振荡1 min,10000 r/min离心6 min,吸取上清液至10 mL离心管中,于45 ℃条件下氮吹至近干,再加1 mL 0.1%甲酸水-甲醇溶液(65-35)溶解,涡旋混合1 min,过0.22 μm微孔滤膜后,UPLC-MS/MS分析。
1.4色谱和质谱条件
色谱条件:Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温40 ℃;样品室温度15 ℃;进样体积5 μL;流速0.3 mL/min;流动相为甲醇,0.1%甲酸溶液;流动相梯度洗脱程序如表1所示。
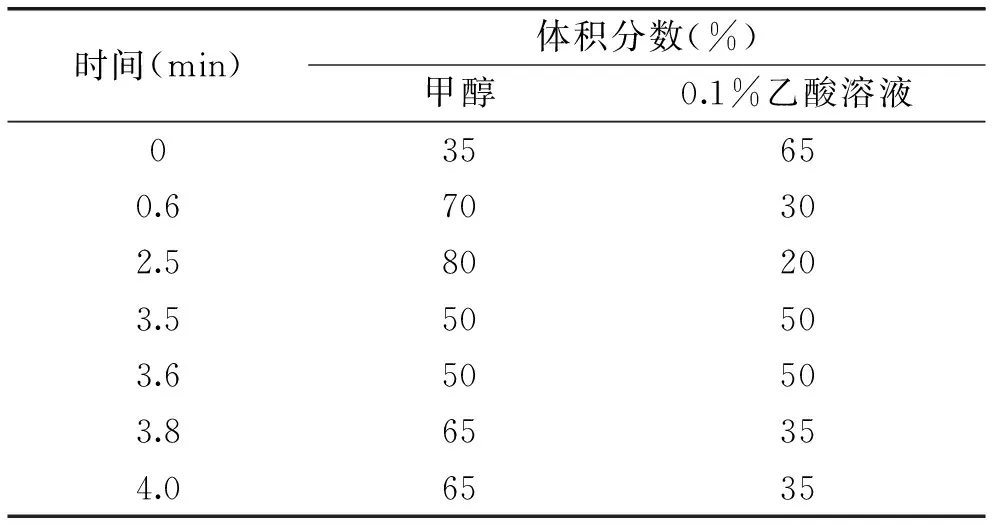
表1 流动相梯度洗脱程序
质谱条件:电喷雾离子源(ESI);2,4-二氯苯氧乙酸、赤霉素采用负离子模式,多菌灵、6-苄基氨基嘌呤、吲哚乙酸、恩诺沙星、多效唑、咪鲜胺、涕灭威、甲基托布津采用正离子模式;多反应监测(Multiple Reaction Monitoring,MRM);毛细管电压2.50 kV;离子源温度150 ℃;脱溶剂气温度500 ℃;脱溶剂气流量1000 L/h;锥孔气流速145 L/h;雾化压力0.6 MPa;碰撞气流速0.15 L/min[14]。
1.5标准溶液配制及标准曲线的绘制
标准储备溶液的配制:分别准确称取5.0 mg多菌灵、6-苄基氨基嘌呤、吲哚乙酸、赤霉素、恩诺沙星标准品于50 mL棕色容量瓶中,用甲醇定容,配制成100.0 mg/L的储备液,密封储存于-20 ℃冰箱中。
混合标准中间溶液:分别吸取100.0 mg/L的标准储备溶液和100.0 mg/L的多效唑、咪鲜胺、涕灭威、甲基托布津、2,4-二氯苯氧乙酸标准溶液1.25 mL于25 mL棕色容量瓶中,用甲醇定容,配制成5.0 mg/L的混合标准中间溶液,密封储存于-20 ℃冰箱中。
上机混合标准溶液:用流动相或者基质空白(阴性豆芽提取液)配制5.0、10.0、20.0、50.0、100.0、200.0 μg/L系列上机浓度,现配现用,并按优化后的条件进行分析,以10种药物进样浓度(x)为横坐标,定量监测离子对峰面积(y)为纵坐标绘制标准曲线。
2 结果与分析
2.1称样量的确定
采用QuEChERS[17]方法结合UPLC-MS/MS仪器对目标化合物进行检测,称样量为5.00、10.00、15.00 g平行样品检测结果的相对标准偏差(RSD%)分别为4.37%~10.21%、2.92%~6.43%、3.01%~6.39%。取样量5.00 g检测结果的相对标准偏差太大,不具备代表性;10.00 g和15.00 g的RSD%相差较小,都能满足要求,考虑到试剂的消耗,本实验确定试样量为10.00 g。
2.2提取溶剂的选择
选择合适的萃取溶剂可以提高萃取效率以及降低基质的干扰,根据10种待测物的化学性质,比较了乙腈、酸化乙腈、丙酮、甲醇、酸化甲醇作为溶剂的提取效果,结果见图1。相对于酸化乙腈、酸化甲醇而言,丙酮、甲醇、乙腈提取赤霉素、恩诺沙星、吲哚乙酸效率较低,为56%~86%,而且丙酮提取杂质多。乙腈极性较强,作为提取溶剂能与水互溶,加入氯化钠后容易与水分离,萃取过程更具选择性,脂肪和糖溶解较少,而且能使蛋白质变性沉淀,适合萃取极性范围宽、多药物残留而广泛应用于QuEChERS方法中。通过不断优化乙腈溶剂中乙酸的体积配比,发现当乙酸:乙腈的体积配比为1∶100时,提取的共存物质少,酸性化合物的回收率高,因而确定1%乙酸乙腈溶液作为萃取溶剂。
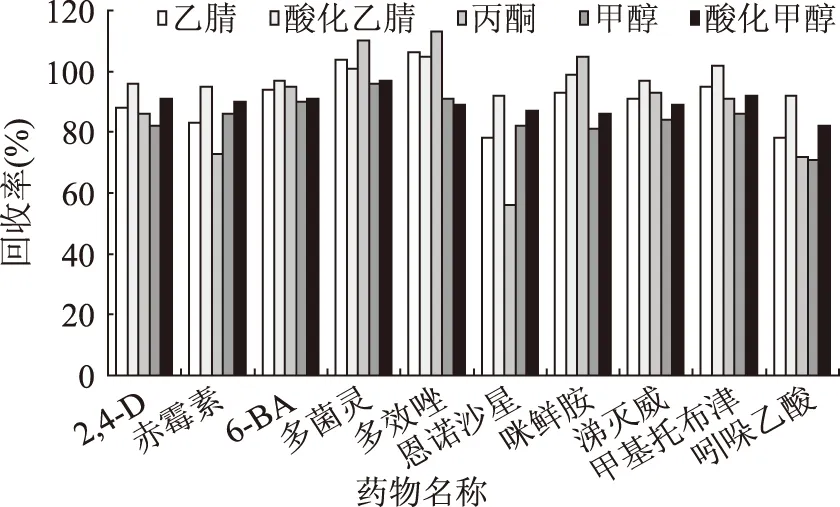
图1 5种提取溶剂对10种化合物的提取回收率Fig.1 Extraction recoveries of the ten compounds with five extraction solvents
2.3提取方式的选择
比较了摇床振荡、超声波、旋涡、均质4种不同的提取方式,并通过阳性样品定量和回收率实验验证,其中摇床振荡方式阳性样品定量和回收率都较低;旋涡提取时,几种药物的回收率和超声波、均质提取相差不大,但实际阳性样品测定值偏低,为42%~83%;超声波和均质提取效果都令人满意,但是超声波提取耗时更长,因此,本实验采取均质方式提取。分析不同提取方式对阳性样品和回收率测定值有偏差的原因,可能是添加药物的方式与药物在活体内自身代谢不同造成的,均质和超声波都能使细胞破碎,使得药物能被充分提取。提取溶剂总量为样品质量的2.5倍,比较了提取1、2、3次对提取回收率的影响,发现少量多次提取比一次提取效果更好,提取1次10种药物回收率58%~77%,提取2次10种药物回收率93%~112%,由于样品中基质和操作不完全平行的因素影响,造成回收率可能超过100%,第三次提取液中目标化合物未检出,说明两次提取可以完全提取目标化合物。
2.4净化方式的优化
比较安捷伦公司SCX、MAX、WCX等不同极性的阴阳离子固相萃取柱对上述10种非法添加物净化效果,实验表明很难用一种萃取柱同时使10种非法添加药物的回收率全部达到满意,因此改变实验思路,结合QuEChERS方法除去脂肪酸、糖类、色素、有机酸等杂质,加入150 mg MgSO4除去水分;PSA、C18和GCB填料是QuEChERS方法中经常使用的净化吸附剂[18],C18能吸附脂肪,GCB能吸附大部分色素,PSA能除去样品中的脂肪酸、糖类和一些色素[19-22],但是其对一些酸性化合物也有部分吸附。实验考察了PSA、C18和GCB三种吸附剂的用量除杂和对10种待测药物吸附效果,PSA、C18、GCB三种填料各自对混合标准的吸附情况见图2。检测结果显示,PSA对恩诺沙星、2,4-D、赤霉素都有一定吸附,随着PSA用量的增加吸附作用不断增强,恩诺沙星回收率从93%降到72%,2,4-D回收率从95%降到70%,赤霉素回收率从91%降到68%;C18对待测10种药物吸附性较小,对6-BA、2,4-D、赤霉素的回收率有轻微的影响,GCB对待测10种药物都有一定的吸附,其中对2,4-D、恩诺沙星、吲哚乙酸3种药物吸附影响较强,2,4-D回收率从96%降到65%,恩诺沙星回收率从95%降到63%,吲哚乙酸回收率从92%降到61%。结合药物回收率和除杂效果,最终确定PSA 25 mg、C18100 mg和GCB 10 mg为最佳用量。由三种吸附剂最佳配比组成的复合吸附剂与单一吸附剂效果对比见图2。
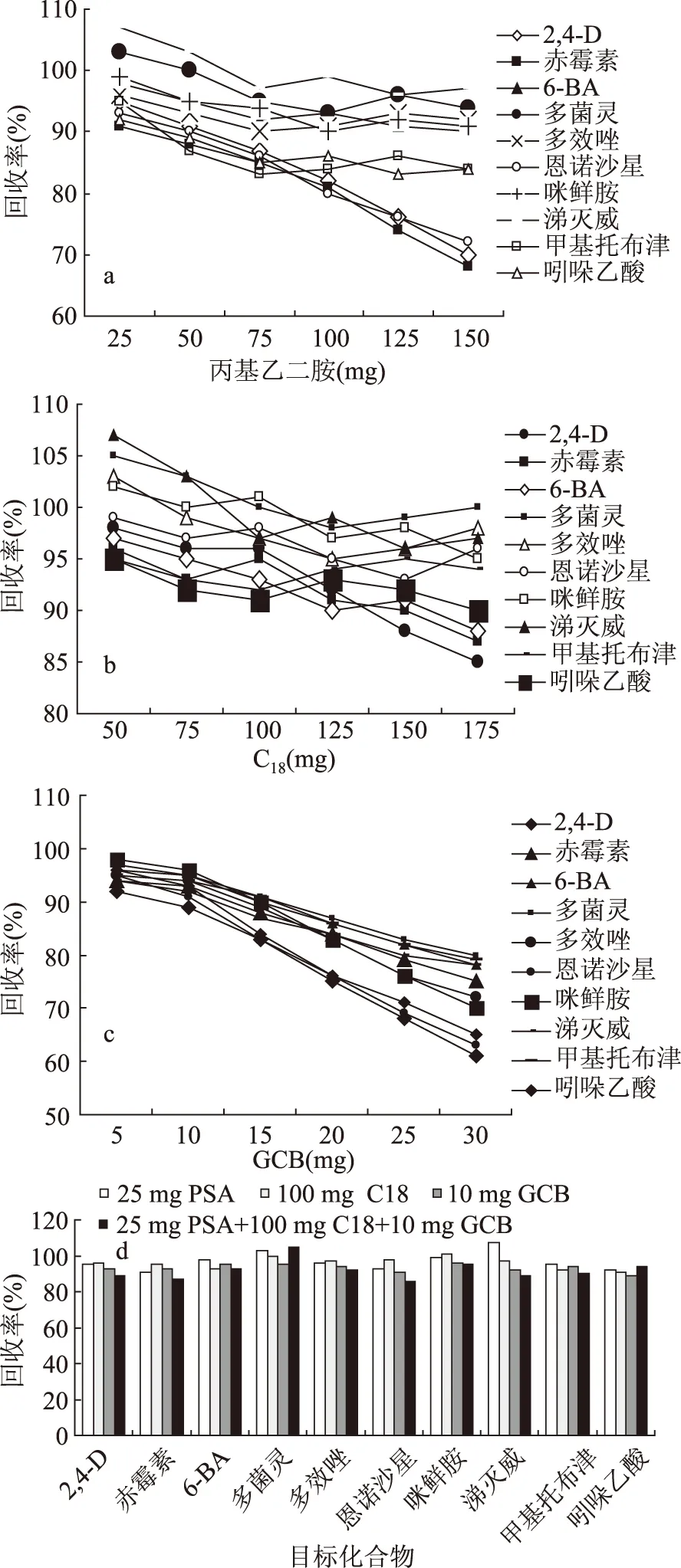
图2 3种净化填料净化效果比较Fig.2 Comparison of the effectiveness of three different purification filler
2.5色谱条件的优化
首先考察了不同流动相的组成对10种添加药物的保留时间与峰型的影响,比较了水、0.1%甲酸水、5 mmol/L甲酸铵分别与乙腈、甲醇组成流动相。结果表明甲醇的响应比乙腈高很多,而且保留时间偏移少,对6-苄基氨基嘌呤影响比较明显,甲酸铵盐溶液作为流动相时,容易引起恩诺沙星、6-苄基氨基嘌呤、多菌灵等药物的分离度降低,且峰型拖尾,导致化合物的干扰严重,灵敏度降低;甲醇和水作为流动相时,部分药物峰型“矮胖”,加入0.1%甲酸能使峰型尖锐对称,分离度提高,而且在ESI+模式检测时,能更容易诱导多菌灵、6-苄基氨基嘌呤、恩诺沙星等在ESI源中产生[M+H]+,但是加入酸后会使2,4-二氯苯氧乙酸、赤霉素等在ESI-模式下抑制响应,不断调整甲酸在水中的浓度使得ESI+检测的药物和ESI-检测的药物响应都能满足要求,确定0.1%甲酸水溶液-甲醇为流动相。实验检测的10种药物化学性质差别很大,选择通用性较强的C18超高效液相色谱柱进行色谱条件优化,比较了安捷伦公司ZORBAX Eclipse Plus C18(30 mm×4.6 mm,3.5 μm)、沃特斯公司ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)和岛津公司InertSustain C18(100 mm×2.1 mm,2.0 μm色谱柱分离效果,实验采用灵敏度和分离度较好的ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,10种药物能得到理想的分离效果,图3为10种药物的基质标准溶液的MRM质谱图。
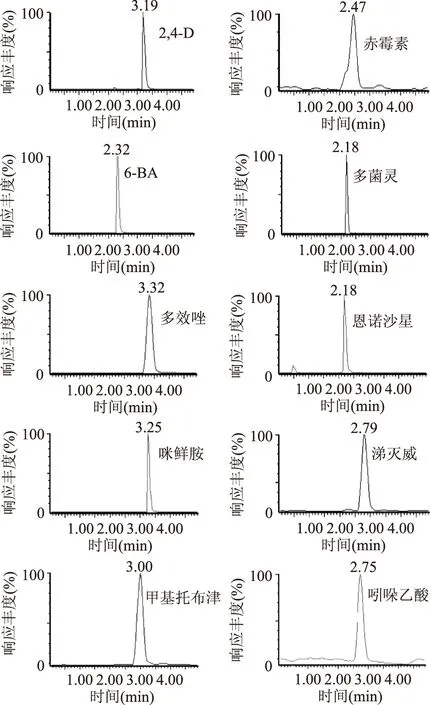
图3 50 μg/L混合基质标准溶液的MRM色谱图Fig.3 MRM chromatogram of 50 μg/L mixed matrix standard solution
2.6质谱条件的优化
用50 μg/L的混标进样,对质谱条件进行优化,通过调节毛细管电压、锥孔电压、锥孔和中性气体的流速,挑选最佳母离子,调节锥孔电压和碰撞能量的电压值使子离子响应到达最高,10种药物的质谱检测参数见表2。
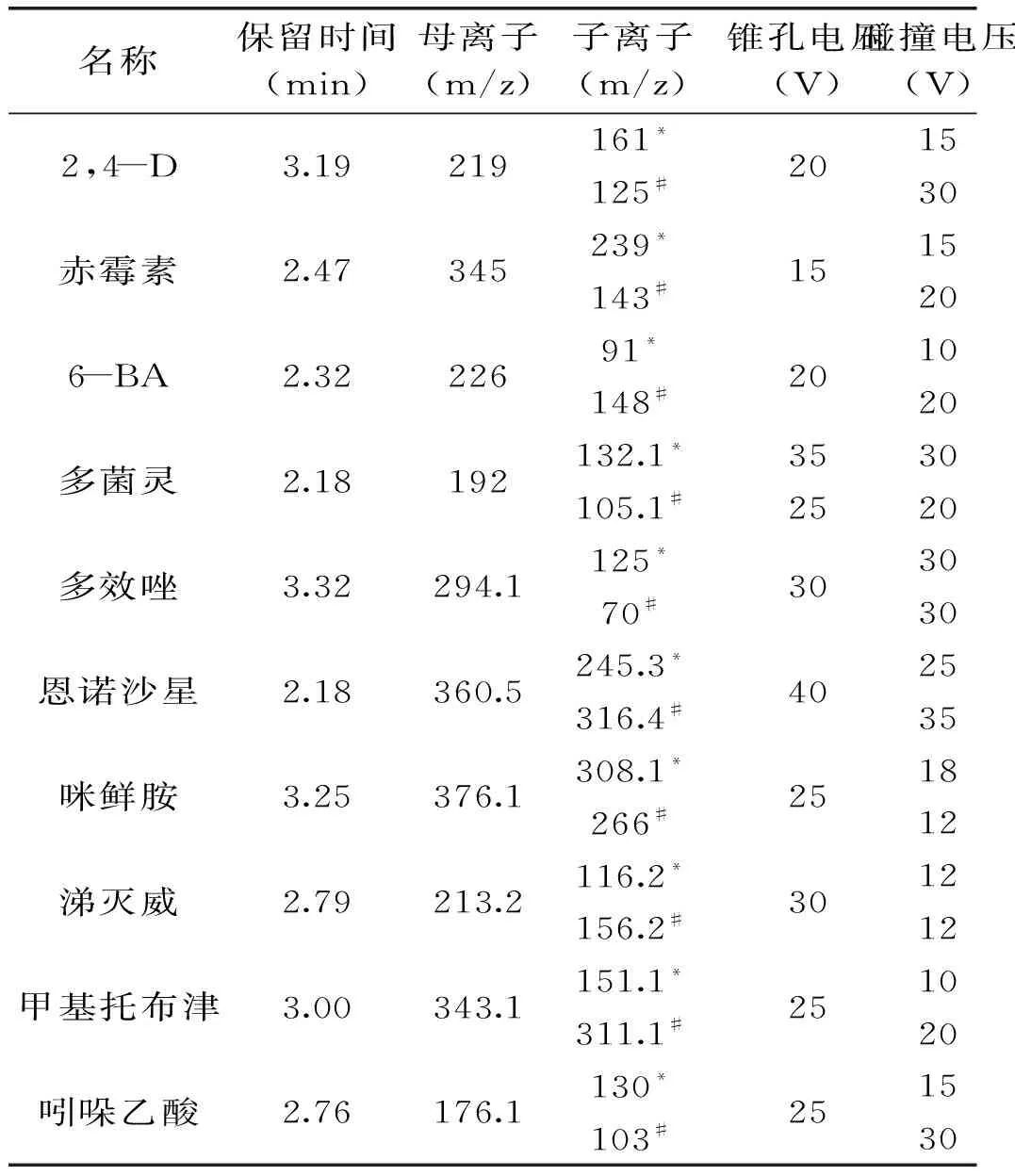
表2 豆芽中10种目标化合物质谱检测参数
注:*:定量离子,#:定性离子。
2.7基质效应
目前在定量过程中,基质效应是必须要考虑的因素,Poole[23]指出色谱分析基质效应的产生归因于样品基质中的杂质分子与目标分析物竞争进样口或柱头上的活性位点,使更多的物质进入色谱柱,基质物质与目标化合物在色谱分离过程中共流出,可能影响目标化合物的离子化过程,进而影响目标化合物的定量、精密度、线性关系等。豆芽样品经过提取和净化步骤后,提取液中同时含有目标化合物和豆芽内源基质物质,加入固相分散剂在一定程度上减少了基质效应,但也不可能彻底解决。解决基质效应在实验室最常用的方法是利用不含农药的空白基质配制标准,本实验配制5.0~200.0 μg/L范围内6个浓度的混合标准溶液,峰面积Y对标准浓度X(μg/L)绘制标准曲线,通过基质标准曲线的斜率除以溶剂标准曲线的斜率,得到的值K 作为评判每种药物是属于基质增强还是基质抑制,比值大于1说明是基质增强,比值小于1说明是基质抑制,本实验测定4种豆芽的10种药物K值见表3。
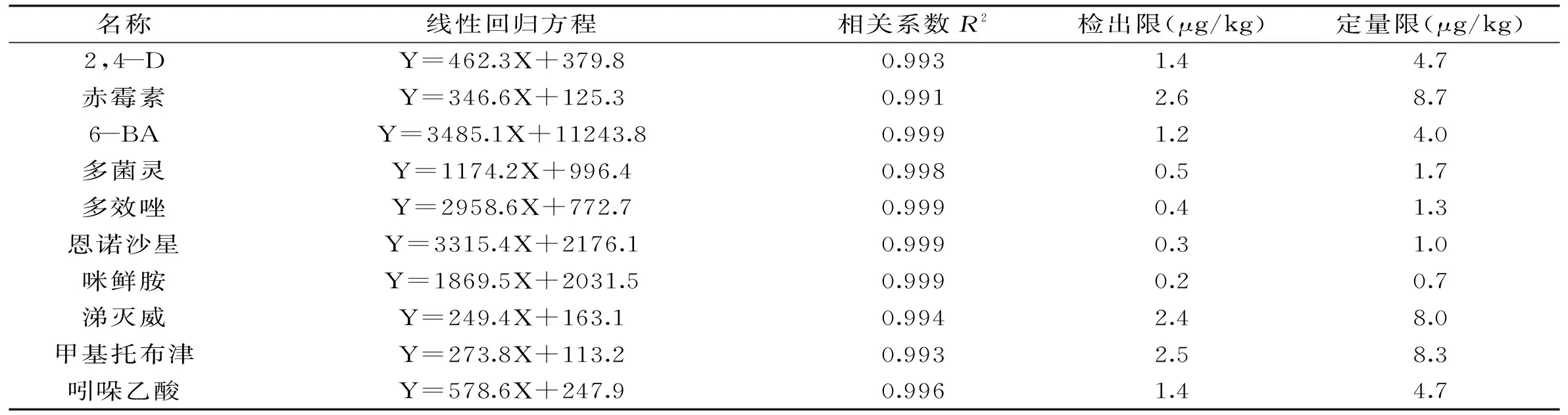
表4 豆芽中10种添加物的回归方程、相关系数、检出限和定量限
从表3中可以看出,不同种类豆芽的基质效应大体顺序为:黑豆芽>绿豆芽>黄豆芽>豌豆苗。
2.8方法评价
2.8.1方法的线性范围、标准曲线和相关系数10种添加物得到的相应的线性回归方程及相关系数结果见表4。结果表明:10种药物在5.0~200.0 μg/L的质量浓度范围内具有良好的线性关系,相关系数R2均在0.99以上,当S/N=3时对应的目标物浓度为最低检出浓度,通过质量、体积换算得到检出限,同理S/N=10换算可得定量限。

表3 10种目标物标准曲线斜率比值K
2.8.2回收率实验实验得到10种药物的回收率为80.4%~99.8%,相对标准偏差为2.0%~7.8%,具体见表5。
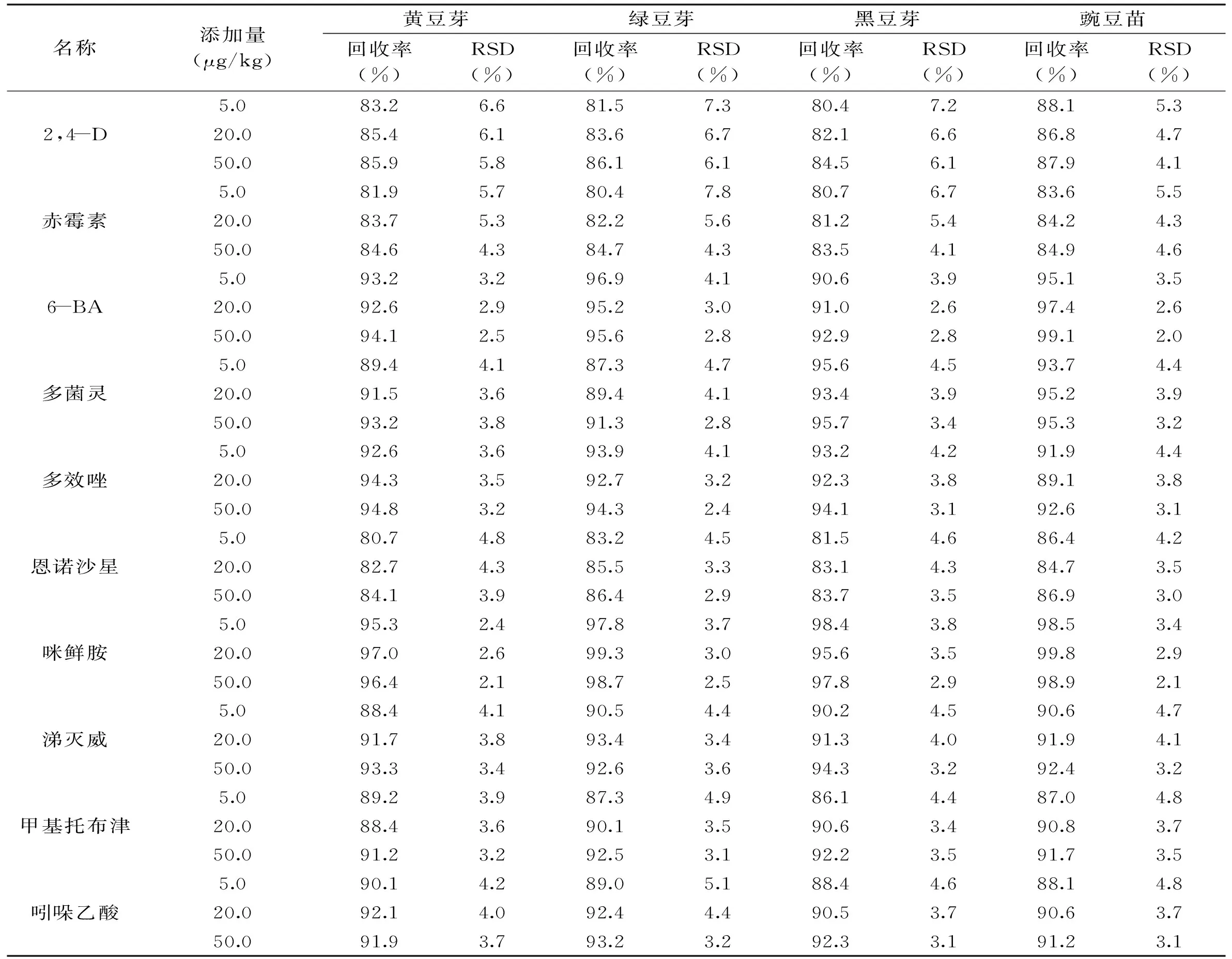
表5 回收率和精密度测定(n=6)
2.8.3实际样品的分析从湛江各超市、农贸市场和批发市场中购买共100份豆芽进行10种药物残留分析,其中涕灭威、甲基托布津、赤霉素、多效唑、吲哚乙酸5种药物全部未检出,部分样品发现恩诺沙星,含量范围为5.61~141.71 μg/kg,检出率为37%;咪鲜胺含量范围为17.14~275.49 μg/kg,检出率为22%;2,4-D含量范围为15.16~109.62 μg/kg,检出率为13%;多菌灵含量范围为10.32~208.46 μg/kg,检出率为29%;6-苄基腺嘌呤含量范围为20.89~319.06 μg/kg,检出率为16%。
3 结论
采用QuEChERS方法结合UPLC-MS/MS在ESI正、负模式同时测定豆芽中的10种药物。10.00 g样品经25.0 mL 1%乙酸乙腈均质提取,150 mg MgSO4、25 mg PSA、100 mg C18、10 mg GCB净化,以0.1%甲酸水溶液-甲醇为流动相梯度洗脱,ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)测定,在5.0、20.0、50.0 μg/kg三个水平添加10种药物,回收率为80.4%~99.8%,相对标准偏差为2.0%~7.8%,方法检出限为0.2~2.6 μg/kg。结果表明:该法具有分析时间短、灵敏度高、准确度好、回收率稳定等优点,可以应用于豆芽中10种药物残留的日常监测,提高食品安全突发事件的应急水平。
[1]Erin N,Afacan B,Ersoy Y,et al.Gibberellic acid,a plant growth regulator,increases mast cell recruitment and alters Substance P levels[J]. Toxicol,2008,254(1-2):75-81.
[2]Zahm S H,Weisenburger D D,Babbitt P A,et al.A case control study of non-hodgkin’s lymphoma and the herbicide 2,4-dichlorophenoxyacetic acid(2,4-D)in Eastern Nebraska[J]. Epidemiol,1990:(5):349-356.
[3]唐莉娟.食品中多种植物生长调节剂同时分析新技术研究及应用[D]. 南昌:南昌大学,2012.
[4]Xu F,Yang Z F,Chen X H,et al.6-Benzylaminopurine Delays Senescence and Enhances Health-Promoting Compounds of Harvested Broccoli[J]. J Agric Food Chem,2012,60:234-240.
[5]Xue J Y,Wang S L,You X W,et al.Multi-residue determination of plant growth regulators in apples and tomatoes by liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom,2011,25:3289-3297.
[6]吴平谷,谭莹,张晶,等.分级净化结合气相色谱-质谱联用法测定豆芽中10种植物生长调节剂[J].分析化学,2014,42(6):866-871.
[7]陈君,安东各,许莉,等.豆芽中甲硝唑、多菌灵、赤霉素、6-苄基腺嘌呤、2,4-二氯苯氧乙酸的定量检测[J].化学通报,2014,77(9):916-918.
[8]Narayan Sukesh Sinha,M Vishnu Vardhana Rao,K Vasudev,et al.A liquid chromatography mass spectrometry-based method to measure organophosphorous insecticide,herbicide and non-organophosphorous pesticide in grape and apple samples[J]. Food Control,2012,25:636-646.
[9]Soonkilchoam,Abdelaty,Kihunpark,et al. Simple multiresidue extraction method for the determination of fungicides and plant growth regulator in bean sprouts using low temperature artitioning and tandem mass spectrometry[J]. Food Chemistry,2013,136:1414-1420.
[10]Shi X M,Jin F,Huang Y T,et al.Simultaneous determination of five growth regulators in fruits by modified quick,easy,cheap,effective,rugged and safe(QuEChERS)extraction and liquid chromatography-tandem mass spectrometry[J]. J Agric Food Chem,2012,60:60-65.
[11]SN/T 3725-2013,出口食品中对氯苯氧乙酸残留量的测定[S]. 北京:中国标准出版社,2013.
[12]GB/T 23381-2009,食品中6-苄基腺嘌呤的测定[S]. 北京:中国标准出版社,2009.
[13]谢寒冰,周明莹,赵海峰等.高效液相色谱-四极杆飞行时间质谱法同时检测豆芽中的3 种外源植物激素残留[J]. 色谱,2014,32(5):493-498.
[14]柳菡,吴斌,殷耀等.高效液相色谱-串联质谱法测定芽苗类蔬菜及其来源豆类中4 种非法添加物的残留量[J]. 色谱,2013,31(1):22-26.
[15]Bharat U,Kaushik B,Ramteke S D,et al.Dissipation kinetics of for chlorfenuron,6-benzyl aminopurine,gibberellic acid and ethephon residues in table grapes[J]. Food Chemistry,2013,141:4208-4214.
[16]刘春生,罗海英,冼燕萍等.超高效液相色谱-串联质谱法测定豆芽中7种药物残留[J]. 质谱学报,2014,35(4):302-310.
[17]Anastassiades M,Lehotay SJ,Stajnbaher D,et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. J AOAC Int,2003,86(2):412-431.
[18]Dipakshi Sharmaa,Avinash B Nagpala,Yogesh Pakadeb,et al. Analytical methods for estimation of organophosphorus pesticide residues in fruits and vegetables:A review[J]. Talanta,2010(82):1077-1089.
[19]Hou X,Han M,Dai XH,et al.A multi-residue method for the determination of 124 pesticides in rice by modified QuEChERS extraction and gas chromatography-tandem mass spectrometry[J]. Food Chemistry,2013(138):1198-1205.
[20]Lu D S,Qiu X L,Feng C,et al.Simultaneous determination of 45 pesticides in fruit and vegetable using an improved QuEChERS method and online gel permeation chromatography gas chromatography mass spectrometer[J]. J Chromatography B,2012,895-896:17-24.
[21]Li J,Dong F S,Xua J,et al. Enantioselective determination of triazole fungicide simeconazole in vegetables,fruits and cereals using modified QuEChERS(quick,easy,cheap,effective,rugged and safe)coupled to gas chromatography/tandem mass spectrometry[J]. Analytica Chimica Acta,2011(702):127-135.
[22]Shi X M,Jin F,Huang Y T,et al.Simultaneous determination of five growth regulators in fruits by modified quick,easy,cheap,effective,rugged and safe(QuEChERS)extraction and liquid chromatography-tandem mass spectrometry[J]. J Agric Food Chem,2012,60:60-65.
[23]Poole C F. Matrix-induced response enhancement in pesticide residue analysis by gas chromatography[J].J Chromatography A,2007,1158(1/2):241-250.
Simultaneous determination of ten plant growth regulators and fungicides in bean sprouts using QuEChERS-UPLC-MS/MS
CHENG Sheng-hua,YANG Chun-liang,ZENG Shao-dong,WEI Xiao-yi,WANG Ming-yue,LI Ji-hua*
(Agricultural Products Processing Research Institute,Chinese Academy of Tropical Agricultural Sciences,Laboratory of Quality and Safety Risk Assessment on Agro-products Processing,Ministry of Agriculture,Zhanjiang 524001,China)
A method was established based on QuEChERS-ultra-high performance liquid chromatography-triple quadrupole mass spectrometry(UPLC-MS/MS)to simultaneously determine 10 kinds of plant growth regulators and fungicides residues in bean sprouts. The sample were extracted with 1% acidic acetonitrile,then dehydrated and cleaned using PSA,C18and GCB. The QqQ mass spectrometer was operated in a multiplereaction monitoring mode and qualified using external standard method. The results showed that All of residues(Carbendazim,6-Benzylaminopurine,Indole-3-acetic acid,Gibberellin,Enrofloxacin,2,4-Dichlorophenoxyacetic acid,Paclobutrazol,Prochloraz,Aldicarb,Thiophanate methyl)were in a good linear relationship between 5.0 and 200.0 μg/L and the relative coefficient were more than 0.99,the recoveries were in the range of 80.4%~99.8%,the relative standard deviations were 2.0%~7.8%,the limits of detection of the method were varied from 0.2 to 2.6 μg/kg. The method is simple,rapid and reliable. It can be suitable for detection and confirmation of these ten plant growth regulators and fungicides in bean sprouts products.
plant growth regulator;fungicide;UPLC-MS/MS;QuEChERS;bean sprouts
2015-06-10
程盛华(1980-),男,硕士研究生,研究方向:农产品质量安全风险评估,E-mail:chengshenghua2013@163.com。
李积华(1979-),男,博士,研究员,研究方向:食品科学,E-mail:foodpaper@126.com。
国家农产品质量安全风险评估项目(GJFP2015012)。
TS207.3
A
1002-0306(2016)12-0053-07
10.13386/j.issn1002-0306.2016.12.002

