茶与油茶花蜜糖类物质研究
徐细建 卢晓欣 梁勤 陈大福(福建农林大学蜂学学院,福州350002)
茶与油茶花蜜糖类物质研究
徐细建卢晓欣梁勤陈大福
(福建农林大学蜂学学院,福州350002)
采用薄层层析法、液相色谱示差折光检测法对茶花蜜和油茶花蜜中的糖类物质进行定性定量的测定,对比分析薄层色谱图谱,了解茶和油茶花蜜中糖类物质的组分、含量。研究结果表明:茶花蜜与油茶花蜜含有较多的寡聚糖,有蔗糖、葡萄糖、果糖、还原糖等。两种花蜜中所含糖类物质成分相似,但油茶花蜜中含有的寡糖的含量要比茶花蜜中的多。
茶;油茶;花蜜;糖类物质;检测
植物花蜜来源于植物体外分泌组织分泌的甜味黏稠液体,主要以多种糖类物质组成,其中含有丰富的糖类物质、挥发性油、矿物质、色素、氨基酸、生物碱等成分[1],是蜜蜂酿造蜂蜜的原料。但蜜蜂并不可以取食所有的植物花蜜,油茶和茶属于山茶科的冬季蜜源植物,蜜多粉足,花期长,蜜蜂取食后会导致中毒。研究油茶花蜜与茶花蜜的糖类物质的成分、含量的差异,对于分析蜜蜂采集茶花蜜、油茶花蜜导致不同程度中毒,充分利用茶、油茶蜜源植物,具有重要的现实意义。
不同的蜜源植物,其花蜜中含有的可溶性糖、寡糖、矿物质的成分以及含量是有区别的[2]。Heil研究表明,花蜜一般含有糖类、氨基酸、蛋白质、脂类、无机离子等,有些花蜜中还含有生物碱、萜类以及一些挥发性物质。花蜜中含有大量糖,糖类物质占干物质重量的15~75%[3]。Wykes和Percival用纸层析法对多种花蜜中糖分进行分析,发现大多数花蜜中都有葡萄糖、果糖、蔗糖,少数含有寡糖[4-5]。Baker研究也发现花蜜中除了含有常见的糖之外,还有单糖、二糖、寡糖[6]。Bake报道花蜜中存在纤维二糖、龙胆二糖、乳糖、海藻糖等多糖物质[7]。国内研究人员徐万林等从花蜜中检测出有毒性的糖苷和生物碱等,花蜜中还含有芳香类物质[8]。
茶花蜜和油茶花蜜中的寡聚糖对蜜蜂有毒性,会造成大幼虫或已封盖的幼虫中毒死亡、腐烂尸体呈现灰白色或乳白色,并散发出酸臭味,油茶花蜜还会造成成年蜂中毒,其中对中华蜜蜂(Apis cerana cerana)毒性大于意大利蜜蜂(Apis mellifera ligustica)[9-11],这种中毒现象在干旱时更为严重。
康冬雪对油茶蜜化学成分的研究表明,油茶蜜中含有较高的棉籽糖和水苏糖,并证明它们是引起蜜蜂中毒的主要成分,随着棉籽糖浓度增加,蜜蜂的死亡率也随之增加[12]。曾志将等人研究进一步得出油茶花蜜中还原糖、葡萄糖,蔗糖、半乳糖的含量分别为73.95%、34.46%、3.17%、2.69%,游离氨基酸中脯氨酸含量最高,矿物质中钾含量最高[13]。孔令蓉等人通过测定半乳糖对东方蜜蜂存活率时发现半乳糖对东方蜜蜂有明显的毒害作用,进而可以推测油茶花蜜对东方蜜蜂的毒害作用至少部分是由于半乳糖寡聚糖水解产物引起的[14]。
本研究采用薄层层析法、液相色谱示差折光检测法(GB/T18932.22-2003)[15],研究茶和油茶花蜜的糖物质成分,对比二者糖成分、含量的差异,进一步分析蜜蜂花蜜中毒原因。可以推断出影响蜜蜂中毒的物质以及中毒程度的深浅,为诊断蜜蜂花蜜中毒提供新的合理依据,为研究预防中毒措施提供思路。
1 材料与方法
1.1材料
1.1.1样本
(1)茶花花蜜(新鲜);油茶花花蜜(新鲜)
(2)茶花花蜜(储存6个月);油茶花花蜜(储存6个月)
1.1.2试剂
1.1.2.1薄层色谱法试剂:0.2 m的过滤膜;乙醇∶水=3∶7;乙醇∶水=1∶1;薄层展开剂(分析纯):正丁醇∶乙酸∶水=1∶1∶1;显色剂
1.1.2.2液相色谱法试剂:乙腈色谱纯;水GB/T 6682规定的一级水
果糖、葡萄糖、蔗糖、麦芽糖标准物质:纯度99%
果糖、葡萄糖标准储备溶液:准确称取5 g果糖标准物质和4 g葡萄糖标准物质,精确至0.0001 g,放入同一容量瓶中,加入60 ml水溶解,用乙腈定容至体积,摇匀。
蔗糖、麦芽糖标准储备溶液:分别称取蔗糖和麦芽糖标准物质各2 g,精确至0.0001 g,放入同一容量瓶中,加入60 ml水溶解,用乙腈定容至体积,摇匀。
四种糖物质的标准工作溶液待用。
1.1.3仪器
移液器
活性炭柱:Inertsep GC柱
真空泵;分析天平、薄层色谱展开槽;真空干燥箱;恒温干燥箱
玻璃喷雾器;点吹风机;10 μl微量注射器
高效液相色谱仪:配有示差折光检测器
分析天平:感量0.1 mg和0.001 g各一台
有机相过滤膜:0.45 μm
样品瓶:1.5 ml
容量瓶:10 ml 25 ml 50 ml 100 ml
1.2方法
1.2.1薄层层析法定性测定茶花蜜与油茶花蜜的成分
1.2.1.1样品前处理:称取茶花蜜、油茶花蜜各2.0 g,溶于20 ml水,搅拌均匀后通过0.2 m的过滤膜,收集好滤液,量取10 ml滤液加入到活性炭柱,同时打开活塞,滤液在真空泵真空抽气作用下通过柱子,直至液面下降到柱面上端的时候及时关闭活塞,之后量取10 ml乙醇(3∶7)加入到Inertsep GC柱,打开活塞,抽气掉流出液,之后量取10 ml乙醇(1∶1)溶液在相同条件下进行洗脱,用干燥至恒重的茄形瓶收集所有洗脱液,80℃水浴下蒸干,真空干燥箱(65℃、26kPa~33kPa)干燥30 min,取出放置于干燥器至室温,加入300μl水溶解,作为薄层层析点样液。
1.2.1.2薄层层析:点样:用10微量注射器在距离薄层板下端20 cm的位置点样,花蜜点样20 μl,直径一般为2~4 mm,点间距离一般为1.5~2.0 cm,点间距离根据点的扩散状况,对检出结果不产生影响。点样时,勿损坏薄层表面。
展开:将点好的样品的薄层板放在展开槽中,以倾斜上行方式展开,注意薄层板浸入展开剂中5~10 mm,样品不可浸入其中,将展开剂前端达到薄层板顶端时,取出薄层板,将展开剂用电吹风吹干后,在薄层板上均匀的喷洒显色剂,显色剂完全蒸发后在恒温箱(90~95℃)中烘干使其显色,之后进行扫描进而保存图谱。
1.2.2液相色谱法定量测定各种糖类物质含量
1.2.2.1提取:精确称取5 g试样,精确到0.001 g。将称后试样放于100 ml烧杯中,加入30 ml水,用玻璃棒不断搅拌使试样完全溶解,然后转移到100 ml容量瓶中,然后再用10 ml水洗烧杯3次并转移至上述100 ml容量瓶中,用乙腈定容至体积,混匀。将样液用0.45μm滤膜进行过滤,将滤液倒入样品瓶中供液相色谱测定。
1.2.2.2测定:用配制的果糖、葡萄糖、蔗糖、麦芽糖标准工作溶液绘制标准工作曲线,要求曲线纵坐标是峰高,横坐标是工作溶液浓度。确保样品溶液中测定糖物质的响应值全部在标准工作曲线的线性范围内,样品溶液与标准工作溶液等体积进样进行测定。
1.2.2.3液相色谱条件:
(1)色谱柱:碳水化合物分析柱10 pm,300 mm×
3.9 mm(I,d)
(2)流动相:乙腈+水(77+23)
(3)流速:1.0 ml/min
(4)柱温:25℃
(5)检测器池温度:35℃
(6)进样量:15 μl
2 结果与分析
2.1薄层层析法定性测定新鲜茶花花蜜与新鲜油茶花花蜜的成分
薄层色谱法用于定性分析花蜜中糖类物质组分。样品为新鲜茶花蜜(1a)和油茶花蜜(1b),通过运用薄层色谱法对两种花蜜进行检测,以纯还原糖作为阴性对照,以多糖标样、掺入高果糖浆的蜂蜜作为阳性对照。结果显示(如图1):在泳道1上,只有一个明显斑点,说明阴性对照中只含有单糖;在泳道2、泳道3上,与纯还原糖阴性对照相比,均有拖尾现象产生,说明阳性对照中除了含有单糖外,还包括其他少数果糖存在;在茶花蜜泳道上(泳道4),出现明显的蓝带,对比泳道2、3,泳道4中拖尾现象较严重,说明茶花花蜜中存在极少数的单糖,存在很多的多糖;在油茶花蜜泳道上(泳道5),出现明显的蓝带,与阴性对照图谱比较,出现明显的拖尾现象,说明花蜜中含有少量的单糖,油茶花花蜜中存在很多的二糖、三糖、四糖甚至含有四糖以上糖成分。
对比泳道4与泳道5的蓝带可知,油茶花蜜泳道上的斑点位置与茶花蜜相差不大,但其颜色要深很多,这说明两种花蜜中糖类组分相差不大,但油茶花蜜糖类物质的含量要高于茶花蜜。

图1 茶和油茶花蜜中糖类物质的薄层色谱图
2.2薄层层析法定性测定储存后的茶花蜜与油茶花蜜的成分
用储存一段时间后(6个月)的样品茶花蜜(2a)和油茶花蜜(2b)再次用薄层色谱法定性分析花蜜中糖类物质组分,结果如下表1所示,检测结果成阴性,说明此时花蜜中均只含有还原性糖,异构化糖全部转换成还原糖。

表1 储存后茶花蜜和油茶花蜜的糖类物质组分
2.3液相色谱法定量测定各种糖类物质含量
茶花蜜和油茶花蜜在薄层色谱法定性检测基础的条件下,进行液相色谱定量分析,通过多次进行检测,得出的平均结果如表2所示。茶花蜜和油茶花蜜中存在少量的寡糖,此条件下无法准确检测出具体数值。茶花蜜中可能存在少量的葡萄糖、麦芽糖,但用此方法不能准确检测出具体含量。茶花蜜中蔗糖的含量比果糖高,果糖占还原糖的60.6%。油茶花蜜中除了麦芽糖以外,能检测出葡萄糖、果糖、蔗糖的含量,其中蔗糖的含量高于葡萄糖和果糖,果糖占还原糖含量的51.2%。
从茶花与油茶花蜜糖物质成分含量检测表(表2)中可以看出,油茶花蜜糖类物质成分果糖、葡萄糖、还原糖含量高于茶花蜜,与薄层色谱法测的图谱相一致。而且在油茶花蜜中检测到葡萄糖含量,而茶花蜜中几乎检测不到。此茶花蜜中蔗糖含量超过油茶花蜜,果糖占还原糖的比重也高于油茶花蜜9.4%。
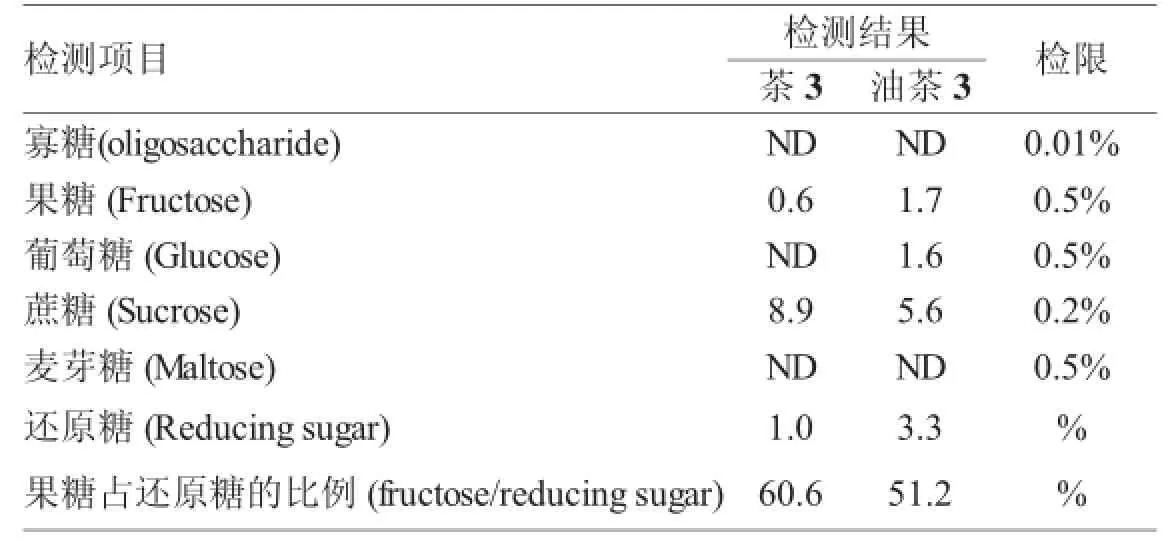
表2 茶花与油茶花蜜糖物质成分含量
3 讨论
结合薄层色谱法和液相色谱法定性定量测定可知:在油茶和茶花蜜中检测出少量的单糖,含有大量的二糖、三糖、四糖。茶花蜜中蔗糖含量高于油茶花蜜,可能是造成茶花蜜中多糖的含量较油茶花蜜中要少的原因。油茶和茶花蜜中除了含有还原糖以外,还会含有大量的二糖、三糖等链较长的多糖。众多研究者通过试验发现导致蜜蜂中毒的因素之一是茶和油茶花蜜中含有蜜蜂不能消化分解的多糖物质,而本实验结果显示油茶花蜜中含有的寡聚糖含量可能比茶花蜜更高,蜜蜂取食时造成的中毒更严重。当干旱时期,花蜜水分减少,糖浓度增加,相应的寡糖浓度就会增加,有可能就会造成蜜蜂严重中毒。茶花蜜中果糖含量占还原糖比重大,王春华研究表示果糖含量高,蜂蜜不容易结晶[16]张金振[17]表示影响蜂蜜结晶的因素是果糖和葡萄糖含量,果糖含量相对高于葡萄糖,则不易结晶。由实验结果可知,茶花蜜中果糖含量相对葡萄糖较高,茶花蜜更不容易结晶,相比容易结晶的油茶花蜜,有可能造成蜜蜂取食后不能消化,从而导致蜜蜂中毒。但是否有这方面的原因,还需要进一步的研究。
当放置一段时间后,再次测得茶花蜜和油茶花蜜中不再含有异构化糖。刘秋意在研究中也表明蜂蜜在储存过程中蔗糖含量是在降低的[18],推断出在储存过程中花蜜中可能含有某种酶,使二糖、二糖以上的糖类水解至单糖,由此将蜜蜂采集后的茶花蜜或油茶花蜜放置一段时间后再饲喂蜜蜂,也有可能就不会造成蜜蜂中毒,为以后研究解决蜜蜂花蜜中毒提供新的思路。
[1]刘林德,李玮,祝宁,等.刺五加、短梗五加的花蜜分泌节律、花蜜成分及访花者多样性的比较研究 [J].生态学报,2002,06: 847-853.
[2]李左栋,刘静萱,黄双全.传粉生物学中几种花蜜采集和糖浓度测定方法的比较[J].植物分类学报,2006,03:320-326.
[3]Heil M.Nectar:Generation,regulation and ecological functions [J].Trends in Plant Science,2010,16:191-200.
[4]Wykes GR.An investigation of the sugars present in the nectar of flowers ofvarious species.NewPhytologist,1952,51:201-215.
[5]Percival MS.Types of nectar in Angiosperms[J].New Phytologist,1961,60:235-281.
[6]Baker HG,Baker I.Chemical Constituents of Nectar in Relation to Pollination Mechanisms and Phylogeny[M].Chicago:University of Chicago Press.1982.
[7]Petanidou T.Sugars in Mediterranean floral nectars:An ecological and evolutionary approach[J].Journal of Chemical Ecology, 2005,31:1065-1088.
[8]徐万林.东北林区的主要蜜源植物—椴树[J].蜜蜂杂志,1993, (5):22-24.
[9]郭冬生.蜜蜂采集油茶蜜粉时蜂群的状况分析 [J].黑龙江畜牧兽医,2014,12:125-126.
[10]余海波.蜜蜂自然中毒的病因与诊治[J].中国蜂业,2014,65 (9)32-34.
[11]席芳贵,杨琳芬,袁芳.蜜蜂与油茶 [J].中国蜂业,2012,63 (5):25-27.
[12]康雪冬,范正友.蜜蜂油茶蜜中毒物质的分析研究[J].蜜蜂杂志,1991,11(1):8-10.
[13]曾志将,周利华.油茶蜜的成分分析[J].养蜂科技,1997,(2):24.
[14]孔令蓉,刘意秋,苏睿,等.半乳糖对东方蜜蜂存活率的影响[J].中国蜂业,2012,63(7-9):14-16.
[15]GB/T18932.22-2003蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量测定方法液相色谱示差折光检测法.
[16]王春华.蜂蜜结晶的原因和融晶的方法[J].蜜蜂杂志,2012,01: 33.
[17]张金振.蜂蜜的结晶[J].中国蜂业,2013,64(5):52-53.
[18]刘意秋,李听安,赵继云,等.新鲜蜂蜜中蔗糖变化分析[J].蜜蜂杂志,2010,30(12):13-14.
Study on the Saccharides in Nectar Derived from Plants Camellia Sinensis and Camellia Oleifera
Xu XijianLu XiaoxinChen Dafu
(1 College of Bee Science of Fujian Agriculture and Forestry University,Fuzhou 350002)
The saccharides in Camellia sinensis and Camellia oleifera nectars are qualitatively and quantitatively determined by Thin Layer Chromatography(TLC)and High Performance Liquid Chromatography differential Refractive Index Detection(HPLC-RID).By a comparative analysis of TLC chromatogram,the composition and content of carbohydrate were known.The results showed that:Camellia sinensis and Camellia oleifera nectars had some oligosaccharide, such as sucrose,glucose,fructose,reducing sugar,etc.Both of them had a similar sport on the chromatogram,So two nectars contain similar carbohydrate,but the content of carbohydrate in the nectar of Camellia sinensis was more than that in the nectar of Camellia oleifera.
Camellia sinensis,Camellia oleifera,nectar,Saccharide,Detection
福建省自然科学基金(2013J01070)资助
徐细建(1987年-),男,硕士,主要从事蜜蜂保护学研究,E-mail:xxjlhj2006@163.corn。.
陈大福(1973年-),男,博士,副教授,硕导,主要从事蜜蜂保护学研究,E-mail:dfchen826@163.com。

