细菌脂多糖对妊娠期小鼠血脂代谢的影响
廖建红,赵 梅,徐德祥,陈远华,于晓玲,苏 畅,章新琼,胡 燕,宇 寰
细菌脂多糖对妊娠期小鼠血脂代谢的影响
廖建红1,赵梅1,徐德祥2,陈远华3,于晓玲1,苏畅1,章新琼1,胡燕1,宇寰1
目的 探讨细菌内毒素(LPS)对妊娠期小鼠血脂代谢的影响。方法 ICR雌鼠分为非孕鼠组、妊娠第5天即孕早期(GD5)组、孕中期(GD8)组、孕晚期(GD15)组,每组再分为对照组和LPS组,分别给予生理盐水和低剂量LPS 40 μg/kg腹腔注射。为了进一步解释小鼠孕期接触不同剂量LPS对血脂代谢的影响,取非孕鼠组和GD8组小鼠,分别腹腔注射LPS 10、40、160 μg/kg。所有小鼠在腹腔注射后禁食16 h,取血清进行血脂检测,取肝脏用于实时定量PCR(RTPCR)法检测脂肪酸摄取、合成、氧化和脂质转运相关基因。结果 ①与对照非孕鼠组比较,不同孕期小鼠血清三酰甘油(TG)和极低密度脂蛋白(VLDL)浓度随着受孕周期的增加而逐步增加,并且从孕中期始增加明显,而血清总胆固醇(TCH)和高密度脂蛋白-胆固醇(HDL-C)水平在孕晚期显著升高;②在LPS处理后,与LPS非孕鼠比较,血清TG和VLDL在孕早期差异无统计学意义,而在孕中期和孕晚期显著增加,血清TCH和HDL-C则在孕早期既已出现上升趋势;③孕中期接触LPS存在剂量效应关系,LPS 40 μg/kg足以引起孕期血脂代谢紊乱;④RT-PCR结果显示,肝脏脂肪酸摄取、从头合成相关基因mRNA水平表达显著增加,而脂肪酸氧化相关基因mRNA水平明显下降。结论 妊娠期接触LPS可引起孕鼠血脂代谢紊乱。
细菌脂多糖;妊娠;血脂代谢;三酰甘油;极低密度脂蛋白
网络出版时间:2016-5-9 15:43:10 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.024.html
在妊娠这一特殊生理时期,会引起母体脂质代谢改变等一系列适应性变化,包括血脂和脂蛋白水平的升高。正常情况下,其引起的高血脂状态有利于满足母体能量需要和胎儿生长发育;但高血脂状态超出生理性需要时,可引起脂质代谢紊乱。而感染和炎症引起的急性期反应可以导致多种脂质和脂蛋白改变[1]。细菌脂多糖(lipopolysaccharide,LPS)或细菌内毒素是革兰阴性细菌细胞壁外壁层的主要成份。研究[2-3]表明,妊娠期细菌性阴道炎、宫内感染、牙周病等会引起孕期暴露LPS。并且人与动物肠道内存在大量革兰阴性细菌产生并释放细菌内毒素,严重创伤和感染等情况下病灶细菌会释放大量LPS引起内毒素血症。课题组前期研究[4]表明,孕期接触LPS可引起胚胎死亡、畸胎、流产、早产和胎儿生长迟缓等。然而,孕期接触LPS对母体脂质代谢的影响尚未见报道。该研究拟比较LPS对非孕与不同孕期小鼠血脂特点的影响,并进一步探讨LPS对孕鼠肝脏脂质代谢相关基因表达水平的影响,从而系统研究接触LPS对孕鼠血脂代谢的影响。
1 材料与方法
1.1实验动物来源 8~10周龄健康ICR小鼠(雄34~36 g、雌28~30 g)购自北京维通利华实验动物技术有限公司。试验前动物适应性喂养1周,自由进食标准饲料,维持12 h光照和12 h黑暗的昼夜节律。实验室温度:20~25℃,湿度:(50±5)%。小鼠于晚9点按雌雄比4∶2合笼,次日晨7点查雌鼠阴栓,查到阴栓者定为受孕第0天(GD0),正常饮食、饮水,定期监测两组小鼠体重。
1.2动物分组与处理 将小鼠分为非孕鼠组、孕早期组(GD5)、孕中期组(GD8)、孕晚期组(GD15),各组再进一步分为对照组和LPS组,LPS组分别腹腔注射LPS 40 μg/kg体重,LPS剂量参考文献[5]。对照组给予相同剂量的生理盐水。为了进一步解释小鼠孕期接触不同剂量LPS对血脂代谢的影响,取非孕鼠组和GD8小鼠,分别腹腔注射LPS 10、40、160 μg/kg体重,比较两组血脂代谢的改变。每组均6只,所有小鼠腹腔注射后禁食16 h,取血清进行血脂检测,取肝脏-80℃保存用于实时定量-PCR法检测。
1.3检测方法与试剂 血清脂质代谢相关指标采用安徽医科大学第一附属医院检验科全自动生化分析仪(瑞士罗氏公司RL7600D全自动生化分析仪)进行检测,包括血清三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TCH)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、极低密度脂蛋白(very low-density lipoprotein,VLDL)。LPS(大肠杆菌LPS,血清型0127:B8)购自美国Sigma公司;实时定量-PCR试剂盒购自美国Promega公司;PCR特异性引物由上海生工生物工程技术服务有限公司合成。引物序列见表1。

表1 实时定量-PCR扩增使用的引物序列
1.4实时定量-PCR 每组选取6只小鼠,每只小鼠肝脏组织取50 mg,按照TRIzol试剂说明书提取总RNA。根据260 nm波长下样品总RNA的吸光度(optical density,OD)值计算样品中RNA含量,定量至0.5 μg/μl。采用OD260/OD280鉴定RNA的纯度,用琼酯糖凝胶电泳技术检测RNA的完整性。取2.0 μg总RNA进行逆转录成cDNA,在加入逆转录反应组分前将总RNA在70℃变性10 min,逆转录反应体系在42℃孵育60 min后在95℃加热5 min中止逆转录反应,逆转录合成的cDNA保存于-80℃冰箱。取1.0 μl DNA进行PCR扩增。PCR扩增反应在95℃预变性5 min启动热启动酶,按95℃变性15 s、60℃退火15 s、72℃延伸30 s三步法循环扩增50次,末次循环后进行溶解曲线分析以检测PCR扩增产物质量。以18s核糖体RNA(Rn18s)作为PCR扩增实验的内对照,用LightCycler 480软件(德国罗氏公司,版本1.5.0)按2-ΔΔCt方法计算目的基因相对比值。
1.5统计学处理 采用SPSS 16.0软件进行分析,计量资料以±s表示。各组间比较采用单因素方差分析,进一步两两比较采用LSD检验。
2 结果
2.1非孕和不同孕期小鼠血脂水平的比较 为观察不同孕期小鼠血脂特点,与对照非孕鼠比较,血清TG和血清VLDL浓度随着受孕周期的增加而逐步增加,并且从孕中期始增加明显;而TCH与HDL-C则在孕晚期明显上升,差异均有统计学意义,见表2。
表2 小鼠不同孕期血脂代谢特点(mmol/L,n=6,±s)
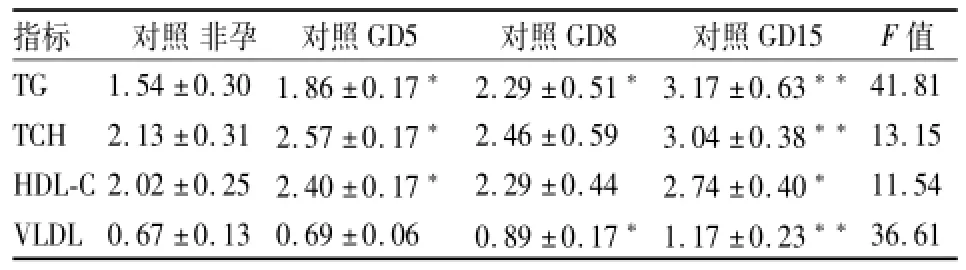
表2 小鼠不同孕期血脂代谢特点(mmol/L,n=6,±s)
与对照非孕鼠比较:*P<0.05,**P<0.01
?
2.2接触LPS对非孕和不同孕期小鼠血脂的影响为比较各组孕鼠在LPS处理后不同孕期的血脂特点,与LPS非孕鼠比较,血清TG和VLDL在孕早期,与非孕鼠差异无统计学意义,而在孕中期和孕晚期,则显著增加(P<0.05),血清TCH和HDL-C则在孕早期既已出现上升趋势,各项指标在孕晚期达最高峰(P<0.01)。并且LPS处理组分别与对照GD5、对照GD8、对照GD15比较,也明显增加其血脂水平,孕中期后愈明显,见表2、3。
表3 小鼠不同孕期接触LPS对血脂代谢的影响(mmol/L,n=6,±s)

表3 小鼠不同孕期接触LPS对血脂代谢的影响(mmol/L,n=6,±s)
与LPS非孕鼠比较:*P<0.05,**P<0.01
?
2.3小鼠孕期接触不同剂量LPS对血脂代谢的影响 上述结果表明,小鼠血脂水平从孕中期始增加明显,而且也是从孕中期始孕鼠接触低剂量LPS(40 μg/kg)后血脂代谢变化明显。选择孕中期小鼠和非孕期对照小鼠,比较不同剂量LPS对其血脂代谢的影响,显示LPS 10 μg/kg处理对非孕鼠及孕鼠血脂的改变有上升的趋势,但差异均无统计学意义;而在LPS 40、160 μg/kg处理后,分别与相同剂量非孕鼠比较,孕鼠组各项指标,随着剂量的增加,均明显上升,但非孕鼠则上升不明显。两组分别与各自对照组比较,也具有相同效应。见表4。
2.4LPS对孕鼠肝脏脂肪酸摄取、合成、氧化与脂质转运相关基因mRNA水平的影响 在GD8腹腔注射LPS 40 μg/kg,与对照组比较,显示其肝脏脂肪酸摄取关键酶脂肪酸转位酶(CD36)mRNA水平明显上升;肝脏脂肪酸合成关键酶脂肪酸合成酶(fas)、乙酰辅酶A羧化酶(acc)、硬酯酰辅酶A去饱和酶-1(scd1)mRNA水平均明显升高;而肝脏脂肪酸β-氧化关键酶肉碱棕榈酰转移酶1α(cpt1α)和ω-氧化关键酶细胞色素P450酶4a10(cyp4a10)和cyp4a14 mRNA水平显著受到抑制;肝脏脂质转运关键酶微粒体TG转运蛋白(mttp)和载脂蛋白B(abob)mRNA水平有上升趋势,但前者差异无统计学意义。见表5。
3 讨论
妊娠状态能够影响母体正常的脂质代谢,孕妇体内雌、孕激素等胎盘激素水平逐渐升高,至妊娠晚期达高峰,从而使脂肪组织的降解能力逐渐增强,肝脏合成TG水平升高[6];肝脏作为体内脂质生成的主要场所,VLDL负责将肝脏内源性合成的TG等脂质运输至血液等肝外组织,其代谢受到脂蛋白脂肪酶(lipoprotein lipase,LPL)的调节[7]。在孕中晚期,脂肪组织中脂解活性加强,导致LPL活性降低,使得脂肪组织摄取血液循环中TG能力下降,肝细胞分泌VLDL增多,从而使血脂水平升高,主要表现为高TG血症[8]。本研究中,正常孕鼠血清TG和VLDL随着孕期的增加而增加,各项血脂水平均高于非孕期,并且所有指标在孕晚期都达到最高值,与上述结论一致。
表4 小鼠孕期接触不同剂量LPS对血脂代谢的影响(mmol/L,n=6,±s)
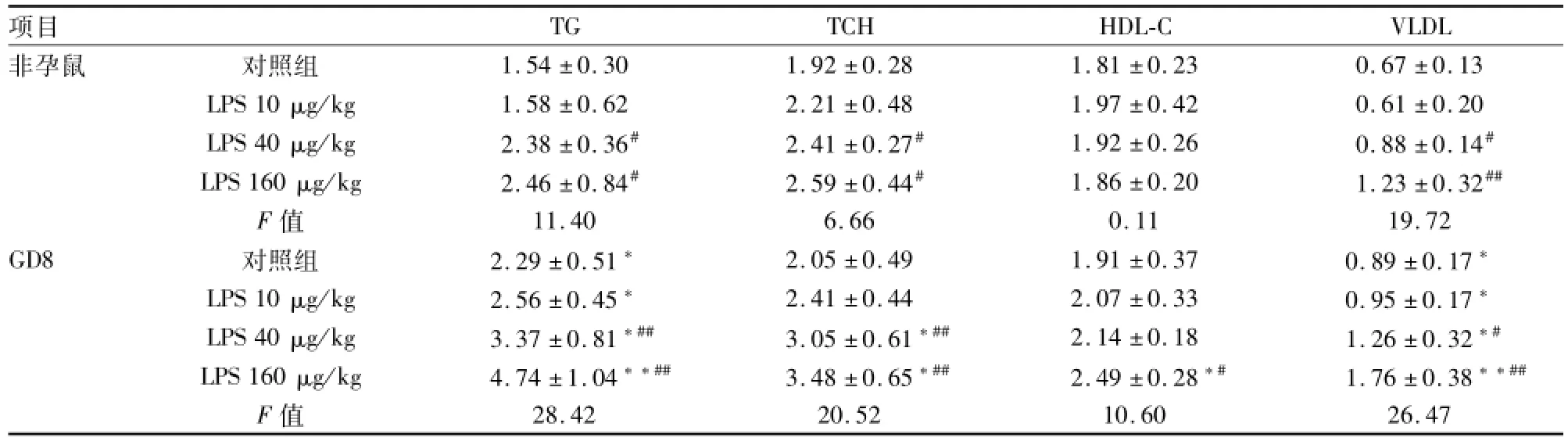
表4 小鼠孕期接触不同剂量LPS对血脂代谢的影响(mmol/L,n=6,±s)
与非孕鼠LPS相同剂量比较:*P<0.05,**P<0.01;与对照组比较:#P<0.05,##P<0.01
项目TGTCHHDL-CVLDL非孕鼠对照组1.54±0.301.92±0.281.81±0.230.67±0.13 LPS 10 μg/kg1.58±0.622.21±0.481.97±0.420.61±0.20 LPS 40 μg/kg2.38±0.36#2.41±0.27#1.92±0.260.88±0.14#LPS 160 μg/kg2.46±0.84#2.59±0.44#1.86±0.201.23±0.32##F值11.406.660.1119.72 GD8对照组2.29±0.51*2.05±0.491.91±0.370.89±0.17*LPS 10 μg/kg2.56±0.45*2.41±0.442.07±0.330.95±0.17*LPS 40 μg/kg3.37±0.81*##3.05±0.61*##2.14±0.181.26±0.32*#LPS 160 μg/kg4.74±1.04**##3.48±0.65*##2.49±0.28*#1.76±0.38**##F值28.4220.5210.6026.47
表5 LPS对肝脏脂肪酸摄取、合成、氧化与脂质转运相关基因相对表达水平的比较(n=6,±s)
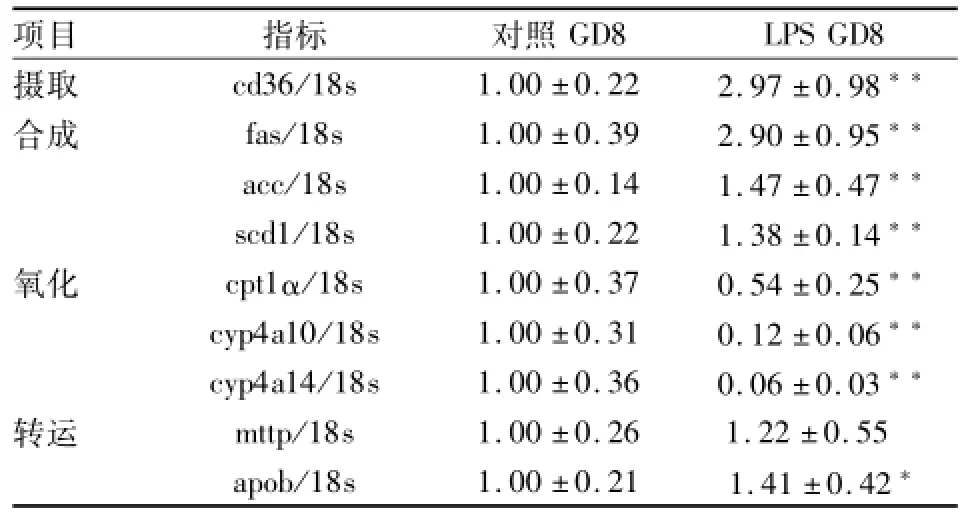
表5 LPS对肝脏脂肪酸摄取、合成、氧化与脂质转运相关基因相对表达水平的比较(n=6,±s)
与对照GD8比较:*P<0.05,**P<0.01
项目指标对照GD8LPS GD8摄取cd36/18s1.00±0.222.97±0.98**合成fas/18s1.00±0.392.90±0.95**acc/18s1.00±0.141.47±0.47**scd1/18s1.00±0.221.38±0.14**氧化cpt1α/18s1.00±0.370.54±0.25**cyp4a10/18s1.00±0.310.12±0.06**cyp4a14/18s1.00±0.360.06±0.03**转运mttp/18s1.00±0.261.22±0.55 apob/18s1.00±0.211.41±0.42*
研究[1]表明,炎症或感染可引起血脂质代谢改变。LPS也被广泛地用于建立炎症或感染的动物模型。研究[9]显示,低剂量LPS是通过肝脏脂肪酸从头合成增加,使得肝脏脂蛋白生成增多;而高剂量LPS则是通过降低LPL活性、延迟富含TG脂蛋白的清除率,导致脂蛋白的分解代谢下降,从而诱导形成高TG血症。但是肝脏VLDL生成过多和血脂异常作为感染性反应的特点,其机制尚未完全明确[10]。本研究中LPS进一步促进孕期血清TG、VLDL水平的升高,与非孕鼠比较,血中TG水平孕晚期已达到5.42 mmol/L;并且在孕中期给予LPS 10、40、160 μg/kg,与非孕鼠相同剂量比较,结果显示随着LPS剂量增加,其血脂代谢紊乱越明显,但非孕鼠则上升不明显,说明LPS对孕期血脂代谢的影响,相较于非孕鼠,具有更明显的剂量效应关系,这些结果提示,小鼠妊娠期间对低剂量LPS影响血脂代谢的敏感性较非孕时强。
如前所述,LPS升高孕期血清TG、VLDL水平的升高可能通过调节肝脏脂肪酸代谢,本研究进一步探讨了孕期接触LPS对肝脏脂肪酸摄取、从头合成、氧化和脂质转运的影响。CD36作为脂肪酸从血浆向肝细胞转运的主要转运体,是促进肝细胞摄取长链脂肪酸的关键酶,在肝脏脂质代谢中具有重要作用[11]。本研究中,LPS可显著上调孕鼠肝脏CD36 mRNA水平,说明孕期接触LPS可促进肝外组织脂肪酸通过血浆向肝细胞转运,使肝细胞摄取脂肪酸增多。越来越多的研究[12]证实,肝脏脂肪酸合成增加在肝脏脂质沉积和非酒精性脂肪肝发病过程中起主要作用。对非孕鼠的研究[13]结果显示,LPS可进一步上调小鼠肝脏fas基因表达。本研究结果显示,LPS孕鼠组肝脏fas、acc和scd1 mRNA水平也相应升高,提示LPS可上调肝脏脂肪酸合成关键酶fas、acc和scd1的基因表达,促进脂质合成增加。而另一项研究[14]表明,LPS通过白介素-1受体相关激酶1(IRAK-1)通路,下调过氧化物酶体增殖物激活受体α(PPAR α),降低肾脏和肝cpt1α mRNA水平,从而抑制游离脂肪酸氧化,从而诱导血液循环中游离脂肪酸和TG水平上升。本项研究中,LPS处理后,肝脏脂肪酸β氧化关键酶cpt1α和ω氧化关键酶cyp4a10和cyp4a14 mRNA水平均较非孕鼠显著降低,说明孕期接触LPS有可能通过抑制脂肪酸氧化水平,进而促进高TG血症的形成。一项禁食大鼠的动物研究[15]表明,LPS引发的高TG血症是由于肝脏生成VLDL增加以及其外周的代谢降低,且与apob和mttp mRNA水平的上升有关。mttp是肝细胞中VLDL和小肠细胞中乳糜微粒合成和分泌所必需的脂质转移蛋白;肝细胞合成TG后,由mttp转移至内质网腔内,再与apob等合成VLDL,从而将肝内脂质运送到细胞外。本研究中LPS组mttp与apob mRNA水平有上升趋势,但仅后者差异有统计学意义,说明孕期接触LPS可以通过上调apob基因表达水平,调节肝脏脂质转运。以上结果表明,LPS可能通过肝脏摄取脂肪酸增加,促进肝脏脂质合成增加,并且抑制肝脏脂肪酸氧化水平,使孕期血清脂质水平上升。
本研究通过系统地探讨LPS对孕鼠血脂代谢影响,证明LPS加重孕期血脂代谢紊乱,对深入研究LPS干扰孕期脂质代谢的分子机制提供依据,为孕期感染所致母体脂质代谢紊乱制定合理有效的防治对策提供理论依据,而且妊娠期避免接触LPS对于预防妊娠并发症和降低不良妊娠结局具有深远的意义。
[1] Khovidhunkit W,Kim M S,Memon R A,et al.Effects of infection and inflammation on lipid and lipoprotein metabolism:mechanisms and consequences to the host[J].J Lipid Res,2004,45(7):1169-96.
[2] Burdet J,Rubio A P,Salazar A I,et al.Inflammation,infection and preterm birth[J].Curr Pharm Des,2014,20(29):4741-8.
[3] Bullon P,Jaramillo R,Santos-Garcia R,et al.Relation of periodontitis and metabolic syndrome with gestational glucose metabolism disorder[J].J Periodontol,2014,85(2):e1-8.
[4] Xu D X,Chen Y H,Zhao L,et al.Reactive oxygen species are involved in lipopolysaccharide-induced intrauterine growth restric-tion and skeletal development retardation in mice[J].Am J Obstet Gynecol,2006,195(6):1707-14.
[5] Aisemberg J,Vercelli C A,Bariani M V,et al.Progesterone is essential for protecting against LPS-induced pregnancy loss.LIF as a potential mediator of the anti-inflammatory effect of progesterone[J].PLoS One,2013,8(2):e56161.
[6] Basaran A.Pregnancy-induced hyperlipoproteinemia:review of the literature[J].Reprod Sci,2009,16(5):431-7.
[7] Mattijssen F,Kersten S.Regulation of triglyceride metabolism by Angiopoietin-like proteins[J].Biochim Biophys Acta,2012,1821(5):782-9.
[8] Herrera E,Ortega-Senovilla H.Lipid metabolism during pregnancy and its implications for fetal growth[J].Curr Pharm Biotechnol,2014,15(1):24-31.
[9] Feingold K R,Staprans I,Memon R A,et al.Endotoxin rapidly induces changes in lipid metabolism that produce hypertriglyceridemia:low doses stimulate hepatic triglyceride production while high doses inhibit clearance[J].J Lipid Res,1992,33(12):1765-76.
[10]Bartolome N,Aspichueta P,Martinez M J,et al.Biphasic adaptative responses in VLDL metabolism and lipoprotein homeostasis during Gram-negative endotoxemia[J].Innate Immun,2012,18(1):89-99.
[11]Koonen D P,Jacobs R L,Febbraio M,et al.Increased hepatic CD36 expression contributes to dyslipidemia associated with dietinduced obesity[J].Diabetes,2007,56(12):2863-71.
[12]Postic C,Girard J.Contribution of de novo fatty acid synthesis to hepatic steatosis and insulin resistance:lessons from genetically engineered mice[J].J Clin Invest,2008,118(3):829-38.
[13]Fukunishi S,Sujishi T,Takeshita A,et al.Lipopolysaccharides accelerate hepatic steatosis in the development of nonalcoholic fatty liver disease in Zucker rats[J].J Clin Biochem Nutr,2014,54(1):39-44.
[14]Maitra U,Chang S,Singh N,et al.Molecular mechanism underlying the suppression of lipid oxidation during endotoxemia[J]. Mol Immunol,2009,47(2-3):420-5.
[15]Aspichueta P,Perez-Agote B,Perez S,et al.Impaired response of VLDL lipid and apoB secretion to endotoxin in the fasted rat liver[J].J Endotoxin Res,2006,12(3):181-92.
Effects of lipopolysaccharide on serum lipid metabolism of pregnancy mice
Liao Jianhong1,Zhao Mei1,Xu Dexiang2,et al
(1School of Nursing,2Dept of Toxicology,School of Public Health,Anhui Medical University,Hefei 230032)
Objective To investigate the effect of lipopolysaccharide(LPS)on lipid metabolism in pregnant mice. Methods ICR female mice were divided into four groups[non pregnant group,pregnancy 5 days(GD5)group,GD8 group,and GD15 group].Mice in each group were divided into control group and LPS group.Mice were intraperitoneally injected with saline and low dose of LPS(40 μg/kg)respectively.To further explain the effects of different doses of LPS on lipid metabolism in mice during pregnancy,nonpregnant mice group and GD8 group were intraperitoneal injected with LPS 10,40,160 μg/kg respectively.Mice were sacrificed 16 h after LPS.Blood serum was collected for serum lipids measurement and liver was collected for RT-PCR to detect related genes of fatty acid intake,synthesis,oxidation and lipid transport.Results ①Compared with the control nonpregnant mice,serum TG and VLDL concentrations elevated gradually with the gestational age,and increased significantly from the second trimester of pregnancy,while the serum levels of TCH and HDL-C significantly increased in the third trimester of pregnancy;②After LPS treatment,compared with LPS nonpregnant mice,serum TG and VLDL had no significant difference in the first trimester of pregnancy,while increased significantly in the second and third stage of pregnancy.The serum levels of TCH and HDL-C increased in early pregnancy;③There was a dose-response relationship between LPS treatment and the disorder of lipid metabolism in the middle of pregnancy,while LPS 40 μg/ kg was sufficient to cause the disorder of lipid metabolism;④RT-PCR results showed that,liver fatty acid intake and synthesis related genes mRNA levels were significantly increased,and liver fatty acid oxidation related genes mRNA levels decreased significantly.Conclusion LPS exposure during pregnancy causes the disorder of serum lipid metabolism.
lipopolysaccharide;pregnancy;serum lipid metabolism;triglyceride;very low density lipoprotein
R 714.148
A
1000-1492(2016)06-0813-05
2016-01-18接收
国家自然科学基金(编号:81100449);安徽医科大学青年拔尖人才支持计划资助;安徽省科技厅第二批科技计划项目(编号:1303063025)
安徽医科大学1护理学院、2公共卫生学院卫生毒理学系、3基础医学院组织胚胎学教研室,合肥 230032
廖建红,女,硕士研究生;赵 梅,女,副教授,硕士生导师,责任作者,E-mail:haizhaomei@163.com

