医疗器械的软件相关召回分析
彭 亮于 一
医疗器械的软件相关召回分析
彭 亮①于 一②
目的:基于软件相关召回分析,探讨医疗器械的软件监管要求.方法:收集整理美国软件相关召回数据,分析软件相关召回的类型、情形、原因和发展趋势,提供医疗器械的软件监管对策.结果:自1983-2011年的4个时期内,美国软件相关召回在医疗器械召回所占比重由6%增至19%,同比增长由47%增至164%,明显高于同期医疗器械的整体水平(由13%增至54%),尤其是放射类医疗器械的软件相关召回,其问题最为严重.结论:软件监管形势较为复杂和严峻,需要针对软件特殊性进一步加强医疗器械的软件监管工作,包括软件确认、不良事件监测和可用性设计.
医疗器械召回;软件相关召回;软件确认;不良事件;可用性

彭亮,男,(1978- ),博士,助理研究员.国家食品药品监督管理总局医疗器械技术审评中心,国际医疗器械监管机构论坛(IMDRF)独立软件(SaMD)工作组成员,从事医疗器械软件的技术审评工作.
[First-author's address] Center for Medical Device Evaluation, China Food and Drug Administration (CFDA), Beijing 100044, China.
随着信息技术的发展,软件在医疗器械的设计、生产和使用等方面的应用日益普遍,作用日趋重要,但软件相关召回(即与软件失效有关系的医疗器械召回)的数量日渐增多,软件质量问题不容忽视,根源在于软件无物理实体,具有其特殊性[1-4].分析和评估软件相关召回数据,不仅有助于提高对软件相关风险以及发展趋势的认识,而且有助于进一步推动软件监管工作,从而保证医疗器械产品的安全性和有效性,保障公众的健康和用械安全.
1 美国FDA软件相关召回调研
美国食品药品监督管理局(F o o d D r u g Administration,FDA)医疗器械上市后监管工作起步较早,召回数据较为系统和完整,因此可以基于美国FDA软件相关召回数据来探讨软件相关监管要求.本研究通过美国软件相关召回研究、美国FDA软件指南的文献调研,收集整理美国自1983-2011年的4个时期软件相关召回数据.数据选用遵循以下3个基本原则:①尽量采用美国FDA官方公布的数据,以保证软件相关召回数据的准确性;②采用长期数据而非短期数据,以体现软件相关召回的总体情况;③时期尽可能相互衔接,以反映软件相关召回的发展趋势.
软件相关召回在美国FDA并无明确定义,不同文献的定义有所不同,如"与软件有关系的召回"、"软件失效导致的召回",同时不同文献的研究方法和统计口径有所差异[1].本研究采用长期总体数据进行分析,数据的异质性问题不会使分析结论受到影响.
1.1 美国软件相关召回情况
美国医疗器械召回数量从1983-2011年的4个时期内,由2792次增至5792次,软件相关召回数量由165次增至1122次,在医疗器械召回所占比重由6%增至19%,同时医疗器械召回同比增长由13%增至54%,软件相关召回同比增长由47%增至164%,明显高于同期医疗器械的整体水平(见表1)[1-4].
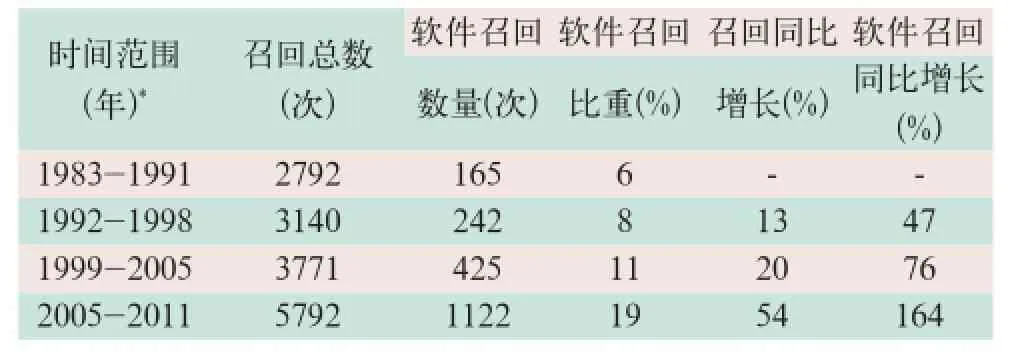
表1 美国软件相关召回情况
1992-1998年的召回数据表明软件相关召回有79%与软件更新有关系,而1999-2005年的召回数据表明含有软件医疗器械的召回有34%与软件失效有关系[2-3].
1.2 美国软件相关召回分布情况
美国FDA将软件相关召回细分为7类:①放射类(如影像设备、放疗设备);②体外诊断类(如生化分析仪、病理分析仪);③心脏类(如起搏器、除颤器);④呼麻类(如呼吸机、麻醉机);⑤手术类(如手术导航、电刀设备);⑥通用类(如监护仪、输注泵);⑦其他类(如眼科设备、妇科设备).
从1983-2011年的4个时期内,放射类和体外诊断类所占比重一直较大,其中放射类所占比重由19%持续增至49%,已成为重灾区,而体外诊断类所占比重先由18%增至35%再降至19%,表明前期软件质量问题较多但现在已得到控制;心脏类和呼麻类总体呈下降趋势,表明软件质量问题已得到有效控制;通用类和其他类总体呈平稳趋势,表明软件质量问题已得到基本控制;手术类所占比重虽然一直都是最低,但发生过多次导致患者死亡或严重伤害的召回事件,因此不能轻视其软件质量问题(见表2)[1,5].
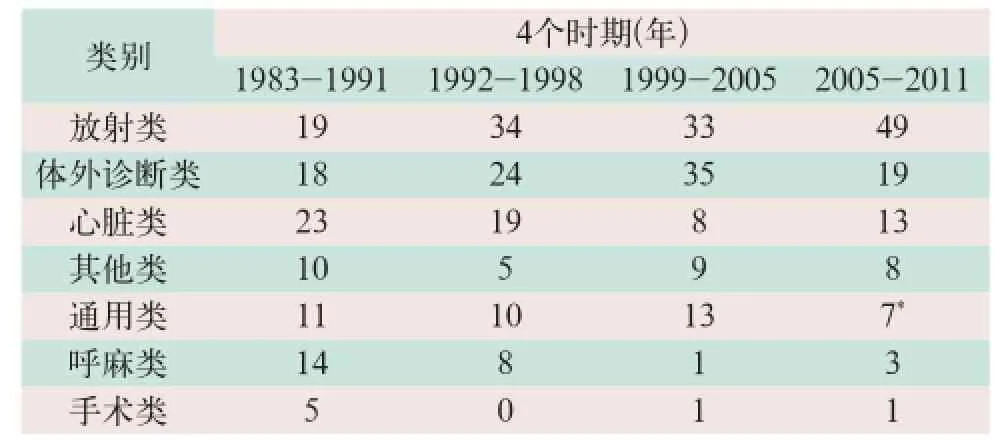
表2 美国软件相关召回分布情况(%)
2 软件相关召回分析
2.1 软件相关召回类型
软件相关召回根据软件与医疗器械关系的不同可以分为医疗器械软件召回和质量相关软件召回两种基本类型.
(1)医疗器械软件召回.医疗器械软件包括独立软件(作为医疗器械或其附件的软件)和软件组件(作为医疗器械或其部件、附件组成的软件)[6].医疗器械软件召回即为医疗器械软件失效导致的医疗器械召回,此时召回的医疗器械产品含有软件,属于有源医疗器械.
(2)质量相关软件召回.质量相关软件是指与医疗器械产品质量有关系的非医疗器械软件,包括生产设备所含软件和质量管理所用软件.质量相关软件召回即为质量相关软件失效导致的医疗器械召回,此时召回的医疗器械产品不一定含有软件,有源医疗器械、无源医疗器械或体外诊断设备皆有可能.
在现实情况下,有源医疗器械的召回可能同时涉及医疗器械软件召回和质量相关软件召回,即软件相关召回情形较为复杂.
2.2 软件相关召回情形
软件相关召回大体可以分为4种情形:①医疗器械软件召回,属于如实统计;②质量相关软件召回,属于如实统计;③硬件失效导致医疗器械召回,但表现为软件失效,属于多统计;④软件失效导致医疗器械召回,但召回报告未提及软件,而归为硬件失效,属于少统计.
前两种情形准确反映了软件相关召回的原因,而后两种情形则模糊了软件相关召回原因,这增加了软件相关召回原因的分析难度.美国FDA曾试图人工区分软件相关召回的具体情形,但由于召回报告所使用的语言不准确或不规范导致信息有限,难以确定全部软件相关召回的真实原因[1].
2.3 软件相关召回原因
美国FDA对软件相关召回原因进行了分类研究,发现软件相关召回原因早期主要是软件的算法或计算、更新、配置管理、数据、异常处理、初始化、接口、逻辑、功能、需求、质量保证及同步等方面出现问题;而目前主要是软件的接口、使用环境、更新、算法或计算及异常处理等方面出现问题[1,4].
随着技术能力的发展和认知水平的提高,软件相关召回原因已发生变化,部分问题已得到基本解决.但有些问题依然没有得到有效控制,归根结底都源自软件的设计缺陷、更新异常和使用错误,因此需要进一步加强软件的设计控制、变更控制和可用性设计.
3 软件相关召回发展趋势
美国医疗器械召回数据表明,软件相关召回日益增多,在医疗器械召回所占比重越来越大,同时软件相关召回增速明显高于医疗器械整体水平,而且增速越来越快,因此软件质量问题不容忽视,需要加强相应监管工作.此外,放射类医疗器械的软件相关召回问题最为突出,尤其需要重视.
4 软件相关召回应对策略
鉴于软件相关召回情形较为复杂,形势较为严峻,针对软件相关召回的主要原因,结合我国软件监管工作的实际情况,建议在以下3方面加强相应监管工作.
4.1 软件确认
由于软件测试不足以保证软件质量,需要综合考虑风险管理、质量管理和软件工程的要求,建立良好规范的软件生存周期过程才能保证软件质量[7].因此,软件确认不仅包括软件确认测试,而且包括软件生存周期过程的建立.
医疗器械软件和质量相关软件均需进行软件确认.对于医疗器械软件,软件生存周期过程的建立可以基于相关标准要求,基于风险水平规范软件的开发过程、维护过程、风险管理过程、配置管理过程和问题解决过程[7-8].而软件确认测试通常指在真实或模拟使用环境进行的用户测试,通过提供客观证据认定软件满足用户需求和预期用途[3,6].对于质量相关软件,其生存周期过程的建立和软件确认测试可参照医疗器械软件,而关注重点则需改为软件对医疗器械产品质量的影响程度.
医疗器械质量管理体系在设计确认和过程确认中均要求进行软件确认,其中设计确认主要是对医疗器械软件进行确认,过程确认主要是对质量相关软件进行确认[9-10].因此,医疗器械质量管理体系检查需要进一步加强软件确认的检查工作.
4.2 不良事件监测
医疗器械不良事件是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或可能导致人体伤害的各种有害事件[11].不良事件产生的主要原因在于设计缺陷,与软件相关召回原因基本契合.
鉴于软件的复杂性,不良事件监测需要在现有工作基础上进一步强化软件的要求.①加强基层监管人员以及相关人员的培训工作,使其了解软件的特殊性和监管要求;②明确不良事件术语集的软件术语,保证不良事件报告和召回报告的用语准确,提高相关报告的数据质量和可利用程度,便于确定医疗器械故障原因;③提高不良事件报告和召回报告的结构化水平,增加软件相关事件的类型描述(如软件相关或软件无关,医疗器械软件或质量相关软件),便于开展后续统计分析工作;④通过与医院的医疗器械质量控制系统相对接等多种方式收集医疗器械不良事件数据,通过对软件相关事件的大数据分析,进一步评估软件的风险及风险控制措施.
4.3 可用性设计
医疗器械可用性是指易于使用的用户接口(用户和医疗器械的交互方式)特性,即在预期使用环境中建立有效性、效率和用户满意所需的特性[12-13].用户由于感知错误、认知错误或动作错误而发生使用错误,导致医疗器械非预期响应,从而产生医疗器械可用性风险,影响患者的安全.
医疗器械软件可用性设计极为重要,软件用户界面设计不当将产生医疗器械可用性风险,因此需要关注软件的用户界面结构、互动方式、信息优先性、信息易读性、美工与颜色、屏幕尺寸和兼容性等要求[14].欧盟和美国近年来逐渐加强了医疗器械可用性的监管要求,我国也将于2017年启动可用性监管工作,而软件可用性问题需要重点关注[12-15].
5 结语
软件相关召回数据表明软件监管形势较为严峻,需要针对软件特殊性进一步加强软件相关监管工作.我国需要在借鉴国外监管经验的基础上,在有限的监管资源和条件下,针对软件监管的薄弱之处,建立符合我国国情并行之有效的软件监管机制.
[1]Simone LK.Software-related recalls:an analysis of records[J].Biomed Instrum Technol,2013,47(6):514 -522.
[2]Bliznakov Z,Mitalas G,Pallikarakis N.Analysis and classification of medical device recalls[J]. IFMBE Proceedings,2007,14(6):3782-3785.
[3]FDA.General principles of software validation;final guidance for industry and FDA staff[EB/OL].(2002-1-11)[2016-4-12].http://www.fda.gov/downloads/ MedicalDevices/DeviceRegulationandGuidance/ GuidanceDocuments/ucm085371.pdf
[4]Dolores R,Wallace D,Richard Kuhn.Failure modes in medical devices software:an analysis of 15 years of recall data[J].Int J Reliabil Qual Saf Eng,2001,8(4):351-371.
[5]Hongli Yang,William A Hyman.An analysis of software-related recalls of medical devices[J].J Clin Eng,2010,35(3):153-156.
[6]国家食品药品监督管理总局.关于发布医疗器械软件注册技术审查指导原则的通告[EB/OL].(2015-8-5)[2016-4-12].http://www.cfda.gov.cn/WS01/ CL0087/126243.html
[7]国家食品药品监督管理局.YY/T0664-2008医疗器械软件 软件生存周期过程[S].国家食品药品监督管理局,2008-04-25.
[8]国家食品药品监督管理局.YY/T0708-2009医用电气设备 第1-4部分:安全通用要求并列标准可编程医用电气系统[S].国家食品药品监督管理局,2009-11-15.
[9]国家食品药品监督管理总局.YY/T0287-2003医疗器械质量管理体系用于法规的要求[S].国家食品药品监督管理局,2003-09-17.
[10]国家食品药品监督管理总局.关于发布医疗器械生产质量管理规范的公告[EB/OL].(2014-12-29) [2016-4-12].http://www.sda.gov.cn/WS01/ CL0087/111642.html
[11]国家食品药品监督管理局.关于印发医疗器械不良事件监测和再评价管理办法(试行)的通知[EB/OL]. (2008-12-29)[2016-4-12].http://www.sda.gov. cn/WS01/CL0845/129146.html
[12]国家食品药品监督管理局.YY/T1474-2016医疗器械可用性工程对医疗器械的应用[S].国家食品药品监督管理总局,2016-01-26.
[13]IEC 62366-1:2015 Medical devices-Part 1: Appli cation of usability engineering to medical devices[S].IEC,2015.
[14]ANSI HE75:2013 Human factors engineering-Design of medical devices[S].ANSI,2013.
[15]Food and Drug Administration.Applying Human Factors and Usability Engineering to Medical Devices-Guidance for Industry and Food and Drug Administration Staff[S]. FDA,2016-02-03.
Analysis of software-related recalls of medical devices
PENG Liang, YU Yi
Objective: To discuss the regulation requirements of software based on the analysis of software-related recalls of medical devices. Methods: The data of software-related recalls of medical devices in America were collected and processed, and the type, situation, cause and trend of software-related recalls were analyzed, then the suggestions on the regulation requirements of software were proposed. Results: During the four periods from 1983 to 2011, the percentage of software-related recalls vs medical device recalls in America increased from 6% to 19%, and the year-on-year growth rate of software-related recalls rose by 47% to 164%, significantly higher than medical device recalls in the same period (from 13% to 54%). Especially, the problem of softwarerelated recalls in radiology medical devices was the most serious. Conclusion: The regulatory situation of software is more complicated and severe, so the regulation requirements of software, including software validation, adverse event monitoring and usability design, need to be further strengthened according to the particularity of software.
Medical device recall; Software-related recall; Software validation; Adverse event; Usability
1672-8270(2016)07-0097-04 [中图分类号] R194
A
10.3969/J.ISSN.1672-8270.2016.07.030
①国家食品药品监督管理总局医疗器械技术审评中心 北京 100044
②国家食品药品监督管理总局药品评价中心(国家药品不良反应监测中心) 北京 100045
2016-01-20

