螺旋断层调强根治性放射治疗同步化疗治疗Ⅳ期非小细胞肺癌的临床效果研究
方 晶胡丽丽李宏奇常冬姝徐向升吴伟章王颖杰*夏廷毅
螺旋断层调强根治性放射治疗同步化疗治疗Ⅳ期非小细胞肺癌的临床效果研究
方 晶①胡丽丽①李宏奇①常冬姝①徐向升①吴伟章①王颖杰①*夏廷毅①
目的:探讨螺旋断层调强根治性放射治疗(HT)同步化疗治疗Ⅳ期非小细胞肺癌的疗效及安全性.方法:对40例Ⅳ期非小细胞肺癌患者的资料进行回顾性分析,所有患者均接受HT同步化疗的治疗方法.结果:近期疗效中,2例(占5%)完全缓解,26例(占65%)部分缓解,治疗总有效率为70.0%.1年和2年局部控制率分别为67.5%和42.5%,无进展生存率分别为32.5%和7.5%,总生存率分别为50.0%和7.5%.所有患者中位无进展生存期为8个月,中位生存期为12个月.两组患者在年龄、性别、有无吸烟史、转移器官数目以及病理类型对生存预后的影响无差异.大部分患者不良反应仅为1~2级,少数患者出现3级不良反应,未出现4级不良反应.结论:螺旋断层调强根治性放射治疗同步化疗治疗Ⅳ期非小细胞肺癌可改善患者生存质量,治疗中不良反应可耐受.
非小细胞肺癌;螺旋断层调强放射治疗;化疗

方晶,女,(1992- ),硕士研究生.空军总医院放疗科,从事肿瘤放射治疗工作.
[First-author's address] Department of Radiation Oncology, Air Force General Hospital, PLA, Beijing 100142, China.
目前,非小细胞肺癌(non-small-cell lung cancer, NSCLC)[1]为癌症致死的首要原因,尤其是初诊的NSCLC患者中Ⅳ期约占30%,已丧失了手术切除的机会[2].目前,约30%的表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶突变的IV期NSCLC患者可接受靶向治疗,但仍有70%的IV期NSCLC患者需要化疗[3].IV期NSCLC是以铂类为主的双药联合化疗治疗手段,其总体有效率仅达35%左右[4].近年来,有研究报道IV期NSCLC原发灶高剂量三维放射治疗同期化疗可能使生存期延长,不良反应可耐受[5].然而鲜有螺旋断层调强放射治疗(helical tomotherapy,HT)同步化疗综合治疗的报道.为此,本研究回顾性分析40例接受HT根治性放射治疗同步化疗治疗IV期NSCLC患者的疗效和不良反应.
1 资料与方法
1.1 一般资料
选取2010年10月至2013年12月空军总医院收治的40例接受HT(根治性放射治疗)同步化疗治疗IV期NSCLC患者,其中男性28例,女性12例,男女比例为2.3:1;年龄(35~78岁),中位年龄60岁.经病理学诊断25例为腺癌,10例为鳞癌,2例为肺泡癌,2例为腺鳞癌,1例为腺癌伴神经内分泌癌.17例患者为单器官转移,其中肺内转移8例,骨转移4例,脑转移5例;23例患者为多器官转移.所有患者中,9例腺癌患者先进行靶向药物治疗,出现疾病进展后行HT同步化疗,16例腺癌患者及余15例非腺癌患者确诊为IV期NSCLC后即行HT同步化疗.
1.2 纳入与排除标准
(1)纳入标准:①患者年龄≥18岁;②均经病理、细胞学方法确诊为NSCLC;③经胸部CT、上腹部CT、头颅MR、骨扫描检查或躯体PET/CT及头颅MR检查以明确重要器官有无转移;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2;⑤签署放射治疗同意书及化疗同意书;⑥均接受HT(根治性放射治疗)同步化疗的治疗.
(2)排除标准:①严重肝、肾功能障碍,多器官功能衰竭及恶液质等;②精神系统病变者;③合并其他原发性恶性肿瘤;④怀孕或哺乳期妇女.
1.3 仪器与设备
使用螺旋断层调强放射治疗系统(Hi-ART,美国安科瑞公司),6MV X射线完成放射治疗.
1.4 治疗方法
(1)扫描范围.患者取仰卧位,根据不同治疗部位选择头颈肩或体部热塑膜进行固定,于平静呼吸下行CT薄层扫描.扫描范围根据治疗部位确定:①肺内病灶,下颌至肾上极;②颅内转移灶,全脑;③肝等腹部转移灶,胸骨角水平至髂前上嵴;④骨转移灶,根据相应部位确定范围.扫描后CT图像传输至治疗计划系统工作站.
(2)靶区制定.在CT图像上勾画大体靶体积(GTV)、临床靶体积(CTV)及计划靶体积(PTV),根据靶区范围勾画周围危及器官.CTV为GTV外扩3~5 mm,一般不超过解剖边界,PTV根据患者的呼吸动度及日常摆位误差,同时考虑各病灶之间的剂量关系而定,一般为CTV前后界外扩5~7 mm,上下界外扩8~10 mm,具体外扩范围根据肿瘤性质定义.
(3)具体计划.肺内原发灶及淋巴结引流区、肝、肺及肾上腺转移灶Dt 60~70 Gy,15~20次;骨转移灶Dt 50~60 Gy,10~20次;脑转移灶行全脑照射Dt 30~40 Gy,10~20次,部分患者进行加量10~20 Gy;制定计划时处方剂量覆盖95%的PTV,患者行放射治疗1次/d,5次/周.放射治疗同时给予对症支持治疗.
(4)化疗.化疗方案为以铂类为基础的双药,其中铂类药物剂量为:顺铂80~100 mg/m2,平均分为3 d静脉滴注,2~4 d;卡铂300~350 mg/m2,2 d静脉滴注;紫杉醇140~170 mg/m2,1 d静脉滴注;多烯紫杉醇60~75 mg/m2, 1 d静脉滴注;21~28 d为1个周期.紫杉醇+顺铂(TP)方案、紫杉醇+卡铂(TC)方案、多烯紫杉醇+顺铂(DP)或多烯紫杉醇+卡铂(DC)方案,分别为22例、12例和6例,化疗4~6个周期.
1.5 近期疗效评价
采取基于单径测量基础上实体肿瘤的疗效反应评价标准(response evaluation criteria in solid tumors,RECIST)对治疗后1个月的CT或MR进行评价,从而判定近期疗效(见表1).近期疗效的有效性以完全缓解(CR)+部分缓解(PR)为评价指标.生存时间(OS)定义为放射治疗开始之日至患者死亡之日或随访截止之日(见表1).

表1 RECIST近期疗效评价标准
1.6 统计学方法
采用SPSS20.0软件对数据进行统计学分析.局部控制率、无进展生存率及总生存率采用Kaplan-Meier法,单因素分析采用Log-rank检验,组间比较采用卡方检验和t检验.以P<0.05为差异有统计学意义.
2 结果
2.1 随访结果
随访信息来源于门诊复查资料及电话随访,随访时间自治疗开始之日计算,截至2015年11月11日,中位随访时间为12个月(4~36个月).
2.2 近期疗效
所有患者的近期疗效中,完全缓解2例(占5%),部分缓解26例(占65%),稳定7例(占14%),进展5例(占12.5%),治疗总有效率为70.0%.
2.3 生存情况及远期疗效
截至末次随访,1年和2年局部控制率分别为67.5%和42.5%,无进展生存率分别为32.5%和7.5%,总生存率分别为50.0%和7.5%.40例患者中37例患者死亡,中位生存期为12个月.中位无进展生存期为8个月,33例患者死于未放射治疗转移灶进展致多器官功能衰竭,4例死因不明(如图1所示).
2.4 预后因素分析
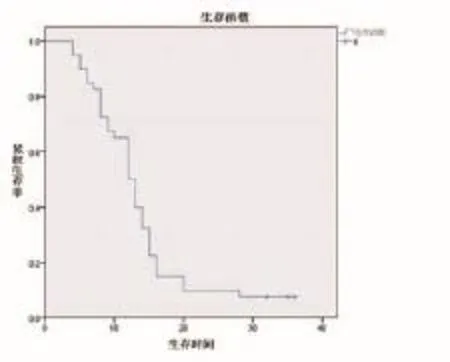
图1 40例IV期NSCLC患者接受HT同步化疗后的总生存率
(1)单因素分析.对患者性别、年龄、有无吸烟史、病理类型以及转移器官数目进行单因素分析结果显示,性别、年龄、有无吸烟史、病理类型及转移器官数目对生存预后相比,差异无统计学意义(x2=0.514,x2=0.440,x2=0.137,x2=0.224, x2=0.099;P>0.05),见表2.
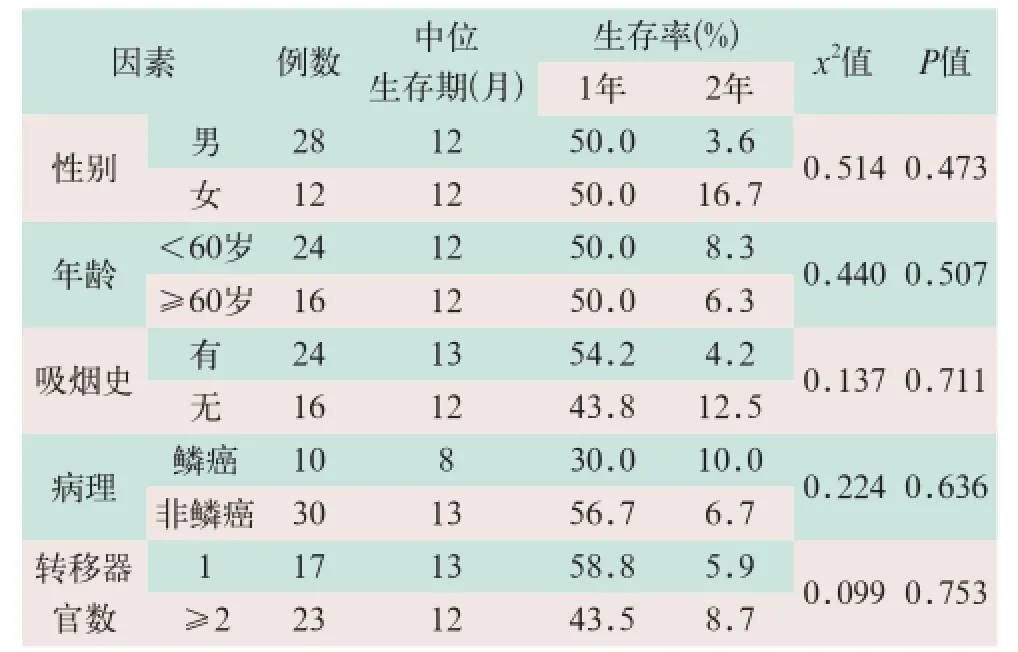
表2 40例患者生存状况及其预后的单因素分析
2.5 不良反应
全组患者中,大部分患者不良反应仅为1~2级,仅1例出现3级不良反应,未出现4级不良反应.不良反应轻微,无治疗相关性死亡,经对症处理后好转,均可耐受,其主要不良反应见表3.

表3 40例患者HT同步化疗的不良反应(例)
3 讨论
目前EGFR突变的Ⅳ期NSCLC患者首选靶向治疗,其余患者主要治疗手段为以含铂类为主的双药联合化疗为主的综合治疗,放射治疗仅作为姑息减症治疗的一种手段.然而以含铂类为主的双药联合化疗有效率不足40%,中位生存期为8~10个月,1年总生存率约30%~40%[6].目前,化疗疗效已到瓶颈阶段,靶向药物的问世,为治疗Ⅳ期NSCLC提供了新的治疗手段,但其费用负担较重.而现代放射治疗技术也在不断创新和发展,部分研究报道开始探索Ⅳ期NSCLC治疗中采用同期放化疗模式.Ⅳ期NSCLC多数肿瘤体积较大,由于心血管搏动及呼吸运动,肿瘤和胸腔内危及器官相对位移较大,导致靶区精确度不高;肺、食管、心脏及脊髓等危及器官对射线较敏感,限制了靶区剂量的提高;而放射性肺炎等不良反应可致生存质量下降而抵消放射治疗所致益处.然而,HT拥有调强能力及在线图像引导功能,可完成最大程度的杀灭肿瘤细胞,同时最大程度保护正常组织的目标[7].
本研究HT同步化疗治疗40例IV期NSCLC患者,其中位生存期为12个月,1年总生存率为50.0%,优于文献报道的单一系统化疗的30%~35%[8].本研究截至末次随访,有3例患者生存,其中2例患者行HT(根治性放射治疗)同步化疗治疗前曾行靶向治疗,表明即使靶向药物治疗失败后,继续给予化疗同步根治性放射治疗同样能改善生存.本研究采取HT(根治性放射治疗)同步化疗治疗IV期非小细胞肺癌,其1年,2年局控率分别为67.5%和42.5%,中位无进展生存期为8个月,1年、2年无进展生存率为32.5%和7.5%.在化疗的基础上,通过根治性放射治疗控制局部病灶,从而减少和延缓肿瘤的潜在转移,提高局控率.
彭红等[9]报道1742例IV期NSCLC的预后分析显示,<65岁肺癌的生存期优于≥65岁患者,这可能与老年患者多数储备功能下降并伴有心脑血管疾病有关,其对放化疗的耐受力也随之降低.而部分研究报道ECOG PS评分为0~1分的老年患者,年龄不影响生存[10].本研究所有患者ECOG PS评分≤2分,活动能力较好,结果显示,年龄<60岁和年龄≥60岁的患者生存结果相似(12个月vs.12个月, P=0.473),因此,若老年患者一般情况较好,不要轻易放弃治疗,而恰当放化疗可改善其生存质量.杨俊体等[11]报道,腺癌患者预后较鳞癌患者更佳,可能由于腺癌放射治疗较鳞癌敏感,且鳞癌多为中央型病灶,病灶较大时易导致阻塞性肺炎及肺不张等并发症.本研究鳞癌患者中位生存期8个月,非鳞癌患者中位生存期13个月,差异无统计学意义,可能与本研究样本量较小有关.
多数报道认为,化疗治疗IV期非小细胞肺癌多器官转移患者较单器官转移患者生存预后差,但仍有研究报道,虽然单器官转移和多器官转移在相同的治疗强度下(4~5个周期化疗同期原发灶放射治疗≥63 Gy)的生存期无显著差异,但单器官转移及多器官转移4~5个周期化疗同期原发灶放射治疗≥63 Gy的中位生存期优于化疗同期原发灶放射治疗<63 Gy的患者[12-13].本研究单器官转移患者与多器官转移患者生存结果相似.因此,无论单器官转移或多器官转移,要使HT延长生存作用,均需给予足够放射治疗剂量使局部病灶得到控制,可能会带来更多的生存获益[14].
本研究不良反应主要为骨髓抑制,但均为轻、中度,经对症处理后均好转,且无治疗相关性死亡.急性期放射性肺炎1级和2级发生率分别为5.0%和7.5%;放射性食管炎1级发生率为5.0%.HT为图像引导下的放射治疗,每次治疗前进行影像校正仅用1~2 cGy,对患者及治疗总剂量影响均很小,校正摆位误差,同时可计算当次照射的实际剂量分布,从而可评估和调整此后分次治疗的治疗计划,这避免了正常组织过多的高剂量照射,减少了不必要的放射性正常组织损伤所致的严重不良反应.同时严格限制20 Gy剂量区在35%以下,且大部分患者无肺部基础疾病也是本研究不良反应轻微可耐受的良好因素.以往多数学者认为,HT治疗肺部病灶时V5数值较高会导致放射性肺炎的发生[15].本研究放射性肺炎较少,但计划审核时仍须遵循剂量分布-体积图的剂量,这样才可能最大限度避免放射性肺炎的发生.
本研究结果提示,HT(根治性放射治疗)同步化疗治疗IV期NSCLC疗效较好,不良反应轻微且能耐受,安全可行.但本研究存在诸多不足之处,样本量小且为回顾性研究,HT根治性放射治疗同步化疗治疗IV期非小细胞肺癌的疗效仍需大样本多中心前瞻性随机分组的研究证实.
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,25:1-18.
[2]Janssen-heijnen ML,Smulders S,Lemmens,et al. Effect of comorbidity on the treatment and prognosis of elderly patients with non small cell lung cancer[J].Thorax,2004,59(7):602-607.
[3]Qian H,Gao F,Wang H,et al.The efficiacy and safety of crizotinib in the treatment of anaplastic lymphoma kinase-positive nonsmall cell lung cancer:a meta-analysisi of clinical trials[J].BMC Cancer,2014,14(1):683.
[4]Kang S,Koh ES,Vined SK,et al.Cost analysis of Lung Cancer management in South Western Sydney[J].J Med Imaging Radiat Oncol,2012,56(2):235-241.
[5]张波,卢冰,苏胜发,等.Ⅳ期非小细胞肺癌化疗同期胸部三维放疗的前瞻性临床研究(四)-近期疗效对生存的影响[J].中华放射肿瘤学杂志,2012,21(1):29-34.
[6]Loriot Y,Sofia JC,Le Chevalier T.Expanding role of chemotherapy in lung cancer[J].Ann Oncol,2006,17(10):101-107.
[7]戚仕涛,汤黎明,刘铁兵,等.TOMO刀原理与临床应用[J].现代仪器,2011,3(17):24-27.
[8]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61 (2):69-90.
[9]彭红,马美丽,韩宝惠,等.1742例IV期非小细胞肺癌的预后分析[J].中国肺癌杂志,2011,14(4):362-366.
[10]Liao ML,Zhou YZ,Ding JA, et al.The study of peri-operative chemotherapy in stage I-IIIa NSCLC[J].Nat Med J China,2003,83(11):962 -966.
[11]杨俊体,兰胜民,曹建忠,等.Ⅳ期非小细胞肺癌姑息性放疗临床价值回顾性分析[J].中华肿瘤防治杂志,2012,19(18):1413-1416.
[12]Scagliotti GV,Parikh PVon Pawel J.Phase III study comparing-cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-nave patients with advancedstage non-small-cell lung cancer[J].J Clin Oncol,2010,26(3):3543-3551.
[13]王刚,卢冰,苏胜发,等.Ⅳ期非小细胞肺癌化疗同期胸部三维放疗的前瞻性临床研究(二)--不同器官转移状态对生存的影响[J].中华放射肿瘤学杂志,2011,11(20):473-477.
[14]Welzel G,Fleekenstein K,Schaefer J,et al.Memory functionbefore and after whole brain radiotherapy in patients with andwithout brain metastases[J].Int J Radiat Oncol Biol Phys,2008,72(5):1311-1318.
[15]Bral S,Duchateau M,Versmessen H,et al. Toxicity report of a phase 1/2 doseescalation study in patients with inoperable, locally advanced non-small cell lung cancer with helical tomotherapy and concurrent chemotherapy[J].Cancer,2010,116(1)241-250.
Clinical value of individualized helical tomotherapy radical radiotherapy united with chemotherapy for the treatment of stage IV non-small cell lung cancer
FANG Jing, HU Li-li, LI Hong-qi, et al
Objective: To discuss the clinical value and safety of individualized helical tomotherapy radical radiotherapy united with chemotherapy in patients with stage IV non-small cell lung cancer (NSCLC). Methods: 40 patients with NSCLC in stage IV were enrolled in this retrospective study, and all of them were admitted to Air Force General Hospital from October 2011 to December 2013. They were treated by helical tomotherapy radical radiotherapy united with chemotherapy. Results: The CR and PR rates of the treated tumor were 5% and 65%. The effective rate (CR+PR) was 70.0%. The 1 and 2 years local control rates were 67.5% and 42.5%. The progression-free survivals were 32.5% and 7.5%. The overall survival time rates were 50.0% and 7.5%, respectively. Of the 40 patients, the median progressionfree time was 8 months and the median survival time was 12 months. There were no significant differences among age, sex, smoking history or numbers of metastatic organs. The toxicities in most of the patients were grade 1 and grade 2, minority of them was grade 3, and none was grade 4. Conclusion: We showed that united individualized helical tomotherapy radical radiotherapy and chemotherapy can be effective, improve the quality of life and be safe.
Non-small cell lung cancer; Helical tomotherapy radical radiotherapy; Chemotherapy
1672-8270(2016)07-0074-04 [中图分类号] R734.2
A
10.3969/J.ISSN.1672-8270.2016.07.023
①空军总医院放疗科 北京 100142
wangyj9999@163.com
2015-08-26

