中高温油藏内源微生物厌氧激活
冯 云,段传慧,林军章,孙刚正
(中国石油化工股份有限公司胜利油田分公司石油工程技术研究院,山东东营257000)
中高温油藏内源微生物厌氧激活
冯云,段传慧,林军章,孙刚正
(中国石油化工股份有限公司胜利油田分公司石油工程技术研究院,山东东营257000)
为了明确中高温油藏内源微生物厌氧激活产气的特点,在胜利油田选取了11个区块开展产气研究,温度范围分别为55~65℃、65~79℃、79~95℃。在模拟油藏条件下厌氧激活发现,低于79℃时,油藏内源微生物普遍能被激活并代谢产气;而高于79℃时,无明显甲烷气产生。利用不同碳源激活后发现,H2/CO2为碳源时,最大产甲烷速率可达1 500 μmol/(g·d),显著高于乙酸钠和淀粉,这表明中高温油藏内产甲烷古菌以氢营养型为主。进一步对正理庄正南区块内源微生物群落组成研究,发现厌氧激活后古菌中Methanobacterium被激活成为优势菌群,有利于在油藏内代谢产甲烷气。厌氧激活前油水样中优势菌都是Pseudomonas,不同激活剂条件下优势菌群发生明显变化,H2/CO2和淀粉以激活Thermotoga为主,而乙酸钠则主要激活了油井中的Deferribacter。此外,该区块不同油井在相同激活条件下,其优势菌群趋向于一致,但油井和水井中优势菌群存在明显差异。通过对中高温油藏内源微生物厌氧激活的研究,为进一步提高微生物采油的效果奠定了基础。
内源微生物;厌氧激活;甲烷气;群落结构
油藏内源微生物群落是油田注水开发过程中一定时期内在数量和种类上保持相对稳定的微生物群落,其随注入水进入油藏[1-4]。通过注水井向地层中注入营养激活剂来激活油藏中的有益微生物群落,利用其自身在油藏中的代谢活动及代谢产物(生物表面活性剂、有机酸、有机溶剂和生物气等)与岩石、原油和水的界面相互作用,降低界面张力,改善原油的流动性质,提高原油采收率,即内源微生物驱油[5-7]。内源微生物激活过程可以分为两个阶段,第一阶段为好氧发酵阶段,第二阶段为厌氧发酵阶段,代谢产生的气体一方面可以增加地层压力,另一方面可溶解于原油中,降低原油黏度,提高原油采收率[8]。胜利油田常规水驱开发动用地质储量35亿t,油藏温度范围在39~175℃,其中55~95℃的中高温油藏占一半以上,技术应用潜力巨大,但对中高温油藏中内源微生物的产气潜力以及菌群利用激活剂产气特点缺乏系统的评价和认识。
本文中,笔者针对胜利油田的11个中高温油藏区块的油(水)井样品,在模拟高温油藏条件下开展分析研究,利用不同激活剂进行厌氧激活产气模拟研究,分析甲烷产生的潜力和速率,同时对中高温油藏内源微生物菌群结构演变规律进行跟踪分析,以期为中高温油藏内源微生物驱油现场试验提供参考。
1 材料与方法
1.1样品采集
油水井井口采集水样至5~20 L塑料桶中,样品采集后立即常温运回实验室,取样信息及编号见表1。
表1 样品采集及编号
Table 1 Sample collection and number
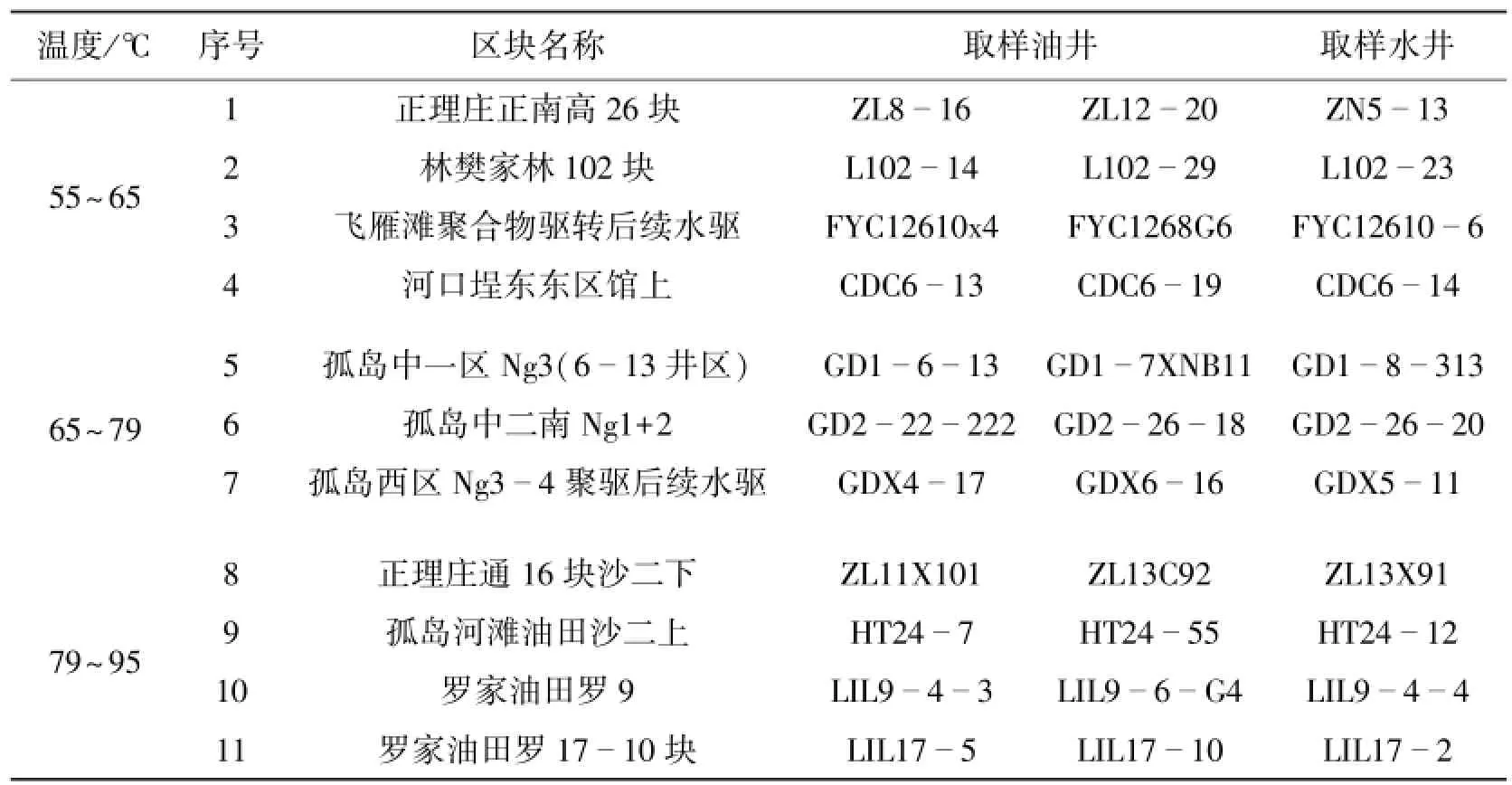
温度/℃序号区块名称取样油井取样水井1正理庄正南高26块ZL813 2林樊家林102块L102 16ZL1220ZN5 23 3飞雁滩聚合物驱转后续水驱FYC12610x4FYC1268G6FYC12610 55~6514L10229L102 6 4河口埕东东区馆上CDC613CDC619CDC614 65~79 79~95 5孤岛中一区Ng3(6 313 6孤岛中二南Ng1+2GD2 13井区)GD1613GD17XNB11GD18 20 7孤岛西区Ng3 22222GD22618GD226 4聚驱后续水驱GDX417GDX616GDX511 12 10罗家油田罗9LIL9 8正理庄通16块沙二下ZL11X101ZL13C92ZL13X91 9孤岛河滩油田沙二上HT247HT2455HT24 43LIL96G4LIL944 11罗家油田罗1710块LIL175LIL1710LIL172
1.2模拟培养方法
利用Hungate厌氧操作平台,取250 mL油水井采出液于厌氧瓶中,通入N2置换O2,依次加入Na2S溶液(50 g/L,维持低氧化还原电位)、维生素溶液和微量元素溶液,分别加入H2/CO2、乙酸钠和淀粉,根据不同区块的温度条件,分别置于55、70和90℃条件下培养。
1.3分析检测方法
1.3.1气体组分测定
采用GC-2010型气相色谱(日本岛津公司)测定气体组分中甲烷含量。安装有TCD检测器、Porapak Q不锈钢填充柱的岛津GC 2010,进样口、柱箱和检测器的温度分别是50、50和70℃,载气为高纯H2(99.999%),流速为50 mL/min。以N2、CH4和CO2混合气作为标准气(三者体积比为29.96∶39.99∶30.05),进样量为0.2 mL,采用面积归一化测定甲烷相对百分含量,根据理想气体状态方程式(PV=nRT)换算成气体物质的量。
1.3.2样品DNA提取及高通量测序
为减少样品中原油对菌体的吸附,离心前先在样品中加入石油醚,搅拌静置后取下层水相,12 000 r/min、4℃高速离心15 min,收集底部菌体沉淀。样品菌体DNA的提取利用AxyPrep基因组提取试剂盒。提取后的DNA利用nanodrop进行浓度检测后用于细菌16S扩增[9-10],所有样品送至华大基因进行16S rDNA V4区高通量测序及后续生物信息学分析,解析其中的微生物群落结构信息。
2 结果与讨论
2.1不同区块内源微生物厌氧产甲烷潜力评价
将收集到的水井和油井的采出液中分别添加H2/CO2、乙酸钠和淀粉作为激活剂碳源,分别在55、70和90℃条件下厌氧静置培养,通过气相色谱测定气体组分中甲烷的含量。培养后分析不同区块的油藏微生物厌氧激活后产甲烷气潜力,结果见图1。
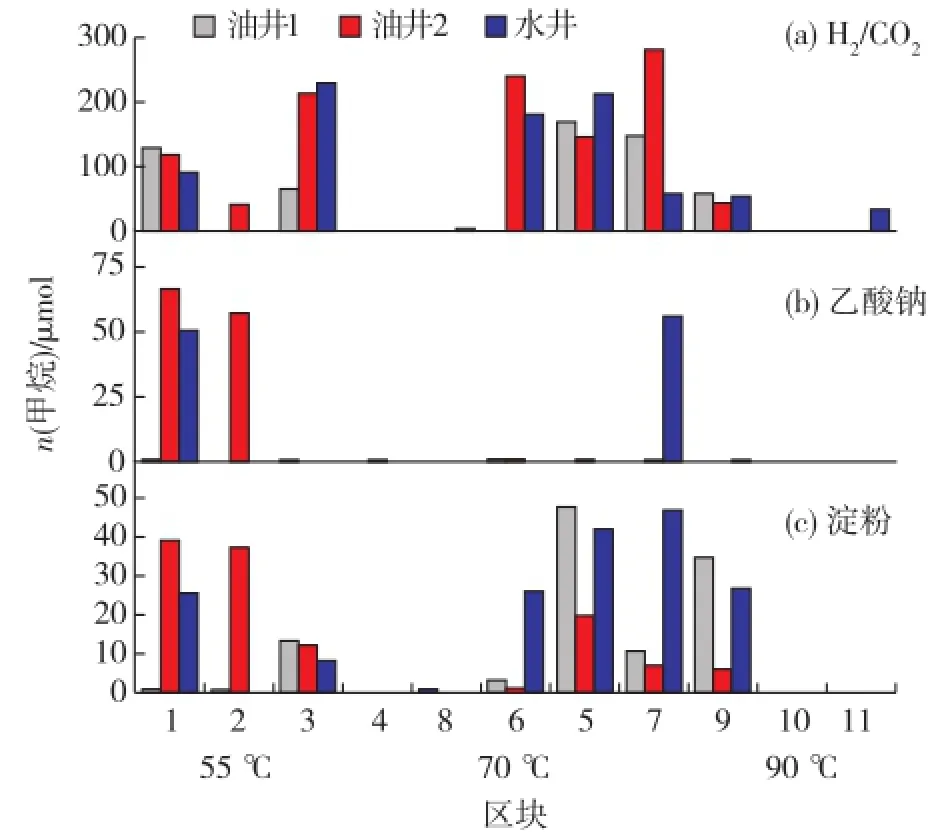
图1 各区块内源微生物厌氧激活产甲烷潜力Fig.1 Methane production potential of endogenous microbial by anaerobic activation in each block
由图1可知:油藏温度低于79℃的区块中,内源微生物普遍被激活,并能代谢产甲烷气;而温度范围在79~95℃的区块中,只有孤岛河滩油田沙二上和罗17-10块的水井具有微弱的产甲烷潜力,而正理庄通16块沙二下、罗家油田罗9、罗家油田罗17-10块的实验中均不能通过厌氧激活内源微生物来代谢产气。此外,在所有能代谢产甲烷气的区块中,当以H2/CO2作为激活剂碳源时,能激活较多区块的油水井,且甲烷产量都显著高于乙酸钠和淀粉,这表明中高温油藏内产甲烷古菌以氢营养型为主。
2.2激活剂对厌氧激活产甲烷能力的影响
考察不同激活剂对厌氧激活产甲烷能力的影响,结果见图2。由图2可知:以H2/CO2为激活剂碳源,大部分区块的内源微生物被有效激活,产甲烷速率较快,普遍能达到500~1 000 μmol/(g·d),最快能达到1 500 μmol/(g·d);添加乙酸钠的甲烷产生速率在200~350 μmol/(g·d)之间,且能激活的区块较少,仅有3个区块的两口油井和两口水井检测到甲烷气,而添加淀粉组的甲烷产生速率普遍低于200 μmol/(g·d),这也进一步验证了在中高温油藏中氢营养型产甲烷菌的活性高于乙酸营养型产甲烷菌。通过厌氧激活,发现不添加激活剂的油/水井几乎都检测不到甲烷的产生(数据未显示),并且添加的激活剂中碳源不同,其甲烷产生速率也存在明显差异。
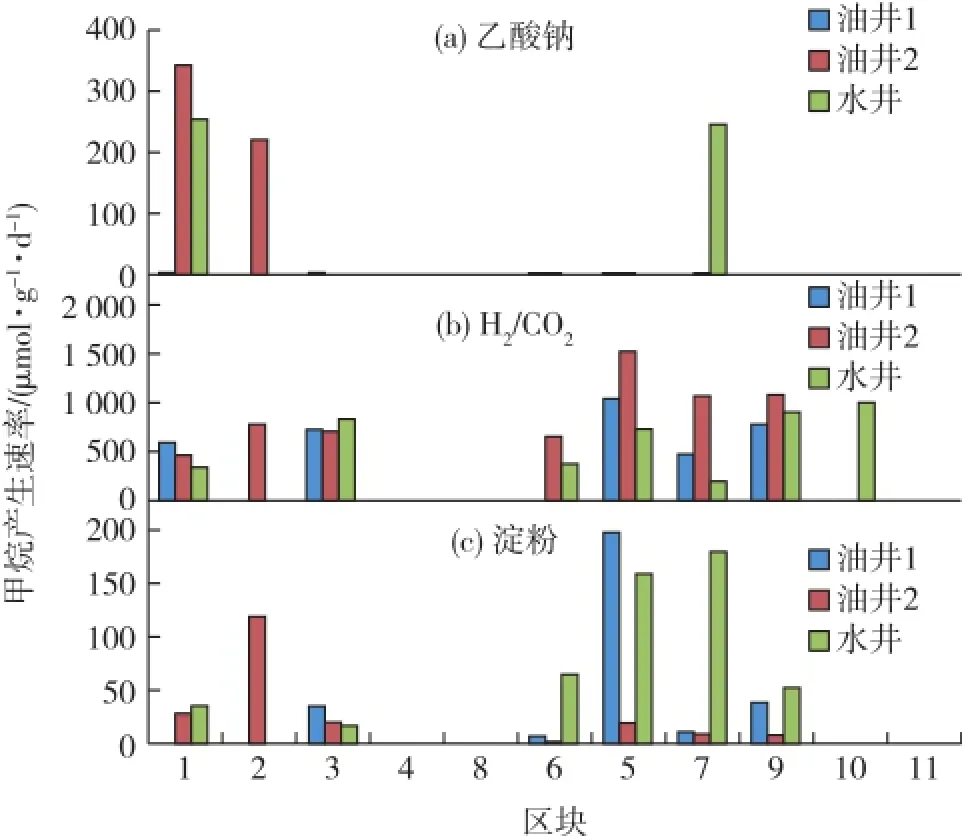
图2 各区块在不同激活剂条件下的产甲烷速率Fig.2 Methane production rate of each block under different activator
综合图1和图2分析可知,正理庄正南沙一、飞雁滩、孤岛中一区Ng3(6-13井区)和孤岛河滩油田沙二上这4个区块的内源微生物具有较好的产气潜力,可作为微生物采油现场试验的候选区块。
2.3激活剂对内源微生物菌群结构的影响
不同区块激活后产甲烷潜力存在明显差异,主要是不同区块油/水井中内源微生物群落差异造成的,因此进一步对产甲烷潜力较高的正里庄正南高26块激活前后的微生物群落结构进行研究,以分析原始油/水样和添加不同激活剂的实验组之间细菌和古菌群落组成的差别。
2.3.1不同激活剂对古菌群落结构的影响
首先考察不同激活剂对古菌群落结构的影响,结果见图3。由图3可知:正里庄正南区块的原始油水井样品中优势古菌类群是Methanobacterium,在水井中的丰度高达76.7%,油井中的丰度为31.1%~ 37.0%,其次是Fervidicoccus和Methanosaeta。在添加以H2/CO2为碳源的激活剂后,氢营养型产甲烷古菌Methanobacteriu成为群落中的绝对优势菌,丰度明显上升到88.4%~91.4%,这表明Methanobacterium是转化利用H2/CO2的主要功能菌,不能利用乙酸产甲烷[11]。而在添加乙酸钠的实验组中,只有水井和油井2可以产生甲烷,油井2中Methanosaeta的丰度最高(50.6%),Methanosaeta可以直接裂解乙酸产生甲烷[12-13]。在淀粉作为激活剂的实验组中,只有水井和油井2中检测到产生的甲烷,优势菌群均是Methanobacterium,丰度分别是45.1%和72.1%,这表明淀粉转化为甲烷的主要途径也是通过氢营养型产甲烷古菌完成。
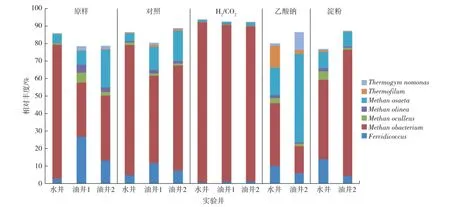
图3 正理庄正南高26块不同激活条件下的古菌群落结构Fig.3 Archaeal community structure of Zhengli Zhuang south block under different activator
2.3.2不同激活剂对细菌群落结构的影响
再次考察不同激活剂对细菌群落结构的影响,结果见图4。由图4可知:在正理庄正南高26块的原始油水样中,优势菌都是Pseudomonas(20.2%~47.9%),水井中的优势菌还有Marinobacterium(15.7%)、Petrobacter(6.4%)和Deferribacter(5.4%),油井1中的优势菌还有Deferribacter(14.7%)。
不同激活剂在油水样中所激活的细菌不同,H2/CO2和淀粉分别作为激活剂碳源时,油井中的Thermotoga普遍被激活,丰度分别为11.9%~ 18.2%和27.3%,而乙酸钠则主要激活了油井中的Deferribacter(28.4%)。
此外,相同激活剂在同一区块的油井和水井中所激活的细菌群落也存在明显差异。当H2/CO2作为激活剂时,水井中优势菌群分别为Marinobacterium(23.2%)、Thermococcoides(18.3%)和Petrobacter(4.5%),而油井1和2中的共同细菌类群是Thermotoga(11.9%~18.2%),此外Fervidobacterium(11.4%)还是油井2中的优势细菌类群之一,在油井1中也存在一定丰度的Petrobacter(4.8%)。
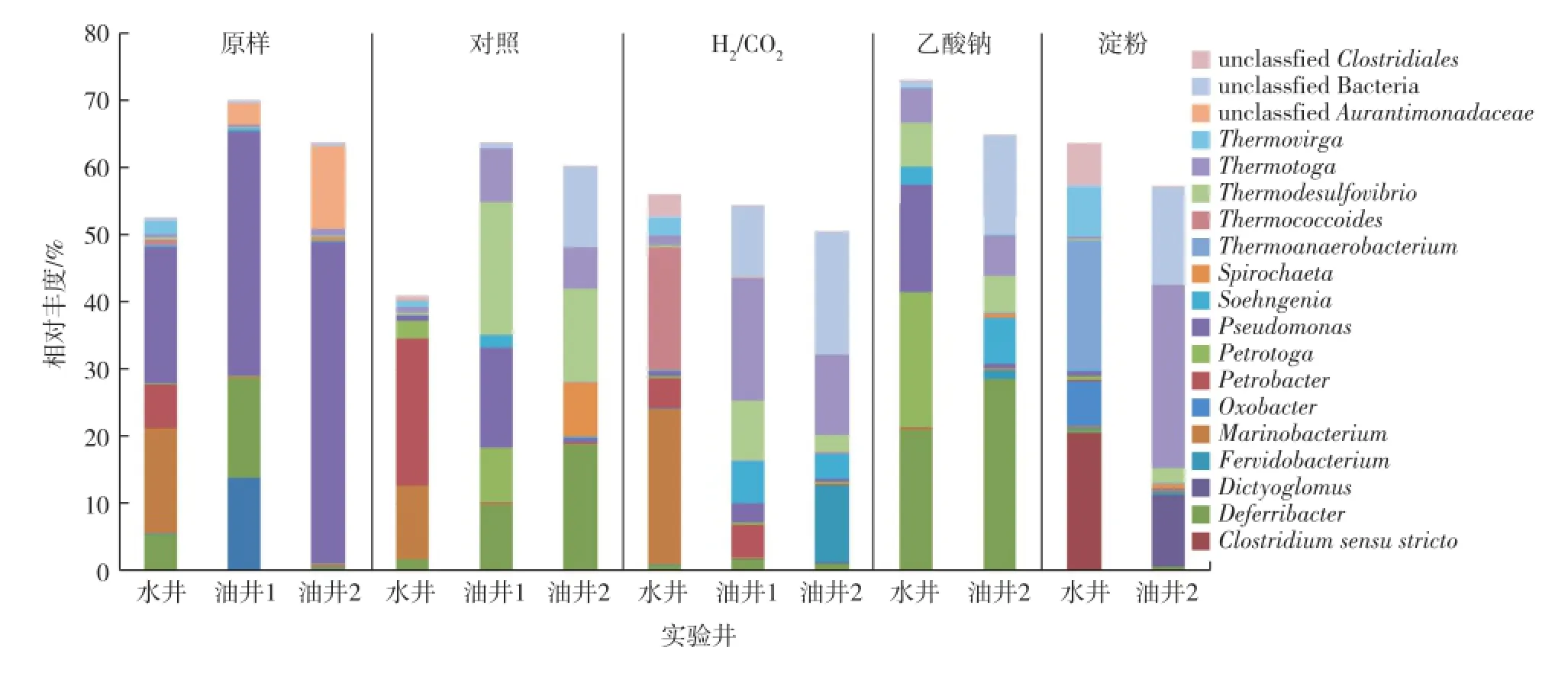
图4 正理庄正南高26块不同激活条件下的细菌群落结构Fig.4 Bacterial community structure of Zhengli Zhuang south block under different activator
3 结论
对胜利油田11个中高温油藏共33口油(水)井样品开展了厌氧激活和产气分析研究,发现低于79℃的油藏,其内源微生物普遍能被激活并代谢产甲烷气,而高于79℃时无明显甲烷气产生。正理庄正南高26、飞雁滩区块、孤岛中一区Ng3(6-13井区)和孤岛河滩油田沙二上中的内源微生物具有较好产气潜力,可作为微生物采油现场试验的候选区块。
厌氧激活研究表明,不同油水井中微生物产甲烷的速率不同,说明在油水井中微生物代谢活性存在显著差异,以H2/CO2作为激活剂碳源时,最大产甲烷速率可达1 500 μmol/(g·d),明显高于乙酸钠和淀粉,这说明中高温油藏中产甲烷古菌以氢营养型甲烷菌为主导。
考察正理庄正南的古菌和细菌群落结构的变化发现,添加不同激活剂后,氢营养型产甲烷菌Methanobacterium演变为绝对优势菌群。另外,添加的激活剂不同,所激活的优势细菌类群不同,正理庄正南高26块不同油井在相同的激活条件下,其优势细菌类群趋向于一致,但油井和水井中优势菌群存在明显差异。
[1] 程杰成,王德民,李群,等.大庆油田三元复合驱矿场试验动态特征[J].石油学报,2002,23(6):37-40.
[2] 王修垣.俄罗斯利用微生物提高石油采收率的新进展[J].微生物学通报,1995,22(6):383-384.
[3] 汪卫东.我国微生物采油技术现状及发展前景[J].石油勘探与开发,2002,29(6):87-90.
[4] 汪卫东,魏斌,谭云贤,等.微生物采油需要进一步解决的问题[J].石油勘探与开发,2004,31(6):88-91.
[5] 程海鹰,王修林,徐登霆,等.内源微生物提高采收率实验研究[J].石油勘探与开发,2006,33(1):91-94.
[6] 宋智勇,郭辽原,袁书文,等.高温油藏内源微生物的调堵及种群分布[J].石油学报,2010,31(6):975-979.
[7] 冯庆贤,向廷生,NAZINA T N,等.高温油藏内源微生物及其提高采收率潜力研究[J].微生物学通报,2008,35(4):496-501.
[8] 包木太,孔祥平,宋永亭,等.胜利油田S12块内源微生物群落选择性激活条件研究[J].石油大学学报(自然科学版),2004,28(6):44-48.
[9] 王慧,宋智勇,郝滨,等.微生物驱产出液群落结构与现场生产动态的关系[J].石油学报,2013,34(3):535-538.
[10] BAO M,LIU T,CHEN Z,et al.A laboratory study for assessing microbial enhanced oil recovery[J].Energy Sources,2013,35(22),2141-2148.
[11] SCHIRMACK J,KAI M,GANZERT L,et al.Methanobacterium movilense sp.nov.,a hydrogenotrophic,secondary alcohol utilizing methanogen from the anoxic sediment of the subsurface lake in Movile Cave,Romania[J].Int J Syst Evol Microbiol,2014,64: 522-527.
[12] PATEL G,SPROTT G.Methanosaeta concilii gen.nov.,sp.nov.("Methanothrix concilii")and Methanosaeta thermoacetophila nom.rev.,comb.nov.[J].Int J Syst Bacteriol,1990,40(1):79-82.
[13] ZHENG D,RASKIN L.Quantification of Methanosaeta species in anaerobicbioreactorsusinggenus-andspecies-specific hybridization probes[J].Microbl Ecol,2000,39(3):246-262.
(责任编辑 荀志金)
Anaerobic activation of indigenous microorganism in the middle and high temperature reservoir
FENG Yun,DUAN Chuanhui,LIN Junzhang,SUN Gangzheng
(Research Institute of Petroleum Engineering Technology,Shengli Oilfield Company,Sinopec,Dongying 257000,China)
In order to define the characteristics of gas production by indigenous microorganism under anaerobic activation,11 blocks of middle and high temperature reservoir were selected to research in the Shengli Oilfield,which temperature ranges were 55 to 65℃,65 to 79℃and 79 to 95℃.Indigenous microorganism could be activated to produce gas below 79℃under simulated reservoir condition,whereas no significant methane gas was produced when temperature was above 79℃.The maximum methane production rate was up to 1 500 μmol/(g·d)when H2/CO2was used as carbon source,significantly higher than those of sodium acetate and starch.Furthermore,Methanobacterium was activated to become the dominant microflora under anaerobic condition in Zhengli Zhuang Zhengnan block,which favored to produce methane gas in the reservoir.Before anaerobic activation,the dominant bacteria were Pseudomonas in the samples and the dominant bacteria were changed under different activation conditions.H2/CO2and starch can activate Thermotoga,whereas sodium acetate mainly activated Deferribacter in oil wells.In addition,the dominant flora of different oil wells tended to be identical in the block,but there were significant differences in the dominant microflora between oil well and water well.Our findings on theanaerobic activation of the internal microorganism could serve reference for further enhancing the effect of microbial oil recovery.
indigenous microorganism;anaerobic activation;methane gas;community structure
Q934;TE357.9
A
1672-3678(2016)03-0012-05
10.3969/j.issn.1672-3678.2016.03.003
2016-03-18
国家高技术研究发展计划(863计划)(2013AA064401)
冯 云(1986—),女,河南鹿邑人,研究方向:微生物采油,E-mail:fengyun866.slyt@sinopec.com

