RGD修饰的葫芦素B纳米脂质载体对乳腺癌荷瘤裸鼠的抑瘤作用*
唐淑洁赵旭伟张佳琦刘洋王梓丞
RGD修饰的葫芦素B纳米脂质载体对乳腺癌荷瘤裸鼠的抑瘤作用*
唐淑洁①赵旭伟①张佳琦①刘洋①王梓丞①
目的:制备RGD修饰的葫芦素B纳米结构脂质载体(RGD-CuB-NLC),观察RGD-CUBNLC对乳腺癌细胞的体外抑制作用和对乳腺癌荷瘤裸鼠的抑瘤作用。方法:采用薄膜分散法制备得RGD-CuB-NLC,按照贴壁细胞的培养方法,制成MCF-7乳腺癌单细胞混悬液,接种于96孔培养板,建立RGD-CuB-NLC组,CuB-NLC、RGD-NLC为对照组,另设NLC空白组,计算不同条件的抑制率。建立裸小鼠移植瘤,将合格的30只移植瘤裸小鼠随机分成五组,每组6只。分别尾静脉注射CuB注射液,CuB-NLC,RGD-NLC,RGD-CuB-NLC和0.9%氯化钠溶液,每间隔24 h给药1次,共7次,记录鼠重、瘤体质量并计算抑瘤率。结果:RGD-CuB-NLC:形态为圆形,包封率>80%,粒径<150 nm,平均为(115.6±2.1)nm,多分散系数为(0.217±0.033),电位为(-12.31±0.76)mV。不同脂质体对乳腺癌细胞体外抑制率分别为:NLC组为0,CuB-NLC组为(46.3±2.21)%,RGD-NLC组为(55.7±3.22)%,RGD-CuB-NLC组为(75.6±5.67)%,比较差异有统计学意义(P<0.05)。0.9%氯化钠溶液组、CuB组、CuB-NLC组、RGD-NLC组与RGD-CuB-NLC组抑瘤率比较差异均有统计学意义(P<0.05);CuB组、CuB-NLC组、RGD-NLC组、RGD-CuB-NLC组与0.9%氯化钠溶液组抑瘤率比较差异均有统计学意义(P<0.05)。结论:RGD修饰的葫芦素B纳米结构脂质载体能够抑制乳腺癌细胞的增值和肿瘤的生长。
RGD肽; 葫芦素B; 纳米脂质载体; 乳腺癌; 抑瘤
First-author's address:The First Affiliated Hospital of Qiqihar Medical College,Qiqihar 161041,China
RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的短肽,RGD与肿瘤细胞或肿瘤新生血管内皮细胞高表达的整合素受体具有特异性结合作用[1-3]。
纳米脂质载体(NLC)是20世纪90年代末出现的一种新型给药系统。纳米脂质载体是由混合脂质作为骨架材料制成的纳米尺度的载药系统,它们具有生理相容性、高熔点、生物可降解的特性[4-6]。混合的骨架材料形成了含一定纳米隔室的脂质骨架,纳米粒固体内核的特性不会由适当比例的液体脂质而改变,避免放置过程中药物外排导致的包封率降低。NLC正成为一种发展潜力巨大的新型纳米药物载体而被广泛应用于药剂学领域[7-10]。葫芦素B(Cucurbitacins B,CuB)主要来源是葫芦素科植物甜瓜瓜蒂,葫芦素类药物是属于19-甲基出现在C-9位上的一类四环三萜化合物[11-12]。课题组前期将其制成纳米脂质载体(CuB-NLC),体外研究表明,CuB及CuB-NLC对乳腺癌MCF-7有明显的抑制作用,且CuB-NLC的作用强于CuB的作用[13-14]。本研究在此基础上将葫芦素B纳米结构脂质载体(CuB-NLC)用RGD修饰,制备具有肿瘤靶向作用的RGD-CuB-NLC,将药物选择性地递送至肿瘤细胞从而提高疗效,现报道如下。
1 材料与方法
1.1实验动物 由齐齐哈尔医学院动物中心提供实验所需的标准动物:5周龄雌性裸鼠(购于成都达硕实验动物公司,动物合格证号:2013001619132),体重22~25 g,共36只。
1.2实验仪器 电镜、共聚焦显微镜、多功能酶标仪、超低温冰箱、超纯水制备系统、全自动显微摄影仪、细胞粉碎仪、生物安全柜、CO2培养箱、超速离心机、沃特斯高压液相色谱仪、均质机、低温摇床等。
1.3实验材料 葫芦素B(宝鸡市辰光生物科技有限公司,纯度98%,批号:20130120);单硬脂酸甘油酯(GMS,德国BASF公司);注射用大豆油、卵磷脂(德国Lipoid公司);聚乙二醇(PEG)40硬质酸酯(美国Sigma公司);DMEM培养基(赛默飞世尔生物化学制品北京有限公司);RGD(上海吉尔生化公司;DSPE-PEG2000(美国Avanti Polar lipids);胎牛血清(杭州四季青生物科技公司);0.25%胰酶(Gibco公司),其它试剂为分析纯。
1.4RGD-CuB-NLC的制备 参照文献[15]合成CuBNLC:精密称取适量GMS、注射用大豆油、卵磷脂和CUB置圆底烧瓶中,加入无水乙醇适量,置(70±5) ℃水浴中,完全溶解后得到CuB分散均匀的有机相,旋转蒸出乙醇,得油相。取一定量的PEG40硬脂酸酯溶于水中,水浴加热至相同温度得水相。将圆底烧瓶迅速移至70 ℃水浴中,800 r/min搅拌下将水相缓慢匀速(0.5 mL/min)滴入油相中,继续搅拌乳化20 min,将其倒入已预热的小烧杯中,探头超声10 min后,迅速置冰浴中搅拌固化30 min,过0.22 μm滤膜,得CuB-NLC混悬液。参照文献[16]合成DSPE-PEG2000-RGD:将DSPE-PEG2000-Mal用适量氯仿溶于茄形瓶中,旋转蒸发除去溶剂成膜,真空干燥过夜。加入适量PBS缓冲液(pH 7.4)水化1 h(37 ℃,200 r/min),水浴超声5 min使形成均匀的DSPE-PEG2000-Mal胶束溶液。将RGD多肽溶于适量PBS缓冲液中,加入DSPE-PEG2000-Mal胶束溶液,N2保护下4 ℃搅拌反应直至TLC薄层色谱(展开剂MeOH∶DCM=1∶10)鉴定DSPEPEG-Mal点基本消失,得DSPE-PEG2000-RGD。将其作为固态脂质加入CuB-NLC处方中,以单硬脂酸甘油酯为固体脂质,M812为液体脂质,HS-15为乳化剂制备得RGD-CuB-NLC。用高校液相色谱法测定CuB的包封率和载药量,用马尔文纳米粒度测定仪测定粒径和电位,用透射电镜观察其形态。
1.5RGD-CuB-NLC对乳腺癌细胞的体外毒性作用
1.5.1乳腺癌细胞的培养 按照贴壁细胞的培养方法,培养基用DMEM,10%~15%的胎牛血清培养并传代MCF-7乳腺癌细胞备用。
1.5.2RGD-CuB-NLC对乳腺癌细胞的毒性 取生长状态良好、呈对数生长期增殖旺盛的乳腺癌MCF-7细胞,使用0.25%胰蛋白酶消化,10%胎牛血清细胞培养液制成单细胞混悬液,精密量取100 μL(细胞浓度5×104个/mL)接种于96孔培养板,5% CO2及饱和湿度,37 ℃的CO2培养箱中静置培养。建立CuB-NLC和RGD-NLC为对照组,NLC空白组,每种条件设5个复孔。加药5% CO2及饱和湿度,37 ℃的CO2培养箱中静置培养48 h后,使用微量进样枪每孔精密加入10 μL CCK-8溶液,CO2培养箱中继续培养2 h,使用酶联免疫检测仪检测波长为450 nm处吸光度(OD)值,计算不同条件的抑制率。细胞抑制率计算公式为:抑制率= (1-实验组OD值/DMSO对照组OD值)×100%
1.6RGD-CuB-NLC对乳腺癌荷瘤裸鼠抑瘤作用的研究
1.6.1裸小鼠移植瘤的建立 裸小鼠移植瘤由人乳腺癌MCF-7细胞细胞株接种于裸小鼠皮下建立,每只裸鼠腋下接种0.1 mL MCF-7细胞悬浊液,10 d左右腋下长出肿块,裸小鼠移植瘤用游标卡尺测量移植瘤直径,待肿瘤生长至100~300 mm3后将动物随机分组。
1.6.2乳腺癌荷瘤裸鼠抑瘤率的测定 将合格的30只移植瘤裸鼠随机分成五组,每组6只,每组鼠重无明显差异。分别尾静脉注射CuB注射液、CuBNLC、RGD-NLC、RGD-CuB-NLC和0.9%氯化钠溶液,每间隔24 h给药1次,共7次,每隔2天测量1次肿瘤长短,计算移植瘤体积:先测量肿瘤的最大径a(mm),再测量与最大径线垂直的最长径线b (mm),肿瘤体积VT=1/2×a×b2。称取鼠重,记录瘤体质量并计算抑瘤率。抑瘤率=(1-处理组平均瘤重/对照组平均瘤重)×100%。
1.7统计学处理 采用SPSS 21.0统计学软件对所得数据进行统计分析,计量资料用()表示,比较采用t检验,计数资料比较采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1一般情况 RGD-CuB-NLC包封率>80%,形态为圆形。经纳米粒度仪测定,粒径<150 nm,平均(115.6±2.1)nm,多分散系数(0.217±0.033),电位(-12.31±0.76)mV,电镜图片见图1。
图1 RGD-CuB-NLC电镜图
2.2不同脂质体干预对乳腺癌细胞抑制率比较 NLC组抑制率为0,CuB-NLC组为(46.3±2.21)%,RGD-NLC组 为(55.7±3.22)%,RGD-CuB-NLC组为(75.6±5.67)%,比较差异均有统计学意义(P<0.05)。
2.3不同药物干预对乳腺癌荷瘤裸鼠抑瘤率比较 0.9%氯化钠溶液组、CuB组、CuB-NLC组、RGD-NLC组与RGD-CuB-NLC组抑瘤率比较差异均有统计学意义(P<0.05);CuB组、CuB-NLC组、RGD-NLC组、RGD-CuB-NLC组与0.9%氯化钠溶液组抑瘤率比较差异均有统计学意义(P<0.05),见表1。
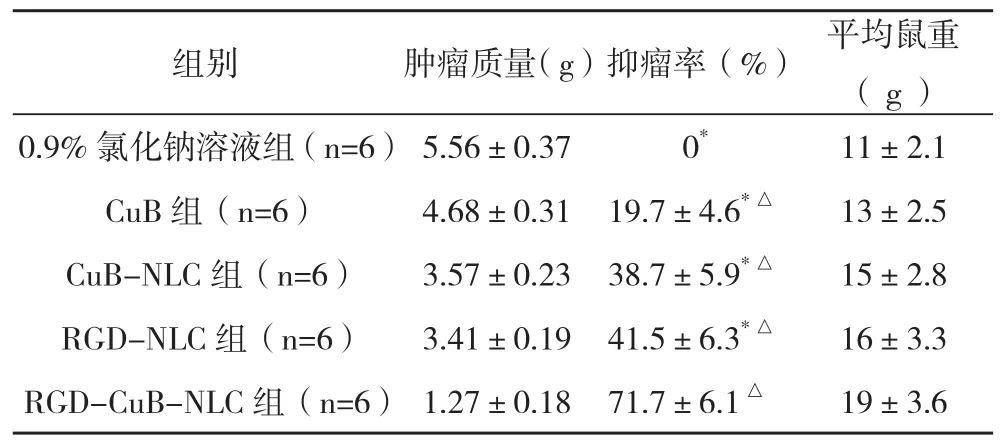
表1 不同药物干预对乳腺癌荷瘤裸鼠抑瘤率比较
3 讨论
体外研究表明,CuB、CuB-NLC、RGD-NLC对乳腺癌MCF-7有明显的抑制作用,且CuB-NLC的作用强于CuB的作用,RGD-NLC的作用强于CuBNLC的作用。RGD-CUB-NLC与不同脂质体干预对乳腺癌细胞的抑制作用相比最强。体内研究表明不同药物干预对乳腺癌荷瘤裸鼠的抑制作用RGDCUB-NLC组较其他组对瘤体的生长具有较强的抑制作用,同时对鼠重的影响最小。
纳米技术是21世纪发展起来的新兴学科,纳米材料作为药物的载体,可以运送低溶解度的抗癌药物,通过包裹方式运载药物使其免于体内酶等物质的溶解,提高药物稳定性。普通纳米粒进入体内后,被机体视为异物,易被单核巨噬细胞系统及网状内皮系统(RES)识别并吞噬,在静脉给药时只能作用于吞噬细胞比较丰富的器官,如肝脏、脾等。但若病灶部位不在网状内皮系统,该类制剂则会增加药物对网状内皮系统的毒性。长循环纳米粒也称为空间立体稳定纳米粒或隐形纳米粒,是以聚乙二醇(PEG)对纳米粒表面进行修饰,PEG链与水分子的相互作用可在纳米粒表面形成一层固定水化层,由于血浆蛋白不能与亲水表面结合,因此,固定水化层的形成可以防止调理素及蛋白的吸附,避免RES吞噬,延长纳米粒在体内的循环时间[4]。
RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的短肽,是整合素(Int)与其配体蛋白相互作用的识别位点。在一些肿瘤细胞或者肿瘤新生血管内皮细胞常特异性地高表达某些整合素受体,如αvβ3,而正常组织血管中含量很少。RGD肽能与血管内皮细胞上的整合素结合,与血小板整合素及普遍存在的细胞受体无交叉反应。因此,这类受体可以作为肿瘤靶向治疗的靶点,利用外源RGD肽竞争结合整合素受体,抑制肿瘤迁移和肿瘤新血管生成,同时还可以靶向标记定位肿瘤和靶向输送抗肿瘤药物。
综上所述,通过RGD肽对药物和纳米载体进行修饰,可以实现药物或其递药系统的肿瘤新生血管靶向性,达到更有效、精确和安全治疗的目的[17-18]。同时因为RGD与整合素配体竞争整合素受体,通过抑制相应的信号传导起到辅助治疗作用,最大限度地提高杀灭乳腺癌细胞的作用[19-20]。
[1]李茜,杜永忠,袁弘,等.RGD肽在肿瘤靶向纳米给药系统中的应用[J].海峡药学,2011,23(6):80-82.
[2]张春丽,杨铭,王荣福.RGD肽与整合素αvβ3受体结合的购效关系及放射性标记配体的设计[J].肿瘤学杂志,2009,15(1):76-81.
[3]杨翠红,张玉民,刘金剑,等.RGD功能化多肽纳米纤维的制备及其体内肿瘤靶向性研究[J].中国生化药物杂志,2014,5(34):5-8.
[4]黄霞,陈卫东.固体脂质纳米粒和纳米脂质载体二类脂质纳米给药系统的比较[J].中国药学杂志,2012,47(17):1351-1355.
[5]孙林林,姜伟化,陈宁,等.呋喃二烯纳米脂质载体的制备及其性质的考察[J].中国药剂学杂志,2015,13(5):153-160.
[6]王晓珊,黄艳,刘迪,等.RGD修饰共载多烯紫杉醇和苏拉明脂质体乳腺癌靶向治疗研究[J].中国肿瘤防治杂志,2014,21(22):1783-1787.
[7] Müller R H,Radtke M,Wissing S A.Nanostructured lipid matrices for improved microencapsulation of drugs[J].Int J Pharm,2012,242(1-2):121-128.
[8] Müller R H,Petersen R D,Hommoss A,et al.Nanostructured lipid carriers(NLC) in cosmetic dermal products[J].Adv Drug Deliv Rev,2007,59(6):522-530.
[9]孙艺丹,赵青,王锐利,等.正交设计联用星点设计效应面法优化蒿甲醚长循环纳米结构脂质载体处方[J].沈阳药科大学学报,2015,32(1):7-13.
[10]李静静,贾运涛,田睿,等.柚皮素纳米结构脂质载体的处方优化和初步评价[J].中草药,2015,46(2):211-215.
[11]孙玉琦,宋永玉,王明月.葫芦素B联合姜黄素、大黄素、苦参碱的体外抗肝癌作用[J].中药药理与临床,2013,29 (1):38-41.
[12] Jayaprakasam B,Seeram N P,Nair M G.Antieancer and anti-inflammatory activities of cucurbitacins from Cucurbita andreana[J].Cancer Lett,2013,189(1):11-16.
[13]李瑶,马晓星,刘畅,等.葫芦素B纳米脂质载体对结肠癌和乳腺癌细胞抑制及凋亡作用的研究[J].黑龙江医药,2014,27(4):773-776.
[14]初生英,孙维玲,张国喜,等.叶酸-白蛋白包覆阳离子纳米脂质载体的制备及体内外评价[J].中国药科大学学报,2015,46(1):73-77.
[15]李瑶,韩翠艳,李津明,等.星点设计-效应面法优化葫芦素 B 纳米脂质载体处方[J].中国医药工业杂志,2014,45 (11):1042-1045.
[16]魏小栋.RGD修饰紫杉醇脂质体的制备及其肺癌靶向治疗研究[J].中国医院药学杂志,2015,35(9):782-786.
[17] Shin Y C,Lee J H,Kim M J,et al.Biomimetic hybrid nanofiber sheets composed of RGD peptide-decorated PLGA as cell-adhesive substrates[J].J Funct Biomater,2015,6(2):367-378.
[18]涂柳晓,徐月红,汤晨懿,等.RGD环肽介导的靶向脂质体体内药动学及荷瘤动物活体成像研究[J].药学学报,2012,47(5):646-651.
[19] Hiob M A,Wise S G,Kondyurin A,et al.The use of plasmaactivated covalent attachment of early domains of tropoelastin to enhance vascular compatibility of surfaces[J].Biomaterials,2013,34(31):7584-7591.
[20]杨婉华,汪蕊,陈春,等.αv整联蛋白拮抗剂RGD肤对乳腺癌细胞增殖侵袭能力影响的研究[J].肿瘤,2006,62(8):728-731.
Inhibitory Effect of RGD Modified B Nano Lipid Carrier on Breast Cancer Bearing Nude Mice
TANG Shu-jie,ZHAO Xu-wei,ZHANG Jia-qi,et al.//Medical Innovation of China,2016,13(14):029-032
Objective:To prepare RGD conjugated cucurbitacin B loaded liposome(RGD-CuB-NLC)and observe RGD-CuB-NLC's anti-cancer effect on the treatment with the cells of breast cancer in vitro and RGDCuB-NLC's anti-cancer effect on nude mice of human breast cancer.Method:The liposomes were prepared by thin film hydration method,a single cell suspension liquid of the MCF-7 cells of breast cancer was made according to the cultivation of the adherent cell method,then it was inoculated into 96 hole cell culture plate,the group of RGD-CuB-NLC was designed,the control groups were CuB-NLC,RGD-NLC and the blank group of NLC were designed,the rate of suppression in different condition were calculated.Nude mouse transplantation tumor were established,30 qualified nude mice models of human breast cancer xenograft were randomly divided into 5 groups,each group was 6,the mice of 5 groups were respectively treated by CuB,CuB-NLC,RGD-NLC,RGD-CuBNLC and 0.9% sodium chloride solution every 24 hours per time,7 times in total.The body weight of nude mice and the weight of the transplanted tumor growth were recorded,and the inhibition rate of tumor growth were calculated. Result:For RGD-CuB-NLC group,the form was the circular,the encapsulation rate>80%,partical size was less than 150 nm,the average particle size was (115.6±2.1)nm,polydispersity index was (0.217±0.033),the electric potential was(-12.31±0.76)mV.The inhibition ratio of different liposome on breast cancer cells in the group of NLC was 0,the group of CuB-NLC was (46.3±2.21)%,the group of RGD-NLC was (55.7±3.22)%,the group of RGD-CuB-NLC was (75.6±5.67)%,the differences were statistically significant(P<0.05). In the inhibition rate of tumor growth,there were statistically significant in 0.9% sodium chloride solution group,CuB group,CuB-NLC group and RGD-NLC group compared with RGD-CuB-NLC group(P<0.05).There were statistically significant in CuB group,CuB-NLC group,RGD-NLC group and RGD-CuB-NLC group compared with 0.9% sodium chloride solution group in the inhibition rate of tumor growth(P<0.05).Conclusion:RGD conjugated cucurbitacin B loaded liposome can restrain the proliferation of breast cancer cells and the growth of tumor.
RGD peptide; Cucurbitacin B; Nanostructured lipid carriers; Cancer of breast;Antitumor
齐齐哈尔市科技局科学技术计划项目(SFGG-201408)
①齐齐哈尔医学院附属第一医院 黑龙江 齐齐哈尔161041
唐淑洁
10.3969/j.issn.1674-4985.2016.14.007
2016-01-27) (本文编辑:李颖)

