灯盏花素对胰岛素抵抗大鼠骨骼肌脂肪酸代谢的影响*
张馨媛武莉李锦平赵栋梁闫瑞琴
灯盏花素对胰岛素抵抗大鼠骨骼肌脂肪酸代谢的影响*
张馨媛①武莉②李锦平②赵栋梁①闫瑞琴②
目的:探讨灯盏花素对胰岛素抵抗大鼠骨骼肌脂质沉积及脂肪酸代谢的影响。方法:选取健康雄性SD大鼠40只,分为正常组10只和高脂高糖组30只,分别给予普通饲料和高脂高糖饲料,喂养12周后行葡萄糖耐量试验,根据成模标准,筛选出成模大鼠30只,剔除4只状态不佳和死亡大鼠,将其余26只大鼠分为模型组9只,灯盏花素高剂量组8只和灯盏花素低剂量组9只。灯盏花素高、低剂量组分别腹腔注射相应剂量的灯盏花素,正常组和模型组腹腔注射等体积0.9%氯化钠溶液,四组均给药2周,2周后取所需组织进行各指标检测。结果:模型组腹脂指数、空腹血糖(FBG)、空腹血清胰岛素(FINS)、胰岛素抵抗指数(IRI)、血清和组织内FFA、TG、脂滴面积/肌纤维总面积、光密度平均值、LccoAs含量及FAT/CD36均处于四组中最高,而CPT-1处于四组中最低。结论:12周高脂高糖喂养成功诱导IR大鼠模型,灯盏花素可明显改善胰岛素抵抗,改善骨骼肌脂质沉积,其作用可能与CPT-1表达的上调和FAT/CD36的表达下降有关。
灯盏花素; 胰岛素抵抗; 长链脂酰辅酶A; 脂肪酸转位酶; 肉脂酰转移酶
First-author's address:Shanxi Medical University,Taiyuan 030000,China
脂肪酸代谢异常在胰岛素抵抗的发生、发展中扮演重要角色。“脂毒性学说”认为:血液中过多的游离脂肪酸(free fatty acid,FFA),以甘油三酯(triglyceride,TG)形式储存于非脂肪组织(骨骼肌、肝脏等),导致脂质异位沉积性疾病[1]。病理状态下,FFA和TG过多积聚导致骨骼肌对胰岛素敏感性降低,而出现胰岛素抵抗(insulin resistance,IR)[2]。脂肪酸转位酶(fatty acid translocation enzyme,FAT/CD36)是长链脂肪酸转运入细胞必须的酶,在脂肪酸摄取中起关键作用;肉碱脂酰转移酶(carnitine palmityl transferase,CPT-1)为线粒体脂肪酸氧化限速酶,张雪梅等[3]研究显示高果糖诱导IR大鼠,FAT/CD36、CPT-1与IR密切相关。灯盏花素(breviscapine),又名灯盏细辛,临床主要用于治疗脑血栓,前期研究发现其对2型糖尿病及IR有一定影响[4]。本研究采用高脂高糖喂养,制备IR大鼠模型,观察灯盏花素对骨骼肌脂质沉积的影响及对脂肪酸代谢相关蛋白的干预作用,旨在进一步探讨灯盏花素改善IR作用及其机制,现报道如下。
1 材料与方法
1.1材料 健康雄性SD大鼠40只,清洁级,体重(220±20)g,购自山西医科大学动物实验中心(合格证书编号:100026);灯盏花素注射液(运城石药有限公司,批号:20140604);大鼠胰岛素(FINS)试剂盒、TG试剂盒、FFA试剂盒、长链脂酰辅酶A(LccoAs) ELISA试剂盒(南京建成生物有限公司);FAT/CD36抗体(Santa Cruz公司);CPT-1抗体(Santa Cruz公司);引物设计(上海生工)。
1.2动物处理与分组 40只大鼠适应性喂养1周,随机分为正常组10只和高脂高糖组30只,分别喂养普通饲料和高脂高糖饲料(配方:普通饲料50%,猪油30%,蔗糖12%,蛋黄8%)[5]。喂养12周后,行葡萄糖耐量实验(葡萄糖2 g/kg,腹腔注射),尾静脉采血测空腹血糖(fasting blood glucose,FBG)及各时间点血糖、空腹血清胰岛素(fasting serum insulin,FINS),以高脂高糖组各时间点血糖均明显高于正常组及胰岛素抵抗指数(insulin resistance index,IRI)与正常组有显著性差异为成模标准[6],高脂高糖组30只大鼠均成模,剔除4只状态不佳和死亡大鼠,将其余随机分为模型组9只,灯盏花素高剂量组8只和灯盏花素低剂量组9只。灯盏花素高、低剂量组分别腹腔注射200 mg/(kg·d)和100 mg/ (kg·d),灯盏花素,正常组和模型组腹腔注射等体积0.9%氯化钠溶液,四组均给药2周,腹腔注射给药2周,正常组、模型组给予等体积的生理盐水。2周后进行腹主动脉采血,分离附睾及肾周脂肪组织并称重,取股四头肌组织,液氮保存备用。
1.3检测指标
1.3.1腹脂指数、FBG、FINS、IRI的测定 14周末,尾静脉采血并采用葡萄糖酶氧化法测定FBG,采用ELISA试剂盒于酶标仪上检测FINS。IRI= (FBG×FINS)/22.5,腹脂指数=内脏脂肪重量(g)/体重(g)[7]。
1.3.2血清、骨骼肌中TG、FFA的检测 取骨骼肌组织0.1 g,用90%的无水乙醇抽提,3500 rpm离心,取组织上清;另取-80 ℃血清,TG按照试剂盒测定、FFA采用铜试剂测定其铜离子含量推算其含量。
1.3.3油红O染色 取OCT包埋骨骼肌组织,置于冰冻切片机,-25 ℃复温20 min,冰冻切片8 μm,室温放置10 min,油红染色25 min,60%异丙醇染色5 min,蒸馏水清洗15 min,苏牧素染核20 s,电子显微镜采集图像,方法同夏同佳实验[8]。
1.3.4ELISA测定骨骼肌LccoAs含量 取骨骼肌组织0.1 g,生理盐水研磨抽提,按10∶1将样品与缓冲液混合,于96孔板严格按照试剂盒操作。
1.3.5Western blot检 测FAT/CD36、CPT-1蛋 白相对表达量 取骨骼肌组织0.1 g,加入1mL RIPA裂解液,冰上研磨,离心取上清。BCA测蛋白浓度,SDS-PAGE电泳,转膜,封闭,一抗4 ℃过夜(FAT/CD36 1∶300,CPT-1∶1400),二抗37 ℃2 h (1∶8000),洗膜,暗室曝光。
1.3.6半定量PCR检测FAT/CD36、CPT-1 mRNA相对含量 采用半定量PCR技术,用Trizol RNA抽提试剂盒,提取骨骼肌总RNA,利用试剂盒,逆转录成cDNA,采用PCR仪扩增,琼脂糖跑胶,仪器采图数据处理。引物序列:(1)actin 正义:gtc cct gta tgc ctc tgg tc,反义:acc gct cat tgc cga tag t;(2)CD36 正义:gtg ctg tcc ctg tgt t,反义:cag tga agg ctc aaa gat gg,产物片段为145 bp;(3)CPT-1正义:gcc act gat gaa gga aga aga,反义:cca gaa gac gaa tgg gtt tg,产物片段为132 bp。以actin为内参基因,采用捷达凝胶系统软件计算目基因相对表达量。
1.4统计学处理 采用SPSS 17.0统计学软件对所得数据进行统计分析,计量资料用()表示,多组间比较采用单因素方差分析法(ANOVA),两组间比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1大鼠腹脂指数、FBG、FINS、IRI变化比较 与正常组比较,模型组腹脂指数、FBG、FINS、IRI明显升高(P<0.01);与模型组比较,灯盏花素高低剂量组腹脂指数、FBG、FINS、IRI均不同程度地降低(P<0.05);与低剂量组比较,高剂量组腹脂指数、FBG、FINS、IRI均不同程度地降低(P<0.05),见表1。
表1 大鼠腹脂指数、FBG、FINS、IRI变化比较()

表1 大鼠腹脂指数、FBG、FINS、IRI变化比较()
*与正常组比较,P<0.05;△与模型组比较,P<0.05;#与灯盏花素低剂量组比较,P<0.05
组别 腹脂指数 FBG(mmol/L) FINS(mU/L) IRI正常组(n=10) 0.05±0.02 4.44±0.21 45.31±2.75 9.50±1.05模型组(n=9) 0.11±0.05* 9.47±0.26* 60.54±4.01* 25.67±1.35*灯盏花素高剂量组(n=8) 0.04±0.03△# 5.23±0.16△# 45.60±3.02△# 11.04±3.04△#灯盏花素低剂量组(n=9) 0.06±0.06△ 6.86±0.34△ 55.13±3.63*△ 17.79±2.07*△

*与正常组比较,P<0.05;△与模型组比较,P<0.05;#与灯盏花素低剂量组比较,P<0.05
2.2大鼠血清、骨骼肌FFA、TG含量比较 与正常组比较,模型组血清、骨骼肌内FFA、TG均明显升高(P<0.01);与模型组比较,灯盏花素高低剂量组FFA、TG均有不同程度降低(P<0.01);与低剂量组比较,高剂量组血清、骨骼肌内FFA、TG均有不同程度降低(P<0.05),见表2。
2.3油红O染色结果比较 正常组细胞核呈蓝色,胞质未出现红色脂滴,见图1;与正常组比较,模型组光密度平均值明显增加(P<0.01);与模型组比较,灯盏花素高低剂量组脂滴面积/肌纤维总面积和光密度平均值均不同程度地降低,比较差异均有统计学意义(P<0.05),见表3。
2.4骨骼肌LccoAs结果比较 正常组LccoAs含量为(3.26±0.19)nmol/g、模型组为(7.18±0.17)nmol/g、灯盏花素高剂量组为(3.10±0.05)nmol/g、灯盏花素低剂量组为(4.95±0.05)nmol/g。与正常组比较,模型组含量明显上升;与模型组比较,灯盏花素高低剂量组含量明显降低;与低剂量组比较,高剂量组含量有所升高,比较差异均有统计学意义(P<0.05)。

图 1 各组大鼠骨骼肌油红染色结果(×400)
表3 油红0染色结果比较()

表3 油红0染色结果比较()
*与正常组比较,P<0.05;△与模型组比较,P<0.05;#与灯盏花素低剂量组比较,P<0.05
组别 脂滴面积/肌纤维总面积 光密度平均值正常组(n=10) - -模型组(n=9) 0.68±0.30* 1.57±0.28*灯盏花素高剂量组(n=8) 0.18±0.21*△# 0.68±0.14*△#灯盏花素低剂量组(n=9) 0.30±0.22*△ 1.02±0.39*△
2.5FAT/CD36、CPT-1蛋白相对表达量比较 与正常组比较,模型组FAT/CD36表达明显增加,CPT-1表达含量明显减少,比较差异均有统计学意义(P<0.05);与模型组比较,灯盏花素高低剂量组FAT/CD36表达均明显降低,CPT-1表达水平均明显升高,比较差异均有统计学意义(P<0.05),见表4。
表4 FAT/CD36、CPT-1蛋白相对表达量比较()
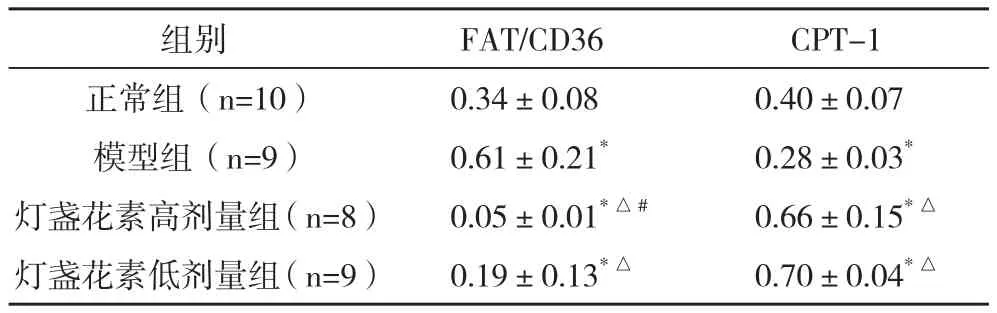
表4 FAT/CD36、CPT-1蛋白相对表达量比较()
*与正常组比较,P<0.05;△与模型组比较,P<0.05;#与灯盏花素低剂量组比较,P<0.05
组别 FAT/CD36 CPT-1正常组(n=10) 0.34±0.08 0.40±0.07模型组(n=9) 0.61±0.21* 0.28±0.03*灯盏花素高剂量组(n=8) 0.05±0.01*△# 0.66±0.15*△灯盏花素低剂量组(n=9) 0.19±0.13*△ 0.70±0.04*△
2.6FAT/CD36、CPT-1 mRNA相对含量比较 与正常组比较,模型组FAT/CD36 mRNA含量明显增加,而CPT-1的含量明显减少,比较差异均有统计学意义(P<0.05);与模型组比较,灯盏花素高低剂量组FAT/CD36 mRNA均降低,且高剂量组效果更明显,而CPT-1 mRNA含量升高,比较差异均有统计学意义,(P<0.05),见图2和表5。

图2 各组大鼠骨骼肌FAT/CD36、CPT-1的mRNA含量PCR检测图
表5 FAT/CD36、CPT-1 mRNA相对含量比较()

表5 FAT/CD36、CPT-1 mRNA相对含量比较()
*与正常组比较,P<0.05;△与模型组比较,P<0.05;#与灯盏花素低剂量组比较,P<0.05
组别 FAT/CD36 CPT-1正常组(n=10) 1.60±0.15 2.02±0.05模型组(n=9) 2.40±0.64* 0.25±0.02*灯盏花素高剂量组(n=8) 0.56±0.13*△# 4.00±0.38*△#灯盏花素低剂量组(n=9) 0.73±0.05*△ 3.33±0.06*△
3 讨论
胰岛素抵抗(IR)被认为各种代谢性疾病的核心,其发病机制复杂,尚未清楚。近年来,游离脂肪酸(FFA)被认为是IR的独立危险因子。本实验大鼠高脂高糖喂养12周,FBG、FINS模型组显著增高,胰岛素敏感性降低,出现明显的IR,且血清、骨骼肌FFA较正常组明显升高。
FFA在机体脂肪代谢中起枢纽作用。外源性的脂肪以FFA形式,经血浆运送至脂肪细胞,内源性的TG,在运动、饥饿时,迅速分解为FFA,进入各组织氧化利用。骨骼肌是机体能量代谢的重要器官,是胰岛素作用的主要组织。餐后70%~90%的能量代谢发生在骨骼肌。研究显示,脂肪酸摄入增加、氧化减少,是导致骨骼肌脂质沉积、IR的主要原因[9]。安静或运动状态下,机体主要有长链脂肪酸(LCFA)氧化供能,LCFA摄入需要脂肪酸转位酶FAT/CD36转运。FAT/CD36是细胞脂肪酸转运的一种重要膜蛋白,特别是介导LCFA的跨膜转运[10-11]。对啮齿类动物和人的研究发现,在肥胖、IR及非酒精性脂肪肝等代谢性疾病中,FAT/CD36与脂肪酸的相互作用可能为其发病原理[12]。进入细胞内LCFA需要转化为有活性的脂酰辅酶A(LccoAs),才能在线粒体进行â氧化。近期研究表明,活性脂代谢中间产物LccoAs与肌细胞对胰岛素敏感性呈负相关,是诱导骨骼肌IR的主要原因[13]。肉碱脂酰转移酶(CPT-1),是线粒体脂肪酸氧化的关键限速酶。CPT-1活性的少量增加至少在一定程度会导致肌细胞内脂质沉积减少[14]。另一项研究也发现,通过超表达CPT-1,可以改善脂肪酸诱导的IR,其机制可能与减少了脂代谢中间产物,激活了PKC,进而促进GLUT4摄取利用葡萄糖有关,这与最新的细胞研究相一致[15-19]。总之,以上途径中任何一个酶活性改变均会引发脂质沉积,导致骨骼肌IR。本实验模型组大鼠高脂高糖喂养12周,IR明显,长链脂酰辅酶A(LccoAs)、FAT/CD36较正常组明显增加,CPT-1含量明显降低,同时伴有肌内TG增加。这说明长期高脂饮食,损伤脂肪酸的转运及线粒体氧化功能,导致糖脂代谢紊乱,引起骨骼肌脂质沉积。灯盏花素,具有降脂、活血化瘀、抗炎及抑制血小板聚集等药理作用。近期研究发现,灯盏花素还可增加糖尿病肾病大鼠AKT的表达,影响NF-kB的作用,抑制糖尿病大鼠肾脏肥大,从而保护肾脏[20-25]。实验在IR模型基础上,分别用灯盏花素200 mg/(kg·d)及100 mg/(kg·d)干预2周后,结果显示灯盏花素明显降低胰岛素抵抗指数,FFA、TG,改善肌肉组织中的脂质沉积和IR,并且影响与脂代谢相关的LccoAs、FAT/CD36、CPT-1。
综上所述,研究提示灯盏花素200 mg/(kg·d)和100 mg/(kg·d)具有改善肌骼肌脂代谢及IR作用,其机制可能与下调LccoAs、FAT/CD36表达,增加CPT-1的表达有关。
[1] Yang X,Bi P,Kuang S.Fighting obesity:when muscle meets fat[J].Adipocyte,2014,3(4):280-289.
[2] Phielix E,Mensink M.Type 2 diabetes mellitus and skeletal muscle metabolic function[J].Physiol Behav,2008,94(2):252-258.
[3]张雪梅,任路平,宋光耀,等.高脂饮食对大鼠骨骼肌脂质中间代谢产物的影响及机制[J].中国老年学杂志,2015,34 (1):323-326.
[4]马倩倩,李锦平,武莉.灯盏花素对2型糖尿病大鼠急性心肌缺血的保护作用[J].中药药理与临床,2014,30(2):72-76.
[5] Yida Z,Imam M U,Ismail M,et al.Edible bird's nest prevents high fat diet-induced insulin resistance in rats[J].J Diabetes Res,2015,2015(9921):760 535.
[6] Matsuzawa-Nagata N,Takamura T,Ando H,et al.Increased oxidative stress precedes the onset of high-fat diet-induced insulin resistance and obesity[J].Metabolism,2008,57(8):1071-1077.
[7] Harati M,Ani M,Messripour M,et al.Effect of vanadyl sulfate on fructose-induced insulin resistance rat[J].Iranian Biomedical Journal,2003,7(4):179-182.
[8]夏同佳,王佑民.二甲双胍对肥胖大鼠骨骼肌脂肪异位沉积的干预作用[J].安徽医科大学学报,2013,48(3):236-240.
[9] Ye J M,Doyle P J,Iglesias M A,et al.Peroxisome proliferatoractivated receptor (PPAR)-alPha activation lowers muscle lipids and improves insulin sensitivity in high fat-fed rats:comparison with PPAR-gamma activation[J].Diabetes,2001,50(2):411-417.
[10] Baumeister S E,Volzke H,Marschall P,et al.Impact of fatty liver disease on health care utilization and costs in a general population:a 5-year observation[J].Gastroenterology,2012,134(1):85-94.
[11] Vizzutti F,Arena U,Nobili V,et al.Non-invasive assessment of fibrosis in non-alcoholic fatty liver disease[J].Ann Hepatol,2009,8(8):89-94.
[12] Greco D,Kotronen A,Westerbacka J,et al.Gene expression in human NAFLD[J].Am J of physiol Gastrointest Liver Physiol,2008,294(5):G1281-1287.
[13] Bergman B C,Perreault L,Hunerdosse D M,et al.Increased intramuscular lipid synthesis and low saturation relate to insulin sensitivity in endurance-trained athletes[J].J APPl Physiol (1985),2010,108(5):1134-1141.
[14] Bruce C R,Brolin C,Turner N,et al.Overexpression of carnitine palmitoyltransferase Ⅰ in skeletal muscle in vivo increases fatty acid oxidation and reduces triacylglycerol esterification[J].Am J Physiol Endocrinol Metab,2009,292 (4):E1231-1237.
[15] Sebastian D,Herrero L,Serra D,et al.CPT Ⅰ overexpression Protects L6E9 muscle cells from fatty acid-induced insulin resistance[J].Am J Physiol Endocrinol Metab,2007,292(3):E677-686.
[16] Schenk S,Horowitz J F.Acute exercise increases triglyceride synthesis in skeletal muscle and prevents fatty acid-induced insulin resistance[J].J Clin Invest,2007,117(6):1690-1698.
[17]赵燕,杨秋萍,刘华,等.灯盏花素对糖尿病大鼠肾脏PI3K/AKT传导通路的影响[J].昆明医学院学报,2010,31 (11):58-62.
[18]邓丽萍,乐有为,黄晓青,等.灯盏花素对糖尿病肾病大鼠肾组织MMP-9表达的影响[J].中国热带医学,2014,14 (4):401-403.
[19]焦彦辉.灯盏花素注射液用于糖尿病肾病80例临床疗效观察[J].甘肃医药,2015,34(1):33-35.
[20]邱英,丁国华.ARB类药物联合灯盏花素治疗糖尿病肾病的有效性及安全性[J].山东医药,2015,59(19):35-37.
[21]李菲,灯盏花素联合甲钴胺治疗糖尿病周围神经病变[J].长春中医药大学学报,2015,31(3):556-557.
[22]龙玲莉,郑淑慧,李宇彬.灯盏花素干预糖尿病模型大鼠睾丸组织增殖细胞核抗原和c-fos的表达[J].中国组织工程研究,2015,19(18):2917-2922.
[23]肖云,肖洁,谢辉,等.灯盏花素联合还原型谷胱甘肽治疗糖尿病肾病的临床疗效[J].中国老年学杂志,2014,34(8):2042-2044.
[24]金桂兰,覃慧林,石孟琼,等.灯盏花素对小鼠局灶性脑缺血损伤的保护作用及与脑组织P-糖蛋白表达研究[J].中药药理与临床,2015,31(1):76-79.
[25]武莉,马倩倩,张轩萍,等.灯盏花素对大鼠2型糖尿病胰岛素抵抗的影响[J].中国实验方剂学杂志,2014,20(16):152-155.
The Effect of Breviscapine on Insulin Resistance in Skeletal Muscle Fatty Acid Metabolism in Rats
ZHANG Xin-yuan,WU Li,LI Jin-ping,et al.//Medical Innovation of China,2016,13(14):024-028
Objective:To discuss the effect of breviscapine on insulin resistance in skeletal muscle fatty acid metabolism in rats.Method:A total of 40 healthy male SD rats were selected,they were divided into the normal group of 10 and the high fat and sugar group of 30,normal feed,high fat and high sugar diets were given respectively,glucose tolerance test was performed after 12 weeks of feeding,30 rats were selected as model rats according to the standard,except for 4 poor state and the death of rats,the remaining 26 rats were divided into the model group of 9,breviscapine high dose group of 8 and breviscapine low dose group of 9.Breviscapine high,low dose group were respectively injected with a corresponding volume of breviscapine,the normal group and model group were intraperitoneally injected with volume of 0.9% sodium chloride solution,four groups were given drugs for 2 weeks,each index were detected by required organization after 2 weeks.Result:The model group abdominal fat index,fasting blood glucose (FBG),fasting serum insulin (FINS),insulin resistance index (IRI),serum and tissue FFA,TG,lipid droplets area/total area of muscle fiber,optical density mean value,LccoAs content and FAT/CD36 were the highest in four groups.Conclusion:Twelve weeks high fat and high sugar diet induce IR rats model,breviscapine can significantly improve insulin resistance and lipid deposition in skeletal muscle,it relate to CPT-1 expression upregulation and FAT/CD36 expression decreased.
Breviscapine; Insulin resistance; Long chain fatty acyl coenzyme A; Fatty acid translocation enzyme; Carnitine palmityl transferase
山西省科技攻关计划项目(20051903);山西医科大学汾阳学院科研基金重点项目(1418)
①山西医科大学 山西 太原 030000
②山西医科大学汾阳学院
李锦平
10.3969/j.issn.1674-4985.2016.14.006
2016-03-22) (本文编辑:李颖)

