维持性血透病人肌肉组织指数 脂肪组织指数与超敏C反应蛋白及细胞因子的关系
王伟东 康乐 方明 杭宏东
维持性血透病人肌肉组织指数 脂肪组织指数与超敏C反应蛋白及细胞因子的关系
王伟东1康乐2方明1杭宏东1
作者单位:1.116011 辽宁 大连,大连医科大学附属第一医院;2.大连大学医学院病理生理教研室
目的 分析维持性血液透析病人肌肉组织指数、脂肪组织指数与超敏C反应蛋白及细胞因子的关系,探讨肌肉组织指数、脂肪组织指数对判断维持性血液透析病人微炎症状态的临床价值。方法 收集2013年8月—2015年11月在大连医科大学附属第一医院血液净化中心进行规律血液透析病人109例,检测病人超敏C反应蛋白、白介素-1、白介素-6等微炎症指标。使用人体成分分析仪,经模型运算得到肌肉组织指数、脂肪指数及校正的肌肉组织指数、校正的脂肪组织指数。应用一元线性回归分析校正的肌肉组织指数、校正的脂肪组织指数与超敏C反应蛋白、白介素-1、白介素-6的相关性。结果 校正的肌肉组织指数与超敏C反应蛋白无相关性。校正的脂肪组织指数与敏C反应蛋白呈正相关,与白介素-1、白介素-6无相关性。结论 通过人体成分分析仪测得的维持性血液透析病人脂肪组织指数与超敏C反应蛋白呈正相关。
维持性血液透析;微炎症;多频生物电阻抗;肌肉组织指数;脂肪组织指数
近年来,慢性肾脏病(CKD)的发病率呈全球性增高趋势,美国>20岁成年人CKD发病率已高达13%,尿毒症的患病率为7.6%[1]。由于缺乏肾源,目前,血液透析是治疗尿毒症的主要措施[2]。尽管血液净化治疗技术已得到明显提高,但维持血液透析(MHD)病人的年病死率仍高达15%~36%,此类人群心血管疾病发病率达86%、病死率达50%,远高于其他人群,是该人群死亡的主要原因[3]。
MHD病人普遍存在慢性微炎症。慢性微炎症是一种在体内各种微生物、内毒素、补体、免疫复合物刺激下,以单核巨噬细胞激活、促炎症因子释放为中心的炎症反应。这种微炎症状态最早由Stenvinkel等在营养不良-微炎症-动脉粥样硬化综合征(MIA)中提出[4],他们认为炎症与血液透析病人的心血管疾病、营养不良等并发症密切相关,且炎症在其中发挥了起始和驱动作用。大量研究证实,终末期肾病(ESRD)病人的微炎症状态与心血管疾病并发症的发生及死亡密切相关。因此,及早发现微炎症状态并积极进行干预,对提高肾病病人的生存质量、延长生存时间具有重要意义。目前的研究显示,尿毒症微炎症状态的主要炎症标志物包括:急性反应蛋白,如超敏C反应蛋白(hs-CRP);细胞因子,如白介素-1(IL-1)、白介素-6(IL-6)等[5]。
多频生物电阻抗技术是利用生物电阻抗原理对人体细胞外液、细胞内液和机体总水量进行成分测量[6],对人体的水分、脂肪、肌肉等进行评估的技术方法,其中,肌肉组织指数(LTI)、脂肪指数(FTI)对评价营养状态具有一定的作用。生物电阻抗技术具有无创、可重复及简便等优点[7]。本研究通过人体成分分析仪(BCM)检测得到维持性血液透析病人的LTI、FTI,经BCM仪中的个人模型标准校正后得到LTI-dtr、FTI-dtr,分析LTI-dtr、FTI-dtr与hs-CRP、IL-1、IL-6的相关性,判断BCM检测在发现微炎症状态方面的临床应用价值。现报告如下。
1 资料与方法
1.1一般资料 选择2013年8月—2015年11月在大连医科大学附属第一医院血液净化中心进行规律血液透析病人。入选标准:年龄18~80岁;规律血液透析,6~7次/2周,血液透析时间>3个月;血液透析通路为动静脉内瘘;签署知情同意书。排除标准:体质量指数(BMI)>40 kg/m2;平衡尿素清除指数(eKt/V)<1.2,尿素下降率(URR)<70%;艾滋病、肝炎或严重肝功能异常者;体内装有心脏起搏器或钢板、钢钉等金属装置;1个月内有严重感染,或出现严重应激事件(如脑缺血、心梗发作)者;存在肢体缺如,双侧肢体存在无功能动静脉内瘘;恶性肿瘤,需要放化疗者;孕妇;其他不符合纳入标准或资料不全者。本研究入组109例病人,男62例、女47例;平均年龄(53.91±12.56)岁;透析6~7次/2周,4 h/次;透析时间(56.57±41.97)个月,血流量200~300 mL/min,透析液流量500 mL/min。血液净化治疗均使用碳酸氢盐透析,透析液钠浓度135~145 mmol/L、钾浓度2.0 mmol/L、钙浓度1.25~1.5 mmol/L;肝素或低分子肝素抗凝,透析机为德国费森尤斯4008s,透析滤器选择高通量(聚砜膜透析器FX60,膜表面积1.4 m2;或聚醚砜膜透析器150DS,膜表面积1.5 m2)。
1.2检测方法
1.2.1人体成分测定 所有病人均于透析前使用BCA-IB型人体成分分析仪(BCM)进行测定。主要指标包括校正后的肌肉组织指数(LTI-dtr)及校正后的脂肪组织指数(FTI-dtr)。LTI-dtr 、FTI-dtr:是在BCM仪中建立个人模型的标准值范围后,将LTI、FTI进行标准校正后所得,其中LTI=肌肉组织量/身高2,FTI=脂肪组织量/身高2,肌肉组织量及脂肪组织量由仪器根据测得的数据,使用生理模型计算得到。
1.2.2人体体格指标测定 主要指标包括身高(cm)、体重(kg)、BMI、上臂中部肌围(MAMC)。
1.2.3实验室相关指标测定 标本收集:采血前禁食8 h,透析开始前采集病人内瘘侧静脉血9 mL,每份3 mL分别装入1支乙二胺四乙酸(EDTA)抗凝管(用于血常规检测)、2支含有分离胶的促凝管中(用于肝功生化、血脂、肾功能检测,以及分离血清)。将其中1支促凝管的3 mL血液样本,于室温下静止20 min后,用TDZ4-WS台式低速自动平衡离心机,以3 000转/min的速度离心10 min,进行血清分离,各取0.5 mL血清分别装于2支0.5 mL EP管中用于进一步检测。其中0.5 mL血清样本储存于4℃冰箱中,于3 d内完成IL-1、IL-6检测;另外0.5 mL血清样本储存于-80℃冰箱中,尽早完成hs-CRP检测。
1.2.4血常规及生化指标检测 采用SF 3000全自动血细胞分析仪检测白细胞计数(WBC)、血红蛋白(Hb)等。采用Hitachi 7170s全自动生化分析仪检测白蛋白(ALB)等。采用BNⅡ全自动蛋白分析仪,用反射比浊法检测hs-CRP。采用酶联免疫吸附法(ELISA)测定IL-1、IL-6。
1.3统计学方法 采用SPSS 19.0软件进行统计学分析,正态分布的数据以均数±标准差表示;非正态分布的数据LTI-dtr、hs-CRP、IL-1、IL-6,进行适当转换成为正态分布资料,应用一元线性回归分析LTI-dtr、FTI-dtr与hs-CRP、IL-1、IL-6的关系;P<0.05为差异有统计学意义。
2 结果
病人平均体重(6 5.1 1±1 0.5)k g、B M I(2 3.0 4±2.8 3)k g/m2、肌肉消耗(26.85±2.28)cm、皮下脂肪厚度(7.35±3.1)cm、MAMC(24.54±2.17)cm;血WBC、Hb及ALB水平均正常;hs-CRP均值1.33 mg/L(参考值0.37 mg/L)、IL-1均值32.59 μg/L(参考值5.34 μg/L)、IL-6均值77.84 μg/L(参考值1.67 μg/L),均高于正常参考值,差异有统计学意义(P<0.05)。应用不同方法评价营养不良结果:BMI法3例(2.75%)、M A M C法9例(8.26%)、ALB法(<40 g/L)21例(19.27%)。BCM检测结果:LTI-dtr均值0.2 kg/m2(正常参考值0~7.5 kg/m2)、FTI-dtr均值4.0 kg/m2(正常参考值0~7.5 kg/m2),上述两个指标均在正常参照值范围内。将LTI-dtr、FTI-dtr分别与hs-CRP、IL-1、IL-6进行相关性分析,发现LTI-dtr 与hs-CRP无相关性,而FTI-dtr与hs-CRP存在正相关(r2=0.1074,P<0.001),见图1。
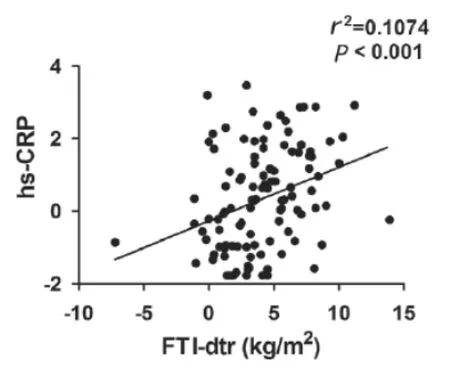
图1 hs-CRP与FTI-dtr的相关性
3 讨论
目前常用评价MHD病人营养状况的指标有:主观综合性营养评估(SGA)、营养不良-炎症积分(MIS)、体质量指数(BMI)、上臂中部肌围(MAMC)、白蛋白(ALB)。目前已普遍认识到,MHD病人常有营养不良、炎症、动脉粥样硬化综合征(MIA),并且炎症发挥起始和驱动作用[8]。目前有研究发现,肌肉百分比与CRP呈负相关[9]。但本研究结果显示,LTI-dtr与hs-CRP、IL-1、IL-6均无统计学关系。本研究应用不同方法检测营养不良的结果:BMI法3例(2.75%)、MAMC法9例(8.26%)、ALB法(<40 g/L)21例(19.27%),营养不良病人所占比例较少。有研究表明,低肌肉组织指数可能与低BMI及低白蛋白有关[10],故笔者认为本研究结果与MHD病人营养不良比例较低有关。
脂肪(肥胖)是导致炎症发生的原因之一。研究表明,内脏脂肪指数与心血管疾病密切相关[11]。目前,人体脂肪总量的测量方法有人体测量法、全身水量测定法、水下称重法、总体水法、总体钾法、密度测定法和全身水量测定法的结合法等,然而,这些测量方法由于设备昂贵、操作复杂、精确度不高,且部分测试方法在测试过程中对人体造成一定的辐射等原因,限制了其大范围应用。BCM为一种相对比较简便、可靠的人体脂肪测量方法。BCM进行机体成分分析可得到FTI。应用生物电阻抗技术分析人体成分显示,脂肪成分与心血管疾病风险因子相关[12]。研究表明,成年人的脂质蓄积指数、内脏脂肪指数与超敏C反应蛋白呈正相关[13]。本研究结果显示,MHD病人人体成分分析仪检测出的FTI-dtr与hs-CRP呈正相关。但是,由于本研究收集样本量偏小,依据BCM关于FTI-dtr的参考范围分组后,各组样本量偏小,无法进一步分析FTI-dtr与hs-CRP的对应关系,尚有待于进一步扩大样本量、进行多中心研究。
[1] Elshamaa MF, Sabry SM, El-Sonbaty MM, et al. Adiponectin: an adipocyte-derived hormone, and its gene encoding in children with chronic kidney disease[J]. BMC Res Notes, 2012, 5: 174-182.
[2] Krishnamoorthy V, Sunder S, Mahapatra HS, et al. Evaluation of protein-energy wasting and inflammation on patients undergoing continuous ambulatory peritoneal dialysis and its correlations[J]. Nephrourol Mon, 2015,7(6): e33143.
[3] Dounousi E, Torino C, Pizzini P, et al. Intact FGF23 and α-klotho during acute inflammation/sepsis in CKD patients[J]. Eur J Clin Invest, 2016, 46(3): 234-241.
[4] Kim JK, Kim YS, Song YR, et al. Excessive weight gain during the first year of peritoneal dialysis is associated with inflammation, diabetes mellitus, and a rapid decrease in residual renal function[J]. PLoS One, 2015, 10(9):e0139033.
[5] Kawaguchi T, Tong L, Robinson BM, et al. C-reactive protein and mortality in hemodialysis patients:the Dialysis Outcomes and Practice Patterns Study(DOPPS)[J]. Nephron Clin Pract, 2011, 117(2):c167-178.
[6] Dong J, Li YJ, Xu R, et al. Ketoacid supplementation partially improves metabolic parameters in patients on peritoneal dialysis[J]. Perit Dial Int, 2015, 35(7):736-742.
[7] Gupta J, Dominic EA, Fink JC, et al. Association between inflammation and cardiac geometry in chronic kidney disease: findings from the CRIC study[J]. PLoS One,2015, 10(4): e0124772.
[8] Beddhu S, Filipowicz R, Chen X, et al. Supervised oral protein supplementation during dialysis in patients with elevated C-reactive protein levels: a two phase,longitudinal, single center, open labeled study[J]. BMC Nephrol, 2015, 16(1): 1-8.
[9] Abramowitz MK, Sharma D, Folkert VW. Hidden obesity in dialysis patients: clinical implications[J]. Semin Dial,2016, 10.1111/sdi.12516.
[10] Chen S, Zhou S, Wu B, et al. Association between metabolically unhealthy overweight/obesity and chronic kidney disease: the role of inflammation[J]. Diabetes Metab, 2014, 40(6): 423-430.
[11] Carrero JJ, Avesani CM. Pros and cons of body mass index as a nutritional and risk assessment tool in dialysis patients[J]. Semin Dial, 2015, 28(1): 48-58.
[12] Vega A, Ruiz C, Abad S, et al. Body composition affects the response to erythropoiesis-stimulating agents in patients with chronic kidney disease in dialysis[J]. Ren Fail, 2014, 36(7): 1073-1077.
[13] 张燕,张素华,龚莉琳,等.成年人脂质蓄积指数、内脏脂肪指数与超敏C反应蛋白的相关性研究[J].解放军医学杂志,2013,38(3):225-229.
辽宁省教育厅科研基金,编号L2015139
杭宏东,Email:goodluckyweidong@126.com
R69
A
1672-7185(2016)08-0069-04
10.3969/j.issn.1672-7185.2016.08.026
2016-04-13)

