马铃薯黑胫病菌的分离、纯化及PCR检测
林燕文,陈妙英,毛露甜,陈兆贵
(惠州学院生命科学系,广东 惠州 516007)
病虫防治
马铃薯黑胫病菌的分离、纯化及PCR检测
林燕文,陈妙英,毛露甜,陈兆贵*
(惠州学院生命科学系,广东惠州516007)
由Pectobacterium atroseptica引起的马铃薯黑胫病是影响马铃薯生产的重要种薯传播细菌病害,从种薯发芽到生长后期均可发病,严重影响马铃薯的产量和品质。为构建马铃薯黑胫病菌的分离、鉴定技术体系,从广东省惠州市惠东县大水坑马铃薯基地采集了疑似感染马铃薯黑胫病植株,对其进行病原菌分离和纯化,得到7株病菌,利用引物Eca 1 g/Eca 2 g对其进行PCR扩增、将PCR产物测序并将所测定序列递交GenBank数据库,使用Blast软件进行比对确定目标菌株。结果表明,其中一株菌株能扩增出长度大约688 bp的特异性条带,其DNA序列符合Eca 3762序列,鉴定为马铃薯黑胫病菌。此方法可以成功地从发病植株中分离出黑胫病菌,成本较低廉,为广东省建立马铃薯种薯质量检测和控制体系提供技术支撑。
马铃薯;黑胫病菌;马铃薯黑胫病;CVP培养基;PCR检测
马铃薯(Solanum tuberosum L.)是茄科茄属一年生双子叶植物,起源于拉丁美洲安第斯山脉一带,是世界四大粮食作物之一,在中国各地均有种植[1,2]。马铃薯黑胫病又称黑脚病,是影响马铃薯生产的重要种薯传播细菌病害,带菌种薯种植后,常造成非常大的产量和经济损失[3,4]。马铃薯黑胫病是由Pectobacterium atroseptica诱发的,是一种革兰氏染色呈阴性的致病菌[5],该病菌主要侵染维管束组织,可侵染马铃薯的茎和块茎,从种薯发芽到生长后期均可发病,以苗期最盛。广东省因冬季气温适宜,近年冬种马铃薯发展迅速,但黑胫病造成烂种死苗,使马铃薯的品质、产量等大幅降低,已成为制约广东省冬种马铃薯产业发展的瓶颈问题。本试验开展马铃薯黑胫病菌分离与鉴定技术研究,为广东省建立冬种马铃薯种薯质量检测和控制技术体系奠定基础。
1 材料与方法
1.1试验材料
1.1.1材料
疑似感染马铃薯黑胫病植株:采自广东省惠州市惠东县平海镇大水坑马铃薯基地。革兰氏染色阳性对照菌:苏云金杆菌(Bacillus thuringiensis)由惠州学院微生物室提供。
1.1.2试剂
牛肉膏、蛋白胨、胰蛋白胨、琼脂粉均为生物化学试剂,碘、碘化钾、草酸铵、95%乙醇、番红、香柏油、二甲苯、CaCl2·2H2O、硝酸钠、聚果胶酸钠、脱水柠檬酸三钠、Tris、EDTA、SDS、蛋白酶K、CTAB、氯化钠、氯仿、异丙醇、Taq酶、10×buffer、DNA marker DL2 000、dNTPs、6× Loading Buffer、GoldviewTMNucleic Acid Stain、Tris碱、硼酸、琼脂糖等均为分析纯或化学纯,购自北京鼎国生物技术有限责任公司和大连宝生物工程有限公司。
1.1.3仪器
LDZX-40KB立式压力蒸汽灭菌锅(上海申安医疗器械厂)、FA1204B电子天平(上海精科天美科学仪器有限公司)、TG16-W微量高速离心机(湘仪离心机仪器有限公司)、DYY-12型电泳仪、WD-9413A凝胶成像分析仪(北京市六一仪器厂)、SW-CJ-1D型单人净化工作台(苏州净化)、SPX-350生化培养箱(北京科技有限公司)、563BR2605 My CyclerTMThermal Cycler(BIO RAD)、ZHWY-2102C恒温培养振荡器(上海智诚分析仪器制造有限公司)等。
1.1.4培养基
牛肉膏蛋白胨固体培养基(按参考文献[6]配制),CVP培养基(按参考文献[7]配制),LB培养基:取LB培养基粉末21 g,加入1 L蒸馏水。
1.2试验方法
1.2.1马铃薯黑胫病菌分离、纯化和保存
(1)马铃薯黑胫病菌分离:取疑似感染马铃薯黑胫病菌植株的茎部(图1),在离茎部发黑部分3 cm处,用灭菌剪刀剪取2 cm的马铃薯茎部,将其放入2%的次氯酸钠水溶液中浸泡3 min,再用灭菌水冲洗2次,用灭菌滤纸将材料吸干。然后,用灭菌剪刀将剪取的马铃薯茎外部去除,再将剩余部分剪成2~3 mm的组织切片,放入灭菌研钵中,加入10 mL灭菌水研磨成组织液。最后,用移液枪吸取1 mL组织液加入盛有9 mL无菌水的试管中充分混匀,此为10-1稀释液。再从其中用移液枪吸取1 mL溶液加入另一支盛有9 mL无菌水的试管中充分混匀,此为10-2稀释液。以此类推制成10-3、10-4和10-5稀释度的组织样品液。用接种环蘸取组织样品液在牛肉膏蛋白胨平板培养基上划线,每种稀释度设3个平行组,置于生化培养箱中,27℃培养2 d,挑取灰白色,圆形单菌落革兰氏染色,染色后在10×100倍显微镜下观察。

图1 疑似感染黑胫病菌的植株茎部Figure 1 The stem suspected of being infected with P.atroseptica
(2)马铃薯黑胫病菌纯化培养:挑取1.2.1(1)中革兰氏染色为阴性短杆状的单菌落,于CVP选择性培养基平板上划线,27℃培养2 d。再挑取培养基出现凹陷处的单菌落于牛肉膏蛋白胨平板培养基上,27℃培养2 d,再进行革兰氏染色。显微镜下除了淡粉色的短杆菌外,如果还存在其他杂菌,则重新挑取单菌落在牛肉膏蛋白胨培养基上划线培养,直至纯化无杂菌为止。
(3)马铃薯黑胫病菌保存:挑取CVP培养基凹陷处已纯化的单菌落,在牛肉膏蛋白胨斜面培养基上划线,置生化培养箱中,27℃培养2 d后,2℃保存菌株。
1.2.2DNA的提取
取1.2.1(3)中获得的疑似马铃薯黑胫病菌株,采用CTAB/NaCl法[1]提取马铃薯黑胫病菌DNA,每株菌株设置2个平行组。具体步骤如下:
(1)用接种环蘸取保存的菌株接种到LB液体培养基中,27℃振荡12 h。
(2)移取1.5 mL培养物于1.5 mL离心管中,在高速离心机中,12 000 r/min离心2 min。
(3)弃去上清液,向沉淀物加入567 μL TE缓冲液,反复吹打使之重新悬浮。
(4)加入30 μL 10%SDS溶液和3 μL 20 mg/mL蛋白酶K混匀,于37℃温育1 h。
(5)加入100 μL 5 mol/L NaCl,充分混匀,再加入80 μL的10%CTAB/0.7 mol/L NaCl溶液混匀,于65℃温育10 min。
(6)加等体积的氯仿/异戊醇(24:1)抽提。于10 000 r/min,离心5 min,将上清液转入1只新离心管中。
(7)加入0.6倍体积的异丙醇,轻轻混合直到DNA沉淀下来(用冰浴放置40 min),10 000 r/ min,离心5 min。
(8)去上清液,用1 mL 70%乙醇进行清洗,10 000 r/min,离心5 min。
(9)弃掉乙醇,在超净工作台中干燥后,重新溶于50 μL TE缓冲液中。-20℃保存备用。
1.2.3PCR扩增
取1.2.2获得的DNA作为模板,参考杨松[7]鉴定马铃薯黑胫病菌的方法,利用特异性引物Eca 1 g/Eca 2 g进行PCR检测。
(1)引物序列、PCR反应条件、反应体系引物序列:Eca 1 g(5'GAAACCGTCACGCTGGATAAC3');Eca 2 g(3'AAGGTGTTGGGCAGATTGAGT5')。PCR反应条件、反应体系分别见表1和表2。
(2)电泳检测:制备凝胶:5×TBE溶液取10 mL,稀释成50mL的1×TBE,取40mL的1×TBE置于锥形瓶中,向其加入0.4g琼脂糖,电炉上煮至沸腾,溶化的琼脂物冷却至65℃左右时加入2 μL的GoldviewTMNucleic Acid Stain,充分混匀,将温热的凝胶倒入已置好梳子的电泳板中,在室温下放置30 min左右,凝固后,轻轻拔出梳子,将铺好胶的内槽放入含有电泳缓冲液1×TBE的电泳槽中备用。
加样:用移液枪分别取5 mL PCR扩增后的样品溶液与1 μL 6×Loading Buffer一起混合均匀后加入加样孔中。
电泳:盖上电泳槽,接通电源,样品端接负极,于99 V/mL电压下电泳40 min,当溴酚蓝快到达凝胶板下沿约1 cm处时,停止电泳。电泳结束后,即可在紫外灯下检测结果。
1.2.4DNA序列测定
PCR产物交由大连宝生物工程有限公司进行纯化测序。

表1 PCR反应条件Table 1 PCR reaction condition

表2 PCR反应体系Table 2 PCR reaction system
2 结果与分析
2.1马铃薯黑胫病菌的分离、纯化结果
利用牛肉膏蛋白胨培养基对马铃薯黑胫病菌进行分离,在培养基上观察到菌落形态为圆形、乳白色,表面光滑湿润、边缘整齐、中间凸起(图2)。
以革兰氏染色阳性菌苏云金杆菌为对照菌,将分离得到的病原菌进行革兰氏染色,结果为淡粉色、呈阴性,短杆状。将分离到的病原菌接于CVP选择性培养基培养2 d后观察到典型的凹坑。
2.2PCR扩增结果
利用引物Eca 1 g/Eca 2 g,以分离得到7株菌株DNA作为模板,进行PCR扩增,结果表明只有标号为1的菌株能扩增出大约688 bp的特异性条带(图3)。
2.3测序结果
将获得的1号菌株PCR扩增产物交由大连宝生物工程有限公司进行测序,得到的测序结果如下:
CGCACGACATCCCTGCTCATCCCGACCACCGCAGGAACTG GTTCAGAAGCCACGCCGAATGCCATTCTGGCGATCCCGGAAAAA GAGACCAAGGTCGGCATTATTACGCCCGTGATGCTGCCGGACTA TGTTGCACTGGTGCCGGAGCTGACCATCAGCATGCCGCCACATA TTGCCGCCTCAACCGGTATCGACGCACTCTGCCACCTGATCGAG TGTTTCACCTCGACGATTGCCAACCCGGTCAGCGACAACTACGC GCTGATTGGCCTGAAGAAGCTGTTTGCCAACCTTGAAACGTCTG TGCGCGAACCGAGCAATCTGGAAGCCAAGCTGAATATGTTGTGG GCGTCCTATTACGGTGGTGCCGCCATTGCCCACTCCGGTACGCA TCTGGTTCACGCCATGTCTTACCCGCTAGGCGGTAAGTACCACA TCCCACACGGCGTCGCGAACGCCATCCTGCTCGCCCCTTGCATG CGCTTCGTGCAGGACGCTGCACAGGACAAATTCGCTCAGGCGTATGACCTGCTGCCGGATGCCGATCTAACGCTCGGTACCGCGGAA AAAGCGCAGGCGCTGGTGA
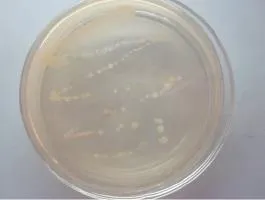
图2 黑胫病菌菌落形态Figure 2 Colony morphology of P.atroseptica

图3 引物Eca 1 g/Eca 2 g PCR扩增结果Figure 3 PCR amplification using the primer Eca 1 g/Eca 2 g
序列长688 bp。所测定序列递交GenBank数据库,使用Blast程序在数据库进行比对(图4和图5)。结果显示,1号菌株PCR扩增的序列与编号为BX950851.1,CP003776.1,CP001657.1,CP001790.1和CP003415.1的5种基因序列同源性相似性分别达97%,93%,92%,91%和91%。经比较鉴定后,1号菌株与编号为BX950851.1的Erwinia carotovora subsp.atroseptica相似性最为接近,表明1号菌株基本为马铃薯黑胫病菌。
3 讨论
本试验根据黑胫病的生物学性状进行检测,采用细菌分离、革兰氏染色鉴定及CVP选择培养基培养等一系列过程初步获得马铃薯黑胫病菌,此分离、纯化菌种过程与前人稍有不同[5,7]。本试验对分离到的菌种先进行革兰氏染色,从中挑选淡粉色、阴性,短杆状符合黑胫病菌特征的菌落接于CVP选择性培养基培养2 d后观察是否形成典型的凹坑,也能获得良好试验效果,而且能降低试验成本。根据杨松[7]试验结果可知,虽然实时定量荧光PCR检测黑胫病菌灵敏度较常规PCR高,特异性也强,但其设备、耗材成本很高,故此方法更适合广东种植马铃薯多个市县开展黑胫病菌检测,此方法对实验室条件要求不高,但可靠性较强。

图4 扩增片段的Blast鉴定结果Figure 4 Identification result of amplified fragment by Blast
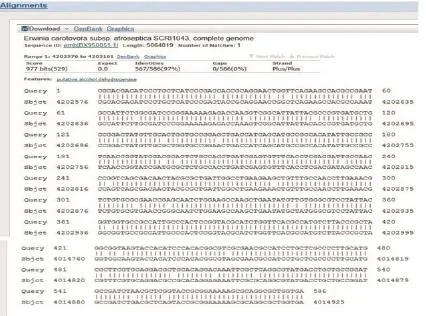
图5 扩增片段与P.atroseptica序列比较结果Figure 5 Result of sample sequence compared with P.atroseptica by Blast
测序结果1号菌株PCR扩增的序列与编号为BX950851.1 Eca的基因序列同源性达97%,其中3%的差异可能是1号菌株在扩增时碱基错配,造成个别基因突变。另外,也可能是由于测序过程中所选择的方法不同,对测序结果有一定程度的影响,因此造成比对差异。
广东省因冬季气温适宜,独具发展冬种马铃薯优势。在政府引导下,近年广东冬种马铃薯发展迅速,全省多个市县马铃薯种植面积逐年增加,马铃薯病害发生也逐年增加,由于目前条件所限,在广东省种薯繁育还存在一定难度,马铃薯种薯主要从北方调种,调出区对种薯的质量检测管理不严,加之广东省目前对种薯质量的监控几乎处于空白,给马铃薯种植户带来巨大的经济损失。根据广东省冬种马铃薯种薯质量的现状,十分有必要开展马铃薯种薯的主要病原的分离与鉴定,为马铃薯种薯的质量检测提供技术支持。本研究结果对于马铃薯黑胫病防治工作、种薯黑胫病的检测以及植物源抗黑胫病农药的研发具有重要意义。
[1]韩广涛,杨志辉,朱杰华,等.双重PCR技术检测马铃薯环腐病菌和黑胫病菌方法的建立[J].中国农业科学,2011,44(20): 4199-4206.
[2]石立航,胡俊,蒙美莲,等.华北地区马铃薯贮藏病害种类调查及病原菌鉴定[J].内蒙古农业大学:自然科学版,2010(4): 53-57.
[3]Deboer S H,Slack S A.Current status and prospects for detecting and controlling bacterial ring rot of potatoes in North America[J]. Plant Disease,1984,68(10):841-844.
[4]Pérombelon M C M,Kelman A.Ecology of the soft rot Erwinias[J]. Annual Review of Phytopathology,1980,18(1):361-387.
[5]董学志,胡林双,魏琪,等.马铃薯黑胫病菌分离纯化体系的建立[J].黑龙江农业科学,2013(7):45-48.
[6]沈萍,陈向东.微生物学实验[M].4版.北京:高等教育出版社,2007.
[7]杨松.马铃薯黑胫病菌实时定量荧光PCR检测[D].哈尔滨:东北农业大学,2009.
Isolation,Purification and PCR Detection of Pectobacterium atroseptica from Potato
LIN Yanwen,CHEN Miaoying,MAO Lutian,CHEN Zhaogui*
(Department of Life Science,Huizhou University,Huizhou,Guangdong 516007,China)
ract:Potato black leg,caused by Pectobacterium atroseptica,is a major bacterial disease influencing potato production.It is spread by seed potato,and may occur in any stage from germination to late growth and seriously affect the yield and quality of potatoes.To establish a technical system which can isolate and identify P.atroseptica from potatoes,the samples suspected of being infected by the pathogen were collected from Dashuikeng of Huidong County in Huizhou City.Seven suspected bacterial objects were isolated and further purified.Their specific DNA fragments were amplified with primer Eca 1 g/Eca 2 g by PCR,and the fragments were sequenced and aligned with GenBank database.Finally,the bacterial objects were compared and determined by using Blast software.The results showed that a specified fragment about 688 bp was amplified in one of the objects,and its sequence matched that of Eca 3762.So it can be identified as P.atroseptica.This method could successfully isolate P.atroseptica from diseased potato plants with low cost,soit mayprovide atechnical support fortheseedpotatoquality detection andcontrolsystemof Guangdong Province.
rds:potato;Pectobacterium atroseptica;potato black leg;CVP culture medium;PCR detection
S532
A
1672-3635(2016)03-0169-06
2015-05-06
广东省科技计划项目“冬种马铃薯健康种薯质量检测和控制技术体系研究(2011B020303010)”,广东省科技计划项目“南方冬种马铃薯健康种薯繁育及高效栽植技术推广应用(2013B090200023)”。
林燕文(1975-),女,高级实验师,研究方向为农业微生物学。
(Corresponding author):陈兆贵,教授,研究方向为马铃薯种薯繁育及栽培技术,E-mail:Chenzg1973@126.com。

