孤独症谱系障碍儿童的脑电特征与临床症状的相关性分析
周妍 张功 邓红珠 邹小兵
·临床研究论著·
孤独症谱系障碍儿童的脑电特征与临床症状的相关性分析
周妍张功邓红珠邹小兵
目的分析孤独症谱系障碍(ASD)患儿脑电特征与临床症状之间的关系,为疾病的早发现、干预提供参考依据。方法对41例17~84月龄的ASD患儿进行常规脑电图检测,根据脑电图结果将其分为正常脑电图组(正常组)和异常脑电图组(异常组),对异常组进行脑电地形图检测,分析异常组的脑电特征与临床症状[采用孤独症治疗评估量表(ATEC)评分评定]的相关性。结果脑电图正常患儿占68.3%(28/41),脑电图异常患儿占31.7%(13/41)。正常组ATEC评分为(73.4±23.4)分,异常组为(63.5±24.2)分,2组比较差异无统计学意义(P>0.05)。异常组中右前颞区的δ频段绝对功率值与ATEC感觉/知觉评分呈正相关(r=0.575,P=0.040)。异常组中<36月及>60月组左右额部δ频段绝对功率值均大于36~60月组,>60月组左右额部θ频段绝对功率值均大于36~60月组(P均<0.05/3)。结论ASD患儿右前颞区域δ频段绝对功率值越高,感知觉障碍越严重;ASD患儿的额部神经元异常放电存在月龄差异。
孤独症谱系障碍;儿童;脑电图;脑电地形图;临床症状
孤独症谱系障碍(ASD)是一组以社会交流和交往缺陷及行为方式、兴趣或活动内容狭隘、重复为主要特征的神经发育障碍疾病的总称,其发病与大脑组织的病理生理学相关联[1]。研究证实,ASD儿童的大脑连接与正常发育的或存在其他发育障碍的儿童明显不同[1]。脑电图有助于了解脑的活动机制、人类的认知过程和诊断脑部疾患,脑电地形图较脑电图而言,更直观化、形象化、定量更精确、对病灶的定位更正确,两者各有利弊,所以在临床工作中在常规脑电图的基础上进行脑电地形图检测,综合两者结果的诊断价值更高。在国外脑电图技术已被广泛应用于ASD病因的探索、诊断评估、疗效评定等领域[2-4]。但笔者见目前国内尚无对ASD儿童的脑电特征进行系统分析的研究。在本研究中,笔者对17~84月龄的ASD儿童的脑电特征进行了分析,以期为疾病的早发现、干预提供参考依据。
对象与方法
一、研究对象
2011年3月至2013年3月在中山大学附属第三医院儿童发育行为中心就诊的、符合美国精神障碍诊断和统计手册(DSM-Ⅳ) 的诊断标准被确诊为ASD的41例17~84月龄的患儿为研究对象,其中男32例、女9例,男女比例为3.6∶1;月龄(42.4±15.6)月;右利手35例,左利手6例。按常规脑电图检测结果将患儿分为正常睡眠脑电图组(正常组)及异常睡眠脑电图(异常组)。正常组28例,男20例、女8例,男女比例2.5∶1,月龄(41.0±12.5)月;异常组13例,男12例、女1例,男女比例为12∶1,月龄(45.5±21.1)个月,将异常组按月龄分为<36月、36~60月、>60月3组,其中<36月组5例,36~60月组5例,>60月组3例。2组的性别、月龄比较差异均无统计学意义(P>0.05),具有可比性。所有患儿均无抽搐病史,并排除合并结节性硬化、儿童精神分裂症、儿童多动症、明显的中枢神经系统损伤等疾病[4]。在进行本研究前所有患儿均未接受任何精神类药物治疗,所有家长对本研究知情同意。
二、方法
1.常规脑电图检测
所有检测均在中山大学附属第三医院脑电图室进行。所有患儿均完成常规脑电图检测(扫描前半小时均口服水合氯醛镇静)。采用16导联脑电图仪,按国际10-20系统电极放置法标准安放头皮电极,低频滤波0.5 Hz,走纸速度3 cm/s,高频滤波70 Hz,进行常规单、双导联描记。
2.脑电地形图检测
对13例异常脑电图进行脑电地形图检测,为便于定位,将脑电波幅随时间的变化转化为脑电波功率随时间的变化,从而可直接观察δ、α、β、θ频段脑电波的分布与变化情况,不同的颜色表示功率由低到高,逐级递增,色级越大,功率值越大,红色覆盖的面积及扩展的区域反映病灶区高能量改变的范围。
3.量表工具
家长均根据患儿日常行为填写孤独症治疗评估量表(ATEC),该量表有77个选项,分4个主题分量表:说话/语言/交流;社交;感觉/知觉;健康/身体/行为,总分为0~179分,可通过分量表分值和量表总分值评估ASD样症状的严重程度,分值越高,则症状越严重[5]。
三、统计学处理
结 果
一、正常组与异常组常规脑电图情况及ATEC评分
41例常规脑电图检测异常率为31.7%(13/41)。异常组的常规脑电图检测均显示在δ频段出现尖波,为亚临床癫痫样放电(仅脑电图出现癫痫样放电但无临床发作不能诊断为癫痫)。正常组ATEC评分为(73.4±23.4)分,异常组为(63.5±24.2)分,2组比较差异无统计学意义(P>0.05),见表1。
二、异常组脑电波频段功率值与ATEC量表评分的相关性
异常组右前颞区(T4)的δ频段绝对功率值与ATEC感觉/知觉评分呈正相关(r=0.575,P=0.040),表示右前颞区δ频段绝对功率值越高,ATEC感觉/知觉评分越高,即感知觉障碍越严重;其余部位的脑电波频段绝对功率值与ATEC评分无明显相关性。见表2。
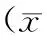
表1 正常组与异常组ATEC评分比较±s) 分
表2 异常组各脑区脑电波绝对功率值(μV2)与ATEC评分的相关性
续表

部 位说话/语言/交流r/rsP值社 交r/rsP值感觉/知觉r/rsP值健康/身体/行为r/rsP值总 分r/rsP值 左后颞区δ0.188a0.539-0.246a0.4180.049a0.873-0.248a0.413-0.050a0.872 左后颞区θ-0.094a0.760-0.135a0.659-0.121a0.694-0.212a0.486-0.129a0.674 左后颞区α0.1160.7060.014a0.9640.0850.782-0.0190.9510.0140.963 左后颞区β0.4140.1600.285a0.3460.4480.125-0.0550.8580.2900.337 右后颞区δ0.254a0.402-0.116a0.7060.264a0.384-0.077a0.8020.003a0.993 右后颞区θ-0.094a0.760-0.320a0.286-0.110a0.721-0.524a0.066-0.303a0.315 右后颞区α0.0390.901-0.354a0.236-0.1380.652-0.3040.313-0.2050.503 右后颞区β0.2050.501-0.173a0.5720.0200.948-0.3170.292-0.0970.752顶区 左顶区δ-0.044a0.886-0.398a0.178-0.181a0.553-0.185a0.546-0.239a0.431 左顶区θ-0.1740.570-0.041a0.893-0.1870.541-0.1450.636-0.1770.563 左顶区α-0.0770.8010.142a0.6420.0210.9460.3880.1900.1490.627 左顶区β-0.298a0.3220.105a0.733-0.209a0.4940.130a0.673-0.129a0.674 右顶区δ-0.1070.727-0.414a0.159-0.3340.265-0.3110.301-0.3150.294 右顶区θ-0.1040.736-0.113a0.713-0.1230.688-0.2590.393-0.1860.543 右顶区α-0.1130.7140.135a0.6590.0070.9830.3020.3170.1110.717 右顶区β-0.2590.392-0.044a0.886-0.1820.552-0.0250.936-0.1290.674枕区 左枕区δ-0.1640.593-0.337a0.260-0.4150.159-0.2900.337-0.3440.249 左枕区θ-0.2180.475-0.122a0.692-0.3220.284-0.2040.504-0.2560.399 左枕区α-0.227a0.4570.036a0.907-0.192a0.5290.326a0.278-0.058a0.851 左枕区β-0.365a0.2210.014a0.964-0.286a0.3440.099a0.747-0.215a0.481 右枕区δ0.188a0.539-0.343a0.2520.132a0.668-0.069a0.823-0.014a0.964 右枕区θ-0.1670.585-0.207a0.497-0.2960.325-0.3640.222-0.3360.262 右枕区α-0.221a0.468-0.133a0.666-0.280a0.3540.006a0.986-0.129a0.674 右枕区β-0.2430.424-0.135a0.659-0.1160.7060.0760.805-0.0900.771
注:a为Spearman秩相关结果,b为P<0.05
三、异常组中不同月龄组各部位脑电波频段功率值的差异
方差分析显示,异常组中3个月龄组左右额部的δ频段及θ频段绝对功率值比较差异具有统计学意义(P<0.05),见表3。进一步行组间两两比较显示,左右额部<36月组与36~60月组、36~60月组与>60月组间δ频段绝对功率值比较差异具有统计学意义,<36月组、>60月组δ频段绝对功率值大于36~60月组(P均<0.05/3)。左右额部36~60月与>60月组间θ频段绝对功率值比较差异具有统计学意义, >60月组θ频段绝对功率值大于36~60月组(P均<0.05/3)。各月龄组各部位脑波频段绝对功率值比较见表4。
四、异常组不同用手习惯脑电波各频段功率值的改变
异常组不同用手习惯患儿在各脑区各频段功率值分布的差异(脑电图发生异常的脑区的大脑半球侧化现象)比较无统计学意义(P>0.05),见表5。
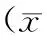
表3 各月龄组各部位脑电波频段绝对功率值比较±s) μV2
续表

部 位<36月(5例)36~60月(5例)>60月(3例)总 数F值P值β频段 左额区30.6±7.138.1±15.052.1±18.038.5±14.82.4700.134 右额区25.6±9.234.0±11.942.6±21.832.7±14.21.5050.268 左中央16.2±4.022.9±8.919.2±6.619.5±7.01.1970.342 右中央13.2±4.819.8±9.717.4±6.716.7±7.51.0100.398 左前颞区10.1±1.612.9±3.69.4±2.411.0±3.02.0620.178 右前颞区6.8±1.47.9±3.28.7±2.57.7±2.40.5380.600 左后颞区6.3±0.96.0±1.25.6±1.26.0±1.00.3380.721 右后颞区5.9±0.95.4±1.85.3±1.25.5±1.30.2440.788 左顶区10.8±1.516.7±6.614.5±6.713.9±5.51.6060.248 右顶区9.9±2.414.3±6.613.2±5.112.3±5.01.0380.389 左枕区8.2±0.511.1±3.512.8±6.010.4±3.61.9730.190 右枕区8.3±1.610.5±3.111.4±54.09.9±2.91.3600.300
注:a为P<0.05
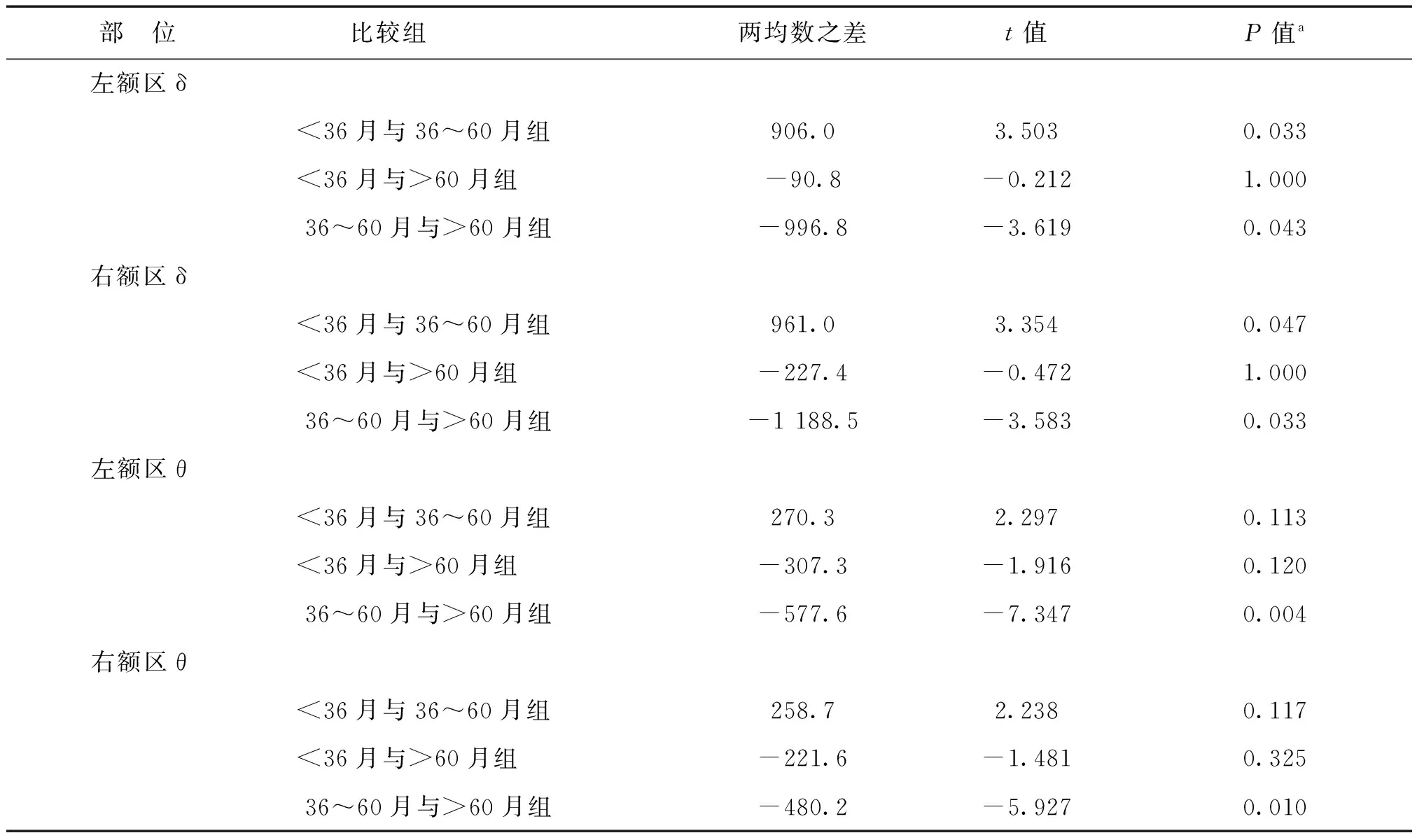
表4 异常组中不同月龄组额部δ、θ频段绝对功率值两两比较 μV2
aP值为软件自动校正后的结果
表5 异常组不同用手习惯各频段绝对功率值的改变±s) μV2
续表

部 位左利手(3例)右利手(10例)t值P值左额区β26.5±7.242.1±14.7-1.7300.112右额区δ1291.0±1037.41230.7±670.70.1220.905右额区θ366.0±294.4511.2±241.7-0.8750.400右额区α45.1±22.871.4±29.5-1.4040.188右额区β22.4±5.135.9±14.7-1.5200.157左中央δ662.0±373.5627.5±315.20.1600.875左中央θ259.0±94.7285.8±95.4-0.4270.677左中央α27.4±8.835.8±14.9-0.9170.379左中央β15.6±5.120.6±7.2-1.1020.294右中央δ678.2±416.5626.9±324.90.2270.825右中央θ203.7±68.0241.5±74.8-0.7800.452右中央α21.0±7.929.4±14.6-0.9260.374右中央β13.0±3.117.8±8.2-0.9740.351左前颞区δ487.1±374.0399.2±256.40.4740.645左前颞区θ181.7±98.9161.1±63.20.4400.668左前颞区α14.5±1.918.4±9.4-0.6960.501左前颞区β9.4±1.411.5±3.2-1.1160.288右前颞区δ159.4±50.5280.4±181.4-1.1110.290右前颞区θ142.6±78.5144.4±67.9-0.0380.970右前颞区α9.3±2.012.7±5.8-0.9590.358右前颞区β6.1±0.48.1±2.5-1.3150.215左后颞区δ355.1±317.4238.7±196.40.7920.445左后颞区θ140.1±86.290.6±50.91.2770.228左后颞区α9.3±2.38.5±2.70.4600.655左后颞区β6.0±0.46.0±1.2-0.0780.939右后颞区δ68.6±31.0206.8±167.2-1.3830.194右后颞区θ129.4±117.691.2±69.00.7260.483右后颞区α6.9±3.17.3±2.7-0.2230.828右后颞区β5.6±1.35.5±1.30.0120.991左顶区δ809.5±512.6788.0±578.80.0580.955左顶区θ277.1±112.5263.2±96.40.2120.836左顶区α18.8±3.624.6±11.8-0.8180.431左顶区β11.1±2.114.7±6.0-0.9940.342右顶区δ776.2±482.1778.1±564.9-0.0050.996右顶区θ232.9±93.1223.2±80.60.1780.862右顶区α16.4±3.320.7±10.0-0.7070.494右顶区β10.0±1.513.0±5.5-0.9150.380左枕区δ874.6±611.2723.9±560.00.4020.695左枕区θ279.2±126.3211.2±105.20.9460.364左枕区α16.1±2.718.2±10.8-0.3260.750
续表

部 位左利手(3例)右利手(10例)t值P值左枕区β9.0±1.010.8±4.0-0.7340.479右枕区δ848.5±696.5639.1±453.70.6280.543右枕区θ231.5±92.5193.0±78.30.7220.486右枕区α14.4±0.416.0±7.8-0.3350.744右枕区β8.7±0.910.2±3.3-0.8080.436
讨 论
一、δ频段功率值改变与临床症状的关系
在本研究中,笔者收集的均为ASD患儿的睡眠脑电图,睡眠脑电图不仅能反映大脑成熟度,而且还能检测没有受外部刺激的动态神经网络[6]。国内报道示30%~80%的ASD患儿的常规脑电图有异常[7]。在本研究中ASD患儿脑电图异常率为31.7%,与该报道基本吻合。
Cantor等[8]发现ASD患儿脑电图在额颞区域显示高功率,在δ频段尤为明显。δ频段与ASD病理相关[9]。Pop-Jordanova 等[10]比较了ASD患儿与正常对照组的脑电活动,发现ASD患儿δ频段功率值增高;Eyler等[11]发现,在语言任务刺激条件下具有ASD风险的婴幼儿右侧颞上回比左侧颞上回激活更强。本研究显示,右前颞区δ频段绝对功率值与ASD患儿的感知觉障碍具有相关性,ASD患儿右前颞区δ频段绝对功率值越高,可能感知觉障碍会越严重。右颞前区涉及颞上沟、颞上回、海马区、杏仁核等。
Gervais等[12]的研究显示,正常人在听到语言时其颞上沟上部区较听到非语言性声音时出现更多的激活,而ASD成年患者处于2种条件下时颞上沟激活均很少;在临床中大多数ASD患儿存在听觉反应异常。研究显示,颞上沟、杏仁核、梭状回与面孔信息加工相关[13-14]。杏仁核在面部情绪、对他人行为中的社会意义的感知方面起重要作用,颞上沟周围脑区同面部动作加工、注视指导的感知相关;杏仁核还负责情绪加工、观点采择、嗅觉学习、社会判断、移情和威胁检测、将接收到的视听觉、本体觉、内脏系统的感觉信息集中等。ASD患儿存在视觉反应异常[14]。海马区主要负责学习、记忆活动、空间定位,为陈述性记忆加工的核心区域,有学者提出智障学者现象,即多数ASD患儿存在与自身能力落后不一致的、相对较好的机械记忆力、音乐能力及方向辨别能力[15]。上述因素与ASD患儿对语言声音反应迟钝、不听指令、对人视而不见、回避目光对视、不惧怕危险、迷恋嗅闻他人及某件物品、对疼痛不敏感、对声音过敏、排斥拥抱、喜欢旋转等感知觉异常行为是否有相关性值得思考。
2012年Dawson等[16]应用丹佛模式对ASD患儿进行早期干预治疗,并用脑电图作为疗效评估方法之一,收效较理想,因此可考虑将脑电图技术应用于判定ASD患儿症状程度、寻找更有效的干预方式、对疗效进行评估。
二、δ、θ频段功率值改变与月龄的关系
大脑的功能连接随年龄而变化,借助任意脑活动模式来发掘潜在的生物标记物可能是对发展时序评估的关键因素[1]。本研究显示脑电图异常的ASD患儿左右侧额部的δ频段绝对功率值在36月后随月龄增长呈逐渐上升趋势,左右侧额部的θ频段绝对功率值在36月后随月龄呈逐渐上升趋势,36月龄是ASD患儿额部脑电波功率值变化的分水岭。
有研究显示,6月龄时ASD高风险儿童的脑电波功率值低于ASD低风险儿童,且最后发展成为ASD患儿的高危儿童在前24个月会表现出跨多个频段的不典型的脑电波动,脑电波功率轨迹的性质差异是ASD的重要内表型[3]。而且与同龄人比较,ASD患儿的社会交往能力会随着年龄的增长而落后[17]。国内学者也发现2~6岁ASD患儿额叶皮质存在神经元丢失或功能下降, 其严重程度与语言、认知障碍等临床表现相关[18]。年龄是决定ASD患儿干预时机及预后的关键;国内学者报道,对≤30月龄ASD患儿进行集中强化治疗,其核心症状改善迅速,生活能力提高较快,语言表达能力出现早,社会交往能力进步也较快[19]。所以探索ASD患儿脑区功能随年龄变化的特征非常必要,遗憾的是本研究没有以相同年龄段的正常儿童作为对照,此点尚需在今后的研究中完善。
三、正常组与异常组ASD患儿临床症状的差别
ASD的临床症状与大脑组织的病理生理学相关联,电现象可阐明大脑病理生理的异常,脑电活动与脑区域、脑状态有着密切的关系,有助于了解人脑信息的处理过程,也是脑功能发育状态的敏感指标,脑电信号蕴含着包括思维、情感、精神及心理等活动的丰富内容,借助脑电图可了解脑活动机制、人类的认知过程和诊断脑部疾病等。本研究借助ATEC评估了脑电图正常及异常ASD患儿的临床症状,结果显示两者差异无统计学意义,考虑与样本量不多使统计效能偏低及观察时间不长有关。国内有学者报道,虽然在综合康复治疗前脑电图异常和正常ASD患儿的临床症状无差异,但治疗前脑电图异常的ASD患儿经治疗后,不但临床症状较治疗前改善,且部分患儿脑电图转为正常,而治疗前脑电图正常的ASD患儿经治疗后临床症状等改善不佳[7]。因此可以考虑将脑电图技术应用于ASD患儿干预方式的选择、疗效及预后的评估。
脑电波与大脑发育、认知能力等密切相关[20]。本研究无分析ASD患儿的头围差异、发育商、智商等多个方面与脑电特征的关系,这些需要在今后的进一步研究中加予补充完善。
[1]Mohammad-Rezazadeh I, Frohlich J, Loo SK, Jeste SS.Brain connectivity in autism spectrum disorder. Curr Opin Neurol, 2016, 29(2): 137-147.
[2]Duffy F.H, Als H. A stable pattern of EEG spectral coherence distinguishes children with autism from neuro-typical controls-a large case control study. BMC Med, 2012, 10: 64.
[3]Tierney AL, Gabard-Durnam L, Vogel-Farley V, Tager-Flusberg H, Nelson CA. Developmental trajectories of resting EEG power: an endophenotype of autism spectrum disorder. PLoS One, 2012, 7(6): e39127.
[4]Kouijzer ME, van Schie HT, Gerrits BJ, Buitelaar JK, de Moor JM. Is EEG-biofeedback an effective treatment in autism spectrum disorders? A randomized controlled trial. Appl Psychophysiol Biofeedback, 2013, 38(1): 17-28.
[5]杨毅,杨阳.运动干预对自闭症儿童的治疗效果分析.中国当代医药, 2016, 23(4): 29-31.
[6]Kurth S, Achermann P, Rusterholz T, Lebourgeois MK. Development of brain EEG connectivity across early childhood: does sleep play a role? Brain Sci, 2013, 3(4): 1445-1460.
[7]邱久军,周利冰,杨俊杰,龚建华. 常规脑电图在儿童孤独症综合康复治疗中的临床价值. 现代电生理学杂志, 2015, 22(2): 76-79.
[8]Cantor DS, Thatcher RW, Hrybyk M, Kaye H. Computerized EEG analyses of autistic children. J Autism Dev Disord, 1986, 16(2): 169-187.
[9]Barttfeld P, Wicker B, Cukier S, Navarta S, Lew S, Sigman M.A big-world network in ASD: Dynamical connectivity analysis reflects a deficit in long-range connections and an excess of short-range connections. Neuropsychologia, 2011,49(2):254-263.
[10]Pop-Jordanova N, Zorcec T, Demerdzieva A, Gucev Z.QEEG characteristics and spectrum weighted frequency for children diagnosed as autistic spectrum disorder. Nonlinear Biomed Phys, 2010, 4(1): 4.
[11]Eyler LT, Pierce K, Courchesne E.A failure of left temporal cortex to specialize for language is an early emerging and fundamental property of autism. Brain, 2012, 135(pt 3): 949-960.
[12]Gervais H, Belin P, Boddaert N, Leboyer M, Coez A, Sfaello I, Barthélémy C, Brunelle F, Samson Y, Zilbovicius M. Abnormal cortical voice processing in autism. Nat Neurosci, 2004, 7(8): 801-802.
[13]Khan S, Gramfort A, Shetty NR, Kitzbichler MG, Ganesan S, Moran JM, Lee SM, Gabrieli JD, Tager-Flusberg HB, Joseph RM, Herbert MR, Hämäläinen MS,Kenet T. Local and long-range functional connectivity is reduced in concert in autism spectrum disorders. Proc Natl Acad Sci U S A, 2013, 110(8): 3107-3112.
[14]张舒琳,李想.孤独症谱系障碍患者对情绪面孔的唤起缺陷:现象,机制及干预. 中国健康心理学杂志, 2016, 24(4): 628-634,635.
[15]邹小兵. 孤独症谱系障碍的研究进展. 临床儿科杂志, 2010, 28(8):715-717,724.
[16] Dawson G, Jones EJ, Merkle K, Venema K, Lowy R, Faja S, Kamara D, Murias M, Greenson J, Winter J, Smith M, Rogers SJ, Webb SJ. Early behavioral intervention is associated with normalized brain activity in young children with autism. J Am Acad Child Adolesc Psychiatry, 2012,51(11): 1150-1159.
[17]Bal E, Yerys BE, Sokoloff JL, Celano MJ, Kenworthy L, Giedd JN, Wallace GL. Do Social Attribution Skills Improve with Age in Children with High Functioning Autism Spectrum Disorders? Res Autism Spectr Disord, 2013, 7(1): 9-16.
[18]邹小兵,曾小璐,胡冰,李建英,唐春.儿童孤独症脑磁共振波谱的病例-对照研究. 中国儿童保健杂志, 2010, 18(1): 5-8.
[19]靳彦琴,姚梅玲,段桂琴,王亚哲,祝秀梅.30个月龄前后孤独谱系障碍患儿治疗效果分析. 中国妇幼保健, 2015, 30(13): 2016-2018.
[20]郑清文,陈凯云,邓红珠,李巧毅,岑超群,邹小兵. 大头围与低年龄孤独症谱系障碍的相关研究. 新医学, 2015,45(9): 584-588.
(本文编辑:洪悦民)
Correlation between electroencephalogram characteristics and clinical symptoms in children with autism spectrum disorder
Zhou Yan, Zhang Gong, Deng Hongzhu, Zou Xiaobing.
Department of Children’s Health Prevention, Anhui Provincial Children’s Hospital, Hefei 230051, China Corresponding Author,Zou Xiaobing, E-mail: zouxb@vip.tom.com
ObjectiveTo analyze the correlation between electroencephalogram (EEG) characteristics and clinical symptoms in children diagnosed with autism spectrum disorder (ASD), aiming to provide reference for early diagnosis and intervention of ASD. MethodsForty one ASD children, aged 17 to 84 months, received routine EEG. All children were divided into the normal EEG (normal group) and abnormal EEG groups (abnormal group) according to the EEG results. Those in the abnormal group further underwent brain electrical activity mapping (BEAM) to analyze the correlation between EEG characteristics and clinical symptoms(according to autism treatment evaluation scale). ResultsAmong 41 children, 28 (68.3%) had normal EEG and 13 (31.7%) yielded abnormal EEG. In the normal group, the mean autism treatment evaluation checklist (ATEC) score was (73.4±23.4), which did not significantly differ from (63.5±24.2) in the abnormal group (P>0.05). In the abnormal group, the δ absolute power at the right anterior temporal region was positively correlated with the consciousness/cognition score of autism treatment evaluation scale (r=0.575, P=0.040). In the abnormal group, the δ absolute power at bilateral frontal region in children aged < 36 months and > 60 months was significantly higher compared with that in those aged between 36 and 60 months. The θ absolute power at bilateral frontal region was significantly higher than that in their counterparts aged 36 to 60 months (both P<0.05/3). ConclusionsThe higher the δ absolute power at the right anterior region, the more severe cognition disorder in ASD children. Abnormal discharge from the frontal neurons differs over age.
Autism spectrum disorder; Children;Electroencephalogram;Brain electrical activity mapping; Clinical symptom
10.3969/j.issn.0253-9802.2016.08.006
国家重点基础研究发展计划(973计划)项目(2012CB517901)
230051 合肥,安徽省儿童医院儿保科(周妍,张功);510630 广州,中山大学附属第三医院儿童发育行为中心(邓红珠,邹小兵)
,邹小兵,E-mail:zouxb@vip.tom.com
2016-04-29)

