HMGB1表达水平对实验性结肠炎小鼠Th1/Tc1细胞反应的影响*
郭向华,黎华辉,周 联,罗 霞,典灵辉,郭润华(.广东医科大学基础医学院,广东 东莞53808;.广州中医药大学药学院,广东广州50006;3.解放军第四一一医院干部病房科,上海0008)
HMGB1表达水平对实验性结肠炎小鼠Th1/Tc1细胞反应的影响*
郭向华1,黎华辉1,周联2,罗霞2,典灵辉1,郭润华3△(1.广东医科大学基础医学院,广东 东莞523808;2.广州中医药大学药学院,广东广州510006;3.解放军第四一一医院干部病房科,上海200081)
目的观察高迁移率族蛋白B1(HMGB1)的表达水平对实验性结肠炎小鼠辅助性T细胞1/细胞毒性T细胞1(Th1/Tc1)细胞反应的影响。方法将BALB/C小鼠分为乙醇对照组、模型组和丙酮酸乙酯(EP)干预组,后两组采用2,4,6-三硝基苯磺酸(TNBS)灌肠建立小鼠结肠炎模型。每天进行疾病活动指数(DAI)评分,于造模后第7天处死小鼠,观察结肠组织病理学损伤情况;流式细胞术分析脾脏、肠系膜淋巴结Th1/Tc1细胞比例的变化,酶联免疫吸附试验(ELISA)法检测血清和结肠组织中HMGB1、干扰素γ(IFN-γ)的表达水平。结果与乙醇对照组比较,模型组小鼠DAI评分、镜下组织病理学损伤评分均明显升高,差异均有统计学意义(P<0.01);同时,外周血和结肠组织中HMGB1、IFN-γ水平,脾脏、肠系膜淋巴结中Th1/Tc1细胞比例也明显高于乙醇对照组,差异均有统计学意义(P<0.01)。与模型组比较,EP干预治疗1周后,EP干预组小鼠血清和结肠组织HMGB1水平明显降低,DAI评分下降,镜下组织病理损伤明显减轻,差异均有统计学意义(P<0.05);伴随脾脏、肠系膜淋巴结Th1/Tc1细胞比例的下降,血清和结肠组织中IFN-γ水平降低,差异均有统计学意义(P0.01)。结论HMGB1可作为内源性免疫刺激剂诱导促进Th1/Tc1细胞反应亢进,进而参与实验性结肠炎小鼠的致病。
结肠炎;HMGB1蛋白质;Th1细胞;T淋巴细胞,细胞毒性;干扰素Ⅱ型;三硝基苯磺酸;小鼠
溃疡性结肠炎(ulcerative colitis,UC)与克罗恩病(Crohn′s disease,CD)同属于炎症性肠病(inflammatory bowel disease,IBD),为一组病因未明、发病机制尚不清楚的慢性复发性肠道炎症疾病,现已证实其容易诱发结直肠癌[1-2]。该病近年在我国呈高发趋势,但目前临床尚缺乏有效的治疗手段。因此,深入研究其发病机制并寻求更有效的治疗途径是目前最紧迫的任务。
尽管IBD的发病机制不十分明了,但免疫机制紊乱一直是该病的研究热点[1],辅助性T细胞1/辅助性T细胞2(Th1/Th2)细胞比例失衡已是被广泛认可的发病机制之一。通常认为,CD是以Th1细胞介导的免疫损伤为主,而UC是Th2细胞介导的炎症性疾病[1-2]。近年来有研究发现,炎性细胞因子——高迁移率族蛋白B1 (high mobility group box-1 protein,HMGB1)可通过激活抗原呈递细胞(antigen presenting cell,APC)表面的相应受体,参与Th1、Treg CD4+T细胞的分化调控[3-4]。既往的研究结果显示,HMGB1与IBD的发病过程密切相关[5-6],但具体机制尚不清楚。HMGB1、Th1细胞均参与了IBD的致病,而HMGB1是否通过调控Th1细胞的活化增殖参与IBD致病目前尚鲜见相关报道,因而值得深入研究。本研究以2,4,6-三硝基苯磺酸 (trinitrobenzenesul fonic acide,TNBS)诱导的小鼠结肠炎为基础,应用HMGB1的高效抑制剂——丙酮酸乙酯(ethyl pyruvate,EP)进行体内干预,探讨IBD发病中HMGB1对Th1/Tc1(细胞毒性T细胞1)的调控作用及其分子机制,为进一步揭示IBD的发病机制及新型药物的研发提供理论基础。
1 材料与方法
1.1动物、药品及试剂无特定病原体级(SPF级)BALB/C小鼠30只,均为雌性,6~8周龄,体质量18~22g,购自广东省医学实验动物中心;2.5%TNBS(美国Sigma公司产品),用无水乙醇1∶1混匀稀释而成;EP(美国Sigma公司)以乳酸林格液配置成所需浓度;乳酸钠林格注射液购自安徽双鹤有限公司;小鼠干扰素γ(interfer on-γ,IFN-γ)、小鼠HMGB1 ELISA试剂盒购自杭州联科生物技术有限公司;单克隆抗体PE-Cy7抗小鼠CD3、APC抗小鼠CD8a、PE抗小鼠CD69、PE-Isotype Control、PE抗小鼠IFN-γ购自美国eBioscience公司;BD FACSCanto流式细胞仪购自美国BD公司。
1.2方法
1.2.1造模、给药及标本采集将30只BALB/C小鼠分为乙醇对照组、模型组和EP干预组,每组10只。各组动物禁食24 h,水合氯醛麻醉后,用灌胃针从肛门插入至肠内4 cm,除乙醇对照组灌注50%乙醇100 μL外,其余动物注入2.5%TNBS 100 μL灌肠造模,注入药液后均倒置60 s,然后放回笼中饲养。造模8 h后开始给药,EP干预组每天按100 mg/kg腹腔注射EP溶液,乙醇对照组和模型组每天腹腔注射等量乳酸林格液。造模后第7天处死动物,收集血清及结肠标本以备检测。
1.2.2疾病活动指数(disease activity index,DAI)评分按Okayasu等[7]方法,观察小鼠每天大便性状(是否成形)、体质量变化(较实验开始时小鼠体质量变化百分比)及血便情况,对小鼠进行DAI评分。
1.2.3结肠黏膜病理改变及组织学损伤指数(tissues damage index,TDI)评分动物处死后,迅速剖开腹腔,截取病变明显处结肠,进行苏木精-伊红(hematoxylineosinstaining,HE)常规染色。镜下观察组织学病理变化,分别观察炎症细胞浸润情况及黏膜受累范围、程度等组织学改变,参照文献[8]评分标准,采用双盲法进行TDI评分。
1.2.4外周血IFN-γ及HMGB1测定采集外周血分离血清,采用酶联免疫吸附试验(enzyme linked immunosor bent assay,ELISA)法检测血清HMGB1、IFN-γ水平,按照试剂盒说明操作。
1.2.5肠组织匀浆上清液中IFN-γ及HMGB1检测将新鲜结肠用冷磷酸盐缓冲液(phosphate buffered saline,PBS)清洗干净并称质量,然后迅速转入液氮保存。切取200 mg结肠剪碎后用冰冷生理盐水制成10%结肠组织匀浆,离心后提取上清液,ELISA检测上清液中IFN-γ及HMGB1水平。
1.2.6Th1/Tc1细胞亚群检测采用流式细胞术标本处理方法[9]制备脾脏(spleen,SP)和肠系膜淋巴结(mesenteric lymph node,MLN)单细胞悬液,每组各取5只小鼠进行测定;使用膜抗体CD3、CD8和内标抗体IFN-γ界定Th1/Tc1细胞,即CD3+CD8-IFN-γ+(Th1)/CD3+CD8+IFN-γ+(Tc1)细胞。数据经BD FACSCanto流式细胞仪获取、处理及分析。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠DAI评分及体质量变化比较模型组小鼠于造模后第1天出现少动、厌食、大便稀软,多数动物出现黏液血便,体质量较乙醇对照组明显下降,而DAI评分则显著高于乙醇对照组,差异均有统计学意义(P<0.05)。EP干预组小鼠造模后也出现不同程度的少动,精神、食欲不佳,稀便或软便,体质量减轻等表现,但在给药第3天症状开始减轻,大便逐渐成形,与模型组比较,体质量回升迅速,DAI评分明显降低,差异均有统计学意义(P<0.05)。见表1。
2.2各组小鼠结肠黏膜病理改变及TDI评分比较光镜下见模型组小鼠结肠黏膜明显充血、水肿、糜烂及溃疡,黏膜和黏膜下层有大量淋巴细胞、单核细胞浸润,腺体破坏且结构紊乱,杯状细胞减少,其TDI评分显著高于乙醇对照组,差异有统计学意义(P<0.01)。而EP干预组小鼠结肠黏膜病理损伤明显改善,表现为黏膜及黏膜下炎症细胞浸润减少,腺体破坏及黏膜充血、水肿减轻,TDI评分较模型组显著降低,差异有统计学意义(P<0.05)。见表1、图1。
表1 各组小鼠DAI、TDI评分及体质量变化比较(±s)
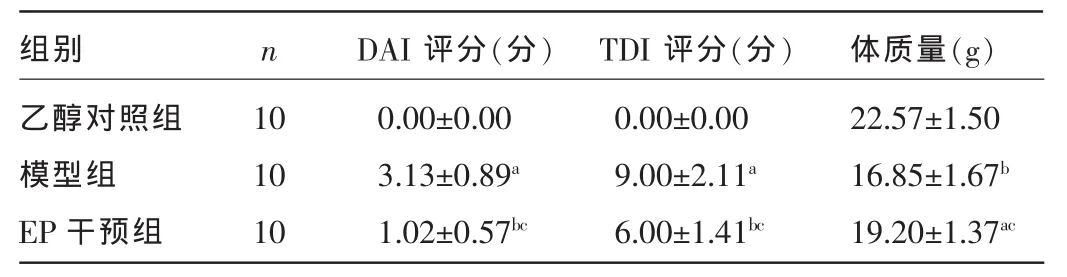
表1 各组小鼠DAI、TDI评分及体质量变化比较(±s)
注:与乙醇对照组比较,aP<0.01,bP<0.05;与模型组比较,cP<0.05。
组别乙醇对照组模型组EP干预组n DAI评分(分) TDI评分(分) 体质量(g)10 10 10 0.00±0.00 3.13±0.89a1.02±0.57bc0.00±0.00 9.00±2.11a6.00±1.41bc22.57±1.50 16.85±1.67b19.20±1.37ac

图1 各组小鼠结肠黏膜病理改变(HE染色,100×)
2.3各组小鼠血清IFN-γ及HMGB1检测结果比较模型组小鼠血清IFN-γ及HMGB1水平较乙醇对照组显著升高(分别升高3倍之多),差异均有统计学意义(P<0.01);应用EP干预治疗1周后,EP干预组血清HMGB1水平较模型组下降50%左右,血清IFN-γ水平也较模型组明显降低,差异均有统计学意义(P<0.01)。见表2。
表2 各组小鼠血清IFN-γ及HMGB1检测结果比较(±s)

表2 各组小鼠血清IFN-γ及HMGB1检测结果比较(±s)
注:与乙醇对照组比较,aP<0.01;与模型组比较,bP<0.01。
组别乙醇对照组模型组EP干预组n IFN-γ(pg/mL) HMGB1(ng/mL)10 10 10 97.17±15.12 312.37±27.64a176.54±31.89ab1.87±1.05 6.72±1.24a3.24±0.47ab
2.4各组小鼠SP及MLN单细胞悬液中Th1/Tc1细胞亚群检测结果比较与乙醇对照组比较,模型组小鼠SP 及MLN单细胞悬液中Th1/Tc1细胞亚群均有所增加,其中Th1细胞在SP中升高明显,Tc1细胞在MLN中变化突出,差异均有统计学意义(P<0.01);与模型组比较,EP干预组小鼠SP及MLN单细胞悬液中 Th1/Tc1细胞亚群呈同步降低,差异均有统计学意义(P<0.05)。见表3。
表3 各组小鼠SP及MLN单细胞悬液中Th1/Tc1细胞亚群检测结果比较(±s,%)

表3 各组小鼠SP及MLN单细胞悬液中Th1/Tc1细胞亚群检测结果比较(±s,%)
注:与乙醇对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
组别n SP Th1细胞 Tc1细胞MLN Th1细胞 Tc1细胞乙醇对照组模型组EP干预组1.07±0.35 4.42±0.62a2.42±0.25c5 5 5 1.83±0.48 5.54±0.79a3.15±0.56c1.21±0.25 3.47±0.51a1.82±0.25b0.81±0.25 2.66±0.36a1.23±0.23b
2.5各组小鼠结肠组织匀浆上清液中HMGB1及IFN-γ水平比较与乙醇对照组比较,模型组小鼠结肠组织匀浆上清液中HMGB1及IFN-γ水平均显著增加,差异均有统计学意义(P<0.01);与模型组比较,EP干预组小鼠结肠组织匀浆上清液中HMGB1及IFN-γ水平明显降低,差异均有统计学意义(P<0.05)。见表4。
表4 各组小鼠结肠组织匀浆上清液中HMGB1及IFN-γ水平比较(±s)

表4 各组小鼠结肠组织匀浆上清液中HMGB1及IFN-γ水平比较(±s)
注:与乙醇对照组比较,aP<0.01;与模型组比较,bP<0.05。
组别乙醇对照组模型组EP干预组n IFN-γ(pg/mL)HMGB1(ng/mL)5 5 5 115.94±23.58 388.62±24.72a254.20±36.43b0.18±0.02 0.41±0.05a0.23±0.03b
3 讨 论
HMGB1是20世纪70年代在小牛胸腺中鉴定得到的一种核内非组蛋白染色体结合蛋白,因其在凝胶电泳中迁移率快而得名[10]。HMGB1通常主要位于细胞核内,但在一些免疫细胞活化或实质细胞损伤、死亡时,核内的HMGB1即可主动或被动释放至细胞质乃至细胞外,一旦进入细胞外即可作为一种重要的炎性细胞因子,在脓毒症、急性胰腺炎、类风湿关节炎、系统性红斑狼疮等重症炎症及自身免疫性疾病中发挥重要作用[11-12]。有研究发现,IBD小鼠血清及结肠组织中HMGB1明显升高,结肠黏膜病理损伤严重;而HMGB1中和抗体或其抑制剂——EP的应用可以明显减轻肠道炎性反应[5-6]。提示HMGB1与IBD的发病密切相关,HMGB1可能成为IBD治疗的新靶点。
根据T淋巴细胞表面分化抗原的不同,可将其分为CD4+细胞和CD8+细胞亚群。前者又称为Th细胞,后者又称为Tc细胞。Th1细胞属于CD4+细胞的一个亚群,以分泌IFN-γ为特征,Th1细胞过度反应可导致迟发性超敏反应和多种自身免疫性疾病。与Th细胞分化相似,1995年Sad等[13]将能分泌Th1型细胞因子的CD8+T细胞命名为Tc1。在很多情况下,由于Tc1和Th1功能相关,因而常会把Tc1细胞也称为Th1样细胞。有研究表明,Tc1亚群可通过分泌Th1型细胞因子在某些炎症及自身免疫性疾病的发生、发展中起重要作用[14]。本研究采用TNBS/乙醇诱导的小鼠结肠炎模型,其肠道组织学变化趋向于人类的CD,引发以Th1型为主的免疫炎性反应[1]。现已基本明确,HMGB1可作为内源性免疫佐剂通过与APC表面的受体结合,参与Th1 CD4+T细胞的分化调控[3]。然而,HMGB1调控Th1/Tc1细胞反应是否参与了TNBS结肠炎小鼠的致病,目前仍鲜见相关报道。因此,本研究以TNBS灌肠诱导小鼠结肠炎为模型,应用HMGB1抑制剂——EP进行体内干预,探索CD发病中HMGB1对Th1/Tc1细胞的调控作用。结果发现,TNBS灌肠1周后,模型组小鼠结肠组织病理损伤严重,其DAI评分、TDI评分均显著高于乙醇对照组;ELISA法检测结果显示,血清及结肠组织中HMGB1、Th1型细胞因子——IFN-γ表达水平均明显升高;SP和MLN中Th1/Tc1细胞也同比升高,提示HMGB1与Th1/Tc1细胞反应均参与介导了CD小鼠的发病过程,与文献报道一致[15-16]。为了验证HMGB1可能是通过调控Th1/Tc1细胞反应参与TNBS结肠炎小鼠致病,本研究进一步应用HMGB1抑制剂——EP进行体内干预,结果发现,结肠炎小鼠血清和结肠组织中HMGB1水平降低的同时,还伴随结肠病理损伤的明显减轻,SP、MLN中Th1/Tc1细胞下调,以及血清和结肠组织中IFN-γ水平降低。表明HMGB1确实能够通过促进Th1/Tc1细胞反应参与TNBS结肠炎小鼠的致病。
综上所述,本研究结果证实,HMGB1能够通过促进Th1/Tc1细胞反应参与CD小鼠的发病过程。其具体机制可能是:IBD小鼠由于肠道免疫细胞过度活化,组织细胞损伤、坏死,使HMGB1主动或被动释放增加,HMGB1可作为内源性免疫激活剂通过活化APC并促使其分泌Th1/Tc1细胞的诱导因子——IFN-γ或白介素-12等,在其作用下,Th1/Tc1细胞大量活化、功能亢进,进而通过介导炎症瀑布反应直接参与IBD的致病。
[1] Malik TA.Inflammatory bowel disease:historical perspective,epidemiology,and risk factors[J].Surg Clin North Am,2015,95(6):1105-1122.
[2] Munkholm P.Review article:the incidence and prevalence of colorectal cancer in inflammatory bowel disease[J].Aliment Pharmacol Ther,2003,18(Suppl 2):S1-5.
[3]Messmer D,Yang H,Telusma G,et al.High mobility group box protein 1:an endogenous signal for dendritic cell maturation and Th1 polarization[J]. J Immunol,2004,173(1):307-313.
[4]Zhu XM,Yao YM,Liang HP,et al.High mobility group box-1 protein regulate immunosuppression of regulatory T cells through toll-like receptor 4[J].Cytokine,2011,54(3):296-304.
[5]Maeda S,Hikiba Y,Shibata W,et al.Essential roles of high-mobility group box 1 in the development of murine colitis and colitis-associated cancer[J]. Biochem Biophys Res Commun,2007,360(2):394-400.
[6]Davé SH,Tilstra JS,Matsuoka K,et al.Ethyl pyruvate decreases HMGB1 release and ameliorates murine colitis[J].J Leukoc Biol,2009,86(3):633-643.
[7]Okayasu I,Hatakeyama S,Yamada M,et al.A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J]. Gastroenterology,1990,98(3):694-702.
[8]McCarthy J.Double blind,placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance[J].Gut,2003,52(7):975-980.
[9]Guo X,Guo R,Luo X,et al.Ethyl pyruvate ameliorates experimental colitis in mice by inhibiting the HMGB1-Th17 and Th1/Tc1 responses[J].Int Immunopharmacol,2015,29(2):454-461.
[10]Bustin M.Regulation of DNA-dependent activities by the functional motifs of the high-mobility-group chromosomal proteins[J].Mol Cell Biol,1999,19(8):5237-5246.
[11]Li G,Wu X,Yang L,et al.TLR4-mediated NF-κB signaling pathway mediates HMGB1-induced pancreatic injury in mice with severe acute pancreatitis[J].Int J Mol Med,2016,37(1):99-107.
[12]Tsung A,Tohme S,Billiar TR.High-mobility group box-1 in sterile inflammation[J].J Intern Med,2014,276(5):425-443.
[13]Sad S,Marcotte R,Mosmann TR.Cytokine-induced differentiation of precursor mouse CD8+T cells into cytotoxic CD8+T cells secreting Th1 or Th2 cytokines[J].Immunity,1995,2(3):271-279.
[14]Delfs MW,Furukawa Y,Mitchell RN,et al.CD8+T cell subsets TC1 and TC2 cause different histopathologic forms of murine cardiac allograft rejection[J].Transplantation,2001,71(5):606-610.
[15]Rakoff-Nahoum S,Bousvaros A.Innate and adaptive immune connections in inflammatory bowel diseases[J].Curr Opin Gastroenterol,2010,26(6):572-577.
[16]Strober W,Fuss I,Mannon P.The fundamental basis of inflammatory bowel disease[J].J Clin Invest,2007,117(3):514-521.
Effects of HMGB1 expression level on Th1//Tc1 cellular response in experimental colitis mice*
Guo Xianghua1,Li Huahui1,Zhou Lian2,Luo Xia2,Dian Linghui1,Guo Runhua3△(1.College of Basic Medicine,Guangdong Medical University,Dongguan,Guangdong 523808,China;2.School of Chinese Materia Medica,Guangzhou University of Chinese Medicine,Guangzhou,Guangdong 510006,China;3.Department of Cadre′s Ward,411 Hospital of PLA,Shanghai 200081,China)
ObjectiveTo investigate the expression level of high-mobility group box 1 protein(HMGB1)on helper T1/ cytotoxic T cell 1(Th1/Tc1)in experimental colitis mice.MethodsThe BALB/c mice were randomly divided into ethanol control group,model group and ethyl pyruvate(EP)intervention group.The colitis model in the latter two groups was induced by the enema of 2,4,6-trinitro-benzene sulfonic acid(TNBS).The disease activity index(DAI)score was daily evaluated.Mice were killed on 7 d after model construction.The colonic tissue pathological damage situation was observed.The flow cytometry was applied to examine the percentages of Th1//Tc1 cells in spleen as well as in mesenteric lymph nodes(MLN).The blood and colonic tissue expression levels of HMGB1 and IFN-γ were measured by ELISA.ResultsThe DAI and microscopic histopathological damage score in the model group were significantly increased compared with the ethanol control group(P<0.01);meanwhile the levels of HMGB1 and IFN-γ in peripheral blood and colonic tissue and the percentages of Th1//Tc1 cells in spleen and MLN were significantly higher than those in the ethanol control group,the differences were statistically significant(P<0.01).After 1 week EP intervention,the HMGB1 level in serum and colonic tissue in the EP intervention group was significantly decreased,the DAI score was declined and microscopic histopathologic damage was obviously alleviated,the differences were statistically significant(P<0.05);with the percentage decrease of Th1/Tci cells in spleen and MLN,serum and colonic tissue IFN-γ expression was decreased,the difference was statistically significant(P<0.01).ConclusionHMGB1 may serve as the endogenous immunologic stimulant to induce and promote Th1/Tc1 cell hyperreaction,thus involves in pathogenesis of experimental colitis mice.
Colitis;HMGB1 protein;Th1 cells;T-lymphocytes,cytotoxic;Interferon typeⅡ;Trinitrobenzenesulfonic acid;Mice
10.3969/j.issn.1009-5519.2016.13.007
A
1009-5519(2016)13-1973-03
中央财政支持地方高校发展专项资金资助项目[276(2014)];广东省科技计划项目(2014A020212457);广东省中医药局科研基金资助项目(20132209);广东医科大学博士启动基金资助项目(2XB13094)。
郭向华(1972-),博士研究生,讲师,主要从事炎症免疫性疾病的免疫药理研究。
△,E-mail:370291797@qq.com。
(2016-04-13)

