田菁茎瘤固氮根瘤菌对小麦叶组织的促生作用研究
陈永超,齐怀廷,王小晶,李 强,刘华伟
(西北农林科技大学 生命科学学院,陕西 杨陵 712100)
田菁茎瘤固氮根瘤菌对小麦叶组织的促生作用研究
陈永超,齐怀廷,王小晶,李强,刘华伟*
(西北农林科技大学 生命科学学院,陕西 杨陵 712100)
利用GFP标记的田菁茎瘤固氮根瘤菌(AzorhizobiumcaulinodansORS 571)侵染露白24 h的小麦种子,分别在侵染后0、6、12、24、48、72和96 h采样,利用实时荧光定量PCR方法检测小麦体内6条与促生作用相关miRNAs(miR156、miR159、miR160、miR167、miR168和miR403)的表达模式,检测其中3条miRNAs(miR159、miR167和miR168)的靶基因表达模式;以接菌8 d 的小麦样品做切片,利用激光共聚焦显微镜检测小麦叶部田菁茎瘤固氮根瘤菌的分布,并测定小麦的生理指标。结果显示:(1)田菁茎瘤固氮根瘤菌侵染小麦后能够在叶片边缘部位定殖。(2)小麦叶片中与促生作用相关的6条miRNAs出现了不同程度变化,在12~24 h到达其峰值,随后逐渐下降,其中miR159在峰值时的表达量为初始表达量的2.88倍。(3)3条miRNAs的靶基因表达模式与相应miRNA表达模式相对应,但并不严格。(4)生理指标测定结果显示,接种田菁茎瘤固氮根瘤菌对小麦叶片产生明显的促生作用,其中叶鲜重在96 h的变化与对照差异极显著。研究表明,接种的田菁茎瘤固氮根瘤菌能够到达小麦叶组织,对小麦叶片的生长产生明显的促生作用,其中miRNAs在促生过程中发挥重要作用。
小麦;田菁茎瘤固氮根瘤菌;促生作用;miRNA
根瘤菌是能与豆科寄主共生,形成根瘤并固定空气中的氮气供植物营养的一类杆状细菌。田菁茎瘤固氮根瘤菌(AzorhizobiumcaulinodansORS 571)属于固氮根瘤菌属,在其天然寄主豆科植物田菁(Sesbaniarostrata)的根部和茎部结瘤固氮,共生固氮效率高,且对氧的要求低于其他根瘤菌,是研究根瘤菌与非豆科植物相互作用的理想材料[1-2]。当其作为一种植物根际促生菌时,能够将分子态氮转换为植物可利用的氨态氮形式,促进互作植物的生长,增强互作植物抗逆境胁迫能力,提高互作植物对病原菌的免疫力[3]。田菁茎瘤固氮根瘤菌侵染小麦后能够在其体内定殖,也能够在2,4-D、类黄酮等诱导产生的类根瘤中定殖[1,3]。但田菁茎瘤固氮根瘤菌侵染小麦后如何发挥其促生作用却一直没有得到合理的解释。
miRNA属于小RNA(small RNA)的一种,长度约为22 nt,由RNA聚合酶Ⅱ转录,再由RNase Ⅲ的核酸内切酶Dicer加工产生。miRNA能够与RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)结合,识别其靶mRNA,并通过两种方式调节靶基因的表达:如果miRNA与mRNA完全互补,miRNA即引导mRNA特异性切割;如果两者没有足够的互补性,则引起翻译抑制[4]。miRNA作为主要调控因子参与植物整个生长发育进程的调控[5],处于基因表达调控的中心位置,可在不同层次上对靶基因进行调控[6]。
李强[3]研究了接种田菁茎瘤固氮根瘤菌小麦根部相关 miRNAs的表达变化,但接菌小麦叶组织相关miRNAs的表达变化尚未报导。本研究在室内限菌条件下利用GFP标记田菁茎瘤固氮根瘤菌侵染小麦种子,利用实时荧光定量PCR研究田菁茎瘤固氮根瘤菌侵染小麦幼苗叶中与促生作用相关miRNAs及其靶基因的表达变化,用激光共聚焦显微镜检测了接菌8 d小麦叶片中田菁茎瘤固氮根瘤菌的分布情况,并测定了小麦叶片的生理指标,为深入研究田菁茎瘤固氮根瘤菌对小麦的促生机制,更好地将其应用于农业生产提供依据。
1 材料和方法
1.1材料
1.1.1小麦品种和接种菌株小麦品种‘小偃22’由西北农林科技大学农学院赵继新博士提供。GFP标记的田菁茎瘤固氮根瘤菌由本实验室保存。
1.1.2培养基与条件TY液体培养基:胰蛋白胨(Tryptone) 5 g/L、酵母粉(Yeast Powder)3 g/L、二水合氯化钙(CaCl2·2H2O)0.88 g/L,pH 7.4,121 ℃灭菌20 min,用于田菁茎瘤固氮根瘤菌的活化与扩大培养。PBS缓冲液:KH2PO40.24 g/L,KCl 0.2 g/L,NaCl 8 g/L,Na2HPO41.44 g/L,pH 7.4,121 ℃灭菌20 min,用于田菁茎瘤固氮根瘤菌菌液的重悬浮与稀释。琼脂粉-水固体培养基:1 L水加琼脂粉5 g,121 ℃灭菌20 min,用于小麦种子预培养。1/2Hogland培养基配方参照迟峰[8]的方法。培养基质:清洗石英砂,180 ℃烘烤4 h,待降到室温后分装至1 L的三角瓶。每瓶加350 mL石英砂和50 mL 1/2Hogland营养液,121 ℃灭菌20 min,用于小麦种子的接菌培养。
1.2方法
1.2.1小麦种子消毒、萌发及接菌处理选取籽粒饱满、均匀一致的小麦种子,用1%次氯酸钠浸泡10 min,用无菌水冲洗3遍;再用70%酒精浸泡30 s,无菌水冲洗3遍,完成表面消毒。参照Senthilkumar方法将表面消毒的小麦种子均匀置于大三角瓶中事先灭菌的琼脂粉-水固体培养基上,腹沟朝下,胚朝向同一个方向,28 ℃萌发1 d,检查表面消毒是否彻底[9]。消毒后的种子整齐摆放在培养皿内灭菌的滤纸上,腹沟朝下,加入适量的无菌蒸馏水,置于黑暗条件下待其萌发露白。
田菁茎瘤固氮根瘤菌的复苏与扩大培养:在小试管中加5 mL TY液体培养基,再加5 μL氨苄青霉素,挑入单菌田菁茎瘤固氮根瘤菌落,28 ℃ 200 r/min恒温培养48 h使其活化。将活化的菌液按2%比例加到大三角瓶TY液体培养基中,扩大培养至对数生长期(OD600=0.6-0.8)。
参照李强[3]的方法,在无菌条件下将露白24 h的小麦种子移载到大三角瓶事先灭好菌的石英砂中,将20 mL田菁茎瘤固氮根瘤菌PBS稀释液均匀加到‘小偃22’种子周围;以等体积无菌PBS缓冲液处理同批平行露白小麦种子作为对照,用无菌透气封口膜封住瓶口,放入光照培养箱培养并开始计时。培养条件: 光照16 h,光强4级,温度25 ℃,相对湿度46%;黑暗8 h,光强0级,温度18 ℃,相对湿度37% 。
1.2.2样本采集分别在0、6、12、24、48、72和96 h等不同时间点取样,对照组与处理组同步进行。先采集0 h的小麦样品,在接菌处理后6、12、24、48、72和96 h等不同时间点分别取样,每个样品做3个重复,平行对照组同步进行。样品于液氮中迅速冷冻,-80 ℃冷冻保存。接菌处理8 d后将全部样品取出,除去黏连的石英砂,用自来水清洗表面3遍,自然风干后挑选有代表性的样品进行激光共聚焦检测,其余样品用直尺测量其叶长,用电子天平测量其地上部分鲜重。测量结果用Excel 2013绘制相应曲线,用IBM SPSS Statistics 22进行统计学分析[10]。
1.2.3小麦叶组织根瘤菌的激光共聚焦检测将选取的用以检测田菁茎瘤固氮根瘤菌分布的小麦叶组织样品进行徒手切片,滴加50%甘油盖上盖玻片后用凡士林封片。首先用10×物镜观察样品,找到需要检测的区域,然后对检测区域照射488和561 nm激光。GFP荧光信号由488 nm激光激发产生,小麦组织的自发荧光信号由561 nm 激光激发产生。在操作面板上以恰好能看到叶片组织为原则确定其z轴的上下界,由系统自动生成最佳的层距间隔和层数,从样品表面由上到下逐层进行扫描,采集图像信号。在扫描得到的不同层照片间选择最具代表性的图像,使用软件 FV10-ASW 3.1调整相应的参数,对样品图像进行保存。
1.2.4小麦叶片总RNA的提取及miRNA的反转录小麦叶片总RNA采用Trizol(Invitrogen)法提取。提取总RNA使用One Step PrimeScript®miRNA cDNA Synthesis Kit(宝生物工程有限公司,大连)试剂盒进行miRNA3’加poly A尾巴和反转录两个过程。反应体系为20 μL,包括3 μL总RNA,10 μL 2×miRNA Reaction Buffer Mix,2 μL 0.1% BSA和2 μL miRNA PrimeScript®RT Enzyme Mix。反应条件为37 ℃ 1 h,然后85 ℃ 5 s。反转录产物保存于-20 ℃。
1.2.5miRNAs表达模式使用SYBR®Premix ExTaqTMⅡ(宝生物工程有限公司,大连)试剂盒在CFX96 Real-Time System(Bio-Rad,USA)仪器上进行实时荧光定量PCR反应,使用β-tublin作为内参基因,miRNA的正向引物和通用反向引物由上海生工公司合成(表1)。反应体系为25 μL,包括1 μL cDNA、1 μL(10 μmol/L)miRNA上游引物、1 μL(10 μmol/L)下游引物、12.5 μL SYBR Premix Ex Taq和9.5 μL ddH2O。反应条件为:95 ℃ 30 s,95 ℃ 5s,60 ℃ 30 s,40个循环。将RT-PCR产物的温度从45 ℃上升到95 ℃,每升高0.5 ℃测定1 次荧光值,最后由仪器生成溶解曲线,根据溶解曲线验证反应产物的特异性。每个样品设置3个重复,每次反应均设置1个无模板对照。实时荧光定量的miRNA表达量采用相对定量法,即2-ΔΔCt法进行处理[11]。

表1 实时荧光定量PCR引物序列
1.2.6miRNAs的靶基因表达模式使用psRNATarget在线软件预测其中3条miRNA的靶基因,在CNKI中查找对应的基因序列并使用primer BLAST设计引物。以GAPDH作为内参基因,所有基因的正向引物和反向引物由上海生工公司合成(表1)。反转录使用GoScriptTMReverse Transcriptase(Promega,美国)及配套的试剂,以oligo(dT)15为引物;实时荧光定量PCR使用GoTaq®qPCR Master Mix(Promega,美国)试剂盒在CFX96 Real-Time System(Bio-Rad,USA)仪器上进行。反应体系为20 μL,包括4 μ LcDNA,0.8 μL上下游引物,10μL GoTaq®qPCR Master Mix和5.2 μL Nuclease-Free Water。反应条件和计算方法与1.2.5描述一致。
2 结果与分析
2.1小麦叶内田菁茎瘤固氮根瘤菌的激光共聚焦检测
GFP荧光蛋白在488 nm的激发光照射下能发出绿色的荧光。用激光共聚焦显微镜观察处理后的小麦叶片组织,发现GFP标记的田菁茎瘤固氮根瘤菌发出的绿色荧光集中在叶片边缘部位,其他部位为红色(图1),说明田菁茎瘤固氮根瘤菌能够到达小麦叶片,并在叶片边缘部位定殖。
2.2接菌小麦叶组织与促生作用相关miRNAs的表达模式
实时荧光定量PCR检测结果表明,接种田菁茎瘤固氮根瘤菌小麦叶片与促生作用相关的miRNAs表现出了不同的表达模式(图2)。miR156在接菌后表达量随之波动,首先在6 h下调到初始表达量的0.36倍,随后又在24 h达到其峰值(1.78倍),最后逐渐恢复到初始表达量的0.42倍。miR159在接菌12 h内相对稳定,但在24 h升到初始表达量的2.88倍,之后迅速回落,并在96 h降低到初始表达量的0.40倍。miR160在接菌6 h内相对稳定,在12h达到其峰值(1.54倍),之后逐渐下调到初始表达量的0.60倍。miR167在接菌6 h内表达量下调,但在12 h逐渐上升,并在24 h恢复到初始水平,随后又下调,在96 h为初始表达量的0.20倍。miR168的表达变化较为剧烈,其表达量在接菌后略微下调,在12 h升到最大值(1.98倍)后逐渐降落,在96 h为初始表达量的0.16倍。miR403的表达量则在接菌后稳步上升,在24 h达到初始表达量的1.77倍,随后急剧下调,在96 h为初始表达量的0.31倍。
综上所述,接种田菁茎瘤固氮根瘤菌小麦叶片中与促生作用相关的6条miRNAs在接菌12 h或48 h达到峰值,随后逐步跌落并在96 h达到最低水平。其不同之处在于各miRNA表达量到达峰值后的持续时间和峰值的相对表达量。

图1 GFP标记的田菁茎瘤固氮根瘤菌定殖于小麦的叶片边缘部位Fig. 1 GFP-labeled A. caulinodans ORS 571 colonized in margin area of wheat leaves
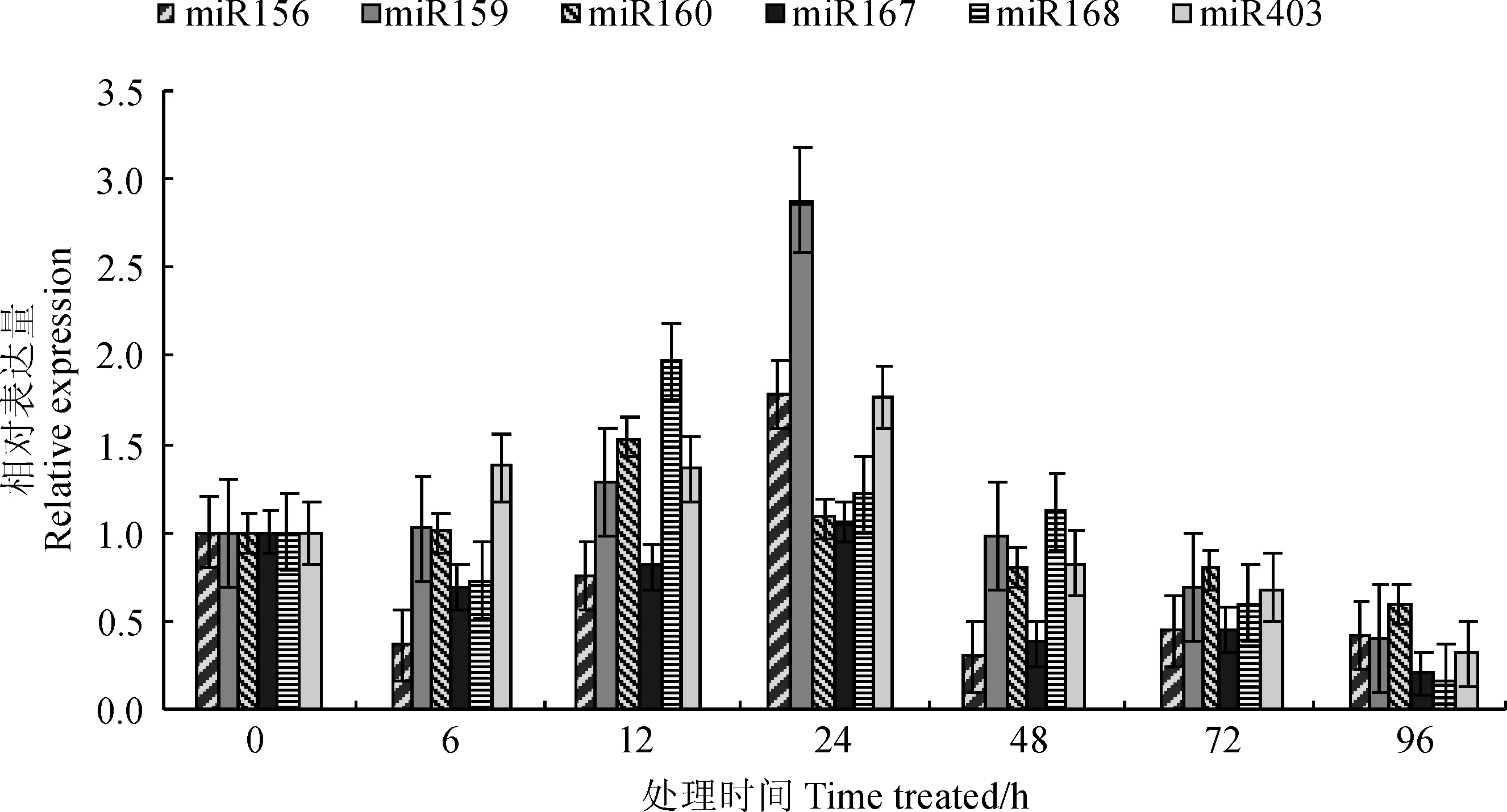
miRNAs在各时间点的表达量均相对于其0 h的初始表达量(设定为1)进行计算图2 接种田菁茎瘤固氮根瘤菌的小麦叶组织与促生作用相关miRNAs在不同时间点的表达模式All expression data were calculated based on the score of 0-pionts which were set as 1Fig. 2 The expression pattern of miRNAs in different time points relating to the growth-promoting effect of wheat leaves inoculated by A. caulinodans ORS 571
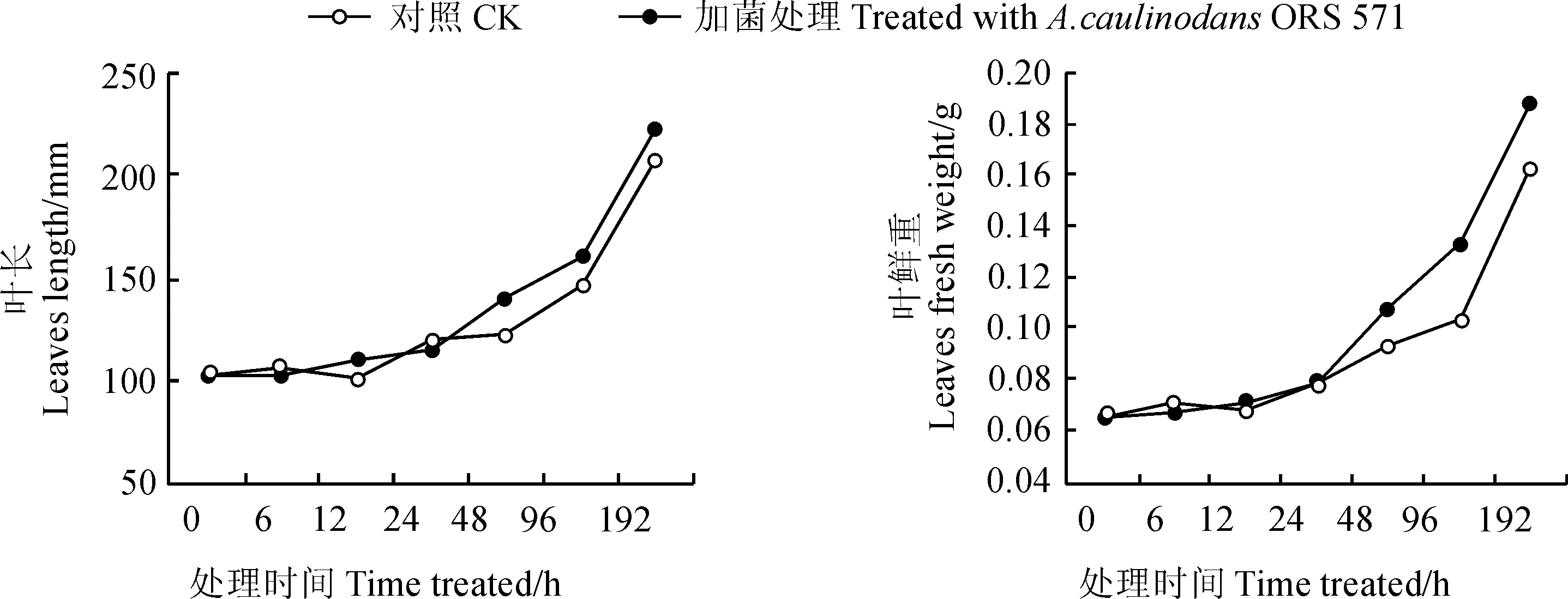
图3 接种田菁茎瘤固氮根瘤菌后叶长和叶鲜重的变化Fig. 3 Change of leaf length and leaf fresh weight of leaves after adding GFP-labeled A. caulinodans ORS 571
2.3接菌小麦叶部生理指标分析
在用田菁茎瘤固氮根瘤菌接种小麦后,分别在取样的各个时间段测量小麦叶长度、叶鲜重等生理指标(图3),测定结果表明,接菌小麦的叶长和叶鲜重均发生明显变化,其中叶鲜重在96 h的变化差异极显著(P<0.01)。
2.4小麦叶组织促生相关miRNAs的靶基因表达分析
实时荧光定量PCR检测结果表明,促生作用相关的miRNAs靶基因表达在处理后发生了较大的变化(图4)。其中miR159的靶基因TaMyb3在6和12 h的表达都受到了抑制,在48 h后达到表达峰值,为初始表达量的3.10倍,而在96 h则逐渐恢复到相对较低的表达水平(2.19倍);miR167的靶基因OsARF8的表达量则在12 h内相对平稳,在24 h达到峰值(6.78倍),随后一直保持较高的表达水平。miR168的靶基因OsAGO1在6与12 h的表达量都稍高于初始表达量,而OsAGO1在24 h达到表达峰值(9.50倍)后逐步下降到初始表达量的2.04倍。
3 讨 论
3.1根瘤菌在小麦叶片部位的共聚焦检测
李强[3]研究表明,田菁茎瘤固氮根瘤菌能够定殖于小麦的根表皮和细胞间,同时也能向上迁移至小麦叶片部位。本研究使用激光共聚焦显微镜检测小麦叶片GFP标记田菁茎瘤固氮根瘤菌的荧光,在叶片边缘处观测到大量GFP标记田菁茎瘤固氮根瘤菌,表明田菁茎瘤固氮根瘤菌能够定殖于小麦的叶片组织。
3.2接菌小麦叶部促生作用相关 miRNAs 表达分析
miR156负调控其靶基因SBP-box(Squamosa promoter binding protein),或称SPL(SQUAMOSA Promoter-binding protein-like)。该基因是植物特有的一类转录因子,广泛参与植物生长发育[12], 如叶片发育[13]、生长时期转换[14]、抗逆[15]和植物株型[16]等。在玉米中miR156调控幼年期到成年期的转变,并调控成年期表皮细胞的形成[17];在水稻中miR156调控幼年期到成年期的转变[18]。本研究中,miR156在接菌处理后下调,随后又逐渐上升,最后又下调,表明接种田菁茎瘤固氮根瘤菌引起了miR156对小麦SPLs等靶基因家族的调控,加速了小麦幼年期到成年期的转变进程,从而发挥了促生的作用,从生理指标来看,在接菌24 h后小麦叶片的鲜重和长度变化都有了较为明显的增加。
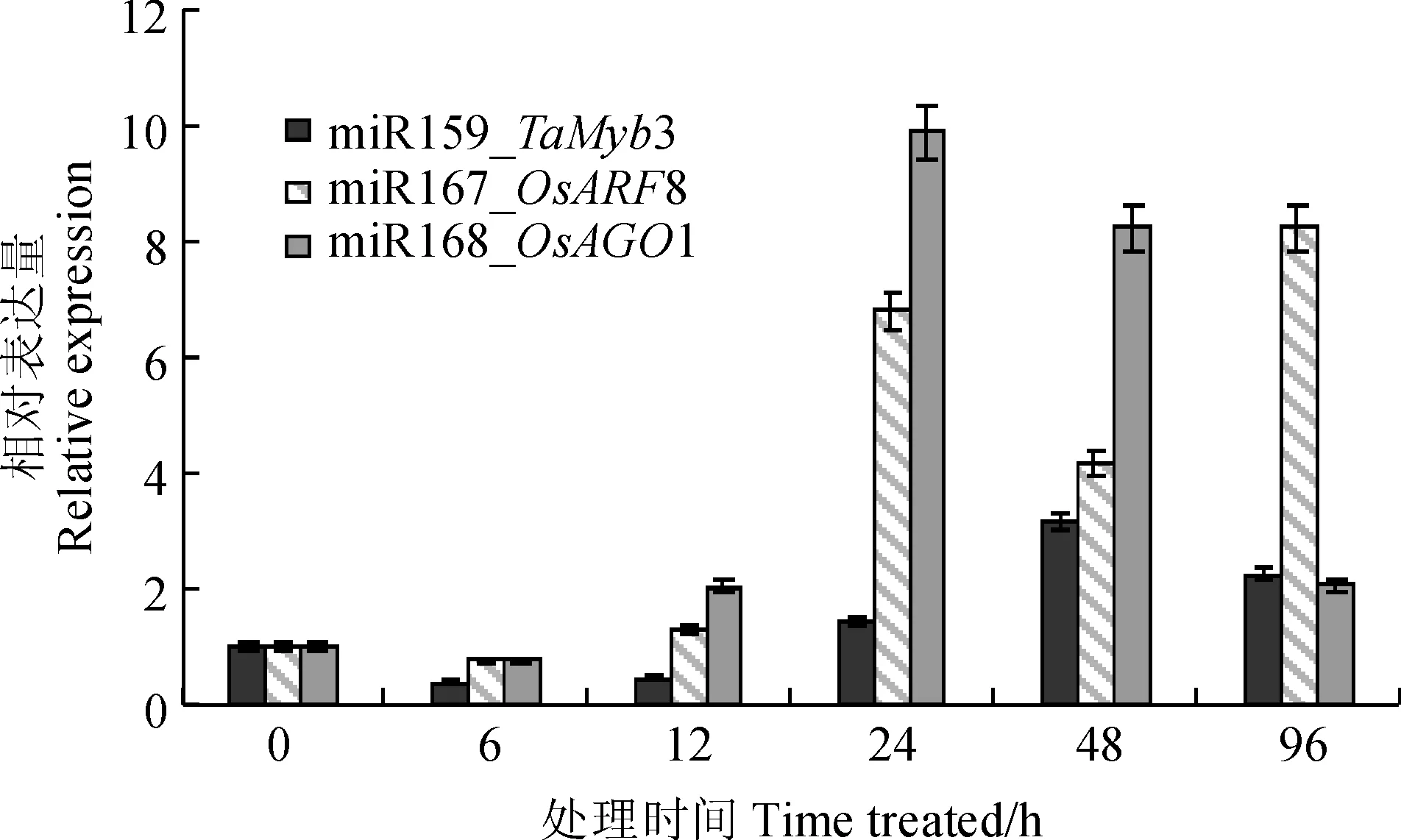
miRNAs靶基因在各时间点的表达量均相对其0 h的初始表达量(设定为1)进行计算图4 接种田菁茎瘤固氮根瘤菌小麦叶部与促生作用相关miRNAs靶基因在不同时间点的相对表达量All expression data were calculated based on the score of 0-pionts which was set as 1Fig.4 The relative expression of miRNAs’ target genes in different time points relating to the growth-promoting effect of wheat leaves inoculated by A. caulinodans ORS 571
miR159编码Myb3转录因子,靶基因为GAMYB基因家族(编码 GAMYB 转录因子,参与赤霉素信号调节[19])。miR159不仅参与植物营养生长也参与生殖生长[20]。Pluskota 等[21]研究发现 miR156、miR159、miR160 参与种子的萌发过程。miR156通过调控激素在胚根萌发之后发挥作用;而miR159则在胚根萌发之前发挥作用。在小麦中miR159在根瘤菌侵染后首先维持其正常水平,在24 h达到其峰值,最后维持在较低的表达水平,表明miR159可能在小麦与田菁茎瘤固氮根瘤菌相互作用过程中参与调控,促进了小麦的营养生长进程。
miR160的靶基因为ARF10、ARF16、ARF17(auxin response factor),参与生长素信号调节。过表达突变的ARF17(5mARF17,对miR160具有抗性)导致许多生长激素应答基因表达改变,拟南芥呈现畸形发育,如叶片锯齿状突起、卷曲、育性降低等[22-23]。在拟南芥、水稻、玉米等植物中,miR160 通过负调控ARF而有效地影响种子萌发、苗期发育及根冠形成等生理发育过程[24-25]。在小麦接菌处理后,miR160逐渐加强了对ARF基因家族的负调控,24 h后表达又逐渐降低,从而影响小麦苗期发育和根冠形成。但miR160的表达强度低于miR156和miR159,其表达峰值仅为初始表达量的1.54倍。
miR167靶向ARF6、ARF8[26],在玉米中,miR167受干旱胁迫表达下调,从而导致其各自的靶基因磷脂酶D表达上调,进而导致植物叶片气孔关闭以及多种抗氧化系统活性的增加,最终提高了对干旱的抵抗能力[27]。此外,在拟南芥中,ARF8调控着生长素介导的侧根结构的性状,从而影响拟南芥的生长发育[28]。推测接种田菁茎瘤固氮根瘤菌后,miR167表达逐渐降低,其靶基因ARF家族表达上调,通过调控小麦侧根发育发挥其促生作用。
miR168 靶基因编码蛋白AGO1是RISC(RNA诱导沉默复合体)的重要组成部分[29]。miR168靶向AGO1,两者之间存在负反馈调节,AGO1蛋白参与miRNA自身积累调控,它与miR168的平衡可以保证其它miRNAs处于正常状态[30]。此外,miR168也与植物的抗逆、抗旱等有关[31]。田菁茎瘤固氮根瘤菌侵染小麦12 h后miR168表达量上升,由于miR168与靶基因AGO1之间存在负反馈调节,因此miR168在表达量上升后又逐渐回落,在96 h降到初始表达量的0.16倍,发挥其促生抗逆等作用。
miR403靶向AGO2,并通过负反馈作用参与自身代谢途径的调控[6]。在拟南芥中,miR403可以通过miR403-AGO2-miR168-AGO1循环途径参与其生长发育的调控过程[32]。本研究中miR403的相对表达量首先上调然后下调,这一变化表明接种田菁茎瘤固氮根瘤菌可能通过调节AGO家族蛋白的表达来控制相关miRNAs的合成,加快miR403的积累,调节小麦幼苗的自身代谢,适应接种田菁茎瘤固氮根瘤菌所产生的变化。
3.3接种根瘤菌对小麦叶片生理指标的影响
在接种田菁茎瘤固氮根瘤菌侵染后,小麦的叶长度及地上部分鲜重均发生明显的变化。在96 h接菌处理组和对照组的叶鲜重分别为0.133和0.104,在统计学分析中差异极显著,叶长平均值分别为151.90和146.20。表明接种田菁茎瘤固氮根瘤菌对小麦叶组织具有促生作用,使叶片生物量累积并加速伸长,强化了对营养元素的吸收和利用,这与本研究前期室内和田间试验结果一致[33]。这些结果也与3.2中所讨论的miRNAs变化相辅相成,即由内源的miRNAs变化调节了小麦的外部生长状态,而接菌小麦所表现出的促生作用也进一步证实了小麦体内由于miRNAs的变化而发生的一系列基因表达变化。
3.4小麦叶组织促生相关miRNAs的靶基因表达分析
本研究以小麦的TaMyb3作为miR159的靶基因进行验证。在接菌处理后miR159的表达量不断上升,在24 h达到峰值后逐渐下降,而TaMyb3的表达量则在接菌处理后随即下调,从24 h开始逐渐上升,并在48 h达到峰值,96 h维持在2.19倍。表明miR159调控TaMyb3,并通过TaMyb3控制其下游赤霉素信号相关基因的表达,促进小麦生长。但TaMyb3的表达可能还受到其他因素的影响,因此在6和24 h时间点的表达量并没有与miR159的表达高度一致。
本研究以水稻的OsARF8作为miR167的靶基因进行验证。与miR167的表达相对应,OsARF8在接菌处理后即开始变化,但直到12 h仅有对照的1.26倍,在24 h大量表达并达到其峰值,之后一直维持较高的表达水平。表明miR167负调控ARF8,从而通过影响侧根发育发挥其促生作用。但ARF8在各个时间点的表达量不仅受到miR167的调控,可能也受到外界环境和自身生长状态的影响。
本研究以水稻OsAGO1作为miR168的靶基因进行验证。miR168的表达量在接菌处理12 h升高,24 h则下降并一直维持在较低的水平,与之对应的OsAGO1基因则在24 h达到峰值并在后期维持较高的表达水平。表明AGO1 受miR168的调控而继续参与其他miRNA的积累,并改变其下游基因的表达,发挥促生作用。
综上所述,小麦叶片中与促生作用相关的miRNAs在接菌处理后能够调节其各自的靶基因,从而发挥其各自的功能。但值得注意的是本研究中所选取的靶基因并非只受到上游miRNAs的调节,其他的内外因素亦对靶基因产生影响,从而使其表达并不能与miRNAs的表达严格匹配。
[1]陈廷伟, SCHERER S, BÖGER P. 固氮根瘤菌(Azorhizoboium)在人工诱发小麦类根瘤种的固氮作用[J]. 中国科学B辑, 1992,22(7): 712-716.
CHEN T W, SCHERER S, BÖGER P. The azotification effect ofAzorhizobiumin artificially induced para-nodules in wheat[J].ScienceinChinaSeriesB:Chemistry, 1992,22(7):712-716.
[2]LEE K B, BACKER P D, AONO T,etal. The genome of the versatile nitrogen fixerAzorhizobiumcaulinodansORS571[J].BMCGenomics, 2008, 9(25):271.
[3]李强.田菁茎瘤固氮根瘤菌与小麦互作中相关microRNA鉴定及其功能分析[D]. 杨陵: 西北农林科技大学, 2014.
[4]JACKSON R J, STANDART N. How do microRNAs regulate gene expression[J].ScienceSTKE, 2007,367:rel.
[5]CHEN X. MicroRNA biogenesis and function in plants[J].FEBSLetters, 2005, 579(26): 5 923-5 931.
[6]VOINNET O. Origin, biogenesis, and activity of plant microRNAs[J].Cell, 2009,136(4): 669-687.
[7]陈新宏, 李璋, 赵继新,等. 国审小麦新品种小偃22的研究与利用[J]. 农艺科学, 2007,23(9): 218-220.
CHEN X H, LI Z, ZHAO J X,etal. Study and utilize on a new wheat variety of nation approve Xiaoyan22[J].ChineseAgriculturalScienceBulletin, 2007,23(9): 218-220.
[8]迟峰. 根瘤菌在植物内的迁移运动及其与植物相互作用的蛋白质组学研究[D]. 北京: 中国科学院研究生院, 2006.
[9]SENTHIKUMAR M, MADHAIYAN M, SUNDARAM S P,etal. Induction of endophytic colonization in rice (OryzasativaL.) tissue culture plants byAzorhizobiumcaulinodans[J].BiotechnologyLetters, 2008,30(8): 1 477-1 487.
[10]马蕊, 张爱霞, 生庆海. SPSS软件在食品感官评分结果分析中的应用[J]. 乳业科学与技术, 2007,30(1): 12-14.
MA R, ZHANG A X,SHENG Q H. The application of SPSS in analyzing the results of food sensory scoring[J].DairyIndustryScienceandTechnology, 2007,30(1): 12-14.
[11]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001,25(4): 402-408.
[12]CHEN X B, ZHANG Z L, LIU D M,etal.SQUAMOSApromoter-binding protein -like transcription factors: star players for plant growth and development[J].JournalofIntegrativePlantBiology, 2010,52(11): 946-951.
[13]WU G, POETHIG R S. Temporal regulation of shoot development inArabidopsisthalianaby miR156 and its targetSPL3[J].Development, 2006, 133(18): 3 539-3 547.
[14]USAMI T, HORIGUCHI G, YANO S,etal. The more and smaller cells mutants ofArabidopsisthalianaidentify novel roles forSQUAMOSAPROMOTERBINDINGPROTEIN-LIKEgenes in the control of heteroblasty[J].Development, 2009, 136(6): 955-964.
[15]王冰, 宋娜, 孙燕飞,等, MicroRNA156家族在小麦非生物胁迫中的表达分析[J]. 植物病理学报, 2013,43(2): 201-204.
WANG B, SONG N, SUN Y F,etal. Expression analysis of wheat mircoRNA156 family in response to abiotic stress[J].ActaPhytopathologicaSinica, 2013,43(2): 201-204.
[16]JIAO Y, WANG Y, XUE D,etal. Regulation ofOsSPL14 by OsmiR156 defines ideal plant architecture in rice[J].NatureGenetics, 2010,42(6): 541-544.
[17]CHUCK G, CIGAN A M, SAETEURN K,etal. The heterochronic maize mutantCorngrass1 results from overexpression of a tandem microRNA[J].NatureGenetics, 2007,39(4): 544-549.
[18]WANG S, ZHU Q H, GUO X,etal. Molecular evolution and selection of a gene encoding two tandem microRNAs in rice[J].FEBSLetters, 2007,581(24): 4 789-4 793.
[19]REYES J L, CHUA N H. ABA induction of miR159 controls transcript levels of two MYB factors duringArabidopsisseed germination[J].ThePlantJ., 2007,49(4): 592-606.
[20]ALONSO-PERAL M M, LI J, LI Y,etal. The microRNA159-regulatedGAMYB-likegenes inhibit growth and promote programmed cell death in Arabidopsis[J].PlantPhysiology, 2010,154(2): 757-771.
[21]PLUSKOTA W E, MARTINEZ-ANDUJAR C, MARTIN R C,etal. MicroRNA function in seed biology[M].ERDMANN V A, BARCISZEWSKI J. Non coding RNAs in plants. New York: Springer-Verlag Berlin Heidelberg, 2011: 339-357.
[22]TURNER M, NIZAMPATNAM N R, BARON M,etal. Ectopic expression of miR160 results in auxin hypersensitivity, cytokinin hyposensitivity, and inhibition of symbiotic nodule development in soybean[J].PlantPhysiology, 2013,162(4): 2 042-2 055.
[23]MALLORY A C, BARTEL D P, BARTEL B. MicroRNA-directed regulation of Arabidopsisauxinresponsefactor17 is essential for proper development and modulates expression of early auxin response gene[J].ThePlantCell, 2005,17(5): 1 360-1 375.
[24]WANG J W, WANG L J, MAO Y B,etal. Control of root cap formation by microRNA-targeted auxin response factors in arabidopsis[J].ThePlantCell, 2005,17(8): 2 204-2 216.
[25]LIU P P, MONTGOMERY T A, FAHLGREN N,etal. Repression ofAUXINRESPONSEFACTOR10 by microRNA160 is critical for seed germination and post-germination stages[J].ThePlantJournal, 2007,52(1): 133-146.
[26]王磊, 范云六. 植物微小RNA(microRNA)研究进展[J]. 中国农业科技导报, 2007,9(3): 18-23.
WANG L, FAN Y L. Progress of microRNA in plants[J].JournalofAgriculturalScienceandTechnology, 2007,9(3): 18-23.
[27]WEI L Y, ZHANG D F, XIANG F,etal. Differentially expressed miRNAs potentially involved in the regulation of defense mechanism to drought stress in maize seedlings[J].InternationalJournalofPlantSciences, 2009,170(8): 979-989.
[28]GIFFORD M L, DEAN A, GUTIERREZ R A, Gutierrez,etal. Cell-specific nitrogen response mediate developmental plasticity[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2008,105(2):803-808.
[29]BAUMBERGER N, BAULCOMBE D C. Arabidopsis ARGO-NAUTEI is an RNA slicer that selectively recruits microRNAs and short interfering RNAs[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2005,102(33): 11 928-11 933.
[30]VAUCHERET H, MALLORY A C, BARTEL D P. AGO 1 home-stasis entails co-expression ofmiR168 andAGO1 and preferential stabilization of miR168 by AGO1[J].MolecularCell, 2006,22(1): 129-136.
[31]韩璐, 栾雨时. 植物miR168的研究进展[J]. 基因组学与应用生物学, 2014,33(2): 438-444.
HAN L, LUAN Y S. Progress on the research of plant miR168[J].GenomicsandAppliedBiology, 2014,33(2): 438-444.
[32]ZHANG C, XIAN Z Q, HUANG W,etal, Evidence for the biological function of miR403 in tomato development[J].ScientiaHorticulturae, 2015,197: 619-626.
[33]刘华伟, 孙超, 杨呼,等. 田菁茎瘤固氮根瘤菌对小麦种子侵染的促生作用及其在根系内的定殖[J]. 植物营养与肥料学报, 2012,18(1): 210-217.
LIU H W, SUN C, YANG H,etal. Promotion for wheat growth and root colonization after infecting wheat seeds withAzorhizobiumcaulinodans[J].PlantNutritionandFertilizerScience. 2012,18(1): 210-217.
(编辑:潘新社)
Growth-Promoting Effect ofAzorhizobiumcaulinodansto Wheat Leaves
CHEN Yongchao, QI Huaiting, WANG Xiaojing, LI Qiang, LIU Huawei*
(College of Life Science, Northwest A&F University, Yangling, Shaanxi 712100,China)
In this study, germinated 24h wheat seeds were inoculated withAzorhizobiumcaulinodans, samples were collected at 0, 6, 12, 24, 48, 72 and 96 h, respectively and 6 miRNAs (miR156, miR159, miR160, miR167, miR168 and miR403)in wheat leaves, 3 of these miRNAs’ target genes were detected using Real-time quantifying PCR. The distribution of GFP-labeledA.caulinodansin 8 d wheat leaves were detectedviaconfocal microscopy, and relevant physiological indices were measured and compared. The results showed that: (1) GFP-labeledA.caulinodanscould colonize in margin area of wheat leaves. (2) All 6 miRNAs relating to growth-promoting varied in different degrees after treatment withA.caulinodans, and soared to their peaks at 12-24 h. The peak of miR159 was 2.88 times as strong as regular expression. (3) The expression of 3 miRNAs’ target genes were corespondent to their upstream miRNA, but not restrict. (4) Physiological indices of length and fresh weight of leaves showed sensible growth promoting, the weight of leaves in 96 h showed significant difference statistically (P<0.01). The study suggested that:A.caulinodansinoculated in wheat could colonize leaves, exerting evident growth-promoting effect to wheat leaves, and miRNAs play an intrinsic role in the growthpromotion.
wheat;AzorhizobiumcaulinodansORS 571; growth-promoting; miRNA
1000-4025(2016)07-1383-08
10.7606/j.issn.1000-4025.2016.07.1383
2016-04-12;修改稿收到日期:2016-06-14
国家自然科学基金(31071870);陕西省农业科技创新与攻关项目(2015NY006)
陈永超(1990-),男,硕士,主要从事非豆科作物固氮研究。E-mail: break0910@126.com
刘华伟,博士,副教授,主要从事非豆科作物内生固氮的分子机理研究。E-mail:bioche@nwsuaf.edu.cn
Q939.11+4;Q789
A
——固氮微生物

